 |
 |
| J Korean Ophthalmol Soc > Volume 65(1); 2024 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£ņØĖņ×Éļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
2022ļģä 3ņøöļČĆĒä░ 2023ļģä 3ņøöĻ╣īņ¦Ć ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäļĪ£ ņ¦äļŗ©ļÉśņ¢┤ ĒÖ®ļ░śļČĆņóģņ£╝ļĪ£ ņ£Āļ”¼ņ▓┤ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ļśÉļŖö ļŹ▒ņé¼ļ®öĒāĆņåÉņéĮņ×ģļ¼╝ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēļ░øņØĆ ĒÖśņ×É 55ļ¬ģ 55ņĢłņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØä ņ▓½ 6Ļ░£ņøö ļÅÖņĢł 3ĒÜī ņØ┤ĒĢśļĪ£ ņŗ£Ē¢ēļ░øĻ│Ā 12Ļ░£ņøö ņØ┤ņāü ļČĆņóģņØś ņ×¼ļ░£ņØ┤ ņŚåļŖö ĒÖśņ×ÉĻĄ░(ļ╣äņ×¼ļ░£ĻĄ░)Ļ│╝ ļ│æņØś ļ░£ņāØ Ēøä ņ╣śļŻīļź╝ ņ¦äĒ¢ēĒĢśņśĆņØīņŚÉļÅä ĒśĖņĀäņØ┤ ņŚåĻ▒░ļéś 12Ļ░£ņøö ņØ┤ļé┤ņŚÉ ļČĆņóģņØ┤ ņ×¼ļ░£ĒĢśņśĆļŹś ĒÖśņ×ÉĻĄ░(ņ×¼ļ░£ĻĄ░)ņ£╝ļĪ£ ļéśļłäņ¢┤ ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņØśļ¼┤ĻĖ░ļĪØņŚÉņä£ ņŗ£ļĀź, ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś, ņĢłņĢĢ, ņŻ╝ņé¼ Ēܤņłś, Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØä ņłśņ¦æĒĢśĻ│Ā, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀ ņĀäĻ│╝ ņŻ╝ņ×ģņłĀ Ēøä 6Ļ░£ņøöņ¦Ė ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØś ĒÖ®ļ░śļČĆļź╝ ņČöņČ£ĒĢśņŚ¼ ņżæņŗ¼ļ¦Øļ¦ēļæÉĻ╗ś, ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗ś, ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØä ņĖĪņĀĢĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ļæÉ ĻĄ░ņØś ņ╣śļŻī ņĀäĒøäņØś ņżæņŗ¼ļ¦Øļ¦ēļæÉĻ╗śņØś ļ│ĆĒÖöļ¤ēņØĆ ļÅÖņØ╝ĒĢśņśĆļŗż. ņ╣śļŻī ņĀäņØś ņŗ£ļĀźņØĆ ļæÉ ĻĄ░ ņé¼ņØ┤ņØś ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś, ņ╣śļŻī 6Ļ░£ņøö Ēøä ņŗ£ļĀźņØĆ ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż. ļ╣äņ×¼ļ░£ĻĄ░ņØĆ ņ×¼ļ░£ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ļéśņØ┤Ļ░Ć ņĀŖĻ│Ā, ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī ņŗ£ņ×æ 6Ļ░£ņøö Ēøä ņĢłņĢĢņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż. ļśÉĒĢ£ ņ╣śļŻī ņĀäĒøäņØś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć Ļ░ÉņåīĒĢĀņłśļĪØ, ņ╣śļŻī ņĀä ļ░śļīĆņĢłĻ│╝ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņ׳ņØäņłśļĪØ, ņ╣śļŻī ņĀäĒøäņØś ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØ┤ ņĀüņØäņłśļĪØ ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£ņØ┤ ņĀüņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż.
Ļ▓░ļĪĀ
ņ╣śļŻī ņĀäĒøäņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ļ│ĆĒÖö, ņ╣śļŻī ņĀä ļ░śļīĆņĢłĻ│╝ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤, ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØś ņĀĢļÅäļŖö ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£Ļ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņŚłļŗż. ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś 6Ļ░£ņøö ļé┤ņØś ņ┤łĻĖ░ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ĒåĄĒĢ┤ ņ×¼ļ░£ ņśłņĖĪņØĖņ×Éļź╝ ņ░ŠņĢäļ│╝ ņłś ņ׳ņŚłļŗż.
ABSTRACT
Purpose
We evaluated factors predicting the recurrence of macular edema in patients with branch retinal vein occlusion using optical coherence tomography (OCT).
Methods
This study enrolled 55 patients diagnosed with branch retinal vein occlusion who presented to the outpatient clinic between March 2022 and March 2023. A retrospective analysis categorized patients into non-recurrence and recurrence groups. Data on visual acuity, spherical equivalent, intraocular pressure, number of injections, and follow-up duration were collected from medical records. OCT images were obtained before and 6 months after intravitreal injection to measure and analyze central retinal thickness, subfoveal choroidal thickness, and disorganization of retinal inner layers.
Results
No statistically significant difference was observed in the central retinal thickness change before and after treatment between the groups. Although no significant differences were observed in visual acuity between the two groups before treatment, significant improvement in visual acuity was observed in the non-recurrence group after 6 months of treatment. The non-recurrence group was younger compared to the recurrence group; moreover, the intraocular pressure in non-recurrence patients decreased significantly during the 6-month treatment period. In addition, a decrease in subfoveal choroidal thickness before and after treatment, the difference in subfoveal choroidal thickness between the affected eye and the fellow eye before treatment, and the reduction in disorganization of retinal inner layers before and after treatment were associated with a favorable prognosis without recurrence.
Conclusions
Changes in subfoveal choroidal thickness before and after treatment, variations in subfoveal choroidal thickness between the affected and fellow eyes before treatment, and the degree of disorganization of retinal inner layers exhibited significant associations with the recurrence of macular edema. This is significant because it allows for predictions based on baseline OCT images.
ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäļŖö ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø ļŗżņØīņ£╝ļĪ£ ļæÉ ļ▓łņ¦ĖļĪ£ ĒØöĒĢ£ ļ¦Øļ¦ēĒśłĻ┤Ć ņ¦łĒÖśņØ┤ļŗż.1 Ļ│╝Ļ▒░ ņØĖĻĄ¼ ĻĖ░ļ░ś ņŚ░ĻĄ¼ņŚÉņä£ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņØś ņ£Āļ│æļźĀņØĆ 0.3%ņŚÉņä£ 1.1%Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉśņŚłļŗż.2-4 ņ£äĒŚś ņØĖņ×ÉļĪ£ļŖö Ļ│ĀļĀ╣, ĒØĪņŚ░, Ļ│ĀĒśłņĢĢ, ļŗ╣ļć©, ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś, Ļ│Āņ¦ĆĒśłņ”Ø ļ░Å ĒśłĻ┤ĆņŚ╝Ļ│╝ ļ▓Āņ│ćļ│æ ļō▒Ļ│╝ Ļ░ÖņØĆ ņĀäņŗĀ ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØ┤ ņ׳Ļ│Ā, Ļ│ĀņĢłņĢĢņ”ØņØ┤ļéś ļģ╣ļé┤ņןļÅä ĻĄŁņåīņØĖņ×ÉļĪ£ņä£ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņØś ņ£äĒŚśņØä ļåÆņØĖļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż.5 ĒÖ®ļ░śļČĆņóģņØĆ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņŚÉņä£ ņŗ£ļĀźņןņĢĀļź╝ ņØ╝ņ£╝ĒéżļŖö ņŻ╝ ņøÉņØĖņ£╝ļĪ£, ĻĘĖ ĻĖ░ņĀäņØĆ ņĢäņ¦ü ļ¬ģĒÖĢĒ׳ ņĢīļĀżņ¦Ćņ¦Ć ņĢŖņĢśņ£╝ļéś, ļ¦Øļ¦ēĒŚłĒśł ļ░Å ļ¦Øļ¦ēņČ£ĒśłļĪ£ ņØĖĒĢ£ ņŚ╝ņ”Ø ļ░śņØæņ£╝ļĪ£ ņĢłĻĄ¼ ļé┤ ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×Éļéś ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖĻ│╝ Ļ░ÖņØĆ ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉļōżņØś ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉśĻ│Ā ĒśłĻ┤Ćļ¦Øļ¦ē ņןļ▓ĮņØ┤ ņåÉņāüļÉśļŖö Ļ▓āņØ┤ ņŻ╝ņÜö ļ│æĒā£ņāØļ”¼ļĪ£ ņČöņĀĢļÉśĻ│Ā ņ׳ļŗż.6 Ēśäņ×¼ ĒÖ®ļ░śļČĆņóģņØś ņ╣śļŻīļĪ£ļŖö ņĢłĻĄ¼ ļé┤ ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×Éļéś ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖĻ│╝ Ļ░ÖņØĆ ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉļōżņØä Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØ┤ ļäÉļ”¼ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ļŗż.7 ĻĘĖļ¤╝ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, ļŗżņłśņØś ĒÖśņ×ÉļōżņŚÉņä£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņŚÉ ļ░śņØæņØ┤ ņŚåĻ▒░ļéś ļśÉļŖö ĒÖ®ļ░śļČĆņóģņØ┤ ņłśļģäņŚÉ Ļ▒Ėņ│É ņ×¼ļ░£ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄĻ│Ā, ņĢĮņĀ£ Ļ░äņØś ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ļŗżņ¢æĒĢ£ ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ņłśĒ¢ēļÉśņ¢┤ ņÖöļŗż. ĻĘĖļ¤¼ļéś ņĢĮņĀ£ņØś ņóģļźśņÖĆļŖö ņāüĻ┤ĆņŚåņØ┤ ĒÖśņ×ÉņØś ņ┤łĻĖ░ ņØśļ¼┤ĻĖ░ļĪØ ļśÉļŖö ļ¦Øļ¦ēļŗ©ņĖĄ ņé¼ņ¦äļ¦īņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ×¼ļ░£ņØĖņ×Éļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ ņŚ░ĻĄ¼ļŖö ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÖ®ļ░śļČĆņóģņ£╝ļĪ£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēļ░øņØĆ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņØ┤ļ»Ėņ¦Ćļź╝ ļ╣äĻĄÉ ļČäņäØĒĢśņŚ¼ ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ© ņ׳ļŖö ņØĖņ×ÉļōżņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļ│ĖņøÉņŚÉ 2022ļģä 3ņøöļČĆĒä░ 2023ļģä 3ņøö ņé¼ņØ┤ņŚÉ ļé┤ņøÉĒĢśņŚ¼ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņØś ņ¦äļŗ©ļ¬ģņ£╝ļĪ£ ņ¦äļŻīļ░øņØĆ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņØ┤ļŗż. ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśĻ│Ā ļ│ĖņøÉ ņ×äņāüņŚ░ĻĄ¼ņŗ¼ņé¼ņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż(IRB File No. 2023-07-042).
ĒÖ®ļ░śļČĆ ņ╣©ļ▓öņØ┤ ņŚåļŖö ņŗ£ļĀź 1.0 ņØ┤ņāüņØĖ Ļ▓ĮņÜ░, ņŻ╝ņé¼ ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖĻ│Ā Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ļ¦ī ĒĢ£ Ļ▓ĮņÜ░, ĒāĆ ļ│æņøÉņŚÉņä£ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ņŚłļŹś Ļ▓ĮņÜ░, ņ▓½ ņ¦äļŗ©ņ£╝ļĪ£ļČĆĒä░ ņĄ£ņåī 1ļģä ņØ┤ņāü ņČöņĀü Ļ┤Ćņ░░ņØ┤ ļČłĻ░ĆļŖźĒĢ£ Ļ▓ĮņÜ░, ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ņØ┤ņÖĖņØś ņŗ£ļĀźņŚÉ ņ£ĀņØśĒĢ£ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö Ļ░üļ¦ēĒś╝Ēāü, ņżæļō▒ļÅä ņØ┤ņāüņØś ļ░▒ļé┤ņן, ņ£Āļ”¼ņ▓┤Ēś╝Ēāü, ņ£Āļ”¼ņ▓┤ņČ£Ēśł ļō▒ņØś ļ¦żņ▓┤Ēś╝ĒāüņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ļéśņØ┤Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļŗ╣ļć©ĒÖ®ļ░śļČĆņóģ, ĒÖ®ļ░śņøÉĻ│Ą, ļ¦Øļ¦ēņĀäļ¦ē ļō▒Ļ│╝ Ļ░ÖņØ┤ ĒÖ®ļ░śļČĆ ĻĖ░ļŖźņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ļŗżļźĖ ļ¦Øļ¦ē ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, 6Ļ░£ņøö ņØ┤ļé┤ ļĀłņØ┤ņĀĆ ņ╣śļŻī, ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ļ░øņØĆ Ļ▓ĮņÜ░, ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ĻĄ¼ļ│äņØ┤ ļÉśņ¦Ć ņĢŖņØä ņĀĢļÅäļĪ£ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ĒĢ┤ņāüļÅäĻ░Ć ļé«ņØĆ Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļ│ĖņøÉņŚÉ 2022ļģä 3ņøöļČĆĒä░ 2023ļģä 3ņøö ņé¼ņØ┤ņŚÉ ļé┤ņøÉĒĢśņŚ¼ ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņØś ņ¦äļŗ©ļ¬ģņ£╝ļĪ£ ņ¦äļŻīļ░øņØĆ ĒÖśņ×É ņżæ ļ│ĖņøÉņŚÉņä£ ņ▓śņØīņ£╝ļĪ£ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢ£ 55ļ¬ģ 55ņĢłņØä ļČäņäØĒĢśņŚ¼ ņ┤łĻĖ░ ĒÖ®ļ░śļČĆņóģņŚÉ ļīĆĒĢśņŚ¼ 6Ļ░£ņøö ļé┤, 3ĒÜī ņØ┤ĒĢśļĪ£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ļśÉļŖö ļŹ▒ņé¼ļ®öĒāĆņåÉ ņéĮņ×ģļ¼╝ ņĢłļé┤ ņŻ╝ņ×ģņłĀņØä ļ░øĻ│Ā, ņ▓½ ņ╣śļŻī ņØ┤Ēøä 12Ļ░£ņøö ņØ┤ņāü ņ×¼ļ░£ ņŚåņØ┤ ņ£Āņ¦ĆļÉśņŚłļŹś ĒÖśņ×ÉĻĄ░ 25ņĢł(ļ╣äņ×¼ļ░£ĻĄ░)Ļ│╝ 12Ļ░£ņøö ņØ┤ļé┤ 5ĒÜī ņØ┤ņāüņØś ņŻ╝ņé¼ ņ╣śļŻīņŚÉļÅä ļČĆņóģņØ┤ ĒśĖņĀäņØ┤ ņŚåĻ▒░ļéś ņ×¼ļ░£ļÉśņŚłļŹś ĒÖśņ×ÉĻĄ░(ņ×¼ļ░£ĻĄ░) 30ņĢłņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż(Fig. 1).
ņØśļ¼┤ĻĖ░ļĪØ ļČäņäØņØä ĒåĄĒĢ┤ ĒśłņĢĢ, ļŗ╣ļć©, ļģ╣ļé┤ņןņØś ņ£Āļ¼┤, body mass inidex (BMI), ļ¦źņĢĢ(pulse pressure)ņØś ņĀĢļ│┤ļÅä ĒĢ©Ļ╗ś ņłśņ¦æļÉśņŚłņ£╝ļ®░, ņĢłņĀĆĻ▓Ćņé¼, spectral-domain optical coherence tomography (SD-OCT) ļśÉļŖö enhanced depth imaging optical coherence tomography (EDI-OCT)ļź╝ ĒåĄĒĢ┤, ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś(central macular thickness, CMT), ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗ś(subfoveal choroidal thickness, SFCT), ļ¦Øļ¦ēļé┤ņĖĄņåÉņāü(disorganization of retinal inner layer, DRIL)ļÅä ĒÅēĻ░ĆļÉśņŚłļŗż. ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņé¼ņ¦äņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļé┤Ļ▓ĮĻ│äļ¦ēņ£╝ļĪ£ļČĆĒä░ ļĖīļŻ©Ēü¼ļ¦ēĻ╣īņ¦ĆņØś Ļ▒░ļ”¼ļź╝ ņłśņ¦üņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. ļ¦Øļ¦ē ļé┤ņĖĄņåÉņāüņØś ņĀĢņØśļŖö ļ¦Øļ¦ēņżæņŗ¼ņśżļ¬®ņØä ņżæņŗ¼ņ£╝ļĪ£ļČĆĒä░ ņ¢æņ¬Į 3,000 ╬╝m ļ▓öņ£ä ļé┤ņØś ņŗĀĻ▓ĮņĀłņäĖĒżņĖĄ, ļé┤ļ¦ØņāüņĖĄļ│ĄĒĢ®ņ▓┤, ļé┤ĒĢĄņĖĄĻ│╝ ņÖĖļ¦ØņāüņĖĄ Ļ░äņØś Ļ▓ĮĻ│äĻ░Ć ļČłļ¬ģĒÖĢĒĢ£ Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.8 ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļ¦Øļ¦ēņżæņŗ¼ņśżļ¬® ņĢäļל ļ¦Øļ¦ēņāēņåīņāüĒö╝ņØś Ēøäļ®┤ļČĆĒä░ ļ¦źļØĮļ¦ēĻ│Ąļ¦ē Ļ▓ĮĻ│äļČĆĻ╣īņ¦ĆņØś Ļ▒░ļ”¼ļź╝ ņłśņ¦üņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż(Fig. 2).
ĒåĄĻ│ä ļČäņäØ ļ░®ļ▓ĢņØĆ SPSS ver. 28.0 (IBM Corp., Chicago, IL, USA)ņØä ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, Kolmogorov-Smirnov testņÖĆ ShapiroWilk testļź╝ ĒåĄĒĢśņŚ¼ ņĀĢĻĘ£ņä▒ Ļ▓ĆņĀĢņØä ĒĢśĻ│Ā ĻĄ░ Ļ░ä ņłśņ╣ś ļ╣äĻĄÉņŚÉ Student's t-test, Mann-Whitney U-test, ņŚ░ļĀ╣ņØä ļ│┤ņĀĢĒĢśņŚ¼ ļæÉ ĻĄ░ ņé¼ņØ┤ņØś Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ Ļ│ĄļČäņé░ļČäņäØ(analysis of covariance, ANCOVA)ņØä ņŗżņŗ£ĒĢśņśĆļŗż. ļśÉĒĢ£ ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī Ēøä 6Ļ░£ņøöņØś ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É Fisher's exact testņÖĆ Mcnemar's testļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØĆ p-value<0.05ļĪ£ ĒĢśņśĆļŗż.
ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×É 55ņĢł ņżæ 12Ļ░£ņøö ņØ┤ņāü ņ×¼ļ░£ņØ┤ ņŚåņŚłļŹś ļ╣äņ×¼ļ░£ĻĄ░ņØĆ 25ņĢł, 12Ļ░£ņøö ņØ┤ļé┤ ņ×¼ļ░£ņØ┤ ņ׳ņŚłļŹś ņ×¼ļ░£ĻĄ░ņØĆ 30ņĢłņØ┤ņŚłĻ│Ā, ļé©ņ×É 22ņĢł(40%), ņŚ¼ņ×É 33ņĢł(60%)ņØ┤ņŚłņ£╝ļ®░, ņÜ░ņĢł 26ņĢł(47.3%) ņóīņĢł 29ņĢł(52.7%)ņØ┤ņŚłļŗż. ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ Ļ░üĻ░ü 59.44 ┬▒ 12.21ņäĖ, 67.77 ┬▒ 11.26ņäĖ(p=0.011), ņĄ£ņóģ ļé┤ņøÉ ņŗ£Ļ╣īņ¦ĆņØś ĒÅēĻĘĀ ņŻ╝ņ×ģņłĀ ĒܤņłśļŖö ļ╣äņ×¼ļ░£ĻĄ░ņØ┤ 2.16 ┬▒ 0.80ĒÜī, recurrenceĻĄ░ņØ┤ 8.67 ┬▒ 3.78ĒÜīļĪ£ ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņ׳ņŚłļŗż(p<0.001). ņ┤Ø Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØĆ 54.38 ┬▒ 39.44Ļ░£ņøö, 35.59 ┬▒ 25.08Ļ░£ņøöļĪ£ ļ╣äņ×¼ļ░£ĻĄ░ņØś Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ļŹö ĻĖĖņŚłļŗż(p=0.046). Non-recurrenceĻĄ░ņŚÉņä£ļŖö 6Ļ░£ņøö ļé┤ ņĢĮņĀ£Ļ░Ć ļ│ĆĻ▓ĮļÉ£ ĒÖśņ×ÉļŖö ņŚåņŚłņ£╝ļ®░, ņ┤Ø 25ņĢł ņżæņŚÉ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö(ranibizumab; Lucentis┬«, Novartis AG, Basel, Switzerland) 4ņĢł, ļŹ▒ņé¼ļ®öĒāĆņåÉ ņéĮņ×ģļ¼╝(dexamethasone implant; Ozurdex┬«, Allergan Inc., Irvine, CA, USA) 3ņĢł, ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö(bevacizumab; Avastin┬«, Genentech, Inc., San Francisco, CA, USA)ņØ┤ 18ņĢłņØ┤ņŚłļŗż. ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņ┤Ø 30ļ¬ģ ĒÖśņ×É ņżæ 6Ļ░£ņøöņŚÉ ņĢĮņĀ£ ļ│ĆĻ▓ĮņØ┤ ņ׳ņŚłļŹś ĒÖśņ×ÉļŖö 15ļ¬ģ, 2ĒÜī ņØ┤ņāü ņĢĮņĀ£ ļ│ĆĻ▓ĮņØ┤ ņ׳ņŚłļŹś ĒÖśņ×ÉļÅä ĻĘĖņżæ 6ļ¬ģņØ┤ ņ׳ņŚłļŗż. ļæÉ ĻĄ░ Ļ░ä ņä▒ļ│ä, ĒÖśņĖĪņĢłņØś ļ░®Ē¢ź, ļŗ╣ļć©, Ļ│ĀĒśłņĢĢņØś ņ£Āļ¼┤, ļ¦źņĢĢ(pulse pressure). BMI ļō▒ņØĆ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 1).
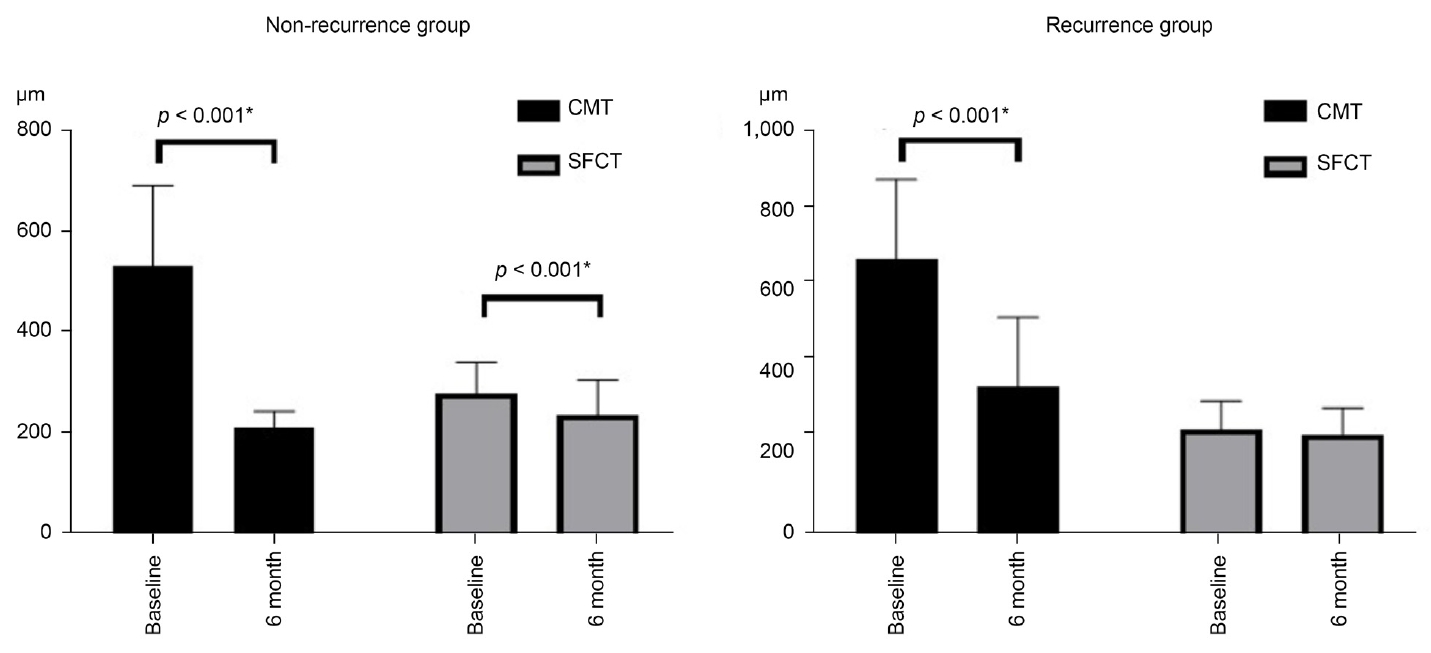
ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņØä ĒåĄĒĢ┤ ĒÖ®ļ░śļČĆļź╝ ņ¦ĆļéśļŖö ļŗ©ņĖĄ ļČĆņ£äļź╝ ņČöņČ£ĒĢśņŚ¼ ņ¦äĒ¢ēĒĢ£ ļČäņäØņŚÉņä£ ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī 6Ļ░£ņøö Ēøä ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗ś(CMT)ļŖö ņ×¼ļ░£ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļéś(p=0.007, p<0.001), 6Ļ░£ņøö ļÅÖņĢł ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś ļ│ĆĒÖöļ¤ēĻ│╝ ļ│ĆĒÖöņ£©ņØĆ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż. ļ░śļ®┤, ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī ĒøäņØś ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗ś(SFCT)ļŖö ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļéś 6Ļ░£ņøöĻ░ä ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ļ│ĆĒÖöļ¤ēĻ│╝ ļ│ĆĒÖöņ£©ņØĆ ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p=0.003, p<0.001), (Table 2, Fig. 3).
Ļ░ü ĻĄ░ņŚÉņä£ ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī Ēøä 6Ļ░£ņøöņ¦Ė Ļ▓░Ļ│╝ ļ╣äĻĄÉņŚÉņä£ ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņÖĆ ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗ś ļ¬©ļæÉ ņ╣śļŻī ņĀäĻ│╝ 6Ļ░£ņøö ĒøäņØś ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆņ£╝ļéś(p<0.001), ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņżæņŗ¼ĒÖ®ļ░śļæÉĻ╗śņØś Ļ░Éņåīļ¦ī ņ£ĀņØśĒĢśņśĆņ£╝ļ®░(p<0.001), ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīļŖö ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż(p=0.077) (Fig. 4).
ļśÉĒĢ£ ņ╣śļŻī ņĀä ļČäņ¦Ćļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņĖĪņĢłĻ│╝ ļ░śļīĆņĢłĻ│╝ņØś ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ļ╣äĻĄÉ ļČäņäØņŚÉņä£ ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņ¢æņĢłņØś ņ░©ņØ┤Ļ░Ć ņ£ĀņØśĒĢśņśĆĻ│Ā, ĒÖśņĖĪņĢłņØś ļ¦źļØĮļ¦ēņØś ļæÉĻ╗śĻ░Ć ņĀĢņāüņØĖ ļ░śļīĆņĢłļ│┤ļŗż ļŹö ļæÉĻ╗ŹĻ▓ī ņĖĪņĀĢļÉśņŚłļŗż(p<0.001), ĒĢśņ¦Ćļ¦ī ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņ¢æņĢłņØś ņ░©ņØ┤Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī ļéśĒāĆļéśņ¦Ć ņĢŖņĢśļŗż(p<0.746) (Fig. 5).
ļæÉ ĻĄ░ Ļ░ä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņ╣śļŻī ņĀäņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļéś ņ╣śļŻī Ēøä 6Ļ░£ņøöņŚÉļŖö ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ ļŹö ņ£ĀņØśĒĢśĻ▓ī Ē¢źņāüļÉ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż(p<0.001). ĒĢ£ĒÄĖ, ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī ņŗ£ņ×æ ĒøäņØś ņĢłņĢĢņØĆ ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļéś, ņĢłņĢĢņØś ļ│ĆĒÖöļ¤ēņØĆ ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö Ļ░ÉņåīĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆĻ│Ā(1.48 ┬▒ 2.28 Ļ░Éņåī), ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņĢĮĻ░ä ņ”ØĻ░ĆĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż(-0.13 ┬▒ 3.01, p=0.013). ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣ś(spherical equivalent)ļŖö ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.301). ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī 6Ļ░£ņøö ĒøäņØś ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüļÅä ņ×¼ļ░£ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļ¦ÄņĢśņ£╝ļ®░, ņ╣śļŻī ņĀäĻ│╝ 6Ļ░£ņøö ĒøäņØś Ļ░ÖņØĆ ĻĄ░ ļé┤ņØś ļ╣äĻĄÉņŚÉņä£ļÅä ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢ£ ļŹ░ ļ╣äĒĢ┤, ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ļ¦Øļ¦ēļé┤ņĖĪņåÉņāüņØś ĒśĖņĀäņØ┤ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż(p=0.157, McnemarŌĆÖs test) (Table 3).
ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņŚÉņä£ļŖö ļ¦Øļ¦ēņĀĢļ¦źĒśłņĀäņ£╝ļĪ£ ņØĖĒĢ£ ļ¬©ņäĖĒśłĻ┤Ć ņĢĢļĀźņØś ņ”ØĻ░ĆļĪ£ ļ¬©ņäĖĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ņĪ░ņ¦üņĢĪĻ│╝ ĒśłņĢĪņØ┤ ļłäņČ£ļÉ£ļŗż. ļÅÖņŗ£ņŚÉ ļ¦Øļ¦ēņØś ĒŚłĒśłĻ│╝ ņĀĆņé░ņåīņ”ØņØ┤ ļ░£ņāØĒĢśļ®┤ņä£ ņØ┤ļŖö ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×Éļź╝ ņāØņä▒ĒĢśņŚ¼ ņ×Āņ×¼ņĀüņ£╝ļĪ£ ļ¬©ņäĖĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØä Ē¢źņāüņŗ£ņ╝£ ņĪ░ņ¦üņĢĪĻ│╝ ĒśłņĢĪņØś ļłäņČ£ņØä ņ┤ēņ¦äņŗ£ĒéżļŖö ņŚŁĒĢĀņØä ĒĢśĻ▓ī ļÉśļ®┤ņä£ ĒÖ®ļ░śļČĆņóģņØś ņĢģĒÖöļĪ£ ņØ┤ņ¢┤ņ¦äļŗż.9 ņØ┤ļ¤¼ĒĢ£ ņØ┤ņ£ĀļĪ£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ļśÉļŖö ļŹ▒ņé¼ļ®öĒāĆņåÉ ņéĮņ×ģļ¼╝ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØĆ ļ¦Øļ¦ēĒśłĻ┤ĆĒÅÉņćäļĪ£ ņØĖĒĢ£ ĒÖ®ļ░śļČĆņóģņŚÉ ļīĆĒĢ£ ņØ╝ņ░© ņ╣śļŻīļĪ£ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ņ£╝ļéś, ĒÖ®ļ░śļČĆņóģņØ┤ ņ×¼ļ░£ĒĢśļ®┤ ņ×¼ņŻ╝ņé¼ļź╝ ĒĢśņŚ¼ ĒĢ┤ļČĆĒĢÖņĀü ļ¦Øļ¦ē ĻĄ¼ņĪ░ļź╝ ĒÜīļ│Ąņŗ£ĒéżĻ│Ā ņŗĀĻ▓Įļ¦Øļ¦ēņØä ļ│┤ĒśĖĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.7,10 ļ¦ÄņØĆ ņ×äņāüņØśļōżņØ┤ pro re nata (PRN)ņÖĆ treat and extend (T&E) ņÜöļ▓Ģņ£╝ļĪ£ ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£ņØä ļ╣ĀļźĖ ņŗ£Ļ░ä ļé┤ņŚÉ ļ░£Ļ▓¼ĒĢśĻ│Ā ņ╣śļŻīĒĢśĻ│Ā ņ׳ņ£╝ļéś ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņśłņĖĪ ņØĖņ×ÉņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņĢäņ¦ü ļČĆņĪ▒ĒĢśļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ╣śļŻī ņ┤łĻĖ░ 6Ļ░£ņøö ņØ┤ļé┤ ĒÖ®ļ░śļČĆņóģņØ┤ ĒśĖņĀäļÉśĻ│Ā 12Ļ░£ņøö ņØ┤ņāü ņ×¼ļ░£ņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŹś ļ╣äņ×¼ļ░£ĻĄ░Ļ│╝ 12Ļ░£ņøö ņØ┤ļé┤ 5ĒÜī ņØ┤ņāüņØś ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĒÖ®ļ░śļČĆņóģņØ┤ ĒśĖņĀäļÉśņ¦Ć ņĢŖĻ▒░ļéś ĒśĖņĀä Ēøä ļŗżņŗ£ ņ×¼ļ░£ļÉśļŖö ĒÖśņ×ÉĻĄ░ņØś ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņé¼ņ¦äņŚÉņä£ ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×Éļź╝ ņĪ░ņé¼ĒĢ┤ ļ│┤ņĢśļŗż.
ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ļéśņØ┤ļŖö ņ×¼ļ░£Ļ│╝ ņśłĒøäņŚÉ Ļ┤ĆļĀ©ļÉ£ ņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ņØś ļ╣äņ×¼ļ░£ĻĄ░Ļ│╝ ņ×¼ļ░£ĻĄ░ ļæÉ ņ¦æļŗ© ņŚŁņŗ£ ļéśņØ┤ņŚÉņä£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż.10 ļéśņØ┤Ļ░Ć ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Ļ│ĄļČäņé░ļČäņäØ(ANCOVA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļæÉ ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆļŗż. ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ╣äņ×¼ļ░£ĻĄ░Ļ│╝ ņ×¼ļ░£ĻĄ░ ļ¬©ļæÉ ņ╣śļŻī Ēøä 6Ļ░£ņøö ņżæņŗ¼ļ¦Øļ¦ēļæÉĻ╗śļŖö ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļéś ļæÉ ĻĄ░ Ļ░äņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ĒĢśņ¦Ćļ¦ī ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī Ēøä 6Ļ░£ņøöņØś ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śļŖö ļ╣äņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉ£ Ļ▓āņŚÉ ļ╣äĒĢ┤ ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ņ╣śļŻī ņĀäĻ│╝ 6Ļ░£ņøö ĒøäņØś ļæÉĻ╗śņØś ļ│ĆĒÖöĻ░Ć ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż. Tsuiki et al11ņØĆ ļ¦Øļ¦ēņżæņŗ¼ņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ĒÖ®ļ░śĒĢś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņśüĒ¢źņØä ļ░øņ¦Ć ņĢŖļŖö ļłłņŚÉ ļ╣äĒĢ┤ ņ”ØĻ░ĆĒĢ┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Song et al12ņŚÉ ļö░ļź┤ļ®┤ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ļ¦Øļ¦ē ņĀĆņé░ņåīņ”ØņØ┤ ļéśĒāĆļéśļ®┤ ļ¦Øļ¦ēņāēņåīņāüĒö╝ņŚÉņä£ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×ÉņÖĆ ņé░ĒÖöņ¦łņåīņØś ļ░£ĒśäņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, ņØ┤ļŖö ĒśłĻ┤ĆĒÖĢņן ņ£Āļ░£Ļ│╝ Ēśłļźśļ¤ēņØä ņ”ØĻ░Ćņŗ£ĒéżĻ▓ī ļÉśņ¢┤ ĒśłĻ┤ĆņØś Ēł¼Ļ│╝ņä▒ņØä ļåÆņØ┤Ļ│Ā ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢĀ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ļśÉĒĢ£ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ļ¦Øļ¦ēņØś ņĀĢņłśņĢĢ ņ”ØĻ░ĆļÅä ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ”ØĻ░Ćļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņ£ĀņČöĒĢśņśĆļŗż. Sakanishi et al13ņØĆ ļ¦Øļ¦ēĒśłĻ┤ĆĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ņĢłĻĄ¼ ļé┤ ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×ÉņØś ņ”ØĻ░ĆļĪ£ ņØĖĒĢ£ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņØś Ļ│╝Ēł¼Ļ│╝ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ĒÖ®ļ░śņ£╝ļĪ£ļČĆĒä░ 500 ╬╝m ņØ┤ļé┤ņØś ļ¬©ļōĀ ņ¦ĆņĀÉņŚÉņä£ ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆĻ│Ā, ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØ┤ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā ĒÖ®ļ░śļČĆņóģļÅä ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀ ņØ┤Ēøä ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śĻ░Ć ņ¢ćņĢäņ¦ĆļŖö ĒÖśņ×ÉņŚÉņä£ ļŹö ņל ņĪ░ņĀłļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż.14 ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ×¼ļ░£ņØ┤ ņŚåņŚłļŹś ĻĄ░ņŚÉņä£ļŖö ĒÖ®ļ░śļČĆņóģĻ│╝ ĒĢ©Ļ╗ś ļ¦źļØĮļ¦ēļæÉĻ╗śĻ╣īņ¦Ć Ļ░ÉņåīĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆĻ│Ā ņØ┤ļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀ ļśÉļŖö ļŹ▒ņé¼ļ®öĒāĆņåÉņéĮņ×ģļ¼╝ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØś ĒÜ©Ļ│╝ļĪ£ ņČöņĖĪļÉ£ļŗż. ļ░śļ®┤ņŚÉ ņ×¼ļ░£ĻĄ░ņŚÉņä£ļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀ ļśÉļŖö ļŹ▒ņé¼ļ®öĒāĆņåÉņéĮņ×ģļ¼╝ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØś ĒÜ©Ļ│╝Ļ░Ć ļČłņČ®ļČäĒĢśņŚ¼ ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīļÅä ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŹś Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ ņ×¼ļ░£ņØ┤ ņŚåņŚłļŹś ĻĄ░ņŚÉņä£ļŖö ņ╣śļŻī ņĀä ĒÖśņĖĪņĢłĻ│╝ ļ░śļīĆņĢł ņé¼ņØ┤ņØś ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņ£ĀņØśĒĢśņśĆņ£╝ļéś, ņ×¼ļ░£ņØ┤ ņ׳ņŚłļŹś ĻĄ░ņŚÉņä£ļŖö ĒÖśņĖĪņĢłĻ│╝ ļ░śļīĆņĢł ņé¼ņØ┤ņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ņØ┤ļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ļśÉļŖö ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļō▒ņØś ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉņØś ņśüĒ¢źņØä ļ░øņĢä ļæÉĻ║╝ņøīņĀĖ ņ׳ļŖö ļ╣äņ×¼ļ░£ĻĄ░Ļ│╝ ļŗ¼ļ”¼, ņ×¼ļ░£ĻĄ░ņØś ļ¦źļØĮļ¦ēņØĆ ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉņØś ņśüĒ¢źņØ┤ ņĀüļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ļ®░ ņØ┤ļŖö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀ ņ╣śļŻīļź╝ ĒĢśļŹöļØ╝ļÅä ļŗżņŗ£ ĒÖ®ļ░śļČĆņóģņØ┤ ņ×¼ļ░£ĒĢśĻĖ░ ņē¼ņÜ┤ ņĀĆĒĢŁņä▒(resistance) ļśÉļŖö ļ¼┤ļ░śņØæņä▒(refractory) ĒÖśņ×ÉņØś Ļ░ĆļŖźņä▒ņØä ņ£ĀņČöĒĢĀ ņłś ņ׳ļŖö ņśłņĖĪņØĖņ×ÉĻ░Ć ļÉĀ ņłś ņ׳ļŗż. Hasegawa et al15ņØĆ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ļ░śņØæņØ┤ ņóŗņØĆ Ļ▓ĮņÜ░ļŖö ņ╣śļŻī ņĀä ĒÖśņĖĪņĢłņØ┤ ļ░śļīĆņĢłņŚÉ ļ╣äĒĢśņŚ¼ ļŹö ļæÉĻ║╝ņÜ┤ ļ¦źļØĮļ¦ēļæÉĻ╗śļź╝ Ļ░Ćņ¦Ćļ®░, ļ¼┤ļ░śņØæņä▒ņØś Ļ▓ĮņÜ░ņŚÉļŖö ĒÖśņĖĪņĢłĻ│╝ ļ░śļīĆņĢłņØś ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņŚåļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļōżņØĆ ņ╣śļŻīņŚÉ ņĀĆĒĢŁņØ┤ ņ׳ļŖö ĒÖśņ×ÉļōżņŚÉņä£ļŖö ņĢłĻĄ¼ ļé┤ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×ÉņØś ļåŹļÅäĻ░Ć ļé«ņØä ņłś ņ׳ļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ļ®░, ļ»ĖņäĖļÅÖļ¦źļźś(microaneurysm)Ļ░Ć ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņä▒ņןņØĖņ×Éļ│┤ļŗż ļŹö Ēü░ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮņÜ░, ĒśĢĻ┤æņĢłņĀĆĻ▓Ćņé¼ņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö ļ»ĖņäĖļÅÖļ¦źļźśņŚÉ ļĀłņØ┤ņĀĆļź╝ ņŗ£Ē¢ēĒĢśļ®┤ ļČĆņóģņØś ĒśĖņĀäņØä ļ│┤ņØĖļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ņŚłļŗż.15 ļśÉĒĢ£ ĒśłņĀä ļō▒ņ£╝ļĪ£ ņØĖĒĢ£ ĒśłĻ┤Ć ĒÅÉņćä ņØ┤Ēøä ļ░£ņāØļÉśļŖö ļ»ĖņäĖĒśłĻ┤ĆņØś ĒÖĢņןĻ│╝ ņØ┤ ņśüņŚŁņŚÉņä£ņØś ļ»ĖņäĖĒśłĻ┤ĆĻ│╝ ļ¦Øļ¦ēņĪ░ņ¦üņØś ņĀĢņłśņĢĢ ĻĘĖļ”¼Ļ│Ā ņé╝Ēł¼ņĢĢņØś ĻĘĀĒśĢ ņāüĒā£, ļśÉ ņ£Āļ”¼ņ▓┤ļ¦Øļ¦ēĒæ£ļ®┤ņŚÉņä£ ņ×æņÜ®ĒĢśļŖö Ēל ļō▒ņØś ņŚŁĒĢÖņĀüņØĖ ņśüĒ¢źņØ┤ ĒÖ®ļ░śļČĆņóģņØś ņśłĒøäņÖĆ ņ×¼ļ░£ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳Ļ▓Āņ£╝ļ®░, ļö░ļØ╝ņä£ ņĀĆĒĢŁņä▒ ļśÉļŖö ļ¼┤ļ░śņØæņä▒ ĒÖśņ×ÉņŚÉņä£ ļĀłņØ┤ņĀĆņÖĆ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ ļō▒ņØ┤ ņ╣śļŻīņØś ņśĄņģśņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ņ×¼ļ░£ņØ┤ ņ׳ņŚłļŹś ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö ņ╣śļŻī ņĀäĻ│╝ 6Ļ░£ņøö ĒøäņØś ņĢłņĢĢņØś ņ░©ņØ┤ļŖö ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśņ£╝ļéś ņ×¼ļ░£ņØ┤ ņŚåļŖö ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö ņ╣śļŻī Ēøä 6Ļ░£ņøöņŚÉ 1.48 ┬▒ 2.28 mmHg ņØś ņĢłņĢĢņØ┤ ļ¢©ņ¢┤ņ¦ĆļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ļŖö ņ×¼ļ░£ņØ┤ ņŚåņŚłļŹś ĒÖśņ×ÉņØś ĒÖśņĖĪņĢłņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņāØņä▒ņØĖņ×É ļśÉļŖö ņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļō▒ņØś ņŚ╝ņ”Ø ļ¦żĻ░£ņØĖņ×ÉņØś ņśüĒ¢źņ£╝ļĪ£ ļ¦źļØĮļ¦ē ļśÉļŖö ļ¦Øļ¦ēņØś ĒśłļźśĻ░Ć ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ņ”ØĻ░ĆļÉ£ Ļ▓āņ£╝ļĪ£ ņČöņĖĪĒĢ┤ļ│╝ ņłś ņ׳ļŗż. Polska et al16ņØĆ ļ¦źļØĮļ¦ēĒśłļźśņÖĆ ņĢłņĢĢņØś ņāüĻ┤Ćņä▒ņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ņ£╝ļéś, ļČäņ¦Ćļ¦Øļ¦ēĒśłĻ┤ĆĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ņØś ļ¦źļØĮļ¦ēĒśłļźś ņ”ØĻ░ĆļĪ£ ņØĖĒĢ£ ņ┤łĻĖ░ ņĢłņĢĢņāüņŖ╣ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢłĻĄ¼Ļ▓Įņä▒ļÅä(ocular rigidity)ņØś ņĖĪļ®┤ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņČöĒøä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ ņ×¼ļ░£ņØ┤ ņ׳ņŚłļŹś ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö ņ×¼ļ░£ņØ┤ ņŚåļŖö ĒÖśņ×ÉĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ╣śļŻī ņĀäĻ│╝ ņ╣śļŻī ņŗ£ņ×æ 6Ļ░£ņøö Ēøä ļ¬©ļæÉ ļ¦Øļ¦ēļé┤ņĖĄ ņåÉņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. Suzuki et al10ņØĆ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ĒÖ®ļ░śņ£╝ļĪ£ļČĆĒä░ ĻĘĆ ņ¬Įņ£╝ļĪ£ ļ░£ņāØĒĢ£ ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØ┤ ļ░śļ│ĄļÉśļŖö ĒÖ®ļ░śļČĆņóģĻ│╝ Ļ┤ĆļĀ©ļÉśņ¢┤ ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, Babiuch et al8ņØĆ ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØś ņĪ┤ņ×¼ļŖö ĒÖ®ļ░śņØś ļ»ĖņäĖĒśłĻ┤ĆņØś ļ╣äĻ┤Ćļźś ļ░Å ĒŚłĒśłĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ£╝ļ®░ ņØ┤ļŖö ĒŖ╣ņĀĢĒĢ┤ļČĆĒĢÖņĀü ĻĄ¼ņĪ░ļź╝ ņåÉņāüņŗ£ņ╝£ ĒÖ®ļ░śņØś ļČĆņóģĻ│╝ ņŗ£Ļ░ü ņĀĢļ│┤ ņĀäļŗ¼ņØś ņØ┤ņāüņØä Ļ░ĆņĀĖņś©ļŗżĻ│Ā ņĀ£ņŗ£ĒĢśņśĆļŗż. ļśÉĒĢ£ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ņĀä ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØĆ ĒÖ®ļ░śļČĆņóģ ņ×¼ļ░£ņØś ņŻ╝ļÉ£ ņ£äĒŚśņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ņ¢┤, Ē¢źĒøä ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØś Ļ░ØĻ┤ĆņĀüņØ┤Ļ│Ā ņĀĢļ¤ēņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ņČöĻ░ĆņĀüņ£╝ļĪ£ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.17-19
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ņ▓½ņ¦Ė, ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉ ļö░ļźĖ ĒÖśņ×É ņäĀņĀĢņŚÉņä£ņØś ĒÄĖĒ¢ź Ļ░ĆļŖźņä▒, ļæśņ¦Ė, ņĀüņØĆ ņłśņØś Ēæ£ļ│ĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░, ņģŗņ¦Ė, ĒÖ®ļ░śļČĆ ļŗ©ņĖĄ ņØ┤ļ»Ėņ¦Ćļ¦īņ£╝ļĪ£ ņŚ░ĻĄ¼ņ×É 1ņØĖņØś ņżæņŗ¼ļ¦Øļ¦ēļæÉĻ╗ś ļ░Å ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗ś, ļ¦Øļ¦ēļé┤ņĖĄņåÉņāü ļō▒ņØä ņŻ╝Ļ┤ĆņĀüņ£╝ļĪ£ ņĖĪņĀĢĒĢśņśĆļŗżļŖö Ļ▓āņŚÉ ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņ╣śļŻī ņĢĮļ¼╝ņØś ņóģļźśņŚÉ ņāüĻ┤ĆņŚåņØ┤ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņØ┤ļ»Ėņ¦Ćļ¦īņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£ ņ£äĒŚśņØĖņ×Éļź╝ ļ»Ėļ”¼ ņśłņĖĪĒĢśņśĆļŗżļŖö Ļ▓āņŚÉ ļ│Ė ņŚ░ĻĄ¼ņØś ņØśņØśĻ░Ć ņ׳Ļ▓Āļŗż.
ņÜöņĢĮĒĢśļ®┤, ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ņĀäĒøäņØś ņżæņŗ¼ļ¦źļØĮļ¦ēļæÉĻ╗śņØś Ļ░ÉņåīĒĢĀņłśļĪØ, ņ╣śļŻī ņĀäĒøäņØś ņĢłņĢĢņØ┤ Ļ░ÉņåīĒĢĀņłśļĪØ, ņ╣śļŻī ņĀä ļ░śļīĆņĢłĻ│╝ ņżæņŗ¼ņÖĆņĢäļל ļ¦źļØĮļ¦ēļæÉĻ╗śņØś ņ░©ņØ┤Ļ░Ć ņ׳ņØäņłśļĪØ, ņ╣śļŻī ņĀäĒøäņØś ļ¦Øļ¦ēļé┤ņĖĄņåÉņāüņØ┤ ņĀüņØäņłśļĪØ ĒÖ®ļ░śļČĆņóģņØś ņ×¼ļ░£ņØ┤ ņĀüņŚłļŗż. ņØ┤ņāüņØś Ļ▓░Ļ│╝ļź╝ ĒåĀļīĆļĪ£, ņ╣śļŻī ņĀä ĻĘĖļ”¼Ļ│Ā ņ╣śļŻī ņŗ£ņ×æ Ēøä 6Ļ░£ņøö ņØ┤ļé┤ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ņé¼ņ¦äņØä ĒÖ£ņÜ®ĒĢśņŚ¼ ĒÖśņ×ÉņØś ļŗ©ĻĖ░ ņ×¼ļ░£ Ļ░ĆļŖźņä▒ņØä ņśłņĖĪĒĢ┤ ļ│╝ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ļśÉĒĢ£ ņØ┤ļź╝ PRN ņÜöļ▓Ģ, T&E ņÜöļ▓Ģ ļśÉļŖö ļ╣äĻ┤Ćļźś ļČĆņ£ä ļĀłņØ┤ņĀĆĻ┤æņĢłņĀĆņłĀ ļō▒ņØś ņ╣śļŻī ļ░®ņ╣©ņØä Ļ▓░ņĀĢĒĢśļŖö ļŹ░ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Figure┬Ā1.
Flowchart of participant selection. Total 399 patients with a diagnosis of branch retinal vein occlusion (BRVO) from March 2022 to March 2023 who visited outpatient clinic were reviewed. After 344 patients who did not meet the criteria were excluded, 55 patients were finally included and divided into recurrence (n = 30) and non-recurrence (n = 25) groups. Recurrence group: patients with no improvement or recurrence of macular edema despite 5 or more injections within 12 months; non-recurrence group: patients whose macular edema improved with less than 3 injections within 6 months and was maintained without recurrence for more than 12 months after the first treatment.

Figure┬Ā2.
The representative SD-OCT and EDI-OCT image of each group. Manual measurements were performed by using the ruler of Heidelberg software. (A) Pre-treatment image of the non-recurrence group patient: CMT = 456 ╬╝m, SFCT = 331 ╬╝m. (B) Six months after the first intravitreal injection of the non-recurrence group patient: CMT = 226 ╬╝m, SFCT = 276 ╬╝m. (C) Pre-treatment image of the recurrence group patient: CMT = 663 ╬╝m, SFCT = 249 ╬╝m. (D) Six months after the first intravitreal injection of the recurrence group patient: CMT = 303 ╬╝m, SFCT = 274 ╬╝m. SD-OCT = spectral-domain optical coherence tomography; EDI-OCT = enhanced depth imaging optical coherence tomography; CMT = central macular thickness; SFCT = subfoveal choroidal thickness.

Figure┬Ā3.
The relationship between the non-recurrence group and the recurrence group. Although there seems to be a difference between the two groups in CMT, the amount and the rate of change did not show a significant difference (left panel). Although there seems to be no difference between the two groups in SFCT, the amount and the rate of change showed significant differences (right panel). The asterisk indicates statistical significance. CMT = central macular thickness; SFCT = subfoveal choroidal thickness.

Figure┬Ā4.
The comparison between baseline and 6 months after treatment of each group. Both CMT and SFCT are statistically significant in the non-recurrence group (left panel). In the recurrence group, only CMT is significantly different between baseline and 6 month (right panel). Wilcoxon signed-rank test was used. The asterisk indicates statistical significance. CMT = central macular thickness; SFCT = subfoveal choroidal thickness.
Figure┬Ā5.
The comparison of SFCT between the affected eye and the fellow eye of each group before treatment. In the non-recurrence group, SFCT is significantly different between affected eye and fellow eye. But, there is no significant difference in the recurrence group. Wilcoxon signed-rank test was used. The asterisk indicates statistical significance. SFCT = subfoveal choroidal thickness.

Table┬Ā1.
Comparison of clinical and demographic characteristics of the included patients (n = 55)
| Demographic | Total (n = 55) | Non-recurrence (n = 25) | Recurrence (n = 30) | p-value |
|---|---|---|---|---|
| Age (years) | 63.98 ┬▒ 12.32 | 59.44 ┬▒ 12.21 | 67.77 ┬▒ 11.26 | 0.011* |
| Sex | 0.270ŌĆĀ | |||
| ŌĆāMale | 22 (40) | 12 (48) | 10 (33.3) | |
| ŌĆāFemale | 33 (60) | 13 (52) | 20 (66.6) | |
| Affected eye | ||||
| ŌĆāRt. | 26 (47.3) | 11 (44.0) | 15 (50.0) | 0.660ŌĆĀ |
| ŌĆāLt. | 29 (52.7) | 14 (56.0) | 15 (50.0) | |
| ŌĆāSuperior | 27 (49.1) | 12 (48.0) | 15 (50.0) | 0.880ŌĆĀ |
| ŌĆāInferior | 28 (50.9) | 13 (52.0) | 15 (50.0) | |
| DM | 7 (12.7) | 4 (16.0) | 3 (10.0) | 0.690ŌĆĪ |
| HTN | 35 (63.6) | 17 (68.0) | 18 (60.0) | 0.540ŌĆĀ |
| Glaucoma | 11 (20.0) | 5 (20.0) | 6 (20.0) | 1.000ŌĆĪ |
| BMI | 24.48 ┬▒ 4.02 | 24.64 ┬▒ 5.17 | 24.36 ┬▒ 3.09 | 0.854* |
| PP | 57.31 ┬▒ 14.48 | 60.00 ┬▒ 14.89 | 55.00 ┬▒ 13.97 | 0.210* |
| No.injection | 5.71 ┬▒ 4.32 | 2.16 ┬▒ 0.80 | 8.67 ┬▒ 3.78 | <0.001┬¦ |
| Total f/u period | 44.13 ┬▒ 33.44 | 54.38 ┬▒ 39.44 | 35.59 ┬▒ 25.08 | 0.046* |
Table┬Ā2.
Comparison of central macular thickness and subfoveal choroidal thickness between the non-recurrence group and recurrence group
| Parameter | Total | Non-recurrence group | Recurrence group | p-value* |
|---|---|---|---|---|
| CMT | ||||
| ŌĆāBaseline | 619.04 ┬▒ 195.46 | 538.32 ┬▒ 160.53 | 686.30 ┬▒ 198.78 | 0.007 |
| ŌĆāAt 6 months | 302.71 ┬▒ 147.42 | 217.48 ┬▒ 33.95 | 373.73 ┬▒ 167.43 | <0.001 |
| ŌĆā╬öCMT | 316.33 ┬▒ 215.24 | 320.84 ┬▒ 167.10 | 312.57 ┬▒ 251.25 | 0.952 |
| ŌĆāpCMT (%) | 0.52 ┬▒ 0.25 | 0.56 ┬▒ 0.14 | 0.41 ┬▒ 0.30 | 0.137 |
| SFCT | ||||
| ŌĆāBaseline | 276.27 ┬▒ 66.76 | 286.36 ┬▒ 62.66 | 267.87 ┬▒ 69.92 | 0.666 |
| ŌĆāAt 6 months | 250.60 ┬▒ 66.19 | 243.56 ┬▒ 69.28 | 256.47 ┬▒ 64.09 | 0.259 |
| ŌĆā╬öSFCT | 25.67 ┬▒ 36.80 | 42.80 ┬▒ 32.96 | 11.40 ┬▒ 34.04 | 0.003 |
| ŌĆāpSFCT (%) | 0.91 ┬▒ 0.13 | 0.15 ┬▒ 0.12 | 0.04 ┬▒ 0.11 | <0.001 |
Table┬Ā3.
Comparison of visual acuity, IOP, spherical equivalent and DRIL between the non-recurrence group and recurrence group
| Parameter | Total | Non-recurrence group | Recurrence group | p-value* |
|---|---|---|---|---|
| BCVA (logMAR) | ||||
| ŌĆāBaseline | 0.61 ┬▒ 0.44 | 0.57 ┬▒ 0.48 | 0.65 ┬▒ 0.41 | 0.428 |
| ŌĆāAt 6 months | 0.32 ┬▒ 0.37 | 0.11 ┬▒0.40 | 0.50 ┬▒ 0.23 | <0.001 |
| ŌĆā╬öBCVA | 0.29 ┬▒ 0.54 | 0.45 ┬▒ 0.65 | 0.15 ┬▒ 0.40 | 0.039 |
| IOP (mmHg) | ||||
| ŌĆāBaseline | 16.33 ┬▒ 3.44 | 17.2 ┬▒ 3.20 | 15.60 ┬▒ 3.51 | 0.201 |
| ŌĆāAt 6 months | 15.73 ┬▒ 3.35 | 15.72 ┬▒ 3.30 | 15.73 ┬▒ 3.44 | 0.443 |
| ŌĆā╬öIOP | 0.60 ┬▒ 2.80 | 1.48 ┬▒ 2.28 | -0.13 ┬▒ 3.01 | 0.013 |
| ŌĆāSE | -1.63 ┬▒ 3.09 | -1.74 ┬▒ 3.23 | -1.54 ┬▒ 3.02 | 0.301 |
| DRIL | ||||
| ŌĆāBaseline | 48 | 19 | 29 | 0.039ŌĆĀ |
| ŌĆāAt 6 months | 31 | 4 | 27 | <0.001ŌĆĀ |
Values are presented as mean ┬▒ standard deviation or number.
BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution; ΔBCVA = baseline BCVA - 6 month BCVA; IOP = intraocular pressure; ΔIOP = baseline IOP - 6 month IOP; SE = spherical equivalent; DRIL = disorganization of retinal inner layers.
REFERENCES
1) Rogers SL, McIntosh RL, Lim L, et al. Natural history of branch retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010;117:1094-101.e5.


2) Cheung N, Klein R, Wang JJ, et al. Traditional and novel cardiovascular risk factors for retinal vein occlusion: the multiethnic study of atherosclerosis. Invest Ophthalmol Vis Sci 2008;49:4297-302.


3) Mitchell P, Smith W, Chang A. Prevalence and associations of retinal vein occlusion in Australia. The Blue Mountains eye study. Arch Ophthalmol 1996;114:1243-7.


4) Wong TY, Larsen EK, Klein R, et al. Cardiovascular risk factors for retinal vein occlusion and arteriolar emboli: the Atherosclerosis Risk in Communities & Cardiovascular Health studies. Ophthalmology 2005;112:540-7.


5) Kolar P. Risk factors for central and branch retinal vein occlusion: a meta-analysis of published clinical data. J Ophthalmol 2014;2014:724780.




6) Noma H, Yasuda K, Shimura M. Cytokines and the pathogenesis of macular edema in branch retinal vein occlusion. J Ophthalmol 2019;2019:5185128.




7) Asami S, Sugimoto M, Tsukitome H, et al. Anti-vascular endothelial growth factor treatment for macular edema in eyes with branch retinal vein occlusion with vs without glaucoma - does glaucoma affect visual outcome in eyes with BRVO-ME after antiVEGF injections? Clin Ophthalmol 2022;16:2275-83.




8) Babiuch AS, Han M, Conti FF, et al. Association of disorganization of retinal inner layers with visual acuity response to anti-vascular endothelial growth factor therapy for macular edema secondary to retinal vein occlusion. JAMA Ophthalmol 2019;137:38-46.


9) Wang H, Wang C, Zhang S, et al. Impact of anti-VEGF therapy on distinctive retina layers in patients with macular edema secondary to branch retinal vein occlusion. BMC Ophthalmol 2023;23:235.




10) Suzuki M, Nagai N, Minami S, et al. Predicting recurrences of macular edema due to branch retinal vein occlusion during anti-vascular endothelial growth factor therapy. Graefes Arch Clin Exp Ophthalmol 2020;258:49-56.



11) Tsuiki E, Suzuma K, Ueki R, et al. Enhanced depth imaging optical coherence tomography of the choroid in central retinal vein occlusion. Am J Ophthalmol 2013;156:543-7.e1.


12) Song M, Kim J, Choi J, Park JH. Changes in choroidal thickness in branch retinal vein occlusion. J Korean Ophthalmol Soc 2016;57:1222-7.

13) Sakanishi Y, Tamaki K, Mashimo K, et al. Relationship between recurrence of macular edema due to branch retinal vein occlusion and changes in choroidal thickness. Ophthalmic Res 2021;64:363-8.



14) Sakanishi Y, Morita S, Mashimo K, et al. Subfoveal choroidal thickness and treatment outcomes of intravitreal aflibercept for branch retinal vein occlusion. Life (Basel) 2021;11:572.



15) Hasegawa T, Kawano T, Maruko I, et al. Clinical findings of eyes with macular edema associated with branch retinal vein occlusion refractory to ranibizumab. Retina 2018;38:1347-53.


16) Polska E, Simader C, Weigert G, et al. Regulation of choroidal blood flow during combined changes in intraocular pressure and arterial blood pressure. Invest Ophthalmol Vis Sci 2007;48:3768-74.


17) Etheridge T, Blodi B, Oden N, et al. Spectral domain OCT predictors of visual acuity in the study of COmparative Treatments for REtinal Vein Occlusion 2: score 2 report 15. Ophthalmol Retina 2021;5:991-8.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 607 View
- 49 Download
- Related articles
-
Carotid Cavernous Fistula with Central Retinal Vein Occlusion2022 December;63(12)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



