 |
 |
| J Korean Ophthalmol Soc > Volume 64(10); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņĮöļĪ£ļéśļ░öņØ┤ļ¤¼ņŖżĻ░ÉņŚ╝ņ”Ø-19 ļ░▒ņŗĀ ņĀæņóģ Ēøä ļ░£ņāØĒĢ£ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż(Vogt-Koyanagi-Harada, VKH)ļ│æ 1ņśłļź╝ ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆņÜöņĢĮ
ĒŖ╣ņØ┤ Ļ│╝Ļ▒░ļĀź, ņĢłĻ│╝ņĀü ņłśņłĀļĀź ņŚåļŹś 53ņäĖ ņŚ¼ĒÖśņØ┤ COVID-19 ļ░▒ņŗĀ(Pfizer-BioNTech) 3ņ░© ņĀæņóģ ĒĢ£ ļŗ¼ ĒøäļČĆĒä░ ņŗ£ņ×æļÉ£ ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢś, ņČ®Ēśł, ņĢłĻĄ¼ĒåĄņ”Ø ļ░Å ļæÉĒåĄņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņ”Øņāü ļ░£Ēśä 1ņŻ╝ņØ╝ Ēøä ļ│ĖņøÉ ņ┤łņ¦ä ļŗ╣ņŗ£ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņÜ░ņĢł 0.63, ņóīņĢł 1.0ņØ┤ņŚłņ£╝ļ®░ ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņāü ņ¢æņĢłņŚÉ ņĀäļ░®ņŚ╝ņ”Ø 2+ ņåīĻ▓¼Ļ│╝ ļŹöļČłņ¢┤ ņĢłņĀĆĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĻ▓Ćņé¼ņāü ņ¢æņĢł ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļČĆņóģ, ļ¦źļØĮļ¦ē ņĀæĒל, ļŗżļ░£ņØś ĻĄŁņåīņĀü ņןņĢĪņä▒ ļ¦Øļ¦ēļ░Ģļ”¼, ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņłĀņāü ņ¢æņĢł ĒøäĻĘ╣ļČĆ ņĪ░ņśüņĀ£ ļłäņČ£ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ņŚÉ VKHļ│æ ņ¦äļŗ©ĒĢś ņĢłņĢĮ ļ░Å Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ņĀ£ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆĻ│Ā 2Ļ░£ņøö Ēøä ņÖäņĀäĒ׳ ĒśĖņĀäļÉśņŚłļŗż.
ABSTRACT
Case summary
A 53-year-old female patient with no history of systemic disease or ocular surgery presented with bilateral decreased visual acuity, hyperemia, eye pain, and headache 1 month after COVID-19 vaccination (Pfizer-BioNTech). She initially presented 1 week after symptom onset. Her best-corrected visual acuity was 0.63 in the right eye and 1.0 in the left eye, and she had bilateral grade 2 anterior chamber reactions on slit-lamp examination. Fundus photography, optical coherence tomography, and fluorescein angiography revealed bilateral optic disc swelling, choroidal folds, multiple serous retinal detachments, and fluorescein leakage at posterior poles. She was diagnosed with VKH disease and treated with topical and systemic medications, which completely resolved her symptoms over 2 months.
ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗż(Vogt-Koyanagi-Harada)ļ│æņØĆ ņ¢æņĖĪņä▒ ņ£ĪņĢäņóģņä▒ ĒżļÅäļ¦ēņŚ╝ņØ┤ ĒŖ╣ņ¦ĢņĀüņØ┤ļ®░ ņןņĢĪņä▒ ļ¦Øļ¦ēļ░Ģļ”¼, ņŗ£ņŗĀĻ▓ĮļČĆņóģĻ│╝ Ļ░ÖņØĆ ņĢłĻ│╝ņĀü ņ”ØņāüĻ│╝ ļŹöļČłņ¢┤ ļæÉĒåĄ, ņØ┤ļ¬ģ ļō▒ņØś ņŗĀĻ▓ĮĒĢÖņĀü ņ”Øņāü ļśÉĒĢ£ ļÅÖļ░śļÉĀ ņłś ņ׳ļŖö ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ ņ¦łĒÖśņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. Ēśäņ×¼ ļ░ØĒśĆņ¦ä ņŻ╝ļÉ£ ļ│æĒā£ņāØļ”¼ļŖö ļ¦źļØĮļ¦ē ļō▒ ņĀäņŗĀņØś ļ®£ļØ╝ļŗīņäĖĒżļź╝ Ēæ£ņĀüņ£╝ļĪ£ ĒĢśļŖö CD4+ TņäĖĒż ļ¦żĻ░£ ļ®┤ņŚŁļ░śņØæņØ┤ļ®░ ņØ┤ Ļ│╝ņĀĢņŚÉņä£ ņŚ¼ļ¤¼ ņé¼ņØ┤ĒåĀņ╣┤ņØĖļōżņØ┤ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.1
ņĮöļĪ£ļéśļ░öņØ┤ļ¤¼ņŖżĻ░ÉņŚ╝ņ”Ø-19 (COVID-19)ļŖö SARS-CoV-2 ļ░öņØ┤ļ¤¼ņŖżņŚÉ ņØśĒĢ£ ĻĖēņä▒ ĒśĖĒØĪĻĖ░ ņĀäņŚ╝ļ│æņ£╝ļĪ£ ņĀäņäĖĻ│äņĀü ņ£ĀĒ¢ēņŚÉ ļö░ļØ╝ ņŚ¼ļ¤¼ ļ░▒ņŗĀļōżņØ┤ Ļ░£ļ░£ļÉśņŚłĻ│Ā ļ░▒ņŗĀņØś ņŚ¼ļ¤¼ ļČĆņ×æņÜ®ļōż ņżæ ņĢłĻ│╝ņĀüņ£╝ļĪ£ļŖö ĒżļÅäļ¦ēņŚ╝, ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä, ņżæņŗ¼ņןņĢĪļ¦źļØĮļ¦Øļ¦ēļ│æņ”Ø, ĻĖēņä▒ ĒÖ®ļ░śņŗĀĻ▓Įļ¦Øļ¦ēļ│æņ”Ø ļō▒ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.2 ĻĘĖņżæ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀļŖö ņāüļīĆņĀüņ£╝ļĪ£ ļō£ļ¼Ė ņāüĒā£ļĪ£ ĻĄŁļé┤ņŚÉņä£ļŖö mRNA-1273 ļ░▒ņŗĀ(Moderna, Cambridge, MA, USA) ņØ┤Ēøä ļ░£ņāØĒĢ£ ņ”ØļĪĆļ¦īņØ┤ ļ░£Ēæ£ļÉśņŚłļŗż.3 ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ĻĄŁļé┤ņŚÉņä£ BNT162b2 ļ░▒ņŗĀ(Comirnaty, Pfizer-BioNTech, New York, NY, USA) ņĀæņóģ ņØ┤Ēøä ļ░£ņāØĒĢ£ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æ 1ņśłļź╝ ņĄ£ņ┤ł ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
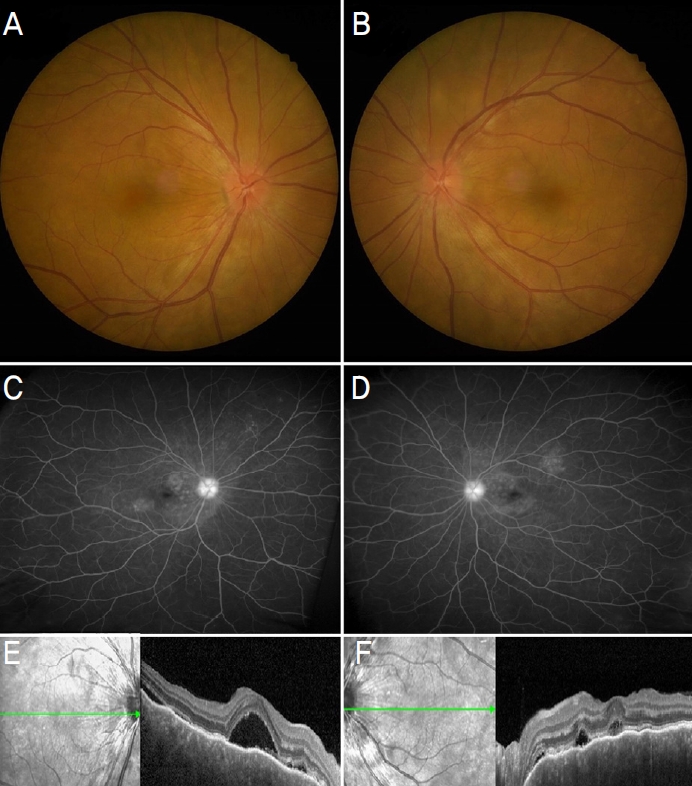
53ņäĖ ņŚ¼ņ×ÉĻ░Ć COVID-19 ļ░▒ņŗĀ(Pfizer-BioNTech) 3ņ░© ņĀæņóģĒĢ£ ļŗ¼ ĒøäļČĆĒä░ ņŗ£ņ×æļÉ£ ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢś, ņČ®Ēśł, ņĢłĻĄ¼ĒåĄņ”Ø ļ░Å ļæÉĒåĄņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. Ļ│Āņ¦ĆĒśłņ”Ø ņÖĖ ĒŖ╣ņØ┤ ļé┤Ļ│╝ņĀü ņ¦łĒÖśņØś Ļ│╝Ļ▒░ļĀźņØĆ ņŚåņŚłņ£╝ļ®░ ņĢłĻ│╝ņĀü ĒŖ╣ņØ┤ ļ│æļĀź ļśÉĒĢ£ ņŚåļŖö ĒÖśņ×ÉņśĆļŗż. ņ”Øņāü ļ░£Ēśä 1ņŻ╝ņØ╝ Ēøä ļ│ĖņøÉ ņ┤łņ¦ä ļŗ╣ņŗ£ ļéśņĢłņŗ£ļĀź(Snellen) ņ¢æņĢł 0.5 ļ░Å Ēśäņä▒ĻĄ┤ņĀłĻ▓Ćņé¼ņŚÉ ņØśĒĢ£ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņÜ░ņĢł 0.63, ņóīņĢł 1.0ņØ┤ņŚłņ£╝ļ®░, ļ╣äņĀæņ┤ē ņĢłņĢĢĻ│äļĪ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØĆ ņÜ░ņĢł 19 mmHg, ņóīņĢł 21 mmHgņśĆļŗż. ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņāü ņ¢æņĢłņŚÉ ņĀäļ░®ņŚ╝ņ”Ø 2+ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā ņĢłņĀĆĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĻ▓Ćņé¼ņāü ņ¢æņĢł ņŗ£ņŗĀĻ▓Įņ£ĀļæÉļČĆņóģ, ļ¦źļØĮļ¦ē ņĀæĒל, ļŗżļ░£ņØś ĻĄŁņåīņĀü ņןņĢĪņä▒ ļ¦Øļ¦ēļ░Ģļ”¼, ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņłĀņāü ņ¢æņĢł ĒøäĻĘ╣ļČĆ ņĪ░ņśüņĀ£ ļłäņČ£ ļśÉĒĢ£ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1). ņØ┤ņŚÉ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņ£╝ļĪ£ ņ¦äļŗ©ĒĢś 0.5% levofloxacin (Cravit, Santen Pharmaceutical, Osaka, Japan)Ļ│╝ 1% prednisolone acetate (Predforte┬«, Allergan Inc., Irvine, CA, USA)ļź╝ ņ¢æņĢł 4ņŗ£Ļ░äļ¦łļŗż ņĀÉņĢł ļ░Å Ļ▓ĮĻĄ¼ prednisolone (Solondo, Yuhan Corporation, Seoul, Korea) ĒĢśļŻ© 30 mgņö® 2ņ░©ļĪĆ, ņ┤Ø 60 mg ļ│ĄņÜ®ņ£╝ļĪ£ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż.
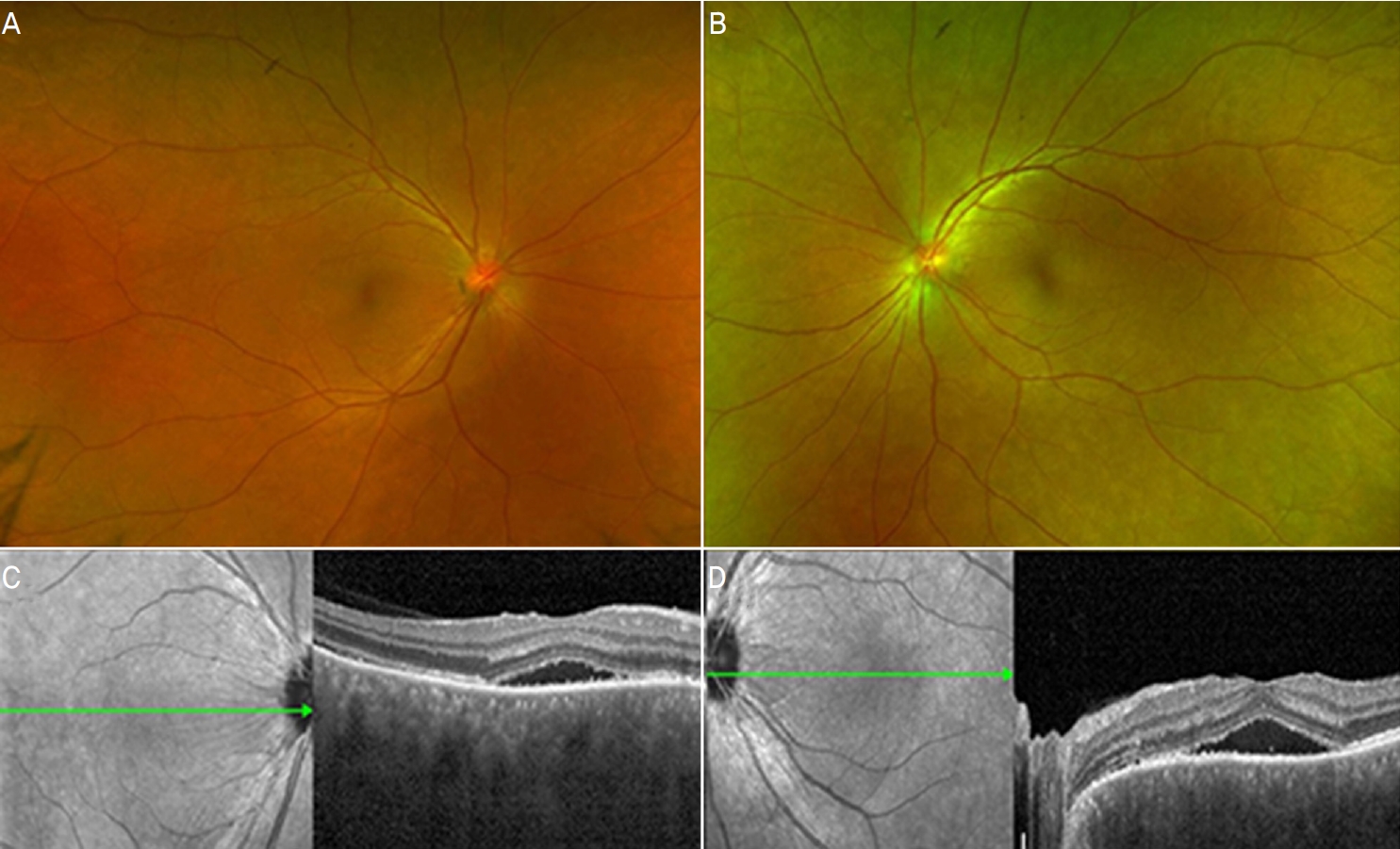
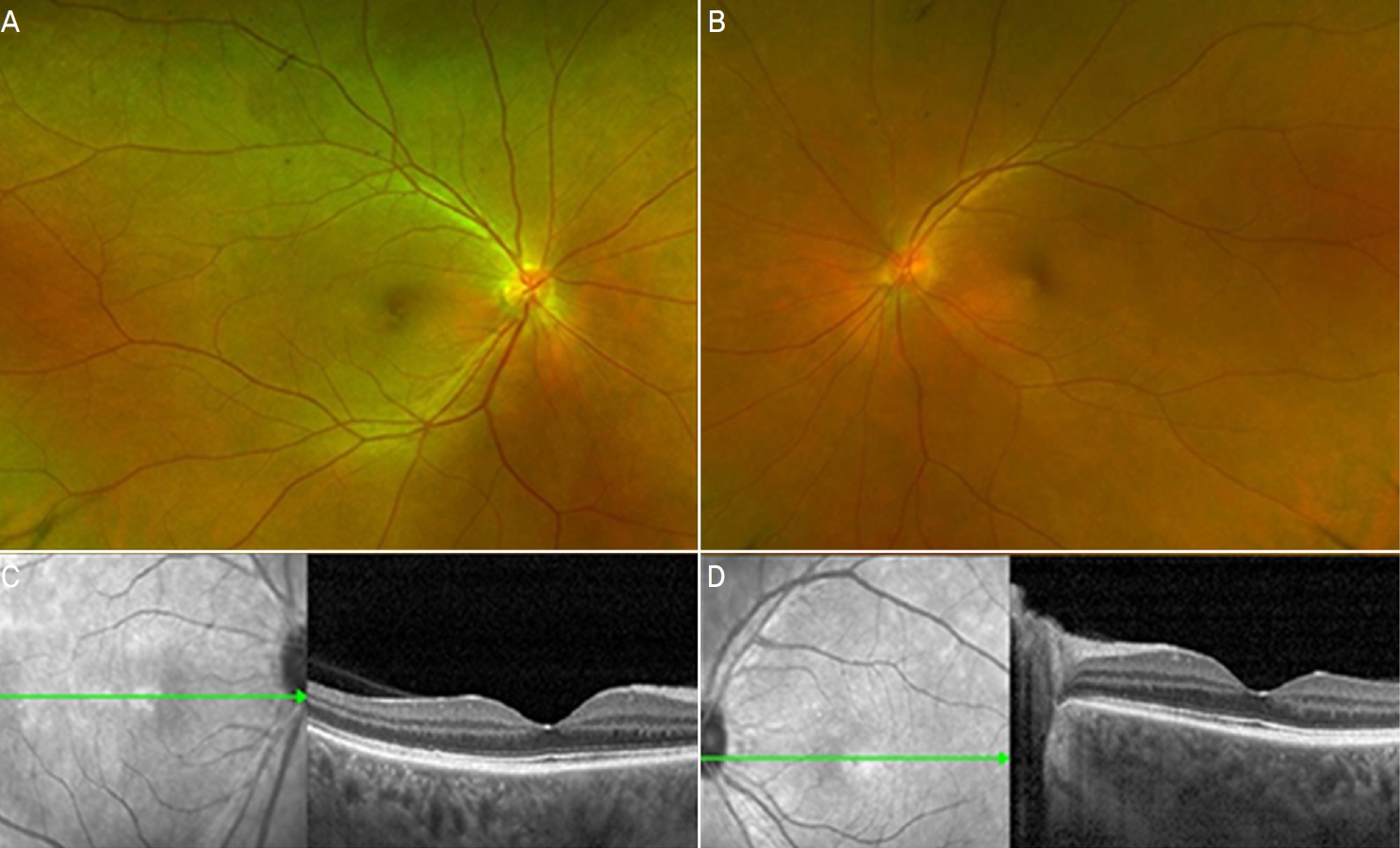
1ņŻ╝ņØ╝ Ēøä ļé┤ņøÉĒĢ£ ņÖĖļלņŚÉņä£ ļéśņĢłņŗ£ļĀźņØĆ ņÜ░ņĢł 0.3, ņóīņĢł 0.15ļĪ£ ļŗżņåī Ļ░ÉņåīĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņ£╝ļéś ņ¢æņĢł ņĢłĻĄ¼ĒåĄņ”Ø ļ░Å ņŗ£ņĢ╝ĒØÉļ”╝ņŚÉ ļīĆĒĢ£ ņŻ╝Ļ┤ĆņĀü ņ”ØņāüņØĆ ļ¦ÄņØ┤ ĒśĖņĀäļÉ£ ņāüĒā£ņśĆĻ│Ā ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņŚÉņä£ ņĀäļ░®ņŚ╝ņ”ØņØĆ Ļ▒░ņØś Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļśÉĒĢ£ ņĢłņĀĆ Ļ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĻ▓Ćņé¼ ņāüņ£╝ļĪ£ļÅä ņ¢æņĢł ļ¬©ļæÉ ņןņĢĪļ¦Øļ¦ēļ░Ģļ”¼ Ļ░Éņåī ņåīĻ▓¼ņØä ļ│┤ņŚ¼ ņĢłņĢĮ ĒĢśļŻ© 4ļ▓ł ļ░Å Ļ▓ĮĻĄ¼ ņĢĮņĀ£ 1ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ 10 mgņö® Ļ░Éļ¤ēĒĢśļ®░ Ļ▓ĮĻ│╝ļź╝ ĒÖĢņØĖĒĢśņśĆļŗż(Fig. 2). Ļ▓░Ļ│╝ņĀüņ£╝ļĪ£ 2Ļ░£ņøö Ēøä ļé┤ņøÉĒĢ£ ņÖĖļלņŚÉņä£ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź ņ¢æņĢł 1.0ņ£╝ļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā ņĀäļ░®ņŚ╝ņ”Ø ņŚåņØ┤ ņ¢æņĢł ļ¦Øļ¦ēņØ┤ ņÖäņĀäĒ׳ ņĀĢņāüĒÖöļÉ£ Ļ▓āņØ┤ ĒÖĢņØĖļÉśņ¢┤ ļ¬©ļōĀ ņĢĮņØä ņżæļŗ©ĒĢśņśĆņ£╝ļ®░ ĻĘĖļĪ£ļČĆĒä░ 3Ļ░£ņøö ĒøäņØĖ ļ¦łņ¦Ćļ¦ē ņÖĖļלņŚÉņä£ ĒÖĢņØĖĒĢ£ Ļ▓Ćņé¼ ņāüņ£╝ļĪ£ļÅä ņ×¼ļ░£ņØĆ ĒÖĢņØĖļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 3).
ļ│Ė ņ”ØļĪĆļŖö ĒŖ╣ņØ┤ ņĢłĻ│╝ņĀü ļ│æļĀź ļ░Å ņłśņłĀļĀź ņŚåļŖö ĒÖśņ×ÉņŚÉņä£ BNT162b2 ļ░▒ņŗĀ ņĀæņóģ ĒĢ£ ļŗ¼ Ēøä ļ░£ņāØĒĢ£ ļæÉĒåĄ, ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢś, ņĀäļ░®ņŚ╝ņ”Ø, ņןņĢĪņä▒ ļ¦Øļ¦ēļ░Ģļ”¼, ņŗ£ņŗĀĻ▓ĮļČĆņóģ ļ░Å ļ¦źļØĮļ¦ēņŚ╝ ņåīĻ▓¼ņ£╝ļĪ£ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ņØ┤ļŗż. ņŗżņĀ£ ĒĢ┤ņÖĖ ļģ╝ļ¼ĖņØä ĒåĄĒĢ┤ ļ│┤Ļ│ĀļÉ£ COVID-19 ļ░▒ņŗĀ ņĀæņóģ Ēøä ņĢłĻ│╝ņĀü ņØ┤ņāü ļ░śņØæļōżņØä ņé┤ĒÄ┤ļ│┤ļ®┤ ņłśņØ╝ņŚÉņä£ ņłśņŻ╝Ļ╣īņ¦Ć ļŗżņ¢æĒĢ£ ĒśĢĒā£ļĪ£ ļČĆņ×æņÜ®ņØ┤ ļ░£ņāØĒĢ£ Ļ▓āņØä ņĢī ņłś ņ׳ņ£╝ļ®░ ņżæņ”ØņØś Ļ▓ĮņÜ░ ĒżļÅäļ¦ēņŚ╝ņØ┤ Ļ░Ćņן ĒØöĒĢśņśĆĻ│Ā ĻĘĖ ļ░¢ņŚÉļÅä ņŗ£ņŗĀĻ▓ĮņŚ╝, ļ¦Øļ¦ēĒśłĻ┤Ć ņ¦łĒÖś ļō▒ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż.2,4
ĻĘĖņżæ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņŚÉ ļīĆĒĢ£ ņ”ØļĪĆļŖö ļŗżņä» ņśłĻ░Ć ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░ ĻĄŁļé┤ņŚÉņä£ļŖö mRNA-1273 ļ░▒ņŗĀ ņĀæņóģ ņØ┤Ēøä ļ░£ņāØĒĢ£ ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ĒĢ┤ņÖĖ ļģ╝ļ¼Ėļ¦īņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż.3,5-8 ĒŖ╣ņØ┤ Ļ│╝Ļ▒░ļĀź ņŚåļŹś 50ņäĖ ņŚ¼ĒÖśņØ┤ ņ▓½ ļ░▒ņŗĀ ņĀæņóģ 35ņØ╝ ņØ┤Ēøä ļ░£ņāØĒĢ£ ņ¢æņĢłņØś ņŗ£ļĀźņĀĆĒĢś, ņĢłĻĄ¼ĒåĄ, ļæÉĒåĄņ£╝ļĪ£ ļé┤ņøÉĒĢś ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ļĪ£ mRNA-1273 ļ░▒ņŗĀņØĆ ļ│Ė ņ”ØļĪĆņØś BNT162b2 ļ░▒ņŗĀĻ│╝ ņ£Āņé¼ĒĢ£ ļ░®ņŗØņØś mRNA ļ░▒ņŗĀņØ┤ļØ╝ļŖö ņĀÉņŚÉņä£ ņ£ĀņØśļ»ĖĒĢ£ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż.3 ņØ┤ ļ░¢ņŚÉļÅä ļÅÖņØ╝ĒĢ£ BNT162b2 ļ░Å ņĢäļŹ░ļģĖļ░öņØ┤ļ¤¼ņŖż ļ▓ĪĒä░ ļ░▒ņŗĀņØĖ AZD1222 (Oxford/AstraZeneca) ļō▒ ļŗżņ¢æĒĢ£ ņóģļźśņØś ļ░▒ņŗĀņŚÉ ļīĆĒĢ┤ņä£ļÅä ļ╣äņŖĘĒĢ£ ņ”ØļĪĆļōżņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż.5-7 ļśÉĒĢ£ ļ░▒ņŗĀ ņĀæņóģ ņÖĖņŚÉļÅä ņŗżņĀ£ COVID-19 Ļ░ÉņŚ╝ Ēøä ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņ£╝ļĪ£ ņ▓½ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ļÅä ņ׳ņŚłļŗż.9,10 Ēśäņ×¼Ļ╣īņ¦Ć mRNA ļ░▒ņŗĀ Ēł¼ņŚ¼Ļ░Ć ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØä ņ£Āļ░£ĒĢśļŖö ņĀĢĒÖĢĒĢ£ ĻĖ░ņĀäņØĆ ņĢīļĀżņ¦ä ļ░öĻ░Ć ņŚåņ£╝ļéś, Ļ░ĆļŖźĒĢ£ ļ░£ņāØ ĻĖ░ņĀäņ£╝ļĪ£ļŖö ņÜ░ņäĀ mRNA ņĀäļŗ¼ Ļ│╝ņĀĢņŚÉņä£ ļČäņ×ÉņĀü ņ£Āņé¼ņä▒ņ£╝ļĪ£ Ļ┤ĆļĀ©ļÉ£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ ĒÖ£ņä▒ĒÖöļÉśņ¢┤ ņ×ÉĻ░Ćļ®┤ņŚŁ ļ░śņØæņØä ņ£Āļ░£ĒĢśņśĆņØä ņłś ņ׳ļŗż.11 ļśÉĒĢ£, RNA ļ░▒ņŗĀņØś ņ¦Ćņ¦łļéśļģĖņ×ģņ×É(mRNA-containing lipid nanoparticles) ļśÉļŖö ļ®┤ņŚŁņ”ØĻ░ĢņĀ£(adjuvant)Ļ░Ć ļ®┤ņŚŁļ░śņØæņØä ĒĢŁņ¦äņŗ£ņ╝£ ļ®┤ņŚŁĒĢÖņĀü ļČłĻĘĀĒśĢņØä Ļ░ĆņĀĖņÖöņØä ņłś ņ׳ļŗż.12 Ēśäņ×¼Ļ╣īņ¦ĆļŖö ļ░▒ņŗĀ Ēł¼ņŚ¼Ļ░Ć ĻĖ░ņ¦łņĀüņ£╝ļĪ£ ņåīņØĖņØ┤ ņ׳ņ¢┤ Ļ▓░ĻĄŁ ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØ┤ ļ░£ĒśäļÉĀ ĒÖśņ×ÉņŚÉņä£ ļ░£ļ│æņØä ņĢ×ļŗ╣ĻĖ░ļŖö Ļ▓āņØĖņ¦Ć ņĀĢĒÖĢĒ׳ ņĢīĻĖ░ ņ¢┤ļĀĄļŗż. ļ│┤ĻĘĖĒŖĖ-Ļ│ĀņĢ╝ļéśĻĖ░-ĒĢśļØ╝ļŗżļ│æņØś ņŻ╝ļÉ£ ļ│æĒā£ņāØļ”¼ļŖö CD4+ TņäĖĒż ļ¦żĻ░£ ļ®┤ņŚŁļ░śņØæņØ┤ļ®░ ĒŖ╣Ē׳ TņäĖĒżļŖö interleukin (IL)-17, IL-23 ļō▒ņØś ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØä ĒåĄĒĢ┤ ņŚ╝ņ”Øļ░śņØæņØä ņØ╝ņ£╝Ēé©ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░ ņ×äņāü ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ COVID-19 mRNA ļ░▒ņŗĀ ņĀæņóģ Ēøä ļ╣äņŖĘĒĢ£ ĻĖ░ņĀäņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīļŗż.1,13-15
ņØ┤ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ļÅÖņØ╝ ļ░▒ņŗĀņØś 3ņ░© ņĀæņóģņØ┤ņŚłļŗżļŖö ņĀÉ, ņĀæņóģĒĢ£ ļŗ¼ Ēøä ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆļŗżļŖö ņĀÉņŚÉņä£ ĒÖĢņŗżĒĢ£ ņŚ░Ļ┤Ćņä▒ņØĆ ļČĆņĪ▒ĒĢĀ ņłś ņ׳ļŗż. ņĄ£ĻĘ╝ ļ░£Ēæ£ļÉ£ COVID-19 ļ░▒ņŗĀ Ļ┤ĆļĀ© ĒżļÅäļ¦ēņŚ╝ ĒÖśņ×ÉļōżņØś ļīĆĻĘ£ļ¬© ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņØ┤ņāüļ░śņØæņØĆ ļīĆĻ░£ 1ņ░© ņĀæņóģ Ēøä, 1ņŻ╝ ņØ┤ļé┤ ļ░£ņāØĒĢśņśĆļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż.16 ĒĢśņ¦Ćļ¦ī COVID-19 ļ░▒ņŗĀ Ēøä ļ░£ņāØĒĢ£ ĻĄŁļé┤ ņżæņČöņŗĀĻ▓ĮĻ│ä ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖś ļ│┤Ļ│ĀņŚÉņä£ ļ░▒ņŗĀņØś ņł£ņä£ļŖö ņ”Øņāü ļ░£ĒśäņŚÉ Ēü░ ņŚ░Ļ┤ĆņØ┤ ņŚåņØīņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳Ļ│Ā ļ░▒ņŗĀ Ēł¼ņŚ¼ņÖĆ ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖś ļ░£ņāØ ņé¼ņØ┤ ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ£ ņĀĢĒÖĢĒĢ£ ņŗ£Ļ░äņĀü ĻĖ░ņżĆņØ┤ ņŚåļŖö ņāüĒā£ņŚÉņä£ ļŗżļźĖ ņ£Āļ░£ ņÜöņØĖņØ┤ ņŚåļŖö ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ļ░▒ņŗĀ ņ£Āļ░£ Ļ░ĆļŖźņä▒ņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż.17 ļśÉĒĢ£ ļ│Ė ņ”ØļĪĆļź╝ ĒżĒĢ©ĒĢśņŚ¼ ļīĆļŗżņłśņØś ĒÖśņ×ÉņŚÉņä£ Ļ▓ĮĻĄ¼ ņŖżĒģīļĪ£ņØ┤ļō£ ļ░Å ņĢłņĢĮ ņ╣śļŻīļ¦īņ£╝ļĪ£ļÅä ĒśĖņĀäļÉśņŚłĻ│Ā ļīĆĻĘ£ļ¬© ņŚ░ĻĄ¼ ņāüņ£╝ļĪ£ļÅä ļ░▒ņŗĀ ņĀæņóģ Ļ┤ĆļĀ© ĒżļÅäļ¦ēņŚ╝ņØś ļ╣äņ£©ņØ┤ ĒśäņĀĆĒ׳ ļé«ņĢä ņĀæņóģ ņŗ£ ņĢłĻ│╝ņĀü ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ņČ®ļČäĒĢ£ ņäżļ¬ģņØä ĒåĄĒĢ┤ ļ╣ĀļźĖ ņ╣śļŻīĻ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ł Ļ▓ĮņÜ░, ļ│┤ļŗż ņĢłņĀäĒĢ£ ļ░▒ņŗĀ ņĀæņóģņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.16
Figure┬Ā1.
Initial fundus examinations using multimodal imaging. Fundus photography showed optic disc swelling with choroidal folds at the posterior poles in right and left eyes (A, B). Fluorescein angiography showed vascular leakages and pooling in the late stage of right and left eyes (C, D). Multiple serous retinal detachments with choroidal folds were noted in optical coherence tomography images of right and left eyes (E, F).
Figure┬Ā2.
Fundus examinations after 1 week of treatment. Optomap showed improvement of choroidal folds in right and left eyes (A, B). Only serous retinal detachments in macula remained with improved choroidal folds and optic disc swelling in optical coherence tomography images of right and left eyes (C, D).
REFERENCES
2) Bolletta E, Iannetta D, Mastrofilippo V, et al. Uveitis and other ocular complications following COVID-19 vaccination. J Clin Med 2021;10:5960.



3) Joo CW, Kim YK, Park SP. Vogt-Koyanagi-Harada disease following mRNA-1273 (Moderna) COVID-19 vaccination. Ocul Immunol Inflamm 2022;30:1250-4.


4) Ng XL, Betzler BK, Testi I, et al. Ocular adverse events after COVID-19 vaccination. Ocul Immunol Inflamm 2021;29:1216-24.


5) Koong LR, Chee WK, Toh ZH, et al. Vogt-Koyanagi-Harada disease associated with COVID-19 mRNA vaccine. Ocul Immunol Inflamm 2021;29:1212-5.


6) De Domingo B, L├│pez M, Lopez-Valladares M, et al. Vogt-KoyanagiHarada disease exacerbation associated with COVID-19 vaccine. Cells 2022;11:1012.



7) Saraceno JJF, Souza GM, Dos Santos Finamor LP, et al. Vogt-KoyanagiHarada syndrome following COVID-19 and ChAdOx1 nCoV-19 (AZD1222) vaccine. Int J Retina Vitreous 2021;7:49.




8) Chen X, Wang B, Li X. Acute-onset Vogt-Koyanagi-Harada like uveitis following COVID-19 inactivated virus vaccination. Am J Ophthalmol Case Rep 2022;26:101404.



9) Yamaguchi C, Kunikata H, Hashimoto K, et al. De novo Vogt-KoyanagiHarada disease after vaccination for COVID-19, successfully treated with systemic steroid therapy and monitored with laser speckle flowgraphy. Am J Ophthalmol Case Rep 2022;27:101616.



10) Yepez JB, Murati FA, Petitto M, et al. Vogt-Koyanagi-Harada disease following COVID-19 infection. Case Rep Ophthalmol 2021;12:804-8.




11) Rossella T. Do COVID-19 RNA-based vaccines put at risk of immune-mediated diseases? In reply to ŌĆ£potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseasesŌĆØ. Clin Immunol 2021;224:108665.



12) Teijaro JR, Farber DL. COVID-19 vaccines: modes of immune activation and future challenges. Nat Rev Immunol 2021;21:195-7.




13) Bettini E, Locci M. SARS-CoV-2 mRNA vaccines: immunological mechanism and beyond. Vaccines (Basel) 2021;9:147.



14) Chi W, Yang P, Li B, et al. IL-23 promotes CD4+ T cells to produce IL-17 in Vogt-Koyanagi-Harada disease. J Allergy Clin Immunol 2007;119:1218-24.


15) Hotez PJ, Bottazzi ME, Corry DB. The potential role of Th17 immune responses in coronavirus immunopathology and vaccine-induced immune enhancement. Microbes Infect 2020;22:165-7.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 651 View
- 58 Download
- Related articles
-
Two Cases of Cataract after COVID-19 mRNA Vaccine Injection2022 December;63(12)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



