|
 |
| J Korean Ophthalmol Soc > Volume 65(4); 2024 > Article |
|
국문초록
목적
본 연구는 대한민국 울산지역의 유일한 상급 종합병원에 COVID-19 백신 접종 후 안과적 이상사례가 발생하여 내원한 환자들의 이상사례의 종류 및 빈도에 대해 조사하여 백신과의 연관성에 대해 분석하였다.
대상과 방법
2021년 3월부터 2022년 8월까지 COVID-19 백신 접종 후 울산대병원에 내원한 안과적 불편감이 발생하여 내원한 환자들에 대한 후향적 단면 연구이다. 관련된 임상 자료는 울산대학교병원의 전자 의무기록과 임상데이터 수집 플랫폼에서 수집되었다.
결과
연구일 기준 울산시에서 총 2,766,569회의 COVID-19 백신 접종이 이루어 졌고 본원에서 총 확인된 안과적 이상사례는 97건이며, 21건은 비가역적인 후유증이 남았다. 발생시기는 접종 후 1주일 이내에 나타났으며(평균: 5.06 ± 6.86일), 가장 흔한 증상은 시력 저하이며(67건), 안구통증(19건), 복시(16건) 순이다. 비가역적으로 진행된 경우 밝혀진 원인 질환으로 뇌졸중과 같은 뇌신경 질환(7건), 망막 질환(5건), 녹내장(5건) 순이다. 이상사례 유발 백신 빈도는 BNT162b2가 가장 높으며(34건), ChAdOx1 (30건), mRNA-1273 (20건), Ad26.COV2.S (4건) 순이다.
ABSTRACT
Purpose
This study explored the types and incidences of adverse ophthalmic adverse events after COVID-19 vaccination and their associations with such vaccination in patients who presented to the sole local, tertiary, general hospital in region Ulsan of South Korea complaining of ophthalmic discomfort after COVID-19 vaccination.
Methods
This cross-sectional study was conducted at Ulsan University Hospital, which is the only tertiary general hospital in Ulsan city. All participants visited the hospital from March 2021 to August 2022 complaining of ophthalmic discomfort after COVID-19 vaccination. Clinical variables were collected from both our clinical data warehouse and the electronic medical records of the hospital.
Results
To date, 2,766,569 COVID-19 vaccine doses have been administered in Ulsan city. A total of 97 cases of vaccination-related adverse ophthalmic events have been confirmed. In 21 of these cases, irreversible sequelae persisted after the side-effects. Most symptoms developed within 1 week after vaccination (mean 5.06 ± 6.86 days). The most common symptom was visual disturbance (67 cases), followed by ocular pain (19 cases) and double vision (16 cases). The most frequent diagnoses associated with irreversible sequelae were neurological diseases (7 cases), retinal diseases (5 cases), and glaucoma (5 cases). The frequencies of side effects were highest for those of BNT162b2 status (34 cases), followed by those of ChAdOx1 (30), mRNA-1273 (20), and Ad26.COV2.S (4).
COVID-19 질병의 발생 이후로 이전에 없던 수준의 백신 접종 캠페인이 전 세계적으로 이루어졌다. 2022년 8월까지 전세계적으로 백신은 대략 125억 회분이 접종되었다. COVID-19 백신 접종에 대해 전세계적으로 통계가 관리되는 기관인 Our World in Data에 따르면 이 기간 동안 한국에서는 약 1억 3000만 회분의 백신이 접종되었다고 한다.
COVID-19 백신의 효능과 안전성을 평가하기 위해 승인 전에 다양한 임상시험이 진행되었으며, 승인 이후에도 주사 부위 통증, 발적과 같은 국소적인 이상사례부터 두통, 피로 등 전신적인 이상사례에 대한 보고들이 있었다.1-3 그러나 백신이 긴급하게 승인되었으며 임상시험 대상자는 일반인보다 건강한 사람들을 대상으로 하기 때문에, 임상시험에서 관찰된 이상사례와 실제 접종 후 발생하는 이상사례 사이에 차이가 있을 수 있다. 따라서 백신 접종 프로그램이 시작된 이후에도 접종자들은 이상사례에 대해 모니터링을 받아야 한다.
COVID-19 백신과 관련된 안과적 이상사례에 대한 몇 가지 연구들이 보고되었다.4-6 한국에서도 백신 접종 후 발생한 안과적 이상사례에 관한 2건의 증례보고가 있었다.7,8 또한 백신 접종 후 발생한 비동맥염 앞허혈시신경병증 및 눈 운동장애에 대한 국내 다기관 연구에 대해서도 보고된 바가 있다.9,10 하지만 아직까지 저자들이 알기로 국내에서 COVID-19 백신 접종 이후 전반적인 안과적 이상사례에 대한 대단위 연구가 없다. 울산광역시의 인구는 110만 명이며, 2021년 3월부터 COVID-19 백신 접종이 시작되었으며 2022년 8월까지 2,766,569회 분의 접종이 진행되었다. 이 시기에 백신 접종 이후 여러가지 안과적 이상사례로 본원을 방문한 환자들이 많았다. 질병과 백신이 새로운 것이었기 때문에, COVID-19 백신 접종 후 불편을 겪은 환자들은 이 지역의 유일한 상급 병원을 대부분 찾았을 것으로 예상되었다. 따라서 본 연구는 이 시기에 울산대학교병원을 방문한 환자들을 대상으로 COVID-19 백신 접종 후 발생한 안과적 이상사례를 인구 기반으로 분석하고, 접종 후 안구 합병증을 평가하고자 한다.
본 연구는 후향적, 단면 연구로 울산대학교병원 임상연구심의위원회의 승인을 받았다(IRB No. 2023-01-026). 본 연구는 헬싱키선언의 원칙을 준수하였다. 연구의 후향적, 기존 자료 분석의 특성으로 인해 개인 동의 요구는 면제되었다.
연구에 사용된 정보들은 Ulsan University Hospital Information of Clinical Ecosystem (uICE)에서 수집되었다. uICE는 본원의 빅데이터센터에서 만들어낸 연구 검색 시스템으로, 환자들의 모든 의무 기록에서 특정 단어가 들어간 기록들을 추출할 수 있다. 이전의 여러 문헌들에서 본원의 uICE 시스템을 이용하여 데이터 추출 및 작성을 하였다.11,12 본 저자들은 이 플랫폼을 이용하여 COVID-19 백신 접종 개시 시점인 2021년 3월부터 2022년 8월까지의 환자의 주관적인 안과 증상을 포함한 안과적 이상사례가 있는 환자들을 평가하였다. 우선, 가능성 있는 데이터 소실을 최소화하기 위해 ‘코로나’, ‘백신’, ‘COVID’가 들어간 환자들을 선택하였다. 이후 이들 중 ‘안구’, ‘시력’, ‘시야’, ‘복시’, ‘흐리게’, ‘우안’, ‘좌안’, ‘눈꺼풀’, ‘VA’, ‘visual’ 그리고 ‘field’가 의무기록에 포함된 모든 환자들을 일차 추출하였다. 이렇게 추출된 환자들은 기타 다른 백신과 관련이 있거나, 코로나 감염 이후 발생한 이상사례이거나, 코로나 백신 접종을 받았지만 그와 상관없는 일반적인 진료를 받은 환자들 등이 포함되어 있을 가능성이 있어, 저자들 중 한 명이(H.C.Y) 추출된 47,201명의 모든 의무기록을 직접 검토하여 최종적으로 COVID-19 백신 접종 이후 발생한 안과적 이상사례 환자들만 수집하였다.
본 연구는 전향적 코호트 연구가 아닌 후향적 단면 연구로서, 안과적 이상사례가 백신 때문에 발생하였다는 것을 직접적으로 시사하지는 못한다. 이에 Barda et al6이 이전 후향적 연구에서 기술한 것처럼 백신 접종이 이상사례에 영향을 미쳤을 가능성은 시간적인 인과관계를 보고 판단한 것을 인용하였다. 해당 문헌에서 적용하였듯이 환자들은 접종 7일 이전에 질병 등으로 병원을 내원한 적이 없으며, 1회 접종 후 최대 21일 이내 이상사례가 발생한 경우를 백신과 관련된 이상사례로 설정하였다.6 비가역적인 후유증의 경우 이상사례들이 6개월 이상 지속되는 것으로 정의하였다.
본 연구에서 분석한 백신의 종류는 연구 시점에 한국에서 사용 가능한 4가지 종류였다: BNT162b2 mRNA SARS-CoV-2 vaccine (Comirnaty, BioNTech/Pfizer, Mainz, Germany; 이하 Pfizer), AZD1222 ChAdOx1 nCoV-19 vaccine (Vaxzevria, AstraZeneca, Cambridge, UK; 이하 Astrazeneca), Moderna mRNA-1273 COVID-19 vaccine (Spikevax, ModernaTX, Inc., Cambridge, MA, USA; 이하 Moderna), Ad26.COV2.S vaccine (Jcovden, Janssen-Cilag International NV, Beerse, Belgium; 이하 Janssen).
COVID-19 백신에 의한 이상사례를 유발하는 위험 요인은 명확히 밝혀져 있지 않기 때문에, Barda et al6이 제시하였던 것과 같이 미국 질병통제예방센터(Centers for Disease Control and Prevention, CDC)가 발표한 COVID-19 감염 시 중증 감염으로 발전하는 위험 요인에 대하여 파악하여 이에 대해 통계 분석을 수행하였다. CDC의 위험 요인은 “확실한” 및 “가능한” 기준에 따라 분류되었다. “확실한” 위험 요인으로는 종양, 만성 신장 질환, 심장 질환, 2형 당뇨병, 흡연이 포함되고, “가능한” 위험 요인으로는 천식, 뇌혈관 질환, 호흡기 질환, 고혈압, 신경과 질환, 간질환이 포함된다.
각 인자들의 결과값은 SPSS 24.0 for Windows (IBM Corp., Armonk, NY, USA)를 이용하여 분석하였다. Logistic regression model을 사용하여 비가역적인 후유증과 위험 요인 간의 관계를 추정하였다. p값이 0.05보다 작으면 95% 신뢰 구간에서 통계적으로 유의미한 것으로 간주하였다.
2021년 3월 1일부터 2022년 8월 31일까지 울산시 질병예방 통제센터(Ulsan Center for Infectious Disease Control & Prevention)에 따르면, 울산광역시에서 백신 접종된 총 횟수는 2,766,569회였다. 이 기간을 연구 기간으로 하였고 저자들은 uICE에서 47,201건의 일차 추출 데이터를 수집하였다. 수집된 환자들의 모든 전자 의무기록을 검토하여 COVID-19 백신 접종 후 97건의 안과적 이상사례가 확인되었으며, 여기에는 76건의 가역적인 후유증 및 21건의 비가역적인 후유증을 확인하였다(Fig. 1).
본 연구에서는 총 97명의 안과적 이상사례가 확인되었고, 전체 환자 중 남성과 여성의 비율은 거의 동일하며 각각 47.4% (46/97)와 52.6% (51/97)였다. 이상사례를 보인 환자들의 평균 연령은 54세였다. 연령을 여섯 개 그룹으로 분류하였으며, 50-59세 그룹과 60-69세 그룹이 전체 연령 그룹 중 가장 높은 발생률을 보였다. 백신별 안과적 이상사례의 발생은 Pfizer는 34건(35.0%), Astrazeneca는 30건(30.9%), Moderna는 20건(20.6%), Janssen는 4건(4.1%) 순이었으며 백신의 종류가 확인되지 않은 경우는 9건(9.3%)이었다(Table 1). 접종 횟수와의 상관관계를 보았을 때 안과적 이상사례는 주로 1차 접종 후에 발생하였으며, 그 다음은 2차, 3차 접종 순으로 발생하였다(Table 1, 2). 백신 접종부터 증상 발생까지의 평균 시간은 5.06 ± 6.86일이었다. 위험 요인들에 대해 분석하였을 때 97명 중 48명은 어떠한 위험 요인도 갖고 있지 않았으며, 49명은 한 가지 이상의 위험 요인을 가지고 있었으며, 위험 요인 중 2형 당뇨병과 고혈압이 가장 흔하였다(Table 1).
환자가 호소하는 증상 및 징후의 빈도는 시력저하가 67건(59.3%)으로 가장 흔하였으며 그 다음은 안구통증이 19건(16.8%), 복시가 16건(14.2%), 안검부종이 4건(3.5%), 안검하수가 2건(1.8%), 결막하 출혈이 2건(1.8%), 가려움증이 2건(1.8%) 순이었다(Table 3). 그리고 이러한 빈도는 백신 접종 차수가 올라가도 거의 비슷한 추세를 보였다(Table 2). 추가적으로 안과적으로는 무증상이었으나, 전신 출혈이 발생하여 시행한 검사 중에 발견된 망막출혈 1건(0.9%)이 있었다. 가장 흔한 안과적 이상사례인 시력저하는 조사한 모든 백신에서 가장 흔히 발생한 이상사례였으나, Pfizer 및 Astrazeneca 백신 사용 시 가장 빈도가 높았다. 안구통증은 두 번째로 흔한 안과적 이상사례며, Moderna로 접종 시 발병률이 높았다. Pfizer의 경우 안구통증보다 복시의 발병률이 더 높았다(Table 4). 시력저하를 일으킨 67명 중 안과 진료를 받은 사람은 34명이며, 망막 질환(8명, 23.5%)이 가장 많이 나타났으며, 뇌신경 질환(7명, 20.6%), 녹내장(3명, 8.8%) 순이었다(Table 5).
안과적 이상사례에서 비가역적인 후유증은 97명 중 21명(22%)에서 발생하였다. 비가역적인 후유증을 유발하는 가장 흔한 질환 중 원인을 알 수 있었던 경우는 뇌신경 질환(7건), 망막 질환(5건), 녹내장(5건) 순이었다. 뇌신경 질환 7건 중 뇌졸중으로 진단된 경우가 4건이 있었고 2건은 뇌신경마비가 의심되었으며 1건은 크로이츠펠트-야콥병이 진단되었다. 망막 질환과 관련된 경우가 5건이 있었으며 세부적으로 유리체출혈이 2건, 망막정맥폐쇄가 2건 그리고 나이관련황반변성이 진단되었던 환자에서의 비가역적 시력 저하가 1건 있었다. 녹내장 질환과 관련된 경우도 5건이 있었으며 세부적으로 이차성 녹내장으로 진단된 경우가 3건, 기존의 녹내장 진단하 조절이 되던 환자에서의 급성으로 안압상승이 발생한 경우가 1건, 급성 폐쇄각녹내장으로 진단되어 레이저 홍채절개술을 한 경우가 1건이 있었다. 특히 녹내장 질환과 관련된 5건 중 3건은 약물로 조절되지 않아 수술까지 시행되었다. 이 외에도 시신경염이 온 경우가 2건, 안와의 염증성 질환 1건, 백내장의 악화 1건, 원인미상 1건이 확인되었다(Table 6). 이들 중 최종적으로 나이관련황반변성이 진단된 환자에서 초기에 시행한 안저검사 및 빛간섭단층검사에서 망막출혈 및 황반부 삼출물이 확인되었다(Fig. 2A). 시신경염에서도 시행한 안저검사 및 빛간섭단층검사에서 우안의 시신경유두부종 소견이 확인되었다(Fig. 2B). 보그트-고야나기-하라다병이 발생한 경우도 있었는데, 이들의 초기 검사에서 양안의 맥락막 접힘, 다발의 국소적 장액성 망막박리 소견이 확인되었다(Fig. 2C). 추가적으로 전신이상으로 인해 내원하여 혈액암이 진단된 환자에서 시행한 검사에서 중심망막정맥폐쇄로 인해 발생하였을 것으로 추정되는 광범위한 망막출혈 소견이 확인되었다(Fig. 2D).
비가역적인 후유증 발생에 영향을 줄 수 있는 통계적으로 유의한 CDC 위험인자는 본 연구에서는 없는 것으로 확인되었다(p>0.05) (Table 7).
COVID-19의 특수한 상황에서 조기에 도입된 백신 접종 후에 여러 이상사례들이 보고되어 왔다. 제3상 임상시험에서 림프절염, 안면신경마비, 충수염, 과민반응, 급성 심근염, 뇌혈관 질환 등의 이상사례가 관찰되었다.1,2 백신의 출시 이후 CDC는 혈전증 및 혈소판 감소 증후군(thrombosis with thrombocytopenia syndrome, TTS), 길랭-바레 증후군(Guillain-Barre syndrome, GBS), 심낭염이 COVID-19 백신과 관련이 있을 수 있다고 보고하였다. 다른 연구들에서는 백신 접종 후 안과적 이상사례와 관련된 증례들이 보고되었다. Austria et al13은 Pfizer 백신 접종 후 안검부종을 겪은 3명의 여성에 대한 증례를 보고하였으며, Bayas et al14은 Astrazeneca 접종 후 안구통증과 복시를 경험한 55세 여성의 증례를 보고하고 상안정맥 혈전증으로 진단하였다. Mudie et al15은 Pfizer 접종 후 안구통증을 경험한 43세 여성의 증례를 보고하고 포도막염으로 진단하였다. Bialasiewicz et al16은 Pfizer 접종 후 시력저하를 경험한 50세 남성의 증례를 보고하고 망막중심정맥폐쇄로 진단하였다. Eleiwa et al17은 Astrazeneca 접종 후 복시를 경험한 46세 남성의 증례를 보고하고 도르래 신경마비로 진단하였다. 한국에서는 Moderna 및 Pfizer로 접종 후 백내장 발생 증례와 Astrazeneca 백신으로 접종 후 독성전안부증후군 증례 등 2건의 안과적 이상사례 증례가 보고되었다.7,8 저자들이 알기로는 국내에서는 본 연구와 같은 지역 인구에서 발생한 안과적 이상사례에 대한 연구가 진행된 적이 없다.
COVID-19 감염에서는 고령자의 사망률이 높은 반면, 본 연구에서는 백신 접종과 안과적 이상 및 비가역적인 후유증 발생과는 중년층 이상으로 갈수록 빈도가 많았으며 50-69세 사이에 환자 발생이 가장 많았다(Table 1). 백신 종류 중 Pfizer가 가장 높은 이상사례 빈도를 보였으며, Astrazeneca, Moderna 순으로 나타났는데, 추정해볼 수 있는 이유로는 본 연구 시기에 한국의 백신 접종량은 질병관리청에 따르면 가장 많은 것이 Pfizer이며 다음으로 Astrazeneca, Moderna 순서인 것으로 보아 안정성이 100% 확보되기 전 백신에서는 접종량이 많을수록 이상사례가 많을 수 있을 것으로 생각된다. 안과적 이상사례의 빈도에서 시력저하가 가장 흔한 안과적 이상사례고, 안구통증과 복시 순이다. Haseeb et al4에 의하면 시력저하의 주요한 원인은 전방염증에 기인하는 경우가 많았으며, 백신과 관련된 포도막염의 경우 COVID-19 백신뿐 아니라 인플루엔자, B형간염, 천연두, 홍역-유행성-이하선염-풍진, 대상포진, 인유두종바이러스 백신 등에서도 보고되어 왔다.18 COVID-19 백신 단백질의 면역원성과 포도막 혹은 망막의 분자적 유사성에 대한 가능성이 제시되고 있다. 이와 관련하여 대규모의 다기관 연구가 Rabinovitch et al19에 의해 수행되었다. 해당 연구에는 21명(23안)의 환자가 포함되었고, 두 명을 제외한 모든 환자가 스테로이드 치료로 호전되었다.
본 연구에서 시력저하의 전방염증 외의 원인으로는 뇌신경 질환과 망막 질환이 확인되었다. 뇌신경 질환에는 뇌졸중, 뇌신경마비 등의 질환이 확인되었다. 뇌졸중의 원인으로 백신 접종 후 혈전이 발생하거나 면역 관련 혈전으로 뇌졸증이 생기고 이와 관련된 시력상실이 발생하였다는 보고가 있었다.4,20
본 연구에서 복시 증상이 온 환자들에서의 원인으로는 뇌신경마비로 진단된 경우가 많았지만 대부분 뇌 자기공명영상을 포함한 영상검사에서 특이한 소견은 발견되지 않았다. 자기공명영상에서 이상 소견이 관찰되지 않은 것은 말초신경의 국소적인 허혈로 인해 발생한 것으로 추정된다. 백신으로 인한 뇌신경마비로 인한 복시는 이전에도 인플루엔자, B형간염, 천연두, 홍역-유행성이하선염-풍진 백신에서도 발생하였다는 보고가 있었고, 이때 제시된 기전으로는 뇌신경의 면역 매개성 탈수초 또는 일시적인 허혈과 같은 이론들이었지만, 정확한 기전은 명확히 확인되지 않고 있다.6,21
Elnahry et al,22 Pawar et al23의 증례에서 보고하였듯이 본 연구에서도 시신경염이 두 건 발생하였다. COVID-19 백신 접종 후 발생하는 시신경염의 추정 발생 기전으로는 시신경 수초의 단백질과 바이러스 입자 간의 분자 유사성, 항원결정기 확산, 방관자 T세포 활성화, 초항원 활성화 등이 백신 접종 후 자가면역성 시신경염을 야기하는 것이다.17,24-28 본 연구에서 안구통증은 특이 소견이 발견되지 않은 경우도 있었지만, 전방염증, 고안압 등에서 나타났으며 대부분은 시간이 지나면서 호전이 되었으나 5안에서는 녹내장으로 약물 치료 및 수술적 치료가 필요하였다.
앞에서 확인한 본 연구의 안과적 이상사례는 대부분 일시적이었으며, 일부 증례에서만 비가역적인 후유증으로 남았다. 초기의 안과적 이상사례가 발생한 환자군을 선택할 때 주관적인 증상이 중요한 기준 중 하나였음으로, 경미한 경우 안과 진료를 못 본 경우가 흔하였고 증상에 대한 안과적 진단이 내려지지 않은 경우가 있었다. 하지만 비가역적인 후유증을 발생시킨 경우 한 명을 제외한 모든 환자들이 안과 진료를 받았으며, 진료를 받지 않은 한 명의 경우 복시 증상이 있었으나 급성으로 중증의 의식저하가 진행되어 안과 진료를 받지 못하였으며 최종적으로 크로이츠펠트-야콥병으로 진단받고 사망한 경우였다. 비가역적인 후유증이 지속된 뇌신경 질환(뇌졸중, 뇌신경마비 등)은 시야 장애나 복시의 증상을 야기하며 다른 질환들보다 비가역적인 후유증을 일으킬 가능성이 높았다. 이와 관련하여 COVID-19 백신 접종 후 혈전증 및 색전증이 증가한다는 연구가 이전에도 보고된 바 있다.29 이러한 현상은 COVID-19 백신이 아닌 다른 백신(홍역-유행성이하선염-풍진, 인플루엔자, 폐렴구균, 수두 백신)에서도 보고되었으며 백신 유발 혈전성 혈소판감소증(vaccine-induced thrombotic thrombocytopenia, VITT)이라고 불린다.6,20 코로나 백신 중 VITT는 특히 Astrazeneca 백신과 관련되었지만, 본 연구에서는 백신 종류에 따른 뇌졸중 등의 혈전성 질환의 유의한 연관성은 없었다. 비가역적인 후유증이 지속된 안과 질환의 경우로는 망막 질환(망막혈관폐쇄 등), 녹내장, 시신경염, 안와의 염증 질환, 백내장의 악화 등이 있었다. 망막의 질환으로는 유리체출혈 2건, 망막정맥폐쇄 2건이 포함되어 있으며 이는 앞서 말한 망막혈관의 혈전증으로 인해 발생하였을 수 있을 수 있다.4,29 녹내장의 경우 포도막염과 관련되었을 수 있으나 추가적인 연구가 필요할 것으로 생각된다.4,19
전국적으로 백신과 관련된 이상사례가 있을 경우 의료기관에서 질병관리청으로 신고하는 시스템이 있다. 하지만 아직까지 이상사례가 정확히 밝혀지지 않은 백신에 대해, 의료인 1인이 주관적으로 백신과의 관련성 여부를 판단하여 보고하기 때문에 많은 환자들이 누락될 수 있다. 또한 해당 시스템에 의해 발생한 이상사례에서 안과적 이상사례는 보고서에서 ‘시력저하’만 포함되어 있으며, 해당 항목은 이상사례 신고서 중 ‘시력’이라는 단어가 들어간 모든 사람을 집계한 것이어서 정확하지 않다고 보고서에 언급되어 있다. 본 연구에서는 안과적 이상사례로 눈 주변 부종에서부터 안구통증, 복시뿐 아니라 시력이나 시야에 영향을 줄 수 있는 경우 등 환자들이 안과를 찾을 수 있다고 생각되는 대부분의 증상들을 포함한 것이 보다 더 임상적이며 현실적인 결과라고 할 수 있다. 일부 질환들의 경우 최종 진단은 뇌졸중 등과 같이 중한 신경과의 질환으로 진단되었으나, 그 질환이 나타내는 증상들 중 복시, 시야장애, 시력저하와 같이 안과적 이상사례가 발생하는 경우에도 연구에 포함시킴으로써 실제로 안과에 이러한 증상을 가지고 찾아오는 환자를 살펴보았다는 것에 보다 임상적으로 의의를 가질 수 있다. 연구 기간 동안 질병관리청을 통해 보고된 이상사례의 경우 시력저하는 1,105건이 보고되었으며 해당 기간 동안 추정 발생률은 약 0.0009% (1,105/128,346,698)이다. 울산시에서 백신 접종 이후 안과적 이상사례가 발생한 모든 환자가 울산대학교병원으로 내원하지는 않았을 수 있으나, 울산시의 유일한 상급종합병원이라는 점에서 울산시 전체 백신 접종량과 비교하였을 때 증상의 발생률을 대략적으로 추정하여 보았을 때 0.0035% (97/2,766,569)로 추정할 수 있다. 안과적 이상사례뿐 아니라 전신적인 이상사례를 대상으로 시행한 이스라엘에서 시행한 대규모 연구 결과에 따르면, 유일한 안과적인 부작용인 포도막염의 경우 발생률이 0.0028% (26/933,217)로 확인되었다.6 이들 세 수치의 차이가 발생하는 이유로는 질병관리청 및 이스라엘의 연구에서 수집하지 않은 안과적 이상사례의 경우도 본 연구에서는 모두 포함하였기 때문으로 판단되며, 특히 질병관리청과의 발생률의 차이가 큰데 이는 시력저하를 보인 모든 환자들이 질병관리청으로 보고되지 않았을 가능성이 있을 것으로 생각된다.
본 연구에는 몇 가지 제한사항이 있다. 무엇보다도, 후향적 연구이면서 의무기록 분석을 통한 빅데이터 연구로 시행한 연구이기에, Bradford Hill의 기준 중 시간적 선후관계만을 만족시킨 연구로서 연구 결과가 인과성이 명확하지 않으며 단순한 상관관계만을 나타낼 수 있다는 근본적인 약점이 있다. 따라서, 예방 접종을 받은 그룹과 받지 않은 그룹 사이의 안과적 이상사례를 동시에 비교하기 위해서는 추가적인 전향적 코호트 연구가 필요하다. 둘째, 울산시 시민 중 안과적 이상사례를 경험하였지만 병원이나 의원을 방문하지 않은 환자들이 있을 수 있다. 그러나 이러한 경우는 의료적 개입이 적극적으로 필요하지 않았기 때문에 의미 있는 이상사례가 아니라고 고려할 수 있다. 셋째, 울산대학교 병원 이외의 시설을 방문한 안과적 이상사례를 가진 환자들이 있을 수 있다. 이러한 경우, 증상이 경미하고 지역 의원에서 해결될 수 있는 경우라면 전문 의료를 요하는 충분히 심각한 안과적 이상사례가 아니라고 추정해 볼 수 있다. 이와 더불어, 저자들의 병원이 해당 지역의 유일한 상급종합병원이며 안과 응급실을 운영하는 다른 병원이 없기 때문에 중대한 안과적 이상사례를 가진 대부분의 환자들이 저자들의 병원에 방문하였을 것으로 추정할 수 있다. 이러한 점이 다른 지역에서 수행된 연구와 비교할 때 본 연구가 가지는 강점이라 생각한다.
본 연구는 COVID-19 백신 접종 후 안과적 이상사례가 발생한 경우를 분석해 보았다. 시간적 선후관계만을 대상으로 하여 인과성이 부족하다는 한계점이 있지만, 백신 접종 후 이상사례의 경우 인과관계의 증명이 힘들다는 점에서 무시할 수 없는 결과라 할 수 있겠다. 다만 본 연구의 많은 이상사례들 중 인과성이 확립된 것도 있지만, COVID-19 백신이 아닌 다른 백신들에서도 보고되어 왔던 이상사례들도 있어 COVID-19 백신이 다른 백신들보다 더 위험하다고 생각할 수는 없겠다. COVID-19 감염은 풍토병으로 진행되어 독감 예방접종과 같이 지속적으로 백신 접종이 필요할 것으로 생각되며, 백신 접종자의 수 대비 이상사례 발생 건수를 비교해 보면 매우 적은 수준으로 현 시점에도 주기적인 백신 접종이 권장되고 있다. 이에 백신 접종 후 안과적 이상사례가 있을 수 있고 특히 뇌신경 질환, 망막 질환, 녹내장이 동반된 경우 비가역적인 안과적 이상사례가 나타날 수 있음을 유념하며 추적 관찰이 필요하다. 또한 COVID-19 백신 접종과 이상 반응과의 인과관계, 위험인자를 살펴보는 추가적인 연구가 필요하다.
Figure 1.
Overview of the study population. uICE = Ulsan University Hospital Information of Clinical Ecosystem.
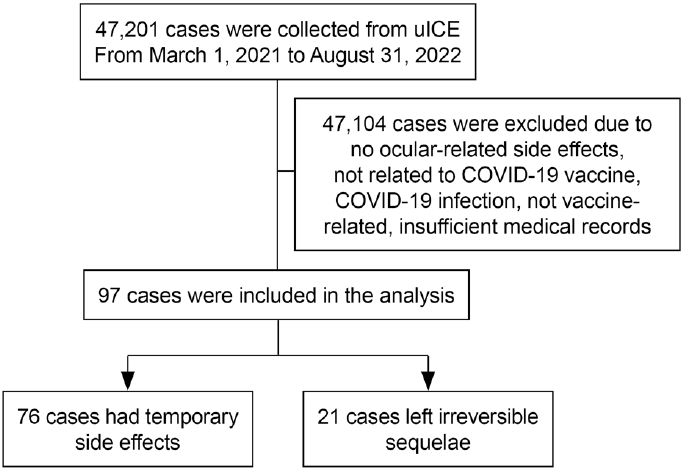
Figure 2.
Ophthalmic images of patients with ophthalmic adverse events. (A) Patient diagnosed with wet age-related macular degeneration following examination. The image reveals retinal hemorrhage. (B) Patient diagnosed with optic neuritis post-examination. (C) Patient diagnosed with Vogt-Koyanagi-Harada disease after experiencing bilateral vision loss. (D) Patient diagnosed with hematologic malignancy, where extensive bilateral retinal hemorrhage is observed.
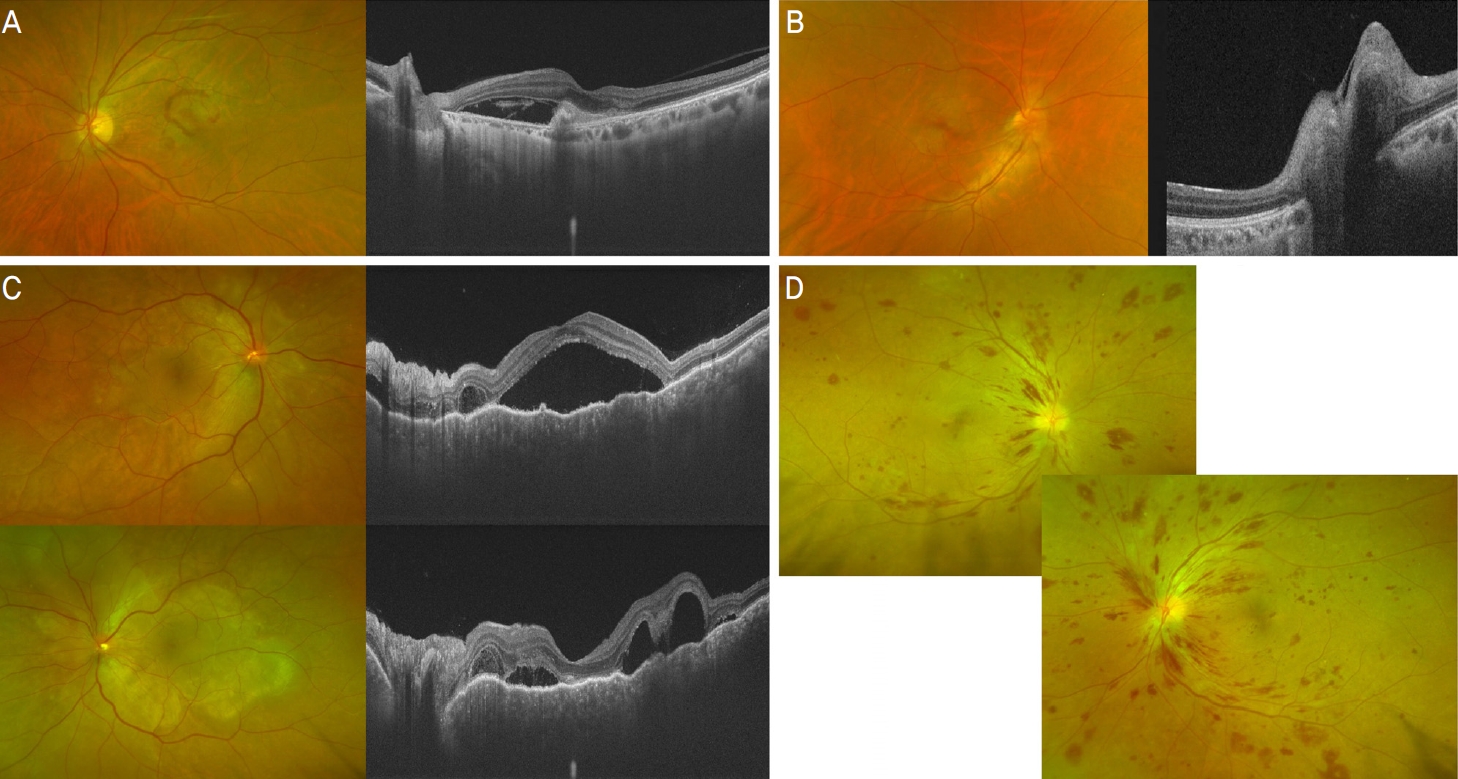
Table 1.
Demographics and clinical characteristics of patients with ophthalmic adverse events (n = 97 cases)
Table 2.
Distribution of ophthalmic adverse events according to the number of vaccinations (multiple responses reflected)
Table 3.
Frequency of ophthalmic adverse events (multiple responses reflected)
| Symptom | Value |
|---|---|
| Visual disturbance | 67 (59.3) |
| Ocular pain | 19 (16.8) |
| Diplopia | 16 (14.2) |
| Periorbital edema | 4 (3.5) |
| Ptosis | 2 (1.8) |
| Subconjunctival hemorrhage | 2 (1.8) |
| Itching | 2 (1.8) |
| Other | 1 (0.9) |
Table 4.
Distribution of ophthalmic adverse events according to the type of vaccine (multiple responses reflected)
Table 5.
Frequency of diagnosis due to visual disturbance (n = 34)
| Diagnosis | Value |
|---|---|
| Retinal disease | 8 (23.5) |
| Neurological disease | 7 (20.6) |
| Glaucoma | 3 (8.8) |
| Optic neuritis | 2 (5.9) |
| Cataract | 1 (2.9) |
| Corneal graft rejection | 1 (2.9) |
| Unknown | 12 (35.3) |
Table 6.
Etiology of irreversible ophthalmic adverse events according to the type of vaccine
| Symptom | Pfizer | Astrazeneca | Moderna | Janssen | Unknown* |
|---|---|---|---|---|---|
| Neurological disease | 3 | 0 | 1 | 3 | 0 |
| Cerebrovascular disease | 2 | 0 | 1 | 1 | 0 |
| Cranial nerve palsy | 0 | 0 | 0 | 2 | 0 |
| Other brain disease | 1 | 0 | 0 | 0 | 0 |
| Retinal disease | 0 | 1 | 2 | 0 | 2 |
| Glaucoma | 2 | 2 | 0 | 1 | 0 |
| Optic neuritis | 2 | 0 | 0 | 0 | 0 |
| Orbital inflammatory disease | 0 | 0 | 1 | 0 | 0 |
| Cataract | 1 | 0 | 0 | 0 | 0 |
Table 7.
Risk factors associated with irreversible sequelae
|
Univariate analysis |
|||
|---|---|---|---|
| Odds ratio | 95% CI | p-value* | |
| CDC certain risk | |||
| No | Reference | ||
| Yes | 1.875 | 0.648-5.421 | 0.246 |
| CDC possible risk | |||
| No | Reference | ||
| Yes | 1.031 | 0.388-2.739 | 0.951 |
REFERENCES
1) Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020;383:2603-15.

2) Baden LR, El Sahly HM, Essink B, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2021;384:403-16.

3) Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARSCoV-2: an interim analysis of four randomized controlled trials in Brazil, South Africa, and the UK. Lancet 2021;397:99-111.


4) Haseeb AA, Solyman O, Abushanab MM, et al. Ocular complications following vaccination for COVID-19: a one-year retrospective. Vaccines 2022;10:342.



5) Kang MC, Park KA, Min JH, Oh SY. Myasthenia gravis with ocular symptoms following a ChAdOx1 nCoV-19 vaccination: a case report. Am J Ophthalmol Case Rep 2022;27:101620.



6) Barda N, Dagan N, Ben-Shlomo Y, et al. Safety of the BNT162b2 mRNA COVID-19 vaccine in a nationwide setting. N Engl J Med 2021;385:1078-90.


7) Yoon E, Choi J, Ahn M, Park M. Two cases of cataract after COVID-19 mRNA vaccine injection. J Korean Ophthalmol Soc 2022;63:1033-7.

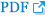
8) Ryu KJ, Kim DH. A toxic anterior segment syndrome-like ocular inflammatory reaction after COVID-19 vaccination. J Korean Ophthalmol Soc 2022;63:625-9.

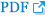
9) Moon Y, Jung JH, Shin HJ, et al. Non-arteritic ischemic optic neuropathy following COVID-19 vaccination in Korea: a case series. J Korean Med Sci 2023;38:e95.



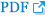
10) Park KA, Jeon H, Choi DG, et al. Ocular motility disorders following coronavirus disease‑19 vaccination. Graefes Arch Clin Exp Ophthalmol 2023;261:1127-39.


11) Chae G, Jun JB, Jung HS, et al. Histiocytic pleural effusion: the strong clue to malignancy. World J Surg Oncol 2021;19:180.



12) Jeon YJ, Han S, Park GM, et al. Intramuscular and intermuscular abdominal fat infiltration in COPD: a propensity score matched study. Int J Chron Obstruct Pulmon Dis 2021;16:1989-99.



13) Austria QM, Lelli GJ, Segal KL, Godfrey KJ. Transient eyelid edema following COVID-19 naccination. Ophthalmic Plast Reconstr Surg 2021;37:501-2.


14) Bayas A, Menacher M, Christ M, et al. Bilateral superior ophthalmic vein thrombosis, ischaemic stroke, and immune thrombocytopenia after ChAdOx1 nCoV-19 vaccinationn. Lancet 2021;397:e11.


15) Mudie LI, Zick JD, Dacey MS, et al. Panuveitis following vaccination for COVID-19. Ocul Immunol Inflamm 2021;29:1-2.


16) Bialasiewicz AA, Farah-Diab MS, Mebarki HT. Central retinal vein occlusion occurring immediately after 2nd dose of mRNA SARS-CoV-2 vaccine. Int Ophthalmol 2021;41:3889-92.



17) Eleiwa TK, Gaier ED, Haseeb A, et al. Adverse ocular events following COVID-19 vaccination. Inflamm Res 2021;70:1005-9.



18) Cunningham ET, Moorthy RS, Fraunfelder FW, Zierhut M. Vaccine-associated uveitis. Ocul Immunol Inflamm 2019;27:517-20.


19) Rabinovitch T, Ben-Arie-Weintrob Y, Hareuveni-Blum T, et al. Uveitis following the BNT162b2 mRNA vaccination against SARS-CoV-2 infection: a possible association. Retina 2021;41:2462-71.

20) Schultz NH, Sørvoll IH, Michelsen AE, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med 2021;384:2124-30.


21) Santovito LS, Pinna G. Acute reduction of visual acuity and visual field after Pfizer-BioNTech COVID-19 vaccine 2nd dose: a case report. Inflamm Res 2021;70:931-3.



22) Elnahry AG, Asal ZB, Shaikh N, et al. Optic neuropathy after COVID-19 vaccination: a report of two cases. Int J Neurosci 2021;133:901-7.


23) Pawar N, Maheshwari D, Ravindran M, Padmavathy S. Ophthalmic complications of COVID-19 vaccinations. Indian J Ophthalmol 2021;69:2900-2.



26) McCoy L, Tsunoda I, Fujinami RS. Multiple sclerosis and virus induced immune responses: autoimmunity can be primed by molecular mimicry and augmented by bystander activation. Autoimmunity 2006;39:9-19.


27) Miller SD, Vanderlugt CL, Begolka WS, et al. Persistent infection with Theiler’s virus leads to CNS autoimmunity via epitope spreading. Nat Med 1997;3:1133-6.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print