 |
 |
| J Korean Ophthalmol Soc > Volume 64(10); 2023 > Article |
|
국문초록
대상과 방법
2010년부터 2019년까지 국민건강보험공단에서 습성 나이관련황반변성으로 등록된 환자 정보를 토대로 발생률, 유병률, 주사 치료 횟수 및 비용에 대한 연도별 기술통계를 작성하였다. 치료제 전환 분석 시 두 약제로 치료하였거나 최초 진단 이후 1년 이내 사망자 및 2019년도 발생자는 제외하였다. 치료 행태 분석 시 발생 시점 기준 5년간 추적 관찰을 위해 2014년까지의 신규 발생 환자들의 주사 횟수 및 비용을 분석하였다.
ABSTRACT
Purpose
We analyzed the incidence and prevalence of neovascular age-related macular degeneration (AMD) and the treatment patterns of AMD in response to changes in health insurance policies in South Korea.
Methods
We retrospectively analyzed the incidence and prevalence of neovascular AMD in patients diagnosed between 2010 and 2019. Data were extracted from the Korean National Health Insurance System database. The incidence and prevalence per 10,000 person-years and corresponding 95% confidence intervals were calculated. Furthermore, we recorded the usage of ranibizumab and aflibercept among newly diagnosed patients with neovascular AMD between 2010 and 2014.
Results
In total, 90,012 patients were diagnosed with neovascular AMD between 2010 and 2019. The incidence of neovascular AMD increased with age, except for individuals aged ≥ 90 years. The prevalence of neovascular AMD increased significantly from 30.29 per 10,000 person-years in 2010 to 50.8 per 10,000 person-years in 2019. The rate of intravitreal ranibizumab injections decreased following the introduction of aflibercept in 2014. Patients who switched from ranibizumab to aflibercept exhibited a higher drug switch rate than those who switched from aflibercept to ranibizumab (28.83% vs. 8.40%). Among newly diagnosed patients, approximately 65% received treatment covered by the health insurance system. On average, six injections were administered per year between 2010 and 2019; the number of injections increased in accordance with the maximum limit supported by the government.
나이관련황반변성은 선진국에서 60세 이상 노인 인구 실명의 주요 원인이다.1,2 고령화 사회가 되어 감에 따라 나이 관련황반변성의 유병률 및 이환 인구는 점차 증가하는 추세이며 이에 따라 의료비도 급격히 상승할 것으로 예상된다.3 선행 연구에 따르면, 안구 내 루센티스 주사술에 대한 국내 나이관련황반변성 관련 의료 비용은 2010년 620억원에서 2014년 830억원 정도로 증가하였고, 미래 인구 변화를 고려하여 추계한 의료 비용은 2030년 약 1,717억원으로 급증할 것이라고 보고하였다.4
나이관련황반변성은 고가의 안구 내 항혈관내피성장인자 주사를 반복적으로 받아야 하는 질환이기에 치료에 큰 경제적 부담이 따른다. 따라서 우리나라에서는 환자의 의료비 부담 경감을 위해 2009년 1월 1일부터 습성 나이관련황반변성을 희귀 난치 질환으로 지정하여 보험 급여 적응 증에 해당하는 치료를 받을 경우, 본인 부담금을 10%로 경감하는 산정특례제도를 시행하고 있다. 2009년 루센티스 주사제(ranibizumab; Lucentis, Genentech Inc., South San Francisco, CA, USA)가 건강보험급여 적용 대상이 되었고 초기에 5회 횟수 제한으로 시작하여 2013년부터 보험 적용 횟수를 확대하였다. 2014년 5월에는 아일리아 주사제(aflibercept; Eylea, Regeneron Pharmaceuticals, Inc., Tarrytown, NY, USA)가 급여화되었고, 2017년 12월부터 기준 시력 이상에서는 주사 횟수 제한이 폐지되어 보험 적용 대상이 확대되었다.
습성 나이관련황반변성의 치료는 보험 정책에 따라 치료 양상의 변화가 나타난다.4 2015년까지 우리나라의 황반변성 치료 경향에 대한 연구에 따르면 보험 급여 주사 횟수가 확대됨에 따라 황반변성 주사 횟수도 증가하였다.5-7 따라서 나이관련황반변성 치료제의 다양화, 2017년 12월 이후 변화된 보험 정책이 실제 습성 황반변성 치료에 미치는 영향과 의료 비용의 변화에 대한 후속 연구가 필요하고 현재 이러한 변화를 반영하여 분석한 연구는 드물다.
따라서 본 연구에서는 국민건강보험공단 자료를 바탕으로 습성 나이관련황반변성의 최신 유병률 및 발생률을 구하고, 황반변성 치료제인 항혈관내피성장인자 주사제의 보험 급여 확대 및 주사제 종류의 다양화가 치료 경향과 의료 비용 변화에 미치는 영향을 분석하고자 한다.
2005년 1월 1일부터 2019년 12월 31일까지 국민건강보험공단 청구명세서 자료를 바탕으로 습성 나이관련황반변성(산정 특례코드 V201)으로 등록된 환자 181,083명을 습성 나이관련황반변성 질환자로 정의하였다. 유병 기준 통계 작성 시 2005년 이후 집계된 177,107명을 기준으로 작성하였고, 발생 기준 통계 작성 시에는 청구 자료의 최초 진단 일자를 기준으로 하나 처음 진단된 환자들만 포함하기 위해 산정특례제도의 시작 시기인 2009년과 그 이전에 등록된 사람들은 분석에서 제외하였고 2010년부터 집계된 90,011명을 기준으로 작성하였다.
위 자료를 토대로 유병률 통계 작성 시 2005년부터 2019년까지, 발생률 통계 작성 시 2010년부터 2019년까지의 습성 나이관련황반변성으로 등록된 질환자를 인구학적 특징(측정연도, 성별, 연령)을 이용하여 그룹을 나누었으며, 40세 미만이거나 인구사회학적 특성이 없는 경우를 제외하였다. 보험공단 청구 자료는 전 국민 정보를 반영하는 데 제한적이기에 전국민 추정치를 이용하였고, 인년 자료는 코시스 연도별 전국민 추계인구를 바탕으로 신규 발생 인구를 예측하였다. 만 명당 발생률 및 유병률 및 유의수준 95%하 신뢰구간 산출 공식은 다음과 같다. 신뢰구간은 포와송 분포를 가정하여 구하였고, 발생률 및 유병률을 λ라고 한다면, 표준오차는 λ / n
나아가 치료 경향을 알아보기 위해 2010년부터 2019년까지 보험 청구되었던 유리체 내 항혈관내피성장인자 주사 치료제의 종류 및 횟수를 분석하였고, 발생 시점을 기준으로 향후 5개년간 추적 관찰을 요하므로, 2010년부터 2014년까지 주사 횟수 및 주사 비용을 조사하였다. 2010년부터 2019년도까지 보험 청구되었던 주사 치료제 횟수 통계를 작성할 때 보험 적응증에 해당되지 않아 아바스틴 주사제를 시행하였거나 황반하 맥락막신생혈관이 확인되어 급여 적응증에 해당한다고 판단하여 아일리아 및 루센티스를 주사하였으나, 추후 삭감이 되어 비급여로 전환된 사례는 제외되었다. 또한 치료제 전환에 대해 분석 시 동일한 날에 두 약제로 동시에 치료받은 환자를 제외하였고, 약제를 전환을 고려하기 위해 치료 반응을 평가할 수 있는 시간 확보가 필요하였기에 최초 진단 이후 1년 이내 사망자 및 2019년도 발생자는 제외하였고, 2013년을 기준 시점으로 두었다.
단일변수 및 다변수 푸와송 회기분석을 통해 연도별 습성 나이관련황반변성의 발생률, 유병률 및 연도별 안구 내 주사 치료 횟수 및 종류, 의료 비용을 분석하였고, 유효 신뢰구간은 p<0.05로 설정하였으며 통계 자료 분석은 SAS ver. 9.2 (SAS Institute Inc., Cary, NC, USA)을 사용하였다. 본 연구는 인증된 연구윤리심의위원회(institutional review board, IRB, 2020-12-019)의 승인을 받았으며 헬싱키선언을 준수하였다.
2010년부터 2019년까지 10년간 40세 이상 인구를 대상으로 분석한 나이관련황반변성의 유병률은 2010년 10,000인년당 39.28명이었고, 2019년에는 50.8명으로 점차 증가하는 추세를 보였다(Table 1, Fig 1). 2014년까지는 여성의 유병률이 높았으나 2015년 이후에는 남성의 유병률이 더 높았다(Fig. 1A). 한편, 발생률은 10,000인년당 평균 3.49명이었고, 전체 90,011명 중 53,362명은 남성, 36,649명은 여성으로 남성에서 더 발생률이 높았다. 2010년부터 2012년까지 점차 감소, 2018년에 비해 2019년 감소를 제외하면 시간의 흐름에 따라 점차 증가하는 추세를 보였다(Table 2, Fig. 2A).
신규 발생한 환자를 대상으로 유리체 내 루센티스 또는 아일리아 주사 치료를 보험 급여로 시행한 환자의 비율은 약 65%로, 2010년부터 2019년까지 큰 변화를 보이지 않았다. 나머지 35%의 대부분은 비급여인 아바스틴으로 치료받았을 것으로 추정되나 보험청구 자료 상에서는 확인이 불가능하였다.
2014년 아일리아가 보험급여 약제로 포함되면서 전체 발병률도 증가하였고, 루센티스의 사용량이 2013년(27,364회/년)에 비해 2014년(23,684회/년)에 현저히 감소하였다. 2014년 이후 전체 주사 치료를 받는 환자 중 루센티스 사용 비율은 점차 감소하여 2016년에는 아일리아 사용 비율이 38.2%, 루센티스 사용 비율 28.4%로 아일리아의 사용률이 앞섰으며, 시간이 흐를수록 두 약제 간의 차이는 점차 증가하였다(Supplementary Table 1, Fig. 3). 루센티스 및 아일리아 주사 약제 간 상호 변경한 사례들을 분석한 결과, 루센티스에서 아일리아로 변경한 환자(28.83%)가 아일리아에서 루센티스로 변경한 환자(8.40%)에 비해 더 많았다(Fig. 4).
신규 진단된 환자들은 진단 시점부터 첫 1년간 평균 3.96회 주사 치료를 받았고, 진단 후 2년간 및 3년간 시행한 주사 횟수는 각각 평균 4.96회, 5.59회로 진단 후 첫 해에 가장 많은 횟수의 치료가 시행되었다(Supplementary Table 2).
2010년부터 2019년까지 이루어진 총 주사 횟수 및 비용은 점차 증가하는 추세를 보이며, 2017년 보험급여 약제 종류와 무관하게 교정시력 0.2 이상일 경우 횟수 제한 없이 주사 치료가 가능해짐에 따라 루센티스 및 아일리아의 연간 사용 횟수 모두 2017년(각각 20,002회/년, 39,058회/년)에 비해 2018년(각각 23,490회/년, 51,213회/년)에 크게 증가하였다(Table 4, Fig. 5).
연도별 신규 발생 환자를 대상으로 진단 후 5년 이내 주사 횟수별 빈도를 분석한 결과, 2012년까지는 주사 치료 급여 횟수가 5회로 제한되어 있었기 때문에 2010년부터 2012년 사이에 신규 진단 환자는 5회 주사 후 중단한 환자의 빈도가 높았다. 2013년 1월 급여 횟수가 10회로 증가함에 따라 2014년을 제외한 모든 연도에서 10회 주사까지 맞은 환자의 빈도가 증가하였고, 2014년 11월부터 급여 횟수가 14회로 증가하였고, 2014년 아일리아 약제의 급여화에 따라 모든 연도에서 14회 주사까지 맞은 환자의 빈도가 증가하였다(Table 5, Fig. 6).
연도별로 진단 후 5년간 시행한 주사 횟수 및 비용을 분석한 결과 주사 횟수 및 비용은 각각 연 평균 6회, 약 597만원이며, 주사 횟수는 2010년부터 2014년까지 4.58회에서 7.53회로 진단 연도에 따라 증가하였고, 비용 역시 506만원에서 689만원으로 점차 증가하였다(Table 6).
본 연구에서는 국민건강보험공단 보험청구 자료 및 산정 특례 등록 자료를 바탕으로 2010년부터 2019년까지 습성 나이관련황반변성의 최신 유병률 및 발생률을 구하고, 치료 약제에 관련된 보험 정책 변화 및 신규 주사 약제 도입에 따른 치료 행태의 변화를 알아보았다.
연구 결과에 따르면 습성 나이관련황반변성의 발생률은 10년간 40세 이상 인구 10,000인년당 3.49명이며, 남성에서 더 높은 발생률을 보였다. 이러한 결과는 기존 연구의 2010년부터 2012년까지 10,000인년당 3.02명이고, 남성이 여성에 비해 더 발생률이 높다는 결과와 유사하였다.5 우리나라와 유사하게 국민 대부분 의료보험 적용이 되는 일본에서 시행한 2011년부터 2018년까지 기간 동안 조사한 연구에서도 일본 습성 나이관련황반변성 환자들의 발생률은 10,000인 년당 평균 4.07명이었고, 전체 246,064명 중 151,029명은 남성, 95,035명은 여성으로 남성에서 더 발생률이 높아 이 결과 또한 본 연구의 경향과 유사하였다.8 발생률은 대체로 점차 증가하는 추세를 보였으나 2010년부터 2012년까지는 감소 추세를 보이는데, 이는 2009년 황반변성에 대한 산정 특례 등록이 처음 시행되면서, 2009년 이전에 황반변성이 발생하였던 사람들이 나중에 등록되는 경우로 인한 결과로 생각된다. 또한 2018년보다 2019년에 발생률이 감소한 것은 2019년 1월 1일부터 추가된 산정특례 등록 기준에 “확진일 기준 최근 3개월 이상 시력이 0.2” 항목으로 인한 현상일 것으로 추정되며, 이러한 시력 기준은 “최대교정시력 0.1 이하인 경우 비급여”라는 주사제의 보험급여 시력 기준과 상충되어 1년 뒤 폐지되었다. 이러한 기준의 변화로 인한 2020년 이후의 발생률 변화는 후속 연구에서 확인이 필요하다.
연령별로 80-89세에서 10,000인년당 14.7명으로 가장 높은 발생률을 보였고, 90대 이상에서 발생률이 감소한 것은 의료 접근성이 저하되어 실제 환자 수에 비해 진단되는 환자 수가 적어 발생률의 감소가 나타났을 가능성이 있다.
나이관련황반변성의 치료 행태는 주사제 종류가 다양해지고 보험 정책이 변화함에 따라 영향을 받는 것으로 나타났다. 나이관련황반변성의 주사 급여 횟수 제한 규제가 완화되는 시기에 따라 총 주사 횟수가 급격히 증가하였고, 이러한 정책 변화가 치료 행태에 주는 영향은 기존의 국내 연구에서도 유사하게 보고된 바 있다.5 2014년 아일리아 주사제의 도입 이후에 루센티스 사용 비율은 감소하고 아일리아 시용 비율은 증가하였으며, 약제 변경 비율 또한 루센티스에서 아일리아로 변경한 환자의 비율이 반대 경우보다 높았다.
본 연구의 한계점으로는 습성 나이관련황반변성의 치료 행태를 확인하기 위해 보험청구 자료 및 산정특례 등록 자료를 활용하였기 때문에 진단 코드가 누락되거나 급여 기준에 해당되나 삭감이 되어 비급여로 주사를 시행하였거나 아바스틴 비급여 주사제를 사용한 환자들이 연구 집단에 포함되지 않았을 가능성이 있다. 또한 병원에 내원하지 않은 환자들 역시 포함되지 않아 발생률과 유병률이 과소 평가되었을 수 있다.
초창기부터 주사의 급여 적응증은 ‘황반하 맥락막신생혈관이 확인되는 경우’로 동일하였지만 횟수 제한의 규제가 완화되었음에도 불구하고, 신규 발생한 환자에서 급여 주사 치료의 시행 비율이 약 65%로 큰 변화를 보이지 않은 것으로 보아 그 외의 환자들은 급여로 치료받지 못 하였을 것으로 사료된다. 미국에서 이루어진 단면 연구에서 200명의 환자 중 157명(78.5%)이 황반하 맥락막신생혈관을 가졌고, 33명(16.5%)은 황반곁(황반으로부터 1-200 μm 이내), 10명(5%)은 황반 외 맥락막신생혈관이 있다고 보고한 것이 이러한 해석을 뒷받침한다.9
또한 본 연구에서 급여 적응증에 해당되지 않는 황반변성에서 비급여로 치료하는 비율을 제외하였는데, 국내 단일기관에서 시행한 연구에서 비급여 치료를 한 원인을 분석한 결과 ‘0.1 이하의 교정시력 혹은 심한 반흔 지도모양 위축의 발생으로 급여 치료가 어려운 경우’가 가장 많았고, ‘중심와 바깥 혹망막하액이나 부종 등 혈관 활동성이 명확하지 않은 경우’였다.10 또한 동일 연구에서 루센티스 또는 아일리아 급여 치료가 76.3%, 아바스틴 비급여 치료는 23.7%인 것으로 보고하였고, 본 연구에서도 신규 발생하였으나 급여 치료를 받지 않은 35%의 환자들 중 치료받지 않은 환자이거나 아바스틴 치료를 받았을 것으로 예상된다.10 이에 대해 면밀한 분석이 요구되며 최근에는 비오뷰(brolucizumab; Beovu, Novartis, East Hanover, NJ, USA)가 국내에 도입되었기에 아바스틴 및 비오뷰를 주사한 환자군들까지 고려한 치료 행태에 대한 후속 연구가 추가적으로 진행되어야 할 것으로 보인다.10,11
정책의 변화가 치료 행태에 영향을 주는 것은 기존의 국내 연구에서도 유사하게 보고된 바 있으나5 본 연구는 전국민 의료보험이 시행되고 있는 한국의 의료환경을 고려해 볼 때 보험청구 자료를 이용하여 대부분의 우리나라 인구를 대상으로 조사하였음에 의의가 있을 것으로 사료된다. 나아가 본 연구에서 보험 급여 기준이 확대될수록 치료 횟수가 증가하는 것을 제시하는 한편, 치료가 필요한 환자임에도 급여 적응증에 해당되지 않아 부득이하게 고가의 비급여 주사를 반복적으로 맞는 환자들이 여전히 상당수 있음을 제시하였다. 오히려 황반을 포함하지 않는 경우 치료 시 시력을 유지할 수 있는 가능성이 높아 이러한 환자들을 급여 적응증에 포함하고, 고가의 주사제로 반복적인 치료를 해야 하는 황반변성 환자들의 의료비 절감을 위해 바이오시밀러 약제 개발 및 사용을 지원을 하도록 보험 정책의 변화 방향을 제시하였다는 점에서 의의가 있다.
Supplementary materials
Supplementary Table 1.
Distribution of incidence and prevalence rate of intravitreal ranibizumab and aflibercept injection
Supplementary Table 2.
The number of intravitreal anti-VEGF injection including aflibercept and ranibizumab in newly diagnosed exudative AMD; injections for 1 year after diagnosis of disease, for 2 years after diagnosis of disease, and for 3 years after diagnosis of disease
Figure 1.
The prevalence of exudative age-related macular degeneration (AMD) according to demographic characteristics (year, sex, age) (person/10,000 populations). Age-standardized prevalence rate by sex (A), and prevalence rate by age groups (B).
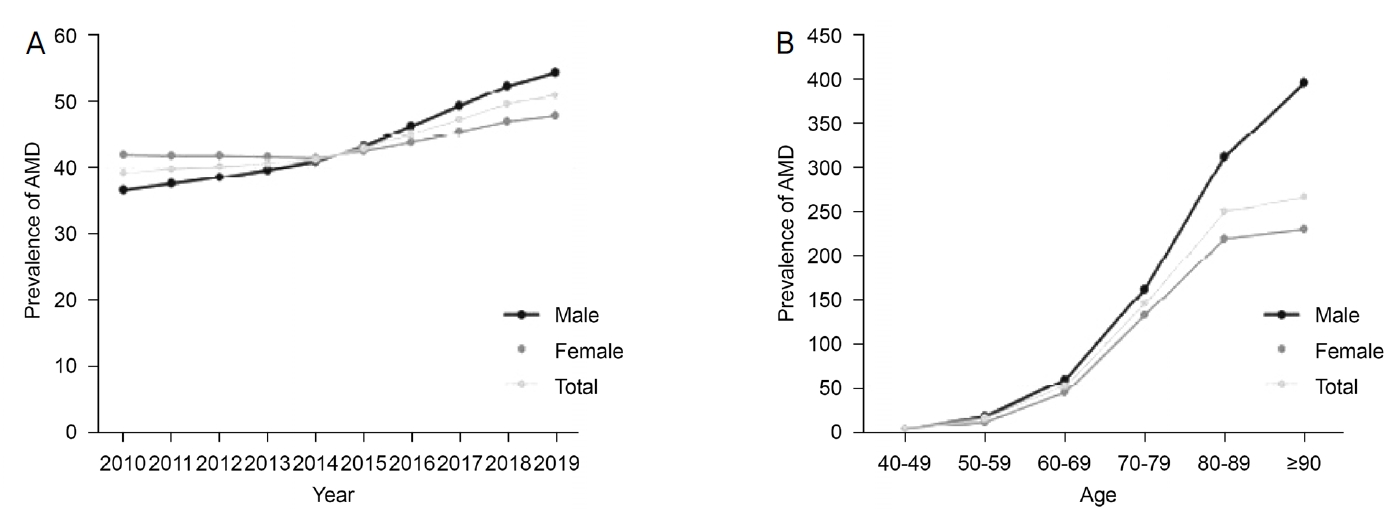
Figure 2.
The incidence of exudative age-related macular degeneration (AMD) according to demographic characteristics (year, sex, age) (person/10,000 populations). Age-standardized prevalence rate by sex (A), and prevalence rate by age groups (B).
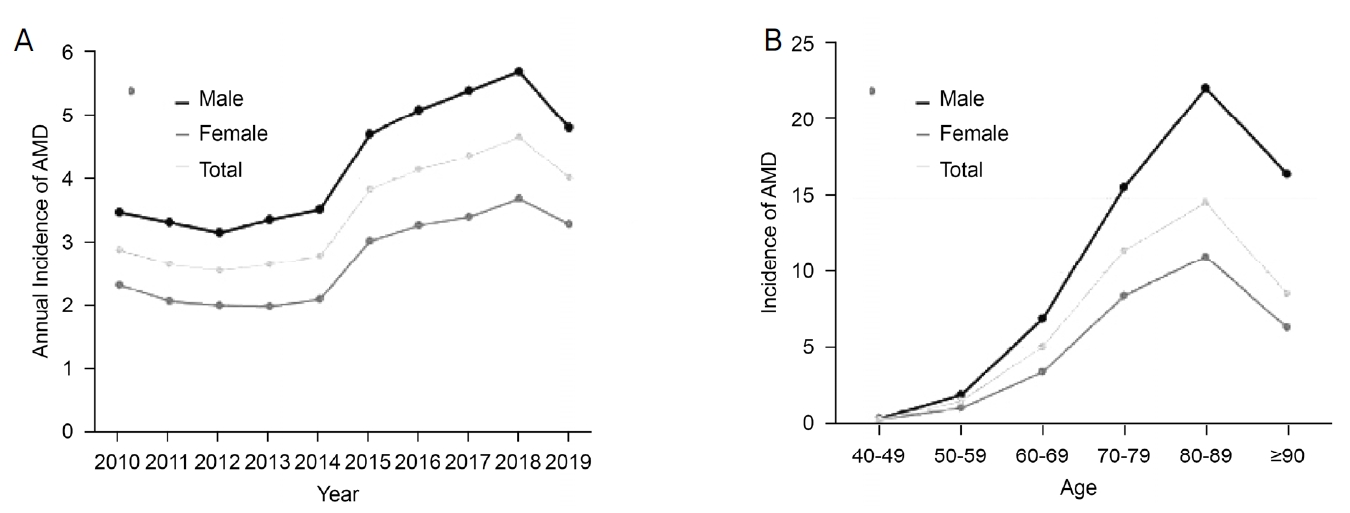
Figure 3.
The number of intravitreal anti-vascular endothelial growth factor (VEGF) injection including aflibercept and ranibizumab in newly diagnosed exudative age-related macular degeneration (AMD) patients.
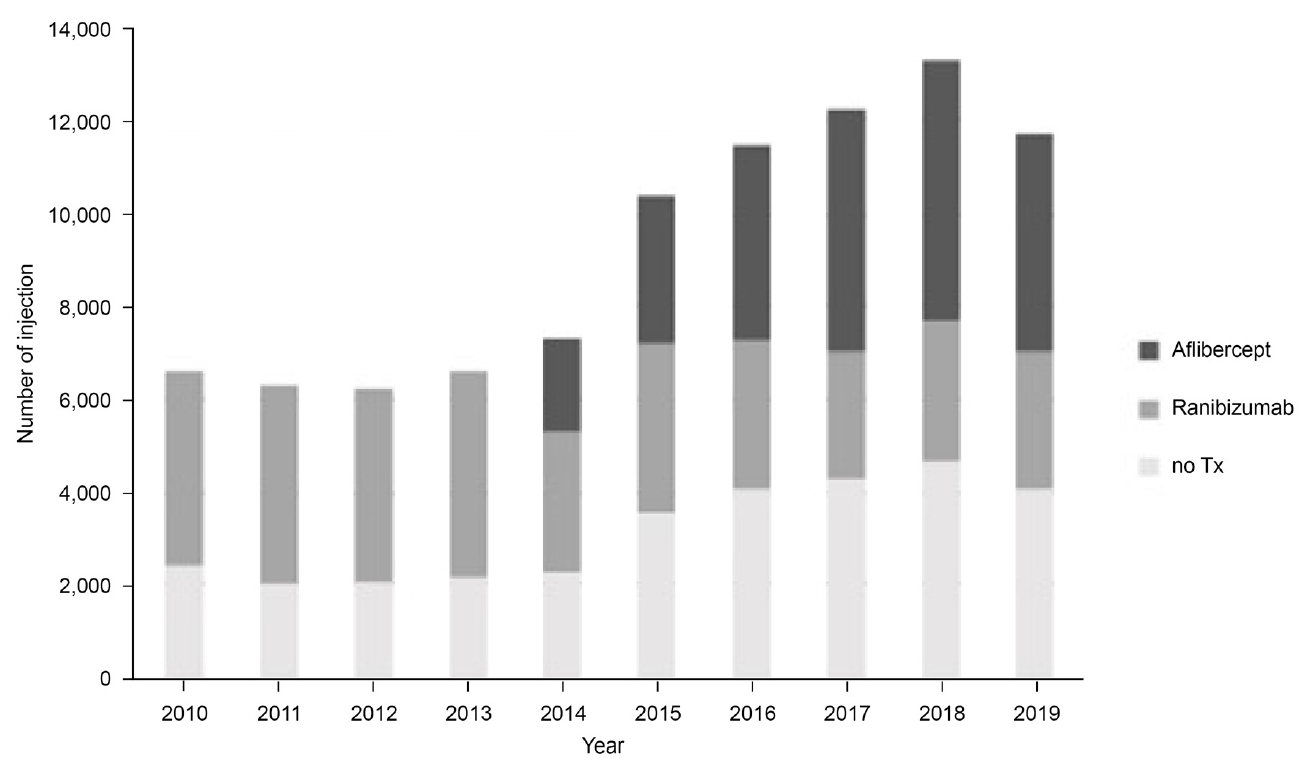
Figure 4.
The proportion of antivascular endothelial growth factor (VEGF) injections switched from ranibizumab to aflibercept or vice versa.
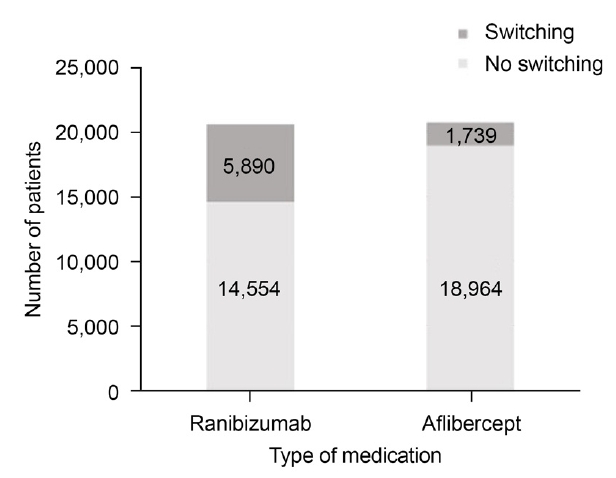
Figure 5.
The changes of yearly use of intravitreal anti-vascular endothelial growth factor (VEGF) injection according to expansion of health insurance coverage.

Figure 6.
Distribution of cumulative anti-vascular endothelial growth factor (VEGF) injections after the diagnosis of exudative age-related macular degeneration (AMD).
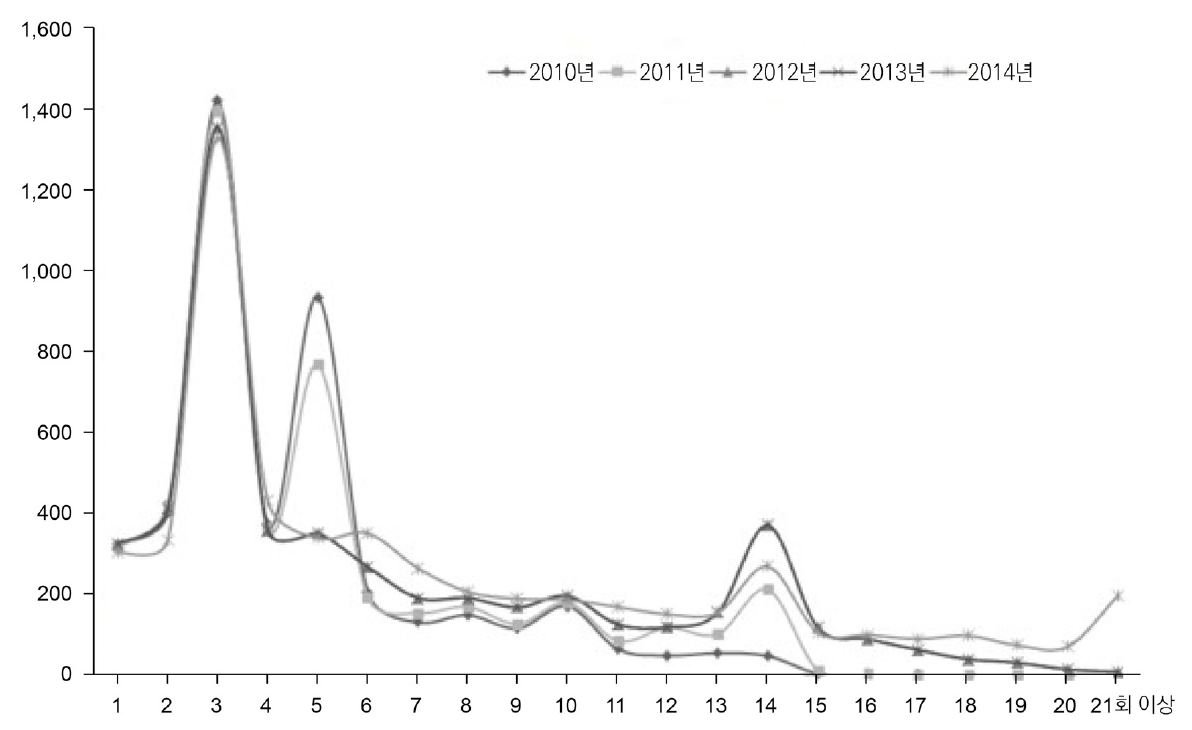
Table 1.
The prevalence rate of AMD patients older than 40 years between 2010-2019 (person/10,000 populations) and age-standardized prevalence rate by sex and prevalence rate by age groups
Table 2.
Changes of incidence rate of AMD patients older than 40 years between 2010-2019 (person/10,000 populations)
Table 3.
Distribution of incidence rate of AMD patients by age groups between 2010-2019 (person/10,000 populations)
Table 4.
The total number of intravitreal anti-vascular endothelial growth factor (VEGF) injections and medical costs between 2010 and 2019
Table 5.
Distribution of cumulative anti-VEGF injections according to the year of diagnosis of exudative AMD
REFERENCES
1) Flaxman SR, Bourne RRA, Resnikoff S, et al. Global causes of blindness and distance vision impairment 1990-2020: a systematic review and meta-analysis. Lancet Glob Health 2017;5:e1221-34.

2) Klein R, Klein BE, Linton KL. Prevalence of age-related maculopathy. The Beaver Dam Eye study. Ophthalmology 1992;99:933-43.


3) Di Stefano AF. VISION 2020: the right to sight. A global initiative for the elimination of avoidable blindness. Optometry 2001;72:619-22.

4) Park SJ, Kwon KE, Choi NK, et al. Prevalence and incidence of exudative age-related macular degeneration in South Korea: a nationwide population-based study. Ophthalmology 2015;122:2063-70.e1.


5) Rim TH, Yoo TK, Kim SH, et al. Incidence of exudative age-related macular degeneration and treatment load under the Korean national health insurance system in 2010-2015. Br J Ophthalmol 2019;103:1361-6.


6) Bakri SJ, Thorne JE, Ho AC, et al. Safety and efficacy of anti-vascular endothelial growth factor therapies for neovascular age-related macular degeneration: a report by the American Academy of Ophthalmology. Ophthalmology 2019;126:55-63.


7) Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration: ninety-six-week results of the VIEW studies. Ophthalmology 2014;121:193-201.


8) Kido A, Miyake M, Tamura H, et al. Incidence and clinical practice of exudative age-related macular degeneration: a nationwide population-based cohort study. Ophthalmol Sci 2022;2:100125.


9) Olsen TW, Feng X, Kasper TJ, et al. Fluorescein angiographic lesion type frequency in neovascular age-related macular degeneration. Ophthalmology 2004;111:250-5.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Supplement1
Supplement1 Print
Print




