 |
 |
| J Korean Ophthalmol Soc > Volume 64(6); 2023 > Article |
|
국문초록
대상과 방법
단안의 일차 열공망막박리로 본원에서 2019년 1월부터 2021년 6월까지 공막두르기술을 받은 환자를 후향적으로 분석하였다. 중심오목하 맥락막두께는 수술 전, 수술 후 1개월, 2개월, 3개월, 6개월로 총 5회 측정되었다.
결과
총 33명의 환자가 본 연구에 포함되었다. 공막두르기술만을 시행한 환자는 18명(54%), 동시 시행군은 15명(46%)이었다. 전체 환자에서 맥락막두께는 수술 후 시간이 경과함에 따라 점차 감소되었다(p<0.05). 공막두르기술만을 시행한 환자군의 수술 6개월 후 맥락막두께(260.51 ± 78.30 μm)는 동시 시행군의 맥락막두께(225.55 ± 75.24 μm)보다 통계적으로 유의하게 두껍게 측정되었다(p<0.05). 또한 수술 전 맥락막두께는 황반부 박리가 있으면(276.46 ± 20 μm) 그렇지 않은 경우(223.93 ± 20 μm)와 비교하여 유의하게 두꺼웠다(p<0.05). 또한 수술 전 중심오목하 맥락막두께와 시력은 유의한 음의 상관관계를 보였다(p<0.05).
ABSTRACT
Purpose
To compare the subfoveal choroidal thickness (SFCT) before and after scleral encircling (SE), with or without trans-pars plana vitrectomy (TPPV), in patients with monocular primary rhegmatogenous retinal detachment (RRD).
Methods
We retrospectively analyzed patients who underwent SE for monocular primary RRD between January 2019 and June 2021 and underwent optical coherence tomography during follow-up. SFCT was measured independently at three regions before the surgery and 1, 2, 3, and 6 months after the surgery. The values were manually analyzed by two independent ophthalmologists.
Results
Of the 33 eyes included in the study, 18 (54%) underwent SE alone, while 15 (46%) underwent SE with TPPV. SFCT gradually decreased after surgery in all patients (p < 0.05). The SFCT was significantly greater 6 months postoperatively in the SE alone group (260.51 ± 78.30 μm) compared to the SE with TPPV group (225.55 ± 75.24 μm) (p < 0.05). Macular detachment patients had significantly greater preoperative SFCTs (276.46 ± 20 μm) compared to others (223.93 ± 20 μm) (p < 0.05). Preoperative SFCT was significantly related to visual acuity (p < 0.05), while the remaining SFCT values did not have any significant effects.
열공성 망막박리(rhegmatogenous retinal detachment, RRD)는 망막박리의 가장 흔한 형태로 연간 10,000명 중 1건의 발생률을 보이며 망막층의 손상을 유발하여 심각한 시력 손상이 발생할 수 있다. 그중 공막두르기술(scleral encircling), 공막돌륭술(scleral buckling), 평면부경유 유리체절제술(trans pars plana vitrectomy)이 망막박리의 효과적인 수술적 치료 방법으로 널리 사용되고 있다.1 맥락막은 망막에 산소와 영양분을 공급하는 일중 변동을 가진 혈관 조직으로, 망막의 여러 질환에서 맥락막 이상이 동반된다는 연구 결과가 발표되면서 그 연관성이 주목받고 있다.2,3 더욱이 중심오목하 맥락막혈류는 중심오목하 망막혈류와 직결되기 때문에, 중심오목하 맥락막두께를 통하여 상관관계를 분석해보는 시도가 이루어지고 있다.2,3 최근 enhanced depth imaging (EDI) spectral-domain optical coherence tomography (SD-OCT)의 개발로 보다 심층적인 이미지를 제시함으로써, 연구자들은 망막수술과 관련된 망막 및 맥락막의 변화를 자세히 관찰할 수 있게 되었다.2 국소 공막돌륭술, 유리체절제술 후에 정상안과 망막박리안의 맥락막두께의 변화를 비교한 이전 연구들이 이에 해당한다고 볼 수 있으며, 수술 종류에 따른 맥락막두께 변화 양상에 대한 다양한 보고가 이루어지고 있다.4-6 그러나 아직까지 공막두르기술 단독 시행과 유리절제술을 동시 시행하였을 경우를 비교 및 분석한 연구는 발표되지 않았다. 따라서 이 연구에서는 망막박리 환자에서 망막박리안의 중심오목하 맥락막두께를 공막두르기술과 유리체절제술 전후로 비교 분석하고자 하였다.
본 연구는 모든 과정에서 헬싱키선언(Declaration of Helsinki)을 준수하였으며, 생명윤리위원회의 승인을 받아 진행되었다(임상시험윤리위원회 승인 번호: 2022-04-027-002). 단안의 일차 열공망막박리로 본원에서 2019년 1월부터 2021년 6월까지 공막두르기술을 받은 환자의 의무기록을 후향적으로 조사하였다. 맥락막두께는 빛간섭단층촬영으로 수술 전, 수술 후 1개월, 수술 후 2개월, 수술 후 3개월, 수술 후 6개월로 총 5회 측정되었다. 망막열공이 하나 이상이거나 하측에 위치한 경우, 열공이 큰 경우 공막두르기술과 유리체절제술을 함께 시행하였다. 빛간섭단층촬영 사진의 해상도가 떨어지거나 중심오목하 망막박리 정도가 커 맥락막두께 분석에 적절하지 않은 빛간섭단층촬영 이미지는 제외되었으며, 나이관련황반변성, 결절맥락망막병증, 망막혈관폐쇄, 근시성 맥락막모세혈관, 증식성 당뇨망막병증, 증식유리체망막병증이 동반된 경우 또한 맥락막두께에 영향을 줄 수 있으므로 대상에서 제외되었다. 또한 증식유리체망막병증이나 증식당뇨망막병증으로 인한 망막박리와 같이 편향을 일으킬 수 있는 경우는 제외되었다. 의무기록을 통해 대상 환자의 나이, 성별, 당뇨, 고혈압, 황반부 박리 여부, 최대교정시력, 백내장수술 여부, 유리체강 내 충전물 종류를 확인하였다. 빛간섭단층촬영은 DRI-OCT (Topcon Medical Systems, Inc., Oakland, NJ, USA)로 시행하였다.
해당 기간 공막두르기술을 받은 환자 중 공막두르기술 단독 시행 환자군은 group 1, 공막두르기술과 유리체절제술 동시 시행 환자군은 group 2로 분류하였다. 중심오목하 맥락막두께는 망막색소상피층의 하부에서 맥락막공막 경계까지의 거리로 정의하였다. 빛간섭단층촬영 소프트웨어에서 제공하는 manual caliper를 이용하여 측정하였고, 서로 다른 2명의 안과의사가 독립적으로 시행 후 측정치의 평균값을 사용하였다. 중심오목 바로 아래에서 먼저 맥락막두께를 측정한 다음, 이를 기준으로 200 μm 간격으로 각각 비측과 이측의 맥락막두께를 측정하여 세 측정값의 평균을 내어 분석 및 비교에 이용하였다(Fig. 1).
망막박리안에서 맥락막두께의 변화 양상과 술 전과 술 후 비교는 paired t-test를 이용하여 검정하였고, 유리체절제술 동시 시행 여부, 황반부 박리 여부에 따른 중심오목하 맥락막두께, 최대교정시력 차이를 비교하기 위해 student t-test를 이용하였다. 중심오목하 맥락막두께에 영향을 주는 요소를 알아보기 위하여 선형회귀분석을 시행하였다. 통계 분석은 IBM SPSS Statistics version 21.0 (IBM Corp., Armonk, NY, USA)을 이용하였으며, 통계적인 유의성 검정의 기준은 p<0.05로 하였다. 두 측정자 간의 일치 수준은 급간내상관계수, 반복 계수, 변이 계수를 이용하였다.
총 33명(33안)의 환자가 대상으로 포함되었으며, 정규성 분포를 만족하였다. 평균 연령은 group 1에서 36.06 ± 18.20세, group 2에서 54.15 ± 12.96세였으며, 전체 인원 중 남성이 17명(52%), 여성이 16명(48%)이었다. 총 33안 중공막두르기술만을 받은 눈(group 1)은 18안(54%), 공막두르기술과 유리체절제술을 함께 받은 눈(group 2)은 15안(46%)이었다. 당뇨병은 12명(36%), 고혈압은 10명(30%)에서 관찰되었다. 전체 망막박리 환자 중 황반부 박리를 동반한 경우는 13안(39%)이었다. Group 1에 속한 눈의 logarithm of the minimum angle of resolution (logMAR) 최대교정시력은 수술 전 0.34 ± 0.44, 수술 1개월 후 0.25 ± 0.43, 2개월 후 0.25 ± 0.33, 3개월 후 0.25 ± 0.30, 6개월 후 0.35 ± 0.33 이었다. Group 2에 속한 눈의 logMAR 최대교정시력은 수술 전 0.57 ± 0.58, 수술 1개월 후 0.98 ± 0.49, 2개월 후 0.68 ± 0.52, 3개월 후 0.47 ± 0.03, 6개월 후 0.48 ± 0.33이었다. 두 그룹의 최대교정시력은 수술 후 1개월에서만 유의미한 차이를 보였고(p<0.05), 수술 전(p=0.219), 수술 후 2개월(p=0.075), 3개월(p=0.056), 6개월(p=0.512)에는 유의미한 차이를 보이지 않았다(Table 1).
중심오목하 맥락막두께는 두 그룹 모두에서 수술 후 시간에 따라 점진적으로 감소하는 양상을 보였다(Fig. 2). Group 1에서는 수술 후 1개월 중심오목하 맥락막두께 평균치가 수술 전 평균치에 비하여 두꺼워진 변화를 보였으나 이는 통계적으로 유의하지 않았다. 수술 전 중심오목하 맥락막두께를 기준으로 수술 후 1개월, 2개월, 3개월, 6개월의 변화 양상을 비교하였을 때, 전체 환자와 group 2에서 수술 후 6개월 중심오목하 맥락막두께가 유의하게 차이가 있었고(p<0.05), 다른 시기에는 통계적으로 유의한 차이는 보이지 않았다(Table 2).
수술 전 중심오목하 맥락막두께는 group 1에서 260.51 ± 78.30 μm, group 2에서는 225.55 ± 75.24 μm로 그룹 간 유의미한 차이를 보이지 않았다(p=0.203). 수술 후 1개월에서 group 1에서 260.53 ± 72.93 μm, group 2에서 215.46 ± 62.33 μm (p=0.069), 2개월에서 group 1에서 249.90 ± 75.32 μm, group 2에서 207.48 ± 69.53 μm (p=0.106)로 유의한 차이를 보이지 않았다. 하지만 수술 후 3개월에서 각각 group 1에서 249.74 ± 69.87 μm, group 2에서 201.80 ± 61.27 μm로 group 2가 group 1에 비해서 의미 있게 감소된 결과를 보였다(p<0.05). 또한 수술 후 6개월에서도 group 1에서 236.38 ± 57.93 μm, group 2에서 188.62 ± 56.48 μm로, group 2가 group 1에 비해서 유의미하게 감소된 결과를 보였다(p<0.05) (Table 3).
수술 전 중심오목하 맥락막두께에 영향을 미치는 요인을 알아보고자 시행한 선형회귀분석을 시행하였다. 황반부 박리 여부(p<0.05)만 수술 전 중심오목하 맥락막두께에 유의한 영향을 끼치는 것으로 나타났다. 나이(p=0.928), 성별(p=0.516), 당뇨 유무(p=0.719), 고혈압 유무(p=0.548)는 유의한 영향을 보이지 않았다. 수술 후 6개월 후 중심오목하 맥락막두께를 기준으로 실시한 선형회귀분석에서는 상기 요인 모두에서 유의한 영향이 없었다(Table 4). 또한 시력에 대한 중심오목하 맥락막두께의 영향을 알아보고자 선형회귀분석을 시행하였다. 수술 전 중심오목하 맥락막두께는 수술 전 시력에 유의한 영향을 끼치는 것으로 나타났다(p<0.05). 그러나 수술 후 1개월(p=0.838), 2개월(p=0.604), 3개월(p=0.245), 6개월(p=0.474)에는 모두 유의한 영향을 보이지 않았다(Table 5).
유리체절제술과 공막두르기술 동시 시행군(group 2) 15안을 대상으로, 백내장수술 여부, 유리체강 내 충전 물질 종류에 따른 중심오목하 맥락막두께와 최대교정시력에 대한 영향을 분석하였다. 총 15안 중 백내장이 있었던 눈은 9안이었고, 모두 백내장수술을 함께 시행하였으며, 나머지 6안은 인공수정체안이었다. 또한 15안 중 유리체강 내 C3F8(12%)을 충전한 눈은 10안, 실리콘오일(5700 cSt)을 충전한 눈은 5안이었다(Table 1). 공막두르기술 단독 시행군(group 1)의 경우 모든 환자에서 백내장수술을 시행하지 않았고, 가스나 실리콘오일과 같은 유리체강 내 충전 물질을 이용하지 않았다. 백내장수술 여부와 유리체강 내 충전 물질 종류에 따른 중심오목하 맥락막두께에 대한 영향을 분석하였으나, 수술 후 1, 2, 3, 6개월 모두에서 유의한 영향을 보이지 않았으며(Table 6), 마찬가지로 백내장수술 여부와 유리체강 내 충전 물질 종류에 따른 최대교정시력에 대한 영향을 분석하였으나, 수술 후 1, 2, 3, 6개월 모두에서 유의한 영향을 보이지 않았다(Table 7).
본 연구는 공막두르기술과, 유리체절제술이 동반된 공막두르기술 후 맥락막두께의 변화를 비교 분석하였다. 공막두르기술을 시행하는 경우 중심오목하 맥락막두께가 수술 직후 증가하였다가 시간이 지남에 따라 점진적으로 감소하였다. 공막두르기술과 유리체절제술을 동시 시행한 경우도 비슷한 경과를 보였으나 맥락막두께가 유의하게 더 얇아져 있음을 확인하였다. 수술 전 중심오목하 맥락막두께는 황반부 박리 여부에 영향을 받았다. 또한 중심오목하 맥락막두께는 술 전 최대교정시력과 유의한 연관이 있는데 이는 중심오목하 맥락막두께의 직접적인 영향보다는 해당 군에서 황반부 박리 여부가 영향을 미친 것으로 사료된다.
망막박리안에서 맥락막두께 변화는 다양하게 보고되고 있다. Kimura et al5은 망막박리안에서 국소 공막돌륭술 후 1주일까지 중심오목하 맥락막두께가 증가하고, 수술 1개월 후부터는 감소한다고 보고하였다. Sayman Muslubas et al6은 망막박리안에서 정상안에 비하여 유리체절제술 1주일 뒤 유의미하게 중심오목하 맥락막두께가 증가하고, 수술 후 1, 3개월이 되면 다시 감소하여 차이가 없어진다고 하였다. 다른 연구에서는 유리체절제술 전후로 맥락막두께 차이가 유의미하게 발생하지 않았으며,7 유리체절제술과 공막돌륭술 간 수술 후 맥락막두께 차이가 없으며, 수술 1개월 후부터 맥락막두께가 정상안과 망막박리안에서 차이가 없다고 하였다.8 Akkoyun and Yilmaz9은 공막돌륭술과 유리체절제술 그룹 모두에서 수술 후 1주차에 맥락막두께가 증가했으며, 수술 후 1개월과 6개월에서 두 그룹 간의 차이는 없으며, 정상안과 비교한 망막박리안에서의 맥락막두께 차이도 없다고 하였다. 본 연구에서는 위 연구들과 다르게, 유리체절제술을 시행한 group 2에서 수술 후 6개월에서 맥락막두께가 유의미하게 감소된 소견을 보였다. 또한 공막두르기술만을 시행한 group 1과 공막두르기술, 유리체절제술을 동시 시행한 group 2의 맥락막두께가 수술 후 3개월과 6개월에서 유의한 차이가 관찰되었다는 점 또한 중요한 차이점이라 할 수 있다.
망막박리안에서 수술 직후 일시적으로 맥락막두께가 증가하는 이유로 포도막공막유출의 증가와 수술 후 안내 염증 반응을 생각해볼 수 있다.6 또한 여러 연구에서 포도막공막유출 증가와 체액 저류가 망막박리안에서 맥락막두께가 증가하는 원인이 될 수 있으며, 망막하액에서 상승된 수치의 프로스타글란딘, 케모카인이 포도막공막유출을 증가시킨다고 하였다.10-13 망막박리가 있는 눈에서 체액이 후방(posterior chamber)에서 나와 유리체액과 망막열공을 통해 망막 아래 공간으로, 망막색소상피를 가로질러 흐른다.14 Azad et al15은 RRD 환자의 포도막공막유출 증가와 체액 저류는 맥락막두께의 증가를 유발하며, RRD 환자의 안압 감소가 이 가설을 뒷받침한다고 하였다. 맥락막혈류의 변화 또한 맥락막두께에 영향을 미치는 요소로 볼 수 있다. 일부 보고에서는 공막돌륭술 후 맥락막혈류가 점진적으로 감소하고 수술 전으로 돌아가지 않는 것으로 나타났지만,16 다른 보고에서는 수술 후 3-6개월 후에 맥락막혈류가 회복되었음이 보고되었다.17 맥락막은 안구 순환의 항상성을 유지하기 위해 수술 후 급성기에 일시적으로 두꺼워질 수 있으며, 시간이 지난 후 결국 혈류는 감소되어 수술 전 수준으로 돌아갈 수 있다.5
유리체절제술 후 발생하는 맥락막두께 변화에 대해서는 아직 확립된 이론은 없으며, 다양한 양상으로 보고되고 있다. Michalewska et al18에 의하면, 망막박리안에서 유리체절제술 후 맥락막두께는 수술 전에 비하여 감소한다고 보고되었다. Kang et al19은 망막전막이 있는 눈에서 유리체절제술을 시행하는 경우, 유리체황반견인이 동반된 경우에는 수술 후 맥락막두께가 감소됨을 확인하였다. 또한 망막전막, 황반원공 환자 모두 유리체절제술 이후 1주일 후 맥락막두께가 증가하였다가 1개월부터는 감소된 소견을 보였다는 보고가 있었다.20 유리체절제술 후 안내 가스가 맥락막에 영향을 미칠 수 있으며, 이는 맥락막두께의 감소를 유발할 수 있는 원인이라고 추정된다.21 Odrobina et al4은 망막박리안에서 유리체절제술 후에 실리콘오일 안내 삽입술을 시행한 경우 수술 후 3개월, 6개월에서 맥락막두께가 유의미하게 감소되었다고 보고하였다. 본 연구에서 유리체절제술 동시 시행 시 맥락막두께가 더 작게 측정된 결과 또한 안내 가스 혹은 실리콘오일 충전술을 시행하였기 때문으로 생각할 수 있다. 기존 존재하던 유리체를 모두 제거하고 가스나 실리콘오일로 대체 시, 유리체에 의한 산소 소비량이 적어지고 망막 조직에서 보다 쉽게 산소를 공급받을 수 있게 된다. 유리체절제술 시행 도중과 수술 이후 산소 분압이 수술 전에 비하여 높게 유지되며,22 유리체절제술 시행 후 망막동맥과 정맥 모두에서 혈액의 산소 분압이 수술 전에 비하여 높아진다.23 높은 산소 수치는 맥락막혈류가 줄어든 상태에서도 망막 조직의 생존을 가능하게 하여 맥락막두께를 감소시키는 효과가 있다고 사료된다. 또한 유리체와 망막 조직 간에는 서로 이온(ion) 교환이 지속적으로 이루어지는데,24 이러한 유리체가 없어졌음에도 망막과 맥락막은 망막색소상피를 통해 지속적으로 물질을 교환하기 때문에 상대적으로 효율적인 운송이 가능해진다. 그러므로 유리체절제술 후에 발생하는 맥락막두께 감소는 유리체의 부재로 인한 결과라 추정할 수 있다. 본 연구에서 수술 후 3개월, 6개월 후 group 1과 group 2의 맥락막두께 차이 또한 이러한 변화에 기인하였다고 생각할 수 있다.
이외에도 다양한 요인이 맥락막두께에 영향을 미친다는 연구가 보고되고 있다. 공막돌륭술과 함께 시행한 냉동고정술이 염증과 혈류 변화를 유발하여 맥락막두께 변화 원인이 될 수 있다.25,26 레이저광응고술 또한 맥락막까지 에너지를 투사하여 맥락막두께 저하를 유발할 수 있다.27,28 공막돌륭술에서 냉동고정술과 레이저광응고술을 비교한 임상시험 결과 냉동 요법 그룹에서 통계적으로 유의하게 느린 시력 회복 및 수술 후 전방 내 염증 반응 증가를 보였다.29,30 이는 중심와아래 맥락막두께의 일시적인 증가가 안구 주위 염증과 관련될 수 있음을 시사한다. 또한 백내장수술 후에 맥락막두께가 증가한다는 보고가 있다. Yilmaz et al,31 Shahzad et al32에 의하면, 수술 후 초기 안압 감소가 안구 관류압을 증가시킬 수 있고, 수술 후 증가된 염증매개물질이 유리체를 통해 망막, 맥락막으로 전달되어 맥락막두께 증가를 유발할 수 있다고 보고되었다. 이는 맥락막두께 변화가 수술 후 시력 예후와 염증 반응 정도를 평가하는 지표로서 중요하게 작용할 수 있다는 점을 시사한다.
본 연구는 첫째, 단독 공막두르기술과 유리체절제술과 동시 시행한 경우를 비교한 장점이 있지만, 다른 연구에 비하여 환자 수가 적다는 한계가 있다. 이에 통상적인 subfoveal choroidal thickness (SFCT)보다 낮은 수치를 보였다는 점, 최초 SFCT가 그룹 간 차이가 어느 정도 있었다는 점에서 통계적 오차가 발생하였을 수 있다. 둘째, 맥락막두께를 manual caliper를 이용하여 측정하였기에 검사자에 따른 차이가 발생하였을 수 있다. 본 연구에 이용된 EDI-OCT 모드에서 맥락막-공막 경계가 관측되지만 다소 불분명한 경우 또한 존재하며, 이 경우 정확한 측정치가 아니라고 할 수 있다. 본 연구에서는 2명의 검사자가 독립적으로 측정 후 측정치의 평균값을 이용하여 이를 극복하고자 하였다. 셋째, 본 논문에서는 수술 시간, 다양한 수술 후 충전 물질, 수술 후 자세에 따른 영향 등을 고려하지 못한 한계가 있다. 수술 후 충전 물질인 C3F8 (12%, 14%, 100%), SF6 (18%, 20%), pure air, silicone oil (1300 cSt, 5700 cSt) 등에 따른 적절한 영향을 파악하지 못하였다. 또한 망막박리수술 후 다양한 자세에 따라 SFCT나 시력이 영향을 받을 수 있으나, 이를 정확히 분석하지 못하였다. 위 요인들에 대한 n수의 한계로 다방면적 분석이 동반되지 못해 본 논문의 결론에 분석적 한계가 있다고 할 수 있다. 넷째, 적은 n수로 인해 맥락막두께가 수술 전후로 시력에 미치는 영향에 대한 분석이 정확히 이루어지지 못하였다. 마지막으로 본 논문은 후향적 연구에서 발생할 수 있는 단점인 선택 편향의 가능성이 있으며, group 1과 group 2의 평균 나이 차이로 인한 가능성을 배제할 수는 없다는 한계가 있다.
결론적으로 본 연구에서 일차성 열공망막박리안에서 공막두르기술만을 단독으로 시행한 경우, 수술 후 짧은 기간 중심오목하 맥락막두께가 증가하고 이후 점진적으로 감소하는 양상을 보였다. 또한 유리체절제술을 동시 시행하는 경우 중심오목하 맥락막두께는 공막두르기술 단독 시행에 비하여 더욱 감소함을 알 수 있었다. 향후 유리체절제술만을 시행한 경우와 공막두르기술을 동시 시행한 경우를 비교하여 두 수술법이 맥락막두께에 끼치는 영향을 정확히 알 수 있을 것이다. 또한 보다 장기적인 연구를 통하여 맥락막두께 변화의 기전에 대한 연구와 시력 예후 등에 미치는 영향을 알아보는 것이 필요할 것이다.
Figure 1.
Optical coherence tomography (OCT) image of subfoveal choroidal thickness measurement. Manual caliper measurement of OCT (Topcon Medical Systems, Inc., Oakland, NJ, USA).
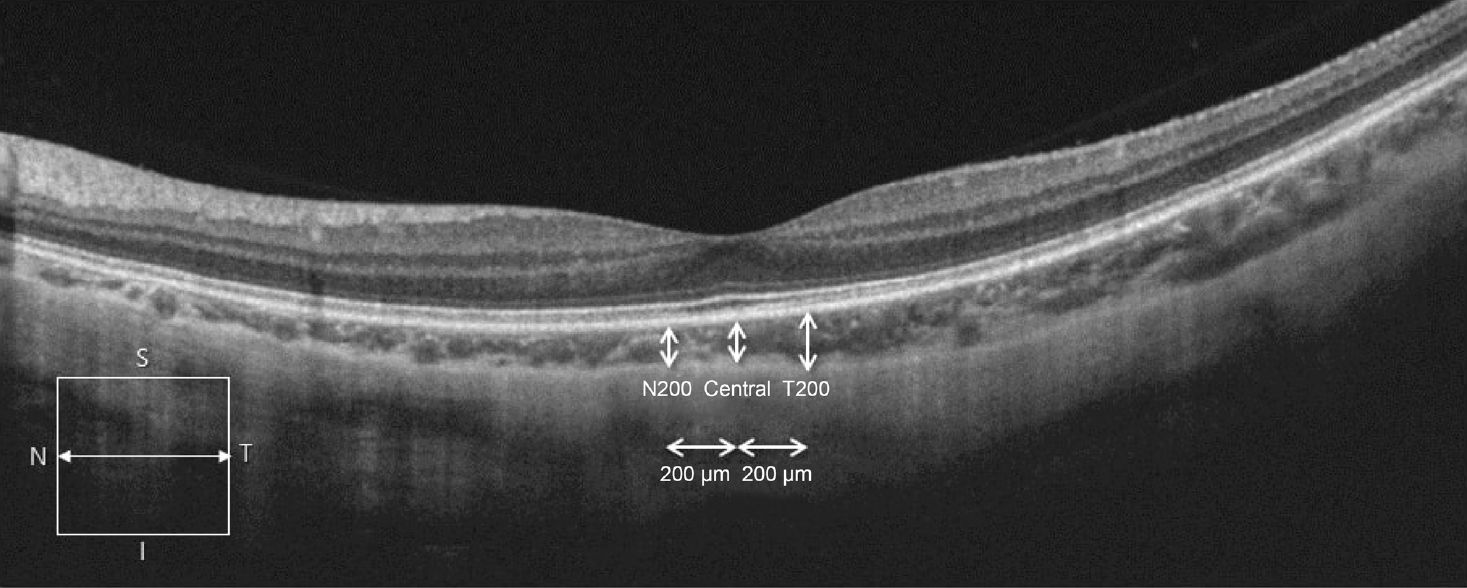
Figure 2.
Subfoveal choroidal thickness (SFCT) of each group. Gt = group total (group 1 + group 2). * Postoperative 6 months SFCT of group 1 was significantly less than preoperative measurement of group 1; †postoperative 6 months SFCT of group total was significantly less than preoperative measurement of group total.
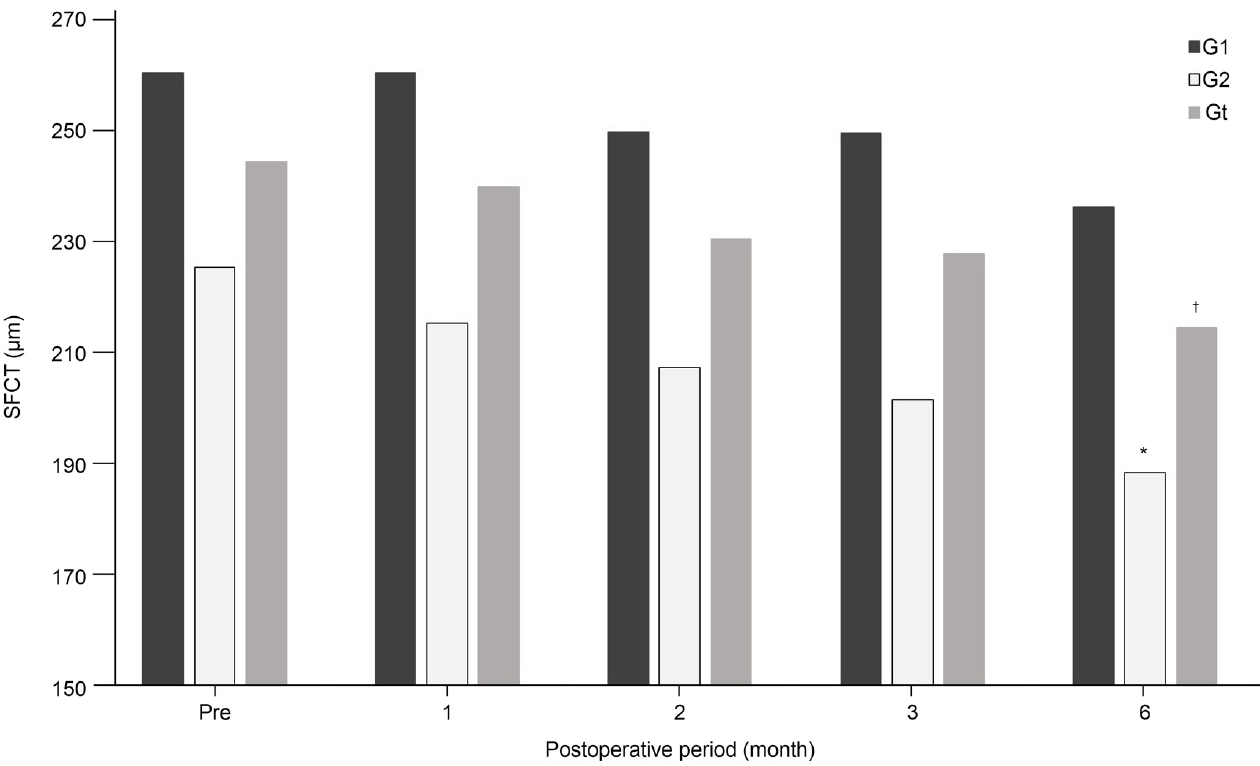
Table 1.
Demographics and ocular characteristics of the eyes with retinal detachment surgery
Values are presented as mean ± standard deviation or n/n, student t test.
M = male; F = female; DM = diabetic retinopathy; Y = yes; N = no; HTN = hypertension; PE c PCL = phacoemulsification and posterior chamber lens implantation; C3F8 = perfluoropropane; SO = silicone oil; BCVA = best corrected visual acuity; logMAR = logarithm of the minimum angle of resolution; Postop = postoperative; m = month(s).
Table 2.
Comparison of SFCT between groups based on preoperative measurement
| Group 1 (n = 18) | p-value | Group 2 (n = 15) | p-value | Gt (n = 33) | p-value | |
|---|---|---|---|---|---|---|
| Postop 1 m SFCT (μm) | -0.18 ± 40.90 | 0.998 | 10.08 ± 39.86 | 0.344 | 4.57 ± 40.12 | 0.517 |
| Postop 2 m SFCT (μm) | 10.61 ± 47.34 | 0.355 | 18.06 ± 52.30 | 0.202 | 14.00 ± 19.01 | 0.111 |
| Postop 3 m SFCT (μm) | 10.77 ± 50.59 | 0.379 | 23.75 ± 56.58 | 0.126 | 16.67 ± 52.95 | 0.080 |
| Postop 6 m SFCT (μm) | 24.12 ± 52.56 | 0.068 | 36.93 ± 61.61 | *0.036 | 29.94 ± 56.30 | *0.005 |
Table 3.
Comparison of subfoveal choroidal thickenss between the two groups
| Group 1 (n = 18) | Group 2 (n = 15) | p-value | ||
|---|---|---|---|---|
| Preoperative SFCT (μm) | ||||
| Nasal | 260.27 ± 79.72 | 221.79 ± 77.96 | 0.162 | |
| Central | 261.49 ± 77.96 | 227.68 ± 78.62 | 0.226 | |
| Temporal | 259.77 ± 77.92 | 227.20 ± 75.02 | 0.233 | |
| Mean | 260.51 ± 78.30 | 225.55 ± 75.24 | 0.203 | |
| Postop 1 m SFCT (μm) | ||||
| Nasal | 258.77 ± 73.39 | 225.55 ± 75.24 | 0.068 | |
| Central | 260.61 ± 73.60 | 216.40 ± 59.77 | 0.071 | |
| Temporal | 262.22 ± 72.38 | 217.53 ± 64.41 | 0.073 | |
| Mean | 260.53 ± 72.93 | 215.46 ± 62.33 | 0.069 | |
| Postop 2 m SFCT (μm) | ||||
| Nasal | 248.33 ± 77.32 | 204.53 ± 71.33 | 0.103 | |
| Central | 249.61 ± 74.85 | 209.53 ± 70.11 | 0.125 | |
| Temporal | 251.77 ± 74.43 | 208.40 ± 68.97 | 0.095 | |
| Mean | 249.90 ± 75.32 | 207.48 ± 69.53 | 0.106 | |
| Postop 3 m SFCT (μm) | ||||
| Nasal | 247.83 ± 70.99 | 207.48 ± 59.53 | 0.047 | |
| Central | 249.72 ± 70.55 | 199.40 ± 60.98 | 0.038 | |
| Temporal | 251.66 ± 68.93 | 206.66 ± 62.00 | 0.060 | |
| Mean | 249.74 ± 69.87 | 201.80 ± 61.27 | *0.047 | |
| Postop 6 m SFCT (μm) | ||||
| Nasal | 235.66 ± 60.02 | 189.33 ± 56.86 | 0.031 | |
| Central | 236.50 ± 56.89 | 187.53 ± 57.11 | 0.020 | |
| Temporal | 237.00 ± 57.24 | 189.00 ± 57.19 | 0.023 | |
| Mean | 236.38 ± 57.93 | 188.62 ± 56.48 | †0.023 | |
Table 4.
Factors affecting total group SFCT by univariable regression analysis
|
Preoperative SFCT (n = 33) |
6 months SFCT (n = 33) |
|||
|---|---|---|---|---|
| β | p-value | β | p-value | |
| Age (years) | 0.47 ± 1.02 | 0.647 | -0.07 ± 0.84 | 0.928 |
| Sex (ref:male) | 17.37 ± 27.66 | 0.535 | 14.95 ± 22.71 | 0.516 |
| DM (ref:Y) | -48.82 ± 36.21 | 0.189 | -10.82 ± 29.73 | 0.719 |
| HTN (ref:Y) | 44.70 ± 39.52 | 0.268 | 19.76 ± 32.44 | 0.548 |
| Macula (ref:on) | -74.43 ± 32.24 | *0.029 | 5.69 ± 26.74 | 0.831 |
Table 5.
Effect of SFCT on BCVA by univariable regression analysis
|
BCVA |
||
|---|---|---|
| β | p-value | |
| Preoperative SFCT (μm) | 0.003 ± 0.001 | *0.007 |
| Postop 1 m SFCT (μm) | 0.001 ± 0.002 | 0.838 |
| Postop 2 m SFCT (μm) | -0.001 ± 0.001 | 0.604 |
| Postop 3 m SFCT (μm) | 0.002 ± 0.002 | 0.245 |
| Postop 6 m SFCT (μm) | -0.001 ± 0.002 | 0.474 |
Table 6.
Effect of phacoemulsification and intravitreal tamponade on SFCT by univariable regression analysis
|
3 months BCVA (n = 15) |
6 months BCVA (n = 15) |
|||
|---|---|---|---|---|
| β | p-value | β | p-value | |
| PE c PCL (ref:n) | 37.64 ± 33.20 | 0.279 | 35.51 ± 30.55 | 0.268 |
| Tamponade (ref:C3F8) | 20.06 ± 36.78 | 0.595 | 17.74 ± 33.84 | 0.610 |
REFERENCES
1) Sayman Muslubas I, Hocaoglu M, Ersoz MG, et al. Choroidal thickness in chronic rhegmatogenous retinal detachment before and after surgery, and comparison with acute cases. Int Ophthalmol 2018;38:1035-42.



2) Sezer T; Altınışık M, Koytak İA, Özdemir MH. The choroid and optical coherence tomography. Turk J Ophthalmol 2016;46:30-7.



3) Tan CS, Ouyang Y, Ruiz H, Sadda SR. Diurnal variation of choroidal thickness in normal, healthy subjects measured by spectral domain optical coherence tomography. Invest Ophthalmol Vis Sci 2012;53:261-6.


4) Odrobina D, Gołębiewska J, Maroszyńska I. Choroidal thickness changes after vitrectomy with silicone oil tamponade for proliferative vitreoretinopathy retinal detachment. Retina 2017;37:2124-9.


5) Kimura M, Nishimura A, Yokogawa H, et al. Subfoveal choroidal thickness change following segmental scleral buckling for rhegmatogenous retinal detachment. Am J Ophthalmol 2012;154:893-900.


6) Sayman Muslubas I, Karacorlu M, Hocaoglu M, et al. Subfoveal choroidal thickness change after pars plana vitrectomy in recent onset rhegmatogenous retinal detachment. Retina 2016;36:2371-6.


7) Giacuzzo C, Bergin C, Potic J, et al. Evolution and patterns of choroidal thickness changes in rhegmatogenous retinal detachment. Retina 2020;40:47-55.


8) Akkoyun I, Pınarcı EY, Yesilirmak N, Yılmaz G. Choroidal thickness after scleral buckling surgery in macula-off rhegmatogenous retinal detachment. Ophthalmologe 2014;111:954-60.



9) Akkoyun I, Yilmaz G. Choroidal thickness after scleral buckling surgery versus pars plana vitrectomy in macula-off rhegmatogenous retinal detachment. Klin Monbl Augenheilkd 2014;231:1029-33.

10) Williams GA, Reeser F, O'Brien WJ, Fleischman JA. Prostacyclin and thromboxane A2 derivatives in rhegmatogenous subretinal fluid. Arch Ophthalmol 1983;101:463-4.


11) Ricker LJ, Kijlstra A, de Jager W, et al. Chemokine levels in subretinal fluid obtained during scleral buckling surgery after rhegmatogenous retinal detachment. Invest Ophthalmol Vis Sci 2010;51:4143-50.


12) Quintyn JC, Brasseur G. Subretinal fluid in primary rhegmatogenous retinal detachment: physiopathology and composition. Surv Ophthalmol 2004;49:96-108.


14) Pederson JE, Cantrill HL. Experimental retinal detachment. V. Fluid movement through the retinal hole. Arch Ophthalmol 1984;102:136-9.


15) Azad R, Mondal AK, Arora R, Tewari HK. Corneal thickness and I.O.P. changes in rhegmatogenous retinal detachment. Indian J Ophthalmol 1990;38:4-6.

16) Sugawara R, Nagaoka T, Kitaya N, et al. Choroidal blood flow in the foveal region in eyes with rhegmatogenous retinal detachment and scleral buckling procedures. Br J Ophthalmol 2006;90:1363-5.



17) Kimura I, Shinoda K, Eshita T, et al. Relaxation of encircling buckle improved choroidal blood flow in a patient with visual field defect following encircling procedure. Jpn J Ophthalmol 2006;50:554-6.



18) Michalewska Z, Michalewski J, Adelman RA, et al. Choroidal thickness measured with swept source optical coherence tomography before and after vitrectomy with internal limiting membrane peeling for idiopathic epiretinal membranes. Retina 2015;35:487-91.


19) Kang EC, Lee KH, Koh HJ. Changes in choroidal thickness after vitrectomy for epiretinal membrane combined with vitreomacular traction. Acta Ophthalmol 2017;95:e393-8.



20) Ahn SJ, Woo SJ, Park KH. Choroidal thickness change following vitrectomy in idiopathic epiretinal membrane and macular hole. Graefes Arch Clin Exp Ophthalmol 2016;254:1059-67.



21) Friberg TR, Lace JW. A comparison of the elastic properties of human choroid and sclera. Exp Eye Res 1988;47:429-36.


22) Holekamp NM, Shui YB, Beebe DC. Vitrectomy surgery increases oxygen exposure to the lens: a possible mechanism for nuclear cataract formation. Am J Ophthalmol 2005;139:302-10.


23) Lim LS, Tan L, Perera S. Retinal vessel oxygen saturation increases after vitrectomy. Invest Ophthalmol Vis Sci 2014;55:3851-6.


24) Käsdorf BT, Arends F, Lieleg O. Diffusion regulation in the vitreous humor. Biophys J 2015;109:2171-81.



25) Odrobina D, Laudańska-Olszewska I, Gozdek P, et al. Influence of scleral buckling surgery with encircling band on subfoveal choroidal thickness in long-term observations. Biomed Res Int 2013;2013:586894.




26) Miura M, Arimoto G, Tsukahara R, et al. Choroidal thickness after scleral buckling. Ophthalmology 2012;119:1497-8.


27) Stitt AW, Gardiner TA, Archer DB. Retinal and choroidal responses to panretinal photocoagulation: an ultrastructural perspective. Graefes Arch Clin Exp Ophthalmol 1995;233:699-705.



28) Zhang Z, Meng X, Wu Z, et al. Changes in choroidal thickness after panretinal photocoagulation for diabetic retinopathy: a 12-week longitudinal study. Invest Ophthalmol Vis Sci 2015;56:2631-8.


29) Veckeneer M, Van Overdam K, Bouwens D, et al. Randomized clinical trial of cryotherapy versus laser photocoagulation for retinopexy in conventional retinal detachment surgery. Am J Ophthalmol 2001;132:343-7.


30) Lira RP, Takasaka I, Arieta CE, et al. Cryotherapy vs laser photocoagulation in scleral buckle surgery: a randomized clinical trial. Arch Ophthalmol 2010;128:1519-22.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




