 |
 |
| J Korean Ophthalmol Soc > Volume 64(12); 2023 > Article |
|
ê”돞ìŽëĄ
ëȘ©ì
걎ì±ì íììì ìŹí ë§ìŽëŽì ìì€ì ìí ììžì ë¶ìíêł ì íìë€.
ëìêłŒ ë°©ëČ
2020ë
ë¶í° 2021ë
êčì§ ê±Žì±ììŒëĄ ìčëŁë°ì íì ì€ ë§ìŽëŽì ìŽŹìì ì ìíí 229ëȘ
ì íìë„Œ ëììŒëĄ ë§ìŽëŽì ìì€ ì ëì ë°ëŒ 4ê°ì ê”°ìŒëĄ ëëìŽ ìêČì°ì íêŽíì„, ë¶ê·ìčì±, ìê”Źíë©Žì§íì§ì, ëčìčšì”ì ëëŹŒë§íꎎìê°, ëëŹŒë§ ì§ì§ìž” ëê», ëëŹŒë ëìŽë„Œ ëčê”íìë€. ëìê”°ì ëìŽ, ì±ëł, ììŽëŒìž 돞ì ìŹë¶, êł íì, ëčëš, ìŽìì§ì§íìŠ, íì ìčëŁ, ëêČœë¶ì ë°©ìŹì ìčëŁ, íêČœêž° ížë„ŽëȘŹ ëìČŽ ìčëŁ, ìê°ë©Žì ì§í ë±ì êłŒê±°ë „ì ìĄ°ìŹíìŹ ìŹí ë§ìŽëŽì ìì€ ì ëìì ìêŽêŽêłë„Œ ë¶ìíìë€. êČ°ë§ ë©Žì ì 75% ìŽì ë§ìŽëŽììŽ ìì€ë êČœì° ìŹí ë§ìŽëŽì ìì€ëĄ ì ìíêł ëĄì§ì€í± íê·ë¶ìì ìŽì©íìŹ ìí ììžì íê°íìë€.
êČ°êłŒ
ë§ìŽëŽì ìì€ ì ëì ë°ëŒ ëë 4ê°ì ê”°ìì ë§ìŽëŽì ìì€ ì ëê° ìŹí ê”°ìì ëìŽê° ë ë§êł (p=0.001) ëëŹŒ ì§ì§ìž” ëê»ê° ëźììŒë©°(p<0.001) ììŽëŒìž 돞ì ëčëê° ëìë€(p=<0.001). êł ì§íìŠ(p<0.001)êłŒ íì ìčëŁë „(p=0.001)ì ëčìšë ë§ìŽëŽì ìì€ìŽ ìŹí ê”°ìì ëìë€. ë€ì€ ëĄì§ì€í± íê·ë¶ì êČ°êłŒ ëìŽ, ììŽëŒìž 돞ì , êł ì§íìŠ, íì ìčëŁì êłŒê±°ë „ì ìŹí ë§ìŽëŽì ìì€êłŒ ì ìí ìí„ì ìŁŒë ëłììë€(p<0.05).
ABSTRACT
Methods
The medical charts of 229 dry eye disease patients who had a meibography were retrospectively reviewed. They were divided into 4 groups according to the degree of meibomian gland loss. Telangiectasia and irregularity of eyelid margin, Ocular Surface Disease Index (OSDI), non invasive breakup time (NIBUT), lipid layer thickness (LLT) and tear meniscus height (TMH) were compared. Age, gender, history of eyeline tattoo, history of hypertension, diabetes, dyslipidemia, chemotherapy, radiation therapy, hormone therapy and autoimmune diseases were also investigated to analyze the correlation with the severe meibomian gland loss. Severe meibomian gland loss was defined as loss of more than 75% of the conjunctival area, and risk factors were evaluated using logistic regression analysis.
Results
Comparing the four groups divided according to the degree of meibomian gland loss, the group with severe meibomian gland loss was older (p = 0.001), had lower LLT (p < 0.001), had a higher frequency of eyeline tattoos. The ratio of hyperlipidemia (p < 0.001) and chemotherapy (p < 0.001) was also high in the group with severe meibomian gland loss. As a result of multiple logistic regression analysis, age, eyeline tattoo, hyperlipidemia, and chemotherapy were variables that had a significant effect on sever meibomian gland loss. (p < 0.05)
걎ì±ìì ëëŹŒì ìì± ë¶ìĄ±, ë¶ìì ì±, êł ìŒíŹì, ìê”Źíë©Žì ìŒìŠìŽë ì êČœê°ê° ìŽìêłŒ ê°ì ë€ìí ììžìŽ ìì©íìŹ ìë „ì í, ë¶ížê° ë±ì ìŠìì ìŒìŒí€ë ìê”Źíë©Ž ì§íìŽë€.1 걎ì±ìì ëłìžì ë°ëŒ íŹêČ ìì±ëëŹŒë¶ìĄ± 걎ì±ìêłŒ ëëŹŒìŠë° 걎ì±ììŒëĄ ëëëë°, ëëŹŒì ê°ì„ ë°êč„ìž”ì ê”Źì±íë©° ëëŹŒìŽ ìœêČ ìŠë°íì§ ëȘ»íëëĄ íë ë§ìŽëŽ ë¶ëčì êŽë šë ëȘšë êž°ë„ ìŽìì ë§ìŽëŽìêž°ë„ë¶ì ìŽëŒêł íë©° ëëŹŒìŠë° 걎ì±ìì ëíì ìž ììžìŽë€.
ë§ìŽëŽì ìì€ì ë§ìŽëŽì ìŽŹìì ìì dropoutìŒëĄ ëíëë ë§ìŽëŽìì ë©Žì ìì€ ì ëì ë°ëŒ ë±êžì 맀êČš ë§ìŽëŽìêž°ë„ë¶ì ì ì§ëšì íì©ëë€. ë§ìŽëŽì ìì€ì ìĄ°ì§íì ìŒëĄ ë§ìŽëŽì ìžìœì ìì¶ì ì믞íë ìêČŹìŒëĄ,2,3 ë§ìŽëŽì ìì€ ì ëë 짧ì ëëŹŒë§íꎎìê°, ìì ëëŹŒì§ì§ìž”êłŒ ì°êŽìŽ ìë€.3-5
MachaliĆska et al6ì ë€ì€íê·ë¶ììì ë§ìŽëŽì ìì€ì ìíìžìëĄ ëìŽ, íêČœ í ížë„ŽëȘŹ ìčëŁ, íìëŹì§ìœì ìŹì© ë±ì ëłŽêł íìêł , Yeh and Lin7ìŽ ì ì ì°ë čì ëììŒëĄ í ëšë©Ž ì°ê”Źììë ì ìŒíêČ ížë„ŽëȘŹ íŒìì ìŹì©ë§ìŽ ìŹê°í ë§ìŽëŽì ìì€ì ìíìžììë€. ê”ëŽììë ììŽëŒìž 돞ì ìŽ ë§ìŽëŽì ìì€ ë° ë§ìŽëŽìêž°ë„ ìŽìì ìŒìŒíšë€êł ëłŽêł íìêł 8 Chen et al9ì ëêČœë¶ìì ìčëŁëĄ ìžêž°ìĄ°ì ë°©ìŹì ìčëŁë„Œ ë°ì íìê”°ìì ë§ìŽëŽì ìì€ìŽ ìŹíêł , ë§ìŽëŽì ì§ìŽ ìąì§ ìì êČì í”íŽ ëêČœë¶ìììì ëì 걎ì±ì ì ëłë„ ìŽ ë°©ìŹì ìĄ°ìŹì ìí ë§ìŽëŽì ìì€ìŽ ììžìŽ ë ì ìë€êł íìë€.
ìŽë ëŻ ë€ìí ììžìŽ ë§ìŽëŽì ìì€êłŒ ì°êŽëìŽ ë§ìŽëŽ ìêž°ë„ë¶ì ì ìŒìŒíŹ ì ìë êČìŒëĄ ìë €ì ž ìì§ë§ í° ê·ëȘšì 걎ì±ì íìë„Œ ëììŒëĄ ë€ìí ëłìë€ì íŹíšíìŹ ë§ìŽëŽì ìì€ì ìíìžìë„Œ ë¶ìí êČì ëíŽìë ìë €ì§ ë°ê° ìë€. ìŽì, ëłž ì°ê”Źììë ìŹê°í ë§ìŽëŽì ìì€ì ìíìžìì ëíŽ ììëłŽêł ìŽ ìíìžìë€êłŒ ìê”Źíë©Ž ì§íë€êłŒì êŽë šì±ì ëíŽ ë¶ìíŽ ëłŽêł ì íìë€.
2020ë
1ì 1ìŒë¶í° 2021ë
1ì 1ìŒêčì§ ë ë¶ížê°ìŒëĄ ëłžì ìêłŒì ëŽìíìŹ ê±Žì±ìêłŒ ë§ìŽëŽì êŽë š êČìŹë„Œ ìí ë°ì íìì ìëŹŽêž°ëĄì íí„ì ìŒëĄ ë¶ìíìë€. ëłž ì°ê”Źë ëłžì êž°êŽìëȘ
ì€ëŠŹììíì ìŹìë„Œ íëíìë€(ìčìžëČíž: CR323026).
ìžê·čë±í믞êČœêČìŹë„Œ í”íŽ ììëëêșŒíì íêŽ íì„ ìŹë¶, ëêșŒí êČœêłì íšì ìŹë¶, ììŽëŒìž 돞ì ìŹë¶ë„Œ êŽì°°íìŹ ê° íëȘ©ìŽ ìĄŽìŹíë êČœì° 1, ìĄŽìŹíì§ ìë êČœì°ë„Œ 0ìŒëĄ êž°ëĄíìë€.
IDRA (Sbm Sistemi, Inc., Torino, Italy) ì„ëčë„Œ ìŽì©íìŹ, ëčìčšì”ì ëëŹŒíꎎìê°(noninvasive break up time, NIBUT), ëëŹŒë ëìŽ(tear meniscus height, TMH), ëëŹŒì§ì§ìž”ëê»(lipid layer thickness, LLT)ë„Œ ìžĄì íìë€. ëìŒ ì„ëčëĄ íìêČìì ë§ìŽëŽì ìŽŹìì ì í”íŽ ë§ìŽëŽì ìì€ ì ëë„Œ ìžĄì íìêł , Arita et al10ìŽ ì ìí ì ìČŽ ë©Žì ëëč ë§ìŽëŽììŽ ìì€ë ë¶ìì ë©Žì ë¶ìš(%)ì ë°ëŒ grade 0-3 (0: 0-25%, 1: 25-50%, 2: 50-75%, 3: 75% ìŽì)ìŒëĄ êž°ëĄíìë€(Fig. 1).
ìê”Źíë©Žì§íì§ì(ocular surface disease index) ì€ëŹžì§ëĄ ìŁŒêŽì ìž ìê”Źê±ŽìĄ°ìŠ ìŠìì ì ëë„Œ ìžĄì íììŒë©° ìŽ ììčë 0ë¶í° 100ì êčì§ëĄ ìžĄì ëêł ì ìê° íŽìëĄ ìŠììŽ ìŹí êČì ëíëžë€. ëí ìČ« 방돞 ì ìŒêŽì ìŒëĄ êłŒê±°ë „ ìŹë¶(êł íì, ëčëš, ìŽìì§ì§íìŠ, íêČœêž° ížë„ŽëȘŹ ëìČŽ ìčëŁ, íì ìčëŁ, ëêČœë¶ì ë°©ìŹì ìčëŁ, ìŒê·žë ìŠíê”°, ë„ë§í°ì€êŽì ìŒ)ë„Œ ìĄ°ìŹíìŹ ê° íëȘ©ìŽ ìĄŽìŹíë êČœì° 1, ìĄŽìŹíì§ ìë êČœì°ë„Œ 0ìŒëĄ êž°ëĄíìë€. ëí ìì ë „ì íìžíììŒë©°, ì”ê·Œ 1ë
ìŽëŽì ìê”Ź ëŽ ìì , ê°ë§ê”Žì ìì ë±ì ë°ì êČœì°ë ëììì ì ìžíìë€.
í”êłíì ë¶ìì IBM SPSS ver. 20.0 (IBM Corp., Armonk, NY, USA) íëĄê·žëšì ìŹì©íìêł , ìì ì€ ììëĄ í ëì ì ííìŹ ë¶ìíìë€. ë§ìŽëŽììŽ ìì€ë ë¶ìì ë©Žì ë¶ìš(%)ì ë°ë„ž ì ëëĄ ëë 4ê°ì ê”° ìŹìŽì ëìŽ, ëčìčšì”ì ëëŹŒíꎎìê°, ëëŹŒ ì§ì§ìž” ëê», ëëŹŒë ëìŽ, ìê”Źíë©Ž ì§íì§ìì íê· ì one-way analysis of varianceë„Œ ìŽì©íìŹ ì ìíë„ ì ì»ììŒë©°, ìŹí êČì ì Bonferroni testë„Œ ìŹì©íìë€. ì±ëł, ìêČì íêŽíì„ ìŹë¶, ìêČ êČœêłì ë¶ê·ìčì± ìŹë¶, íìêČì ììŽëŒìž 돞ì ì ìŹë¶, êłŒê±°ë „ì ëčë ì°šìŽë Fisherâs exact testë„Œ ìŹì©íìë€. ë§ìŽëŽì ìì€ ì ëì ìê”Źíë©Ž ì§íìž ëčìčšì”ì ëëŹŒíꎎìê°, ëëŹŒ ì§ì§ìž” ëê», ëëŹŒë ëìŽ, ìê”Źíë©Žì§íì§ììì ìêŽêŽêłë ëšì ì ííê·ë¶ììŒëĄ ë¶ìíììŒë©°, ë§ìŽëŽì ìì€ grade 3ë„Œ ìŹí ë§ìŽëŽì ìì€ê”°ìŒëĄ ì ìíìŹ ëìŽ, ì±ëł, ìêČì íêŽíì„ ìŹë¶, ìêČ êČœêłì ë¶ê·ìčì± ìŹë¶, ììŽëŒìž 돞ì ì ìŹë¶, êłŒê±°ë „ì ëłìëĄ ê°ê° ëšëłë ëĄì§ì€í± íê·ë¶ì íì ìčì°ëčë„Œ ê”ŹíììŒë©°, ëšëłë ëĄì§ì€í± íê·ë¶ì êČ°êłŒ p-value<0.05ëĄ ì ìí ëłìë€ì íŹíšíìŹ ë€ëłë ëĄì§ì€í± íê·ë¶ììŒëĄ ìŹí ë§ìŽëŽì ìì€ì ìíìžìë„Œ êČì íìë€. ëȘšë í”êłì êČì ì ì ìì±ì p<0.05ëĄ ì ìíìë€.
229ëȘ
ì ëìììì ë§ìŽëŽì ìì€ ì ëì ë°ëŒ ë¶ë„í êČ°êłŒ, grade 0ì 54ëȘ
(23.6%), grade 1ì 87ëȘ
(38.0%), grade 2ë 44ëȘ
(19.2%), grade 3ì 44ëȘ
(19.2%)ìŽ íŹíšëìë€. grade 0ìì ìì€ ì ëê° ìŹí grade 3ìŒëĄ ê°ìëĄ ê° ê”°ì íê· ì°ë čìŽ ëìêł ì ìí ì°šìŽë„Œ 볎ìë€(p=<0.001) (Table 1). ë§ìŽëŽì ìì€ìŽ ìŹí ê”°ìŒìëĄ ìêČì íêŽíì„ ìŹë¶ì, ìêČ êČœêłì ë¶ê·ìčì± ìŹë¶ì ë¶ìšë ì ìíêČ ëìë€(p<0.001, p<0.001) (Table 1). ëëŹŒ ì§ì§ìž” ëê»ë grade 3ì ìŹí ë§ìŽëŽì ìì€ê”°ìì 64.11 ± 14.96ìŒëĄ ë€ë„ž ê”°ì ëčíŽ ì ìíêČ ëźìêł (p<0.001), ëčìčšì”ì ëëŹŒíꎎìê°ì 5.22 ± 1.18ëĄ ì ìíêČ ì§§ìë€(p=0.010). ììŽëŒìž 돞ì ì ëčìšì ë§ìŽëŽì ìì€ìŽ ìŹí ê”°ìŒìëĄ ì ìíêČ ëì ë¶ìšì 볎ìë€(p<0.001) (Table 1). 4ê°ì ê”°ìì ìĄ°ìŹí êłŒê±°ë „ì ë¶ìšì ë€ìêłŒ ê°ë€(Table 1).
ëí ë§ìŽëŽì ìì€ ì ëì ëčìčšì”ì ëëŹŒíꎎìê°, ëëŹŒ ì§ì§ìž” ëê», ëëŹŒë ëìŽ, ìê”Źíë©Žì§íì§ìì ìêŽêŽêłë„Œ ë¶ìíìì ë ëëŹŒ ì§ì§ìž” ëê»ê° ì ìŒíêČ ì ìí ìì ìêŽêŽêłë„Œ 볎ìë€(R=0.058, B=-0.015, p<0.001) (Table 2).
ëšëłë ëĄì§ì€í± íê·ë¶ìììë grade 3ì íŽëčíë ìŹí ë§ìŽëŽì ìì€ì ì ìí ìíìžìë ëìŽ(odds ratio [OR]=1.032, p=0.043), ìêČì íêŽíì„ ìŹë¶(OR=6.054, p=0.038), ììŽëŒìž 돞ì ìŹë¶(OR=11.834, p<0.001), êł ì§íìŠì êłŒê±°ë „(OR=3.260, p=0.005), íì ìčëŁì êłŒê±°ë „(OR=5.684, p=0.006)ìŒëĄ íìžëìë€(Table 3). ìŽ ëłìë€ì íŹíší ë€ì€ ëĄì§ì€í± íê·ë¶ì êČ°êłŒìì ëìŽ, ììŽëŒìž 돞ì , êł ì§íìŠ, íì ìčëŁë ë€ë„ž ëłìë„Œ í”ì íìë ì믞 ìë ìíìžìëĄ íìžëìë€.
ëłž ì°ê”Źë 걎ì±ì íìë„Œ ëììŒëĄ ë§ìŽëŽì ìì€ ì ëì ë°ëŒ ìêČì íêŽíì„, ìêČì ë¶ê·ìčì±, ëčìčšì”ì ëëŹŒ íꎎìê°, ëëŹŒ ì§ì§ìž” ëê», ëëŹŒë ëìŽë„Œ ëčê”íêł ìŽë€ ìŹìŽì ìêŽêŽêłë„Œ ë¶ìíìë€. ëí íìì ëìŽ, ì±ëł, ììŽëŒìž 돞ì ìŹë¶, êł íì, ëčëš, ì§ì§íìŠ, ë°©ìŹì ìčëŁë „, íì ìčëŁë „ ë±ìŽ íŹíšë êłŒê±°ë „ ë±ìŽ ìŹê°í ë§ìŽëŽì ìì€ì ìíìžììžì§ ìì볎ìë€.
íìì ìê”Źê±ŽìĄ°ìŠì ìŠìêłŒ ì§íì êŽë šìŽ ìë ìê”Źíë©Žì§íì§ì, ëčìčšì”ì ëëŹŒíꎎìê°, ëëŹŒ ì§ì§ìž” ëê», ëëŹŒë ëìŽ ì€ ëłž ì°ê”Źìì ì ìŒíêČ ëëŹŒ ì§ì§ìž” ëê»ë§ìŽ ë§ìŽëŽì ìì€êłŒ ì ìí ìì ìêŽêŽêłë„Œ 볎ìë€. ë€ë„ž ì°ê”Źììë ë§ìŽëŽì ìì€ì ëźì ëëŹŒ ì§ì§ìž” ëê»ì ì°êŽìŽ ììì§ë§, ëźì ì§ì§ìž”ìŽ ì€íë € ëëŹŒì ìì± ìŠê°ë„Œ ì ëíìŹ ë§ìŽëŽì ìì€ê”°ìì ë ëì ìŹë„ŽëšžêČìŹìč ê°ì 볎ìŽê±°ë ëëŹŒë§íꎎìê° ê°ìì ë€ë„ž ê”°êłŒ ì°šìŽë„Œ 볎ìŽì§ ìëë€ë êČ°êłŒ ë±ìŽ ììë€.11,12 ëí 걎ì±ìì ë§ìŽëŽìêž°ë„ë¶ì ìŽìžìë ëëŹŒì ìì ì±êłŒ ëëŹŒì ê”Źì±íë ë€ìí ììë€ì ëł”í©ì ìž ìížìì©ìŒëĄ ëíëêž° ë돞ì, ë§ìŽëŽìì íŽë¶íì ìì€ìŽ 걎ì±ìì ìŹëŹ ìŠì ë° ì§íìë ìêŽêŽêłê° íŹì§ ìì ì ìë€ë ë§ì ì°ê”Źë€ìŽ ìë€.13,14
ìêČì°ì íêŽíì„ìŽë íë°, íšì, ë¶ê·ìčì±, ê°ê”Źë¶ ë§í ë±ì íííì ëłíë„Œ êŽì°°íë êČì ë§ìŽëŽìêž°ë„ë¶ì ì ì§ëšíë ì€ìí ìììŽì§ë§ ìŽëŹí íííì ëłíë ëìŽì ì°êŽìŽ ìë€.15 ëłž ì°ê”Źììë ë§ìŽëŽì ìì€ìŽ ìŹí ê”°ìì ìêČì íêŽíì„, ë¶ê·ìčì±ì ëčëê° ì ìíêČ ëìêł , ë§ìŽëŽì ìì€ìŽ ìŹí ê”°ìŒìëĄ íê· ëìŽê° ëìë€. íê·ë¶ì êČ°êłŒ ëìŽë ìŹí ë§ìŽëŽì ìì€ì ì ìí ìíìžììë€. ë
žíë ìêČì°ì íííì ëłíì ëë¶ìŽ ë§ìŽëŽì ìžìœì ìì¶ì ìŠê°ìí€êł ë§ìŽëŽì ê”Źì±íë ì§ì§ ìĄ°ì±ì ëłíë ìŒìŒíšë€.15,16 ë§ìŽëŽì ìžìœì ìì¶ì ì ëíë ë€ìí ììžìŽ ìì êČìŽë©°, ë§ì ììê° ë
žíê° ì§íëë©Žì ìí„ìŽ ì»€ì§ êČìŽë€. ê°ë č, ìëëĄì êČ°íìŽ ë§ìŽëŽìêž°ë„ë¶ì êłŒ êŽë šìŽ ìë€ë ì°ê”Źë ë
žíì ë°ë„ž ìëëĄì ê°ìì ìí„ìŽëŒêł ëłŒ ì ìë€.17 ëłž ì°ê”Źì í”êłíì ë¶ììì ëìŽë ë§ìŽëŽì ìì€ì ì ë°íë ìíìžììŽì§ë§ ì±ëłì ë°ë„ž ì°šìŽë 볎ìŽì§ ìë ìŽì ë ëìŽì ë°ë„ž ìí„ìŽ ë íŹêž° ë돞ìŒëĄ íŽìí ì ìë€. ëí, ìì€ížëĄì ì ìí„ì ì¶ì í ì ìë íêČœêž° ížë„ŽëȘŹ ëìČŽ ìčëŁë ì°ê”Źì íŹíšë íìê”° ì€ ì ì ìì íìë§ íŹíšëìŽ ë§ìŽëŽì ìì€êłŒì ì°êŽì±ì 볎ìŽêž° ìŽë €ì ì ìë ìë€.
ììŽëŒìž 돞ì ì êČœì° ëŹžì ì ìŹì©íë ììê° ìêČì ë§ì± ìŒìŠì ìŒìŒí€êł 돞ì ì ììčê° ë§ìŽëŽì ê°ê”Źë¶ì ê°êčìžìëĄ ë§ìŽëŽì ììêłŒ ëëŹŒ ì§ì§ìž” ëê» ê°ìê° ìŒìŽëë€ë ëłŽêł ê° ììë€.8,18 ëłž ì°ê”Źììë ë§ìŽëŽì ìì€ ì ëì ë°ëŒ ììŽëŒìž 돞ì ì ëčìšìŽ ëêł ìŹí ë§ìŽëŽì ìì€ì ê°ë „í ìíìžì ì€ íëëĄ íìžëìë€. ëłž ì°ê”Źë ìŒêŽì ìŒëĄ íìêČììë§ ë§ìŽëŽì ìŽŹìì ì ìííìŹ ë§ìŽëŽì ìì€ ì ëë„Œ íê°íìêž° ë돞ì ììŽëŒìž 돞ì ëí íìêČì ì€ìí êČœì°ë§ í êČìŒëĄ ë¶ë„íìëë°, ì€ì ëĄë ììêČì ììŽëŒìž 돞ì ì íë ëčìšìŽ ëêž° ë돞ì ììêČì íŹíšíìŹ ë¶ìì íìë€ë©Ž ë ì ìí êČ°êłŒë„Œ ì»ì ì ììì êČìŒëĄ ìê°ëë€. ëí ììŽëŒìž 돞ì ì ë°ì ìêž°ì ë§ìŽëŽì ìì€, ë§ìŽëŽìêž°ë„ë¶ì êłŒì ì°êŽì±ìŽ ìëì§ë ì¶í ì°ê”ŹíŽ ëłŒ íìê° ìë€.
êłŒê±°ë „ ì€ ìŹí ë§ìŽëŽì ìì€ì ìíìžìëĄ íìžë êČì ìŽìì§ì§íìŠêłŒ íì ìčëŁì êłŒê±°ë „ìŽìë€. íì„ ì§ì§ ìĄ°ì±ì ëłíê° ì§ì§ í©ì± êž°êŽì ííì êž°ë„ ëłíë„Œ ìŒìŒíšë€ë êČì ìŽëŻž íŒë¶ì ê°ì ë€ë„ž êž°êŽìì ìë €ì ž ìêł , ë§ìŽëŽìììë êł ì€ì±ì§ë°©íìŠ, êł ìœë ì€í
륀, ì ë°ëì§ì§ëšë°± ìŠê° ë±ìŽ ë§ìŽëŽìêž°ë„ë¶ì ì ë°ìêłŒ êŽë šìŽ ìììŽ ë°íìĄë€.19,20 ìŽìì§ì§íìŠìŽ ë§ìŽëŽì ìì€ì 믞ìčë ìí„ì ëíŽìë ìë €ì§ ë°ê° ë§ì§ ìêł , ëłž ì°ê”Źìì ì ìí ìíìžìëĄ íìžëêž°ë íìì§ë§, ìŽìì§ì§íìŠ íììì ë§ìŽëŽì ìì€ìŽ ìŒìŽëë êČìŽ íì„ ì§ì§ ìĄ°ì±ì ëłíê° ììžìžì§ ìŽìì§ì§íìŠìŒëĄ ìžíŽ ëł”ì©íë ìœì ê° ììžìŽ ëëì§ë ì¶ê° ì°ê”Źê° íìíë€êł ìê°ëë€. íì ìčëŁì êČœì° ìœëŹŒ ë
ì±ì í ííëĄ ë§ìŽëŽìì ìŹì ë° ìŠìì ìí„ì ìŁŒìŽ ë§ìŽëŽì ìì€ìŽ ëíëŹì ê°ë„ì±ìŽ ìë€. íì ìčëŁê° ë§ìŽëŽì ìì€ìŽë21 ëčëŁšêŽ ëëŹŒ ë°°ì¶êłì ì„ì ë„Œ ìŒìŒìŒ22 ë§ìŽëŽìêž°ë„ë¶ì ì ìŒìŒíŹ ì ìë€ë ìŽì ì°ê”Źë ëłŽêł ë ë° ììŒë©°, í„í íì ìœì ëłëĄ ë§ìŽëŽìì 믞ìčë ìí„ì ì¶ê°ì ìŒëĄ ë¶ìí íìê° ìì êČìŒëĄ ìê°ëë€. ëêČœë¶ì ë°©ìŹì ìčëŁ ëí ì§ì ì ìŒëĄ ë§ìŽëŽìì íꎎíë€ë ì°ê”Ź êČ°êłŒê° ììëë°,9 ëłž ì°ê”Źììë ìœ ìȘœì ê”ìì ìž ë°©ìŹì ìčëŁë„Œ ë°ì íììì ëìžĄ ìêČì ëë ·í ë§ìŽëŽì ìì€ìŽ êŽì°°ëë íìê° ìììŒë, ëêČœë¶ì ë°©ìŹì ìčëŁë„Œ ë°ì íìê° ë§€ì° ì êČ íŹíšëìŽ ììŽ ëĄì§ì€í± íê·ë¶ìììë ì ìí ìíìžìëĄ ëíëì§ ìì êČìŒëĄ ìê°ëë€.
ëłž ì°ê”Źììë í° ê·ëȘšì ê±ŽìĄ°ìŠ íìë„Œ ëììŒëĄ ìŹí ë§ìŽëŽì ìì€ì ìŒìŒíŹ ì ìë€êł ìë €ì§ ììžë€ì íŹíšíìŹ ìíìžìë„Œ ë¶ìíìë€ë êČì ììê° ìë€. ê·žëŹë íí„ì ì°ê”Źìë€ë ì êłŒ íìêČììë§ ì°ê”Źê° ìŽëŁšìŽìĄë€ë íêłê° ìë€. ì¶íìë ìŽ ì ì 볎ìíêł ëí íìê° ëł”ì©íêł ìë ìœì ë±ì ììží ìĄ°ìŹíë©Ž ë§ìŽëŽì ìì€ì ìŒìŒí€ë ë€ìí ëłìžì ìŽíŽíë ë° ëììŽ ë êČìŒëĄ ìê°íë€.
Figure 1.
Representative images of grading of meibomian gland loss (A: grade 0, B: grade 1, C: grade 2, D: grade 3).10
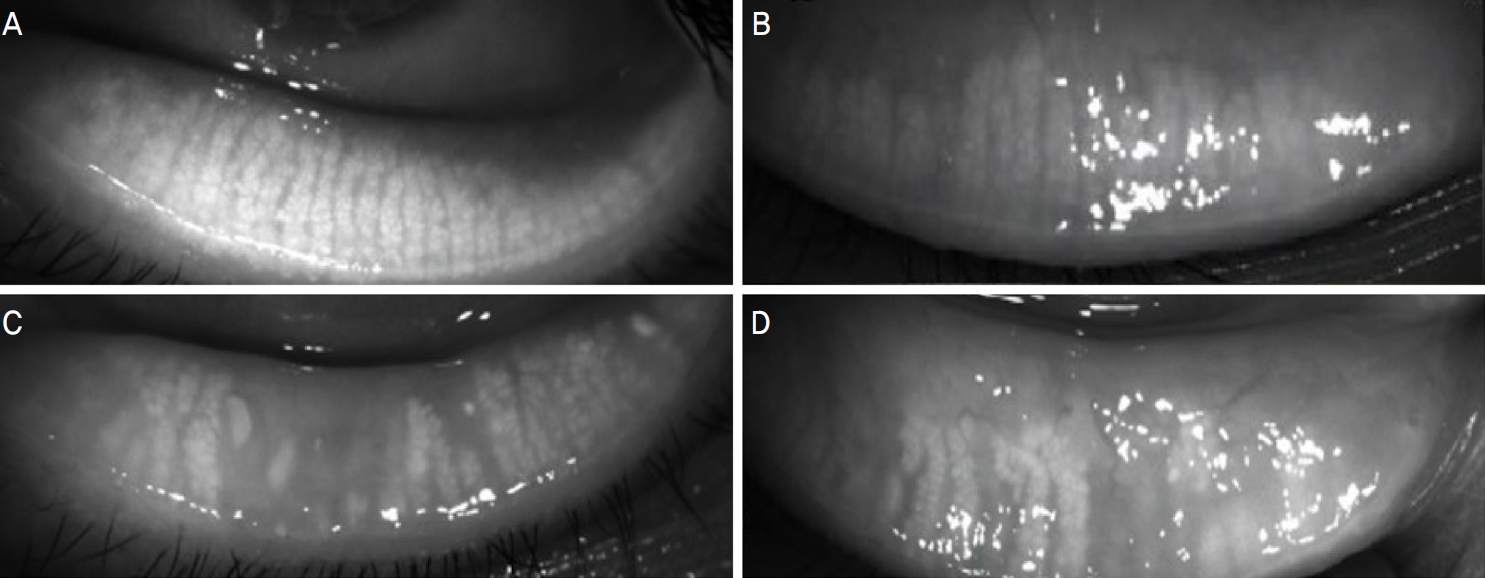
Table 1.
Demographics and clinical data of the study group
| Characteristic | MG loss grade 0 (n = 54) | MG loss grade 1 (n = 87) | MG loss grade 2 (n = 44) | MG loss grade 3 (n = 44) | p-value |
|---|---|---|---|---|---|
| Age (years) | 59.65 ± 13.00 | 68.48 ± 12.13 | 69.14 ± 9.85 | 70.20 ± 9.76 | 0.000* |
| Sex, female (%) | 59.3 | 48.3 | 54.5 | 52.3 | 0.040â |
| Telangiectasia (%) | 13.2 | 31 | 60.9 | 90.7 | 0.000â |
| Notching (%) | 1.9 | 12.6 | 8.7 | 14 | 0.000â |
| Tear parameters | |||||
| âNIBUT | 5.55 ± 1.28 | 4.92 ±5.48 | 5.48 ± 1.27 | 5.22 ±1.18 | 0.010* |
| âLLT | 77.57 ± 17.25 | 74.43 ± 15.57 | 75.27 ± 17.66 | 64.11 ± 14.96 | 0.000* |
| âTMH | 0.16 ± 0.06 | 0.18 ± 0.06 | 0.19 ± 0.09 | 0.17 ± 0.07 | 0.217* |
| âOSDI | 41.36 ± 23.04 | 37.38 ± 19.58 | 43.24 ± 20.70 | 39.77 ± 22.16 | 0.462* |
| âEyeliner tattoo (%) | 0 | 2.3 | 9.1 | 18.2 | 0.000â |
| Past history (%) | |||||
| âHypertension | 37.0 | 55.2 | 75.0 | 31.8 | 0.000â |
| âDiabetes mellitus | 22.2 | 28.7 | 40.9 | 32.5 | 0.013â |
| âDyslipidemia | 25.9 | 26.4 | 50.0 | 52.3 | 0.000â |
| âHormone replacement therapy | 1.9 | 0.0 | 0.0 | 0.0 | 0.005â |
| âChemotherapy | 1.9 | 3.4 | 2.3 | 13.6 | 0.001â |
| âRadiation therapy | 0.0 | 1.1 | 0.0 | 6.8 | 0.001â |
| âSjogrenâs syndrome | 5.6 | 0.0 | 0.0 | 0.0 | 0.000â |
| âRheumatoid arthritis | 5.6 | 3.4 | 4.5 | 2.3 | 0.030â |
Table 2.
Correlation between meibomian gland loss and other indices using simple linear regression
| Dependent variable | R2 | B | p-value |
|---|---|---|---|
| NIBUT | 0.010 | -0.024 | 0.664 |
| LLT | 0.058 | -0.015 | 0.000 |
| TMH | 0.003 | 0.771 | 0.437 |
| OSDI | 0.000 | 0.000 | 0.950 |
Table 3.
Correlation between severe meibomian gland loss and other indices using logistic regression
REFERENCES
1) Craig JP, Nelson JD, Azar DT, et al. TFOS DEWS II report executive summary. Ocul Surf 2017;15:802-12.


2) Alsuhaibani AH, Carter KD, AbrĂ moff MD, Nerad JA. Utility of meibography in the evaluation of meibomian glands morphology in normal and diseased eyelids. Saudi J Ophthalmol 2011;25:61-6.


3) Ban Y, Shimazaki-Den S, Tsubota K, Shimazaki J. Morphological evaluation of meibomian glands using noncontact infrared meibography. Ocul Surf 2013;11:47-53.


4) Eom Y, Lee JS, Kang SY, et al. Correlation between quantitative measurements of tear film lipid layer thickness and meibomian gland loss in patients with obstructive meibomian gland dysfunction and normal controls. Am J Ophthalmol 2013;155:1104-10.e2.


5) Finis D, Pischel N, Schrader S, Geerling G. Evaluation of lipid layer thickness measurement of the tear film as a diagnostic tool for meibomian gland dysfunction. Cornea 2013;32:1549-53.


6) MachaliĆska A, Zakrzewska A, Safranow K, et al. Risk factors and symptoms of meibomian gland loss in a healthy population. J Ophthalmol 2016;2016:7526120.


7) Yeh TN, Lin MC. Risk factors for severe meibomian gland atrophy in a young adult population: a cross-sectional study. PLoS One 2017;12:e0185603.



8) Yoon J, Kim AY, Jun RM, Han KE. The effect of eyeliner tattoo on meibomian gland dysfunction and the ocular surface. J Korean Ophthalmol Soc 2020;61:146-52.


9) Chen X, Badian RA, Hynne H, et al. Alterations in meibomian glands in patients treated with intensity-modulated radiotherapy for head and neck cancer. Sci Rep 2021;11:22419.




10) Arita R, Itoh K, Maeda S, et al. Proposed diagnostic criteria for obstructive meibomian gland dysfunction. Ophthalmology 2009;116:2058-63.e1.


11) Arita R, Morishige N, Koh S, et al. Increased tear fluid production as a compensatory response to meibomian gland loss: a multicenter cross-sectional study. Ophthalmology 2015;122:925-33.


12) Kim WJ, Ahn YJ, Kim MH, et al. Lipid layer thickness decrease due to meibomian gland dysfunction leads to tear film instability and reflex tear secretion. Ann Med 2022;54:893-9.



13) Pult H, Riede-Pult BH, Nichols JJ. Relation between upper and lower lids' meibomian gland morphology, tear film, and dry eye. Optom Vis Sci 2012;89:E310-5.


14) Ramos-Betancourt N, Gonzålez-Dibildox LA, Robles-Gutiérrez CR, et al. Correlation between infrared meibography and ocular surface disease signs and symptoms. Invest Ophthalmol Vis Sci 2015;56:2510.
15) Hykin P, Bron A. Age-related morphological changes in lid margin and meibomian gland anatomy. Cornea 1992;11:334-42.


16) Sullivan BD, Evans JE, Dana MR, Sullivan DA. Influence of aging on the polar and neutral lipid profiles in human meibomian gland secretions. Arch Ophthalmol 2006;124:1286-92.


17) Sullivan DA, Sullivan BD, Evans JE, et al. Androgen deficiency, meibomian gland dysfunction, and evaporative dry eye. Ann N Y Acad Sci 2002;966:211-22.


18) Goldman A, Wollina U. Severe unexpected adverse effects after permanent eye makeup and their management by Q-switched Nd: YAG laser. Clin Interv Aging 2014;9:1305-9.


19) Bukhari AA. Associations between the grade of meibomian gland dysfunction and dyslipidemia. Ophthalmic Plast Reconstr Surg 2013;29:101-3.


20) Braich PS, Howard MK, Singh JS. Dyslipidemia and its association with meibomian gland dysfunction. Int Ophthalmol 2016;36:469-76.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 449 View
- 52 Download
- Related articles
-
Risk Factors for Early and Late Intraocular Lens Dislocation2023 February;64(2)
Risk Factors for Structural Changes in Meibomian Gland in Thyroid Eye Disease.2018 July;59(7)
Clinical Evaluation of Lacrimal Gland Ductal Disease.2014 January;55(1)
The Refractive Errors of Dominant and Non-dominant Eyes.2009 February;50(2)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



