 |
 |
| J Korean Ophthalmol Soc > Volume 64(9); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
1ĒśĢ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ņØ╝ņ░© ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀ Ļ░äņØś ņ╣śļŻī ĒÜ©Ļ│╝ ņ░©ņØ┤ļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņØ╝ņ░© ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĒÖśņĢä 32ļ¬ģ 61ņĢłņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. 1ĒśĢ ļśÉļŖö aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĒÖśņĢäņŚÉņä£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä ņŻ╝ņ×ģĒĢ£ ĻĄ░Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņŻ╝ņ×ģĒĢ£ ĻĄ░ņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņśĆĻ│Ā, ņ▓½ ņŻ╝ņé¼ Ēøä plus disease ņåīņŗżĻ╣īņ¦ĆņØś ĻĖ░Ļ░ä, ņ×¼ĒÖ£ņä▒ĒÖö ņĀĢļÅä, ņČöĻ░Ć ņ╣śļŻī ņŚ¼ļČĆ, ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀ(ņ▓½ ņŻ╝ņé¼ ņŗ£ņłĀ Ēøä ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ņŻ╝ļ│ĆļČĆĻ╣īņ¦Ć ĒśĢņä▒ļÉ£ Ļ▓ĮņÜ░)ņØä ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ 16ļ¬ģ(30ņĢł)Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ 6ļ¬ģ(12ņĢł)ņØś ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ Ļ░üĻ░ü 100.0%, 91.7%ņśĆņ£╝ļ®░, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ 5ļ¬ģ(9ņĢł)Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ 5ļ¬ģ(10ņĢł)ņØś ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ Ļ░üĻ░ü 55.6%, 60.0%ņśĆļŗż. 1ĒśĢ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ļ¬©ļæÉņŚÉņä£ ņŻ╝ņé¼ ņĢĮņĀ£ņŚÉ ļö░ļźĖ ņ▓½ ņŻ╝ņé¼ Ēøä plus disease ņåīņŗżĻ╣īņ¦ĆņØś ņŗ£Ļ░ä, ņ×¼ĒÖ£ņä▒ĒÖöņØś ņĀĢļÅä, ņČöĻ░Ć ņ╣śļŻīņØś ņĀĢļÅäļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
Ļ▓░ļĪĀ
1ĒśĢ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ Ļ░äņŚÉ ļ╣äņŖĘĒĢ£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ĻĘĖļ¤¼ļéś aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś Ļ▓ĮņÜ░ ņ╣śļŻī ļČĆņĪ▒ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöļĪ£ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ»ĆļĪ£, ņØ╝ņ░© ņŻ╝ņé¼ ņ╣śļŻī Ēøä ļ®┤ļ░ĆĒĢ£ ņČöņĀü Ļ┤Ćņ░░ņØ┤ ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśĻ▓Āļŗż.
ABSTRACT
Purpose
To investigate the differences in treatment effects between primary intravitreal bevacizumab injections and ranibizumab injections in type 1 retinopathy of prematurity (ROP) and aggressive ROP.
Methods
We retrospectively analyzed the medical records of 61 eyes from 32 premature infants who underwent primary intravitreal anti-vascular endothelial growth factor (VEGF) injections for ROP. Patients with type 1 or aggressive ROP were divided into two groups: the intravitreal bevacizumab injection group and the ranibizumab injection group. We analyzed the period until plus disease disappeared after the first injection, reactivation, additional treatment, and the primary treatment success rate (cases in which retinal vessels formed to the periphery without additional treatment after the first injection).
Results
In the type 1 ROP group, the primary treatment success rates for 16 patients (30 eyes) in the bevacizumab injection group and 6 patients (12 eyes) in the ranibizumab injection group were 100.0% and 91.7%, respectively. In the aggressive ROP group, the primary treatment success rates for 5 patients (9 eyes) in the bevacizumab injection group and 5 patients (10 eyes) in the ranibizumab injection group were 55.6% and 60.0%, respectively. In both type 1 and aggressive ROP, there were no significant differences in the period until plus disease disappeared after the first injection, reactivation rate, or additional treatment rate depending on the type of anti-VEGF.
ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØĆ ļ»ĖņłÖņĢäņŚÉņä£ ļ¦Øļ¦ēĒśłĻ┤ĆņØś ļ╣äņĀĢņāüņĀüņØĖ ļ░£ļŗ¼ļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£,1 ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ĒśĢņä▒ļÉ£ ļČĆņ£äņÖĆ ĒśĢņä▒ļÉśņ¦Ć ņĢŖļŖö ļ¦Øļ¦ēņØś ņĀæĒĢ®ļČĆ(vascular-avascular retinal junction) ļśÉļŖö ĒśłĻ┤ĆĒÖöļÉ£ ļ¦Øļ¦ē ļé┤ņŚÉņä£ ņŗĀņāØĒśłĻ┤Ć ņ”ØņŗØņØ┤ ņØ╝ņ¢┤ļéśļ®┤ņä£ Ļ▓¼ņØĖ ļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēļÉ£ļŗż.1,2 ņØ┤ļŖö ņåīņĢä ņĀĆņŗ£ļĀź ĒśĢņä▒ ļ░Å ņŗżļ¬ģņØś ņŻ╝ņÜö ņøÉņØĖ ņżæ ĒĢśļéśļĪ£, ņŗ£ĻĖ░ ņĀüņĀłĒĢ£ ņäĀļ│äĻ▓Ćņé¼ņÖĆ ņ╣śļŻīĻ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćļ®┤ ņŗżļ¬ģņØä ņśłļ░®ĒĢĀ ņłś ņ׳ļŗż.3
2003ļģä Early Treatment of Retinopathy of Prematurity4 ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢĀ ņĄ£ņ┤łņØś ņŗ£ņĀÉņØä 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ņĀĢĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ņØ╝ļČĆ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØĆ plus diseaseĻ░Ć ļ¦żņÜ░ ļÜ£ļĀĘĒĢśĻ│Ā ļ│æļ│ĆņØś Ļ▓ĮĻ│äĻ░Ć ļČłļ¬ģĒÖĢĒĢ£ ĒÄĖĒÅēĒĢ£ ņŗĀņāØĒśłĻ┤ĆņØ┤ Ļ▓ĮĻ│ä ļČĆņ£äļ┐Éļ¦ī ņĢäļŗłļØ╝, ĒśłĻ┤ĆņØ┤ ĒśĢņä▒ļÉ£ ļ¦Øļ¦ē ļé┤ņŚÉņä£ Ļ┤Ćņ░░ņØ┤ ļÉśļ®░, ņ¦äĒ¢ē Ļ│╝ņĀĢņØ┤ ļŗ©Ļ│äļ│äļĪ£ ņ¦äĒ¢ēļÉśņ¦Ć ņĢŖĻ│Ā ņĢäņŻ╝ ĻĖēĻ▓®Ē׳ ņ¦äĒ¢ēĒĢśņŚ¼ ņĪ░ĻĖ░ņŚÉ ļ¦Øļ¦ēļ░Ģļ”¼Ļ░Ć ņāØĻĖ░ļŖö ņåīĻ▓¼ļōżņØ┤ ļ│┤ņŚ¼, ņØ┤ļź╝ aggressive posterior ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ļ¬ģļ¬ģĒĢśņśĆļŗż.5 2021ļģäļÅä International Committee for the Classification of Retinopathy of Prematurity, 3rd edition (ICROP3)ņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņ¦ĢņØä Ļ░Ćņ¦ä ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØ┤ ļ│æļ│ĆņØś ņ£äņ╣śļ│┤ļŗżļŖö ĒŖ╣ņ¦ĢņĀüņØĖ ņŗĀņāØĒśłĻ┤Ć ĒśĢņä▒ ļ░Å ņ¦äĒ¢ē ņåŹļÅä(tempo)Ļ░Ć ļŹö ņżæņÜöĒĢśļŗżĻ│Ā ļģ╝ņØśĒĢśņŚ¼ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ļ¬ģņ╣ŁņØä ļ│ĆĻ▓ĮĒĢśņśĆļŗż.6 Aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØĆ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻ│╝ ļ╣äĻĄÉĒĢśļ®┤ ļ░£ņāØ ņŗ£ĻĖ░Ļ░Ć ļ╣Āļź┤Ļ│Ā ņ¦äĒ¢ē ņåŹļÅäļÅä ļ¦żņÜ░ ļ╣©ļØ╝ņä£ ļ│┤ļŗż ņĀüĻĘ╣ņĀüņØĖ ļłł Ļ▓Ćņé¼ņÖĆ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļ®░, ļĀłņØ┤ņĀĆ ļśÉļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É(vascular endothelial growth factor, VEGF) ņŻ╝ņé¼ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēĒĢĀ ļ╣łļÅäĻ░Ć ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.6,7 ĻĘĖļ¤¼ļéś ņĢäņ¦üĻ╣īņ¦Ć aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņäĀļ│äĻ▓Ćņé¼ņŚÉ ļīĆĒĢ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØ┤ļéś ļ¬ģĒÖĢĒĢ£ ņ╣śļŻī ĒöäļĪ£ĒåĀņĮ£ņØĆ ņĀĢĒĢ┤ņ¦ä Ļ▓āņØ┤ ņŚåļŗż.
ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×ÉļŖö ļ¦Øļ¦ēĒśłĻ┤ĆņØś ļ░£ļŗ¼Ļ│╝ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ēņŚÉ ĒĢĄņŗ¼ ņŚŁĒĢĀņØä ĒĢśļ®░,8,9 The Bevacizumab Eliminate the Angiogenic Treat (BEAT)-ROP ņŚ░ĻĄ¼,10 The RAnibizumab compared with laser therapy for the treatment of INfants BOrn prematurely With retinopathy of prematurity (RAINBOW) ņŚ░ĻĄ¼11 ļō▒ņØä ĒåĄĒĢ┤ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉ ņ׳ņ¢┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ņŚÉ ļīĆĒĢ£ ļ¦ÄņØĆ ņ×äņāü ņŚ░ĻĄ¼ļōżņØ┤ ņØ┤ļŻ©ņ¢┤ņĀĖ ņÖöļŗż. ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļŖö ļĀłņØ┤ņĀĆ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ ņĀäņŗĀļ¦łņĘ©ņŚÉ ņØśĒĢ£ ņ£äĒŚśņØ┤ ņŚåĻ│Ā ņ×äņāüņĀü ļ░śņØæņØ┤ ļ╣Āļź┤ļ®░ ļ¦Øļ¦ēņØś ņśüĻĄ¼ņĀü ņåÉņāüņØä ņØ╝ņ£╝Ēéżņ¦Ć ņĢŖĻ│Ā ļ»Ėņä▒ņłÖ ļ¦Øļ¦ē(immature retina)ņŚÉņä£ņØś ĒśłĻ┤Ć ļ░£ļŗ¼ņØä ņ£Āņ¦Ćņŗ£ņ╝£ ņżĆļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż.12
ĻĄŁļé┤ņŚÉņä£ļŖö ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö(Avastin┬«, Genentech Inc., San Francisco, CA, USA)ņØä off-labelļĪ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉ ņé¼ņÜ®ĒĢ┤ ņśżļŗżĻ░Ć, 2021ļģä 1ņøöļČĆĒä░ ņŗØĒÆłņØśņĢĮĒÆłņĢłņĀäņ▓śņŚÉņä£ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö(Lucentis┬«, Novartis Pharmaceutical Co, East Hanover, NJ, USA)ņØä ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņŖ╣ņØĖĒĢśņŚ¼ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż. ļ│┤ĒŚś ņĀüņÜ® ļīĆņāü ņ¦łĒÖśņØĆ ņĢäļŗłĻĖ░ņŚÉ ņĢĮņĀ£ņŚÉ ļīĆĒĢ£ ņ╣śļŻīļ╣ä ļČĆļŗ┤ņØ┤ ņ׳ņ£╝ļéś, ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØ┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņŚÉ ļ╣äĒĢ┤ ļ░śĻ░ÉĻĖ░Ļ░Ć ņ¦¦ņĢä13 ņĀäņŗĀņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ņĀüņ¢┤ Ē¢źĒøä ĻĄŁļé┤ņŚÉņä£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļ¤ēņØ┤ ĻĖēņ”ØĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļéś Ēśäņ×¼ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØś ĒÜ©Ļ│╝ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖö ņĀĢļÅäņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼14-16ļōżņØĆ ņ׳ņ£╝ļéś, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņĢäņ¦ü Ļ▒░ņØś ņŚ░ĻĄ¼ļÉ£ ļ░öĻ░Ć ņŚåļŖö ņŗżņĀĢņØ┤ļŗż.
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻ│╝ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĒÖśņĢäņŚÉņä£ ņØ╝ņ░© ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ņØś ņ╣śļŻī ļ░śņØæ ļ░Å ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Ā, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņ×ģņłĀ Ļ░äņØś ņ╣śļŻī ĒÜ©Ļ│╝ļÅä ļ╣äĻĄÉĒĢ┤ ļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
2018ļģä 1ņøöļČĆĒä░ 2021ļģä 12ņøöĻ╣īņ¦Ć Ļ│äļ¬ģļīĆĒĢÖĻĄÉ ļÅÖņé░ļ│æņøÉņŚÉņä£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņØ╝ņ░© ņ╣śļŻīļĪ£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢśĻ│Ā ņøöĻ▓ĮĒøäņŚ░ļĀ╣ 70ņŻ╝Ļ╣īņ¦Ć(70 ┬▒ 3ņŻ╝) ņČöņĀü Ļ┤Ćņ░░ņØä ļ¦łņ╣£ ļ»ĖņłÖņĢäļōżņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ļłłņØĆ ICROP36 ĻĖ░ņżĆņ£╝ļĪ£ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻ│╝ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ļéśļłäņŚłļŗż. 1ĻĄ¼ņŚŁņŚÉņä£ ļ│æĻĖ░(stage)ņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ plus diseaseļź╝ ļÅÖļ░śĒĢ£ Ļ▓ĮņÜ░, 1ĻĄ¼ņŚŁņŚÉņä£ plus diseaseļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņ£╝ļéś ļ│æļ│ĆņØś Ļ▓ĮĻ│ä ļČĆņ£äņŚÉ ņŗĀņāØĒśłĻ┤ĆņØä ļÅÖļ░śĒĢ£ Ļ▓ĮņÜ░, 2ĻĄ¼ņŚŁņŚÉņä£ plus diseaseļź╝ ļÅÖļ░śĒĢśļ®┤ņä£ ņ£ĄĻĖ░(ridge) ņØ┤ņāüņØś ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£, plus diseaseĻ░Ć ļ¦żņÜ░ ņŗ¼ĒĢśļ®┤ņä£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņ¦äĒ¢ē ņåŹļÅäĻ░Ć ļ╣Āļź┤Ļ│Ā ļ¦Øļ¦ē ļé┤ ļśÉļŖö ļÜ£ļĀĘĒĢśņ¦Ć ņĢŖļŖö ĒśłĻ┤Ćļ¼┤ĒśĢņä▒ ļ¦Øļ¦ēĻ│╝ ĒśłĻ┤ĆĒÖöļÉ£ ļ¦Øļ¦ē Ļ▓ĮĻ│ä ļČĆņ£äņŚÉ ņŗĀņāØĒśłĻ┤Ć ļśÉļŖö ļ¦Øļ¦ēĒśłĻ┤Ć ņØ┤ņāüņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ņĀĢĒĢśņśĆļŗż. ņ╣śļŻīļ░øņØĆ ĒÖśņ×ÉņØś ņä▒ļ│ä, ņ×¼Ēā£ ĻĖ░Ļ░ä, ņČ£ņāØ ņ▓┤ņżæ, ļ»ĖņłÖņĢä ņ▓½ ļłł Ļ▓Ćņé¼ ņŗ£ĻĖ░, ņ▓½ ļ▓łņ¦Ė ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ņŗ£ĻĖ░, ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņóģļźś(ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ļśÉļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö), ņŻ╝ņé¼ Ēøä plus diseaseĻ░Ć ņåīņŗżļÉśļŖöļŹ░ Ļ▒Ėļ”░ ĻĖ░Ļ░ä, ņ×¼ĒÖ£ņä▒ĒÖö ņŚ¼ļČĆ, ņČöĻ░Ć ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ ĻĘĖ ņ╣śļŻī ļ░®ļ▓ĢĻ│╝ ņŗ£ĻĖ░ļź╝ ņĪ░ņé¼ĒĢśņśĆļŗż.
ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ņØ╝ņ░© ņ╣śļŻīļĪ£ ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ▒░ļéś ļĀłņØ┤ņĀĆņÖĆ ĒĢ©Ļ╗ś ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØä ņŗ£Ē¢ēĒĢ£ ļ│ĄĒĢ® ņ╣śļŻī(combination treatment)ļź╝ ĒĢ£ Ļ▓ĮņÜ░ Ēś╣ņØĆ ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ Ļ░ÖņØĆ ņ£Āļ”¼ņ▓┤-ļ¦Øļ¦ēņłśņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļśÉĒĢ£ ņČöņĀüĻ▓Ćņé¼Ļ░Ć ņÖäļŻīļÉśĻĖ░ ņĀäņŚÉ ņé¼ļ¦ØĒĢśĻ▒░ļéś Ļ▓Ćņé¼Ļ░Ć ņżæļŗ©ļÉ£ Ļ▓ĮņÜ░, ĒāĆļ│æņøÉņ£╝ļĪ£ ņĀäņøÉĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņĀ£ņÖĖĒĢśņśĆļŗż. ļŗżļ¦ī ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ņ¦äĒ¢ēņ£╝ļĪ£ ĒāĆļ│æņøÉņ£╝ļĪ£ ņĀäņøÉĒĢśņŚ¼ ņČöĻ░Ć ņ╣śļŻīļĪ£ ņłśņłĀņØä ļ░øņØĆ Ļ▓ĮņÜ░ļŖö ņ╣śļŻī ņŗżĒī©ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢Ė(Declaration of Helsinki)ņØä ņżĆņłśĒĢśņśĆņ£╝ļ®░, Ļ│äļ¬ģļīĆĒĢÖĻĄÉ ļÅÖņé░ļ│æņøÉ ņ×äņāüņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øĻ│Ā ņ¦äĒ¢ēĒĢśņśĆļŗż(ņŖ╣ņØĖļ▓łĒśĖ 2021-10-026).
ļ¬©ļōĀ ļ»ĖņłÖņĢä ļłł Ļ▓Ćņé¼ ļ░Å ņ╣śļŻīļŖö 1ļ¬ģņØś ņłÖļĀ©ļÉ£ ļ¦Øļ¦ēņĀäļ¼ĖņØś(J.J.H.)ņŚÉ ņØśĒĢ┤ ņłśĒ¢ēļÉśņŚłļŗż. ņĢłņĀĆĻ▓Ćņé¼ļŖö ļÅäņāüĻ▓ĆņĢłĻ▓Į ļ░Å Ļ│Ąļ¦ēļłäļź┤Ļ░£ļź╝ ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, ņĢłņĀĆ ņé¼ņ¦äņØĆ Ļ┤æĻ░üņĢłņĀĆņ╣┤ļ®öļØ╝(RetCamŌäó, Clarity Inc., Pleasanton, CA, USA)ļź╝ ĒåĄĒĢ┤ ņ┤¼ņśüĒĢśņśĆļŗż. ņĢłņĀĆĻ▓Ćņé¼ Ēøä ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļŗżĻ│Ā ĒīÉļŗ©ļÉśļŖö Ļ▓ĮņÜ░, Ļ░ĆļŖźĒĢ£ ĒĢ£ 48ņŗ£Ļ░ä ņØ┤ļé┤ļĪ£ ņĄ£ļīĆĒĢ£ ļ╣©ļ”¼ ņŻ╝ņé¼ ņŗ£ņłĀņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØä ņøÉņ╣Öņ£╝ļĪ£ ĒĢśņśĆĻ│Ā, ļ│┤ĒśĖņ×ÉņØś ņ╣śļŻī Ļ▓░ņĀĢ ļ░Å ļÅÖņØś ļ¼ĖņĀ£ļĪ£ ņŗ£Ļ░äņØ┤ ņ¦Ćņ▓┤ļÉĀ Ļ▓ĮņÜ░ņŚÉļŖö ņĄ£ļīĆ 7ņØ╝ ņØ┤ļé┤ņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņŻ╝ņé¼ ņŗ£Ē¢ē ņĀä ĒÖśņĢäļōżņØś ļ│┤ĒśĖņ×ÉņŚÉĻ▓ī ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ņŚÉ ļīĆĒĢ£ ĒÜ©Ļ│╝ ļ░Å ļ░£ņāØĒĢĀ ņłś ņ׳ļŖö ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ┤ ņČ®ļČäĒ׳ ņäżļ¬ģĒĢ£ Ēøä, ļ│┤ĒśĖņ×ÉņØś ļÅÖņØś ĒĢśņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż.
2018ļģä 1ņøöļČĆĒä░ 2020ļģä 12ņøöĻ╣īņ¦ĆļŖö ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä 0.625 mg/0.025 mL(ĒÖ®ļ░śļČĆņóģ ļ░Å ņŖĄņä▒ ĒÖ®ļ░śļ│Ćņä▒ ņ╣śļŻī ņŗ£ ņä▒ņØĖ ņÜ®ļ¤ēņØś ņĀłļ░ś) ņÜ®ļ¤ēņ£╝ļĪ£ ņŻ╝ņé¼ĒĢśņśĆĻ│Ā, 2021ļģä 1ņøöļČĆĒä░ 2021ļģä 12ņøöĻ╣īņ¦ĆļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä 0.2 mg/0.02 mL (RAINBOW studyņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņÜ®ļ¤ēĻ│╝ ļÅÖņØ╝ ņÜ®ļ¤ē) ņÜ®ļ¤ēņ£╝ļĪ£ ņŻ╝ņé¼ĒĢśņśĆļŗż.
ņŻ╝ņé¼ ņĀä proparacaine hydrochloride (Paracaine┬«, Hanmi, Seoul, Korea)ļĪ£ ĻĄŁņåīļ¦łņĘ©ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ļź╝ 30Ļ▓īņØ┤ņ¦Ć(gauge) ļ░öļŖśņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņ£żļČĆļĪ£ļČĆĒä░ 0.5-1.0 mm ļ¢©ņ¢┤ņ¦ä ņ¦ĆņĀÉņŚÉņä£ ņłśņ¦üņ£╝ļĪ£ ĻĮéņĢä ņä¼ļ¬©ņ▓┤ ņŻ╝ļ”äļČĆļź╝ ĒåĄĒĢ┤ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ļĪ£ ņŻ╝ņé¼ĒĢśņśĆļŗż. ņŻ╝ņé¼ Ēøä ņØ╝ņŻ╝ņØ╝Ļ░ä levofloxacin (Cravit ┬« , Santen Pharmaceutical Co., Ltd., Osaka, Japan) ĒĢŁņāØņĀ£ ņĢłņĢĮņØä ĒĢśļŻ© 4ļ▓ł ņĀÉņĢłĒĢśņśĆļŗż.
ņ╣śļŻī Ļ▓ĮĻ│╝Ļ░Ć ņ¢æĒśĖĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņøöĻ▓ĮĒøäņŚ░ļĀ╣ 45ņŻ╝ ņØ┤ņĀäĻ╣īņ¦ĆļŖö 1ņŻ╝ļ¦łļŗż, ņøöĻ▓ĮĒøäņŚ░ļĀ╣ 45ņŻ╝ņŚÉņä£ 55ņŻ╝ ņé¼ņØ┤ņŚÉļŖö 2ņŻ╝ Ļ░äĻ▓®, ĻĘĖ ņØ┤ĒøäļĪ£ļŖö 3ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ņĢłņĀĆĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ×¼ĒÖ£ņä▒ĒÖö ļ░Å ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö 1ņŻ╝ņØ╝ļ¦łļŗż ĒÖĢņØĖĒĢśņśĆĻ│Ā, ņČöĻ░Ć ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓ĮņÜ░ņŚÉļŖö ļ¦Øļ¦ēņØ┤ ņĢłņĀĢļÉĀ ļĢīĻ╣īņ¦Ć 1ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņØ╝ņ░© ņ╣śļŻī ĒøäņŚÉļÅä plus diseaseĻ░Ć ņŚ¼ņĀäĒ׳ ņ¦ĆņåŹļÉśĻ▒░ļéś ļ│æļ│ĆņØś ņåīņŗżņØ┤ ļŹ£ ņØ┤ļŻ©ņ¢┤ņĀĖ 4ņŻ╝ ņØ┤ļé┤ņŚÉ ļŗżņŗ£ ņ╣śļŻīĒĢ£ Ļ▓ĮņÜ░ļŖö ņ╣śļŻī ļČĆņĪ▒(insufficient treatment)ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, 4ņŻ╝ ņØ┤ĒøäņŚÉ plus diseaseĻ░Ć ņåīņŗżļÉśņŚłļŗżĻ░Ć ļŗżņŗ£ ļéśĒāĆļéśĻ▒░ļéś ņĀäņ¦äļČĆ(advanced edge)ņŚÉ ļ│æļ│ĆņØ┤ ļŗżņŗ£ ļéśĒāĆļéśļ®┤ ņ×¼ĒÖ£ņä▒ĒÖö(reactivation)ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņ╣śļŻī ļČĆņĪ▒ ļ░Å ridge ņØ┤ņāüņØś ņ×¼ĒÖ£ņä▒ĒÖö ņåīĻ▓¼ņØ┤ ļ│┤ņØ┤ļ®┤ ņČöĻ░Ć ņ╣śļŻī(additional treatment)ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ┤ļĢīļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻī, ļĀłņØ┤ņĀĆ ņ╣śļŻīņłĀ, ņŻ╝ņé¼ ņ╣śļŻīņÖĆ ļÅÖņŗ£ņŚÉ ļĀłņØ┤ņĀĆ ņ╣śļŻī ņŗ£Ē¢ēĒĢśļŖö ļ│ĄĒĢ® ņ╣śļŻīņłĀ ņżæņŚÉ ĒĢśļéśļź╝ ņäĀĒāØĒĢśņŚ¼ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│Ą(primary treatment success)ņØĆ ņ▓½ ņŻ╝ņé¼ ņŗ£ņłĀ Ēøä ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ņŻ╝ļ│ĆļČĆĻ╣īņ¦Ć ĒśĢņä▒ņØ┤ ļÉ£ Ļ▓ĮņÜ░ļĪ£, ņĄ£ņóģ ņ╣śļŻīņØś ņä▒Ļ│Ą(final treatment success)ņØĆ ņ×¼ĒÖ£ņä▒ĒÖöņØś ņ£Āļ¼┤ ļ░Å ņČöĻ░Ć ņ╣śļŻīņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņĄ£ņóģņĀüņ£╝ļĪ£ ļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖĻ│Ā ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ĒśĢņä▒ņØ┤ ļÉ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢĒĢśņśĆļŗż. ņ╣śļŻī Ēøä ļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ņØś ņ¦äĒ¢ēņ£╝ļĪ£ ņ£Āļ”¼ņ▓┤-ļ¦Øļ¦ēņłśņłĀņØä ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓ĮņÜ░, ņŗ¼ĒĢ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ļ¦Øļ¦ēĻ▓Ćņé¼Ļ░Ć ļČłĻ░ĆļŖźĒĢśĻ▒░ļéś ņČöĻ░Ć ņ╣śļŻīļź╝ ĒżĻĖ░ĒĢ£ Ļ▓ĮņÜ░ ņ╣śļŻīņØś ņŗżĒī©ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż. ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØ┤ ņ¦äĒ¢ēĒĢśņŚ¼ ĒāĆļ│æņøÉņ£╝ļĪ£ ņĀäņøÉĒĢ┤ņä£ ņ£Āļ”¼ņ▓┤-ļ¦Øļ¦ēņłśņłĀņØä ņČöĻ░ĆļĪ£ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ļÅä ņ╣śļŻī ņŗżĒī©ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż. ļśÉĒĢ£, ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░ä ņżæņŚÉ ņĢĮņĀ£ ņé¼ņÜ®ņŚÉ ļö░ļźĖ ņØ┤ņāü ļ░śņØæ ņŚ¼ļČĆ ļ░Å ņ£ĀĒĢ┤ ņé¼ļĪĆĻ░Ć ņ׳ņŚłļŖöņ¦ĆļÅä ļ¬©ļŗłĒä░ļ¦üĒĢśņśĆļŗż.
IBM SPSS ver. 23.0 for Windows (IBM Corp., Armonk, NY, USA) ĒöäļĪ£ĻĘĖļשņØä ņé¼ņÜ®ĒĢśņŚ¼ ļ¬©ņ¦æļÉ£ ņ×ÉļŻīļōżņŚÉ ļīĆĒĢ£ ĒåĄĻ│äņĀü ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ▓öņŻ╝ĒśĢ ņ×ÉļŻī ļČäņäØņŚÉļŖö ņ╣┤ņØ┤ņĀ£Ļ│▒Ļ▓ĆņĀĢ ļśÉļŖö Ēö╝ņģöņØś ņĀĢĒÖĢĻ▓ĆņĀĢņØä, ņŚ░ņåŹĒśĢ ņ×ÉļŻīņŚÉļŖö ļÅģļ”ĮĒæ£ļ│Ė T Ļ▓ĆņĀĢņØä ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, pĻ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØ╝ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
ļ»ĖņłÖņĢä 32ļ¬ģ(61ņĢł) ņżæņŚÉņä£ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ņØ╝ņ░© ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ▓ĮņÜ░ļŖö 22ļ¬ģ(42ņĢł), aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Øņ£╝ļĪ£ ņŻ╝ņé¼ ņ╣śļŻīļź╝ ņŗ£Ē¢ēļ░øņØĆ Ļ▓ĮņÜ░ļŖö 10ļ¬ģ(19ņĢł)ņØ┤ņŚłņ£╝ļ®░, ĒÖśņ×ÉĻĄ░ļ│ä ĒŖ╣ņä▒ņØĆ Table 1ņŚÉ ņĀĢļ”¼ĒĢśņśĆļŗż.
1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░Ļ│╝ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉ ļö░ļźĖ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņ╣śļŻī ļ░śņØæ Ļ▓░Ļ│╝ļŖö Table 2ņÖĆ Ļ░Öļŗż. ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä plus diseaseĻ░Ć ĒśĖņĀäļÉśļŖö ļŹ░ Ļ▒Ėļ”░ ĻĖ░Ļ░äņØĆ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ 17.3 ┬▒ 16.2ņØ╝, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ 13.5 ┬▒ 12.6ņØ╝ļĪ£ ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.192). ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ņ×ÉņŚ░ Ēć┤ĒÖö(regression)ļÉ£ Ļ▓ĮņÜ░ļÅä ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.114). ņ╣śļŻī ļČĆņĪ▒ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöļĪ£ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ļŖö 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ 1ņĢł(2.4%, ņ×¼ĒÖ£ņä▒ĒÖö), aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ 8ņĢł(42.1%, 2ņĢłņØĆ ņ╣śļŻī ļČĆņĪ▒, 6ņĢłņØĆ ņ×¼ĒÖ£ņä▒ĒÖö)ņ£╝ļĪ£, ļæÉ ĻĄ░ Ļ░ä ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(p<0.001). ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ 97.6%, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ 57.9%ļĪ£, ņØ╝ņ░© ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļŖö 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ│┤ļŗż ņóŗņØĆ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż(p<0.001). ņĀäņ▓┤ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł ņ£Āļ”¼ņ▓┤ņČ£Ēśł ļ░Å ņĢłļé┤ņŚ╝ ļō▒ ņĢłĻ│╝ņĀü ļČĆņ×æņÜ®ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż.
1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ ņØ╝ņ░© ņ╣śļŻīļĪ£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä ņŻ╝ņé¼ĒĢ£ ĻĄ░Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņŻ╝ņé¼ĒĢ£ ĻĄ░ Ļ░äņŚÉ ņ×¼Ēā£ņŚ░ļĀ╣, ņČ£ņāØ ņ▓┤ņżæ, ņ▓½ ņŻ╝ņé¼ ņ╣śļŻī ņŗ£ĻĖ░ļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Plus diseaseĻ░Ć ņåīņŗżļÉśļŖöļŹ░ Ļ▒Ėļ”░ ĻĖ░Ļ░äņØĆ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ 18.8 ┬▒ 17.5ņØ╝, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ 13.5 ┬▒ 12.1ņØ╝ļĪ£ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØ┤ ņĪ░ĻĖł ļŹö ļ╣©ļ×Éņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż(p=0.347). ņ×¼ĒÖ£ņä▒ĒÖöļÉśņŚłņ£╝ļéś ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ņ×ÉņŚ░ Ēć┤ĒÖöļÉ£ Ļ▓ĮņÜ░Ļ░Ć ļæÉ ĻĄ░ ļ¬©ļæÉ 33.3% ļ░£ņāØĒĢśņśĆĻ│Ā, ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ Ļ░üĻ░ü 100%, 91.7%ņśĆļŗż(p=0.286) (Table 3). ņČöĻ░Ć ņ╣śļŻīļź╝ ĒĢ£ 1ņĢłņØĆ 4ņŻ╝ ņØ┤ĒøäņŚÉ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ļź╝ ņČöĻ░ĆļĪ£ ņŗ£Ē¢ēĒĢśņśĆņØīņŚÉļÅä ĒśĖņĀäņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢä ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņØ┤Ēøä ĻĄŁņåīļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēĒĢśņŚ¼ ĒāĆļ│æņøÉņ£╝ļĪ£ ņĀäņøÉĒĢśņŚ¼ Ļ│Ąļ¦ēļÅīļźŁņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Fig. 1).
Aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ ņØ╝ņ░© ņ╣śļŻīļĪ£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä ņŻ╝ņé¼ĒĢ£ ĻĄ░Ļ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņŻ╝ņé¼ĒĢ£ ĻĄ░ Ļ░äņŚÉļÅä ņ×¼Ēā£ņŚ░ļĀ╣, ņČ£ņāØ ņ▓┤ņżæ, ņ▓½ ņŻ╝ņé¼ ņ╣śļŻī ņŗ£ĻĖ░, plus diseaseĻ░Ć ņåīņŗżļÉśļŖö ļŹ░ Ļ▒Ėļ”░ ĻĖ░Ļ░äņØĆ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ņ×ÉņŚ░ Ēć┤ĒÖöļÉ£ Ļ▓ĮņÜ░Ļ░Ć ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ļŖö 2ņĢłņØ┤ņŚłņ£╝ļéś, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ļŖö ņŚåņŚłļŗż. ņ╣śļŻī ļČĆņĪ▒ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöļĪ£ ņČöĻ░Ć ņ╣śļŻīļź╝ ņÜöĒĢ£ Ļ▓ĮņÜ░ļŖö ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ 4ņĢł(44.4%), ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņŚÉņä£ 4ņĢł(40.0%)ņ£╝ļĪ£, ņ£Āņé¼ĒĢ£ ļ╣äņ£©ļĪ£ ļ░£ņāØĒĢśņśĆļŗż(p=1.000). 8ņĢł ļ¬©ļæÉ ņČöĻ░Ć ņ╣śļŻīļĪ£ ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņĄ£ņóģņĀüņ£╝ļĪ£ ļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēļÉśņ¦Ć ņĢŖĻ│Ā ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ņל ĒśĢņä▒ļÉśņŚłļŗż. Aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØś ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ 55.6%, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØś ņØ╝ņ░© ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ 60%ņśĆņ£╝ļ®░(p=1.000), ņĄ£ņóģņĀüņ£╝ļĪ£ ņ╣śļŻī ņŗżĒī©ļź╝ ļ│┤ņØĖ ļłłņØĆ ņŚåņŚłļŗż(Table 4).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĒśĢĒā£(1ĒśĢ vs. aggressive)ņŚÉ ļö░ļźĖ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆĻ│Ā, ļśÉĒĢ£ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ņØś ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØś ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ņØś ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØś ņ╣śļŻī ĒÜ©Ļ│╝ļÅä ļ╣äĻĄÉĒĢśņśĆļŗż.
ĻĘĖ Ļ▓░Ļ│╝ļź╝ ņÜöņĢĮĒĢśļ®┤ ļŗżņØīĻ│╝ Ļ░Öļŗż. 1) 1ĒśĢ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø Ļ░äņØś ņĄ£ņóģ ņ╣śļŻī ņä▒Ļ│ĄļźĀņØĆ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś, ņ▓½ ņŻ╝ņé¼ Ēøä ņØ╝ņ░© ņä▒Ļ│ĄļźĀņØĆ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśļŗż. 2) 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņŻ╝ņé¼ Ēøä ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ļ░£ņāØĒĢśļŹöļØ╝ļÅä ņČöĻ░Ć ņ╣śļŻīļź╝ ņÜöĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŗż. 3) ņ╣śļŻī ļČĆņĪ▒ ļśÉļŖö ņ×¼ĒÖ£ņä▒ĒÖöļĪ£ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ļŖö 1ĒśĢļ│┤ļŗż aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļŹöņÜ▒ ĒØöĒĢśĻ▓ī ļéśĒāĆļé¼ļŗż. 4) 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļéśļ╣äņŻ╝ļ¦Ö Ļ░äņØś ņŻ╝ņé¼ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ļ╣äņŖĘĒĢśņśĆĻ│Ā, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļÅä ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņóģļźśņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ļ╣äņŖĘĒĢśņśĆļŗż. ņØ┤ņŚÉ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ ņóģļźśļ│┤ļŗżļŖö ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņ£ĀĒśĢņØ┤ ņ╣śļŻī ĒÜ©Ļ│╝ņŚÉ ļŹö ņśüĒ¢źņØä ņżīņØä ņĢī ņłś ņ׳ņŚłļŗż.
ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ļŖö ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņØ╝ņ░© ņ╣śļŻīļĪ£ ņĀÉņĀÉ ļŹö ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖöļŹ░, ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö, ņĮśļ▓Āļź┤ņģēĒŖĖ(conbercept),17 ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ(aflibercept)18ļŖö Ēśäņ×¼ ļ»ĖņŖ╣ņØĖ ņāüĒā£ņØ┤ļ®░, ļØ╝ļŗłļ╣äņŻ╝ļ¦Öļ¦īņØ┤ ņ£Āļ¤ĮņŚÉņä£ ņ▓śņØī ĒŚłĻ░Ćļź╝ ļ░øņĢä ĻĄŁļé┤ņŚÉļÅä 2021ļģäļÅäņŚÉ ņŖ╣ņØĖļ░øņĢśļŗż. Ēśäņ×¼ ĻĄŁļé┤ņŚÉņä£ Ļ░Ćņן ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśļŖö ņĢĮņĀ£ļŖö ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØ┤ņ¦Ćļ¦ī,15,19,20 ņĢäņ¦ü ņĀüņĀłĒĢ£ ņŻ╝ņé¼ ņÜ®ļ¤ē, ņé¼ņÜ® Ēܤņłś, ņןĻĖ░ņĀüņØĖ ņĢłĻĄ¼ ļ░Å ņĀäņŗĀ ĒÜ©Ļ│╝ņŚÉ Ļ┤ĆĒĢ£ ļŹ░ņØ┤Ēä░ļŖö ņĀ£ĒĢ£ņĀüņØ┤ļŗż. ļśÉĒĢ£, ņä£ļĪ£ ļŗżļźĖ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ Ļ░äņØś ņØ╝ļīĆņØ╝ ļ╣äĻĄÉ(head to head study)ļÅä ļČĆņĪ▒ĒĢ£ ņāüĒā£ņØ┤ļŗż.
ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä ļ¦Øļ¦ēĒśłĻ┤Ć ĒśĢņä▒ ņåŹļÅäļŖö ņØ┤ņĀäĻ│╝ ļŗ¼ļ”¼ ļŖÉļĀżņ¦Ćļ®░, ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØ┤ ļČłņÖäņĀäĒĢśĻ▓ī Ēć┤Ē¢ēļÉśĻ▒░ļéś ņÖäņĀäĒ׳ Ēć┤Ē¢ē Ēøä ļ¦Øļ¦ēĒśłĻ┤ĆņØ┤ ņĀ£ļīĆļĪ£ ĒśĢņä▒ļÉśņ¦Ć ņĢŖņ£╝ļ®┤ ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ņל ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż.6,21 ņŻ╝ņé¼ ņ╣śļŻī Ēøä ļ░£ņāØĒĢśļŖö ņ×¼ĒÖ£ņä▒ĒÖöļŖö ņŻ╝ļĪ£ ņøöĻ▓ĮĒøäņŚ░ļĀ╣ 45ņŻ╝ņŚÉņä£ 55ņŻ╝ ņé¼ņØ┤ņŚÉ ļ░£ņāØĒĢśņŚ¼,22 ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ņØś ņäĀĒāØ ļ░Å ņÜ®ļ¤ēņŚÉļÅä ņśüĒ¢źņØä ļ░øļŖöļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż.23,24 ņ×¼ĒÖ£ņä▒ĒÖöņØś ņĀĢņØśļŖö ņŚ¼ļ¤¼ ļ¼ĖĒŚīņŚÉ ļö░ļØ╝ ļŗżļź┤Ļ▓ī ņĀĢņØśļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņ×¼ĒÖ£ņä▒ĒÖöņØś ļŗ©Ļ│äļŖö ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ Ēć┤Ē¢ēĒĢśļŖö Ļ▓ĮĻ│äņäĀ(demarcation line)ņŚÉņä£ļČĆĒä░ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ļŗ©Ļ│äĻ╣īņ¦Ć ļŗżņ¢æĒĢśĻ▓ī ļéśĒāĆļé£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ▓½ ņŻ╝ņé¼ Ēøä ņ£ĄĻĖ░(ridge) ņØ┤ņāüņØś ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśļ®┤ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ļŗ©Ļ│äļĪ£ ĒīÉļŗ©ĒĢśĻ│Ā, ņČöĻ░Ć ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ļ░£ņāØĒĢśļŹöļØ╝ļÅä ņČöĻ░Ć ņ╣śļŻī ņŚåņØ┤ ņ×ÉņŚ░ Ēć┤Ē¢ēĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŹś ļ░śļ®┤ņŚÉ, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ņ×¼ĒÖ£ņä▒ĒÖöĻ░Ć ļŹö ņל ļ░£ņāØĒĢśņśĆļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś Ļ▓ĮņÜ░ņŚÉļŖö ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢĀ ņ£äĒŚśņØ┤ ļåÆņĢä ņŻ╝ņé¼ ņ╣śļŻī Ēøä ņČöņĀü Ļ┤Ćņ░░ņØä ņĪ░ĻĖł ļŹö ļ®┤ļ░ĆĒĢśĻ▓ī ĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
ņØ╝ņ░© ņŻ╝ņé¼ ņ╣śļŻī Ēøä ņ╣śļŻī ļČĆņĪ▒ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ņ╣śļŻīņŚÉ ļīĆĒĢ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØĆ ņĀĢĒĢ┤ņ¦ä ļ░öĻ░Ć ņŚåļŖö ņāüĒā£ņØ┤ņ¦Ćļ¦ī, RAINBOW study6ņŚÉņä£ļŖö Ļ░ü ļłłņŚÉ ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņĄ£ļīĆ 2ĒÜī ņĀĢļÅä ņŻ╝ņé¼ĒĢśļŖö Ļ▓āņŚÉ ļīĆĒĢ┤ ĒŚłņÜ®ņØä ĒĢśņśĆļŗż. Mart├Łnez-Castellanos et al25ņØĆ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä ņŻ╝ņ×ģ Ēøä ņ╣śļŻī ņŗżĒī© ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöņŚÉ ļīĆĒĢ£ ņ╣śļŻī ņĢīĻ│Āļ”¼ņ”śņØä ņĀ£ņĢłĒĢśņśĆļŖö ļŹ░, ņ¦äĒ¢ēļÉ£ Ļ░Ćņןņ×Éļ”¼ņŚÉņä£ ĒÄĖĒÅēĒĢ£ ņŗĀņāØĒśłĻ┤ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ļź╝ ļ░śļ│ĄĒĢśĻ│Ā, ņ£ĄĻĖ░ ļ│æļ│ĆņŚÉņä£ ņ£Āļ”¼ņ▓┤ Ļ▓¼ņØĖņØ┤ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢśņśĆļŗż. Garcia Gonzalez et al26ņØĆ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØä ņŻ╝ņ×ģ Ēøä ņŻ╝ļ│ĆļČĆ ņ¦ĆņåŹņĀü ļ¼┤ĒśłĻ┤Ćņä▒ ļ¦Øļ¦ē(peripheral persistent avascular retina)ņŚÉ ņśłļ░®ņĀü ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ņŗżņŗ£ĒĢśļŗł, ņ╣śļŻī ņŗżĒī© ļ╣äņ£©ņØ┤ ļé«ņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņØ╝ņ░© ņŻ╝ņé¼ĒĢ£ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ĒÖśņĢä 1ņĢłņŚÉņä£ ņ£Āļ”¼ņ▓┤ Ļ▓¼ņØĖņØ┤ ņ׳ņØīņŚÉļÅä ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØä ņČöĻ░Ć ņŻ╝ņé¼ĒĢśņśĆĻ│Ā, ļéśņżæņŚÉļŖö Ļ▓¼ņØĖ ļČĆņ£äĻ░Ć ĻĄŁņåīļ¦Øļ¦ēļ░Ģļ”¼ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ ņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļśÉĒĢ£, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ ļ¬©ļæÉ ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ņäĀĒāØĒĢśņŚ¼ ņĄ£ņóģ ņ╣śļŻī ņä▒Ļ│ĄļźĀņØä ļåÆņśĆļŗż. ņØ┤ņŚÉ ņČöĻ░Ć ņ╣śļŻīļź╝ ĒĢśĻ│Āņ×É Ļ▓░ņĀĢĒĢĀ ļĢī, ļ░śļō£ņŗ£ ļ¦Øļ¦ē ņāüĒā£ļź╝ ņל Ļ┤Ćņ░░ĒĢśņŚ¼ ņ£Āļ”¼ņ▓┤ Ļ▓¼ņØĖņØ┤ ņ׳ļŖöņ¦Ć, ļ¦Øļ¦ēļ░Ģļ”¼ ņ¦äĒ¢ē ņ£äĒŚśņØ┤ ņ׳ļŖöņ¦Ć ņé┤ĒÄ┤ļ│┤Ļ│Ā ņ╣śļŻī ļ░®ļ▓ĢņØä Ļ▓░ņĀĢĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ ņóģļźśņŚÉ ļö░ļźĖ ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöņŚÉ ļīĆĒĢ£ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļōżņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļéś,14-16 aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņŚ░ĻĄ¼ļÉ£ ļ░öĻ░Ć ļ│äļĪ£ ņŚåļŖö ņŗżņĀĢņØ┤ļŗż. Kang et al15 ņŚÉ ņØśĒĢśļ®┤, 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ 0.625 mg ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØś 7.9%, 0.2 mg ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØś 13.5%ņŚÉņä£ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśņśĆņ£╝ļéś, ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØś Ļ▓ĮņÜ░ņŚÉ ļ│┤ļŗż ņłśņłĀņĀü ņ╣śļŻīļź╝ ņÜöĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Kimyon and Mete16ņØś Ļ▓ĮņÜ░ņŚÉļŖö, zone IņŚÉ ņ£äņ╣śĒĢ£ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ 0.625 mg ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ 0.25 mg ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØś ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆĻ│Ā Ļ░üĻ░ü 10.0%, 7.14%ņØś ņ×¼ĒÖ£ņä▒ĒÖöļź╝ ļ│┤ņśĆļŗżĻ│Ā ĒĢśņśĆļŗż. ņĄ£ĻĘ╝ Chang et al24ņØś ļ®öĒāĆļČäņäØ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņĀ£ņĀ£ ņóģļźś(ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö, ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖ) Ļ░ä ņ×¼ņ╣śļŻīņ£©ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļŗżļ¦ī, ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ņĢĀĒöīļ”¼ļ▓äņģēĒŖĖļŖö ļØ╝ļŗłļ╣äņŻ╝ļ¦Öļ│┤ļŗż ņ×¼ņ╣śļŻīĻ╣īņ¦ĆņØś ĻĖ░Ļ░äņØ┤ ĻĖĖņ¢┤ ĻĖ┤ ņ×æņÜ® ņŗ£Ļ░äņØä ļéśĒāĆļāłļŗżĻ│Ā ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļ┐Éļ¦ī ņĢäļŗłļØ╝ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļÅä ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ Ļ░äņŚÉ plus diseaseĻ░Ć ĒśĖņĀäļÉśļŖöļŹ░ Ļ▒Ėļ”¼ļŖö ĻĖ░Ļ░ä, ņ×¼ĒÖ£ņä▒ĒÖö ļ╣äņ£©, ņØ╝ņ░© ļ░Å ņĄ£ņóģ ņ╣śļŻī ņä▒Ļ│ĄļźĀņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļź╝ ņóģĒĢ®ĒĢśļ®┤ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņżæ ņØ╝ņ░© ņ╣śļŻī ņĢĮņĀ£ļź╝ ņäĀĒāØĒĢĀ ļĢī, ļæÉ ņĀ£ņĀ£ Ļ░ä ĒÜ©Ļ│╝ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņ£╝ļéś, aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ╣łļ▓łĒĢśļ»ĆļĪ£ ļ®┤ļ░ĆĒĢ£ ņČöņĀü Ļ┤Ćņ░░ņØä ĒĢ┤ņĢ╝ ĒĢ©ņØä ņ£ĀļģÉĒĢ┤ņĢ╝ ĒĢĀ Ļ▓āņØ┤ļŗż.
ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ņØś ņĀüņĀłĒĢ£ ņŻ╝ņé¼ ņÜ®ļ¤ē ļ░Å ļ╣łļÅäļŖö ņĢłĻĄ¼ ļ░Å ņĀäņŗĀ ļģĖņČ£ņØś ņ£äĒŚś ļĢīļ¼ĖņŚÉ ļģ╝ņ¤üņØś ņŚ¼ņ¦ĆĻ░Ć ņ׳ļŗż. ļ»ĖņłÖņĢäņØś ņĢłĻĄ¼ ņÜ®ņĀüņØĆ ņä▒ņØĖņØś ņĢĮ 1/4-1/3ņŚÉ ļČłĻ│╝ĒĢśļŗż. ņØ┤ļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ĒåĄņāüņĀüņ£╝ļĪ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ņ╣śļŻīņŚÉ ņ׳ņ¢┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖņØĆ ņä▒ņØĖ ņŻ╝ņé¼ ņÜ®ļ¤ēņØś 50% (0.625 mg), ļØ╝ļŗłļ╣äņŻ╝ļ¦ÖņØĆ ņä▒ņØĖ ņŻ╝ņé¼ ņÜ®ļ¤ēņØś 40% (0.20 mg)ļź╝ ņé¼ņÜ®ĒĢśļÅäļĪØ ĻČīņןĒĢśĻ│Ā ņ׳ļŗż. Ēśäņ×¼ ņĢłņĢĢņāüņŖ╣ ļ░Å ņĀäņŗĀ ļČĆņ×æņÜ®ņØä ņĀüĻ▓ī ņØ╝ņ£╝Ēéżļ®┤ņä£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļŖö ņĄ£ņåī ņÜ®ļ¤ēņØä ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż.27-29 Chen et al29ņØĆ ļ»ĖņłÖņĢäļ¦Øļ¦ē ļ│æņ”Ø 254ņĢłņŚÉņä£ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö 0.3 mgĻ│╝ 0.25 mgņØś ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆļŖöļŹ░, 0.3 mg ņŻ╝ņé¼ ņŗ£ 0.25 mg ņŻ╝ņé¼ ņŗ£ņŚÉ ļ╣äĒĢ┤ ņ×¼ļ░£ļźĀņØ┤ ļé«ņĢśĻ│Ā ņĀäņŗĀņĀü ļśÉļŖö ņĢłĻ│╝ņĀü ĒĢ®ļ│æņ”ØļÅä ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśļŗżĻ│Ā ĒĢ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ ņØ╝ņ░© ņŻ╝ņé¼ ņ╣śļŻī Ēøä ņ×¼ļ░£ļźĀņØ┤ ļåÆņĢśļŹś Ļ▓āņ£╝ļĪ£ ļ│┤ņĢä aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņŚÉņä£ļŖö ņĪ░ĻĖł ļŹö Ļ│ĀņÜ®ļ¤ēņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłśļÅä ņ׳ņØä Ļ▓āņØ┤ļŗż. ĻĘĖļ¤¼ļéś Ļ░ü ņŚ░ĻĄ¼ļōżņŚÉņä£ ļīĆņāüņØ┤ ļÉ£ ĒÖśņĢäļōżņØś ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņżæņ”ØļÅäĻ░Ć ļŗ¼ļØ╝ ņŚ░ĻĄ¼ Ļ░ä ļ╣äĻĄÉĻ░Ć ļČĆņĀüņĀłĒĢśļ®░ ņČöĒøä ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņ£ĀĒśĢ ļ░Å ļ│æļ│Ć ĒśĢĒā£ņŚÉ ļö░ļźĖ ņĀüņĀłĒĢ£ ņŻ╝ņé¼ ņÜ®ļ¤ēņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņĀÉņ£╝ļĪ£ļŖö ņ▓½ ļ▓łņ¦Ė, ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ ņäżĻ│äļĪ£ ņØĖĒĢ£ ņäĀĒāØ ĒÄĖĒ¢źņØ┤ ņ׳ņŚłņØä ņłś ņ׳ļŗż. ļæÉ ļ▓łņ¦Ė, 1ĒśĢ ļ░Å aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ ņĢłņŚÉņä£ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņóģļźś Ļ░äņØś ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆņ£╝ļéś aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻĄ░ ļé┤ ļ▓Āļ░öņŗ£ņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØ┤ 9ņĢł, ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ĻĄ░ņØ┤ 10ņĢłņ£╝ļĪ£ ņłśĻ░Ć ņĀüņ¢┤ ņČöĒøä ļīĆĻĘ£ļ¬© ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņäĖ ļ▓łņ¦Ė, ĒÖśņĢäļōżņŚÉĻ▓ī ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņé¼ ņ╣śļŻī Ēøä ņĢłĻ│╝ņĀü ļČĆņ×æņÜ®ņØä ļ│┤ņØĖ ņé¼ļĪĆļŖö ņŚåņŚłņ£╝ļéś ņĀäņŗĀņĀü, ņןĻĖ░ņĀüņØĖ ņĢłņĀäņä▒ņŚÉ ļīĆĒĢ£ ņĪ░ņé¼ļŖö ļČĆņĪ▒ĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŚ░ĻĄ¼ļŖö ĒĢ£ ļ¬ģņØś ļ¦Øļ¦ēņĀäļ¼ĖņØśņŚÉ ņØśĒĢ┤ ļ¬©ļōĀ ĒÖśņĢäņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻīĻ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖ ņ¦äļŗ© ļ░Å ņ╣śļŻī ĻĖ░ņżĆĻ│╝ ļ░®ļ▓ĢņŚÉ ņØ╝Ļ┤Ćņä▒ņØä Ļ░Ćņ¦äļŗżļŖö ļŹ░ Ļ░ĢņĀÉņØ┤ ņ׳ņ£╝ļ®░, ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØä ņ£ĀĒśĢļ│äļĪ£ ļéśļłäņ¢┤ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØś ņ╣śļŻī ĒÜ©Ļ│╝ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖö ņĀĢļÅäļź╝ ĒÖĢņØĖĒĢ©ņ£╝ļĪ£ņŹ© Ē¢źĒøä ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś ņ╣śļŻī ļ░Å ņŚ░ĻĄ¼ ļ░®Ē¢ź ņĀ£ņŗ£ņŚÉ ļÅäņøĆņØä ņżä ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņ×ģņłĀņØĆ 1ĒśĢ ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØĻ│╝ aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”Ø ļ¬©ļæÉņŚÉņä£ ĒÜ©Ļ│╝ņĀüņØĖ ņØ╝ņ░© ņ╣śļŻīļĪ£ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļ▓Āļ░öņŗ£ņŻ╝ļ¦ÖĻ│╝ ļØ╝ļŗłļ╣äņŻ╝ļ¦Ö ņŻ╝ņé¼ ņĀ£ņĀ£ Ļ░äņØś ņ╣śļŻī ĒÜ©Ļ│╝ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ĻĘĖļ¤¼ļéś aggressive ļ»ĖņłÖņĢäļ¦Øļ¦ēļ│æņ”ØņØś Ļ▓ĮņÜ░ ņ╣śļŻī ļČĆņĪ▒ ļ░Å ņ×¼ĒÖ£ņä▒ĒÖöļĪ£ ņČöĻ░Ć ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ»ĆļĪ£, ņØ╝ņ░© ņŻ╝ņé¼ ņ╣śļŻī Ēøä ļ®┤ļ░ĆĒĢ£ ņČöņĀü Ļ┤Ćņ░░ņØ┤ ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśĻ▓Āļŗż.
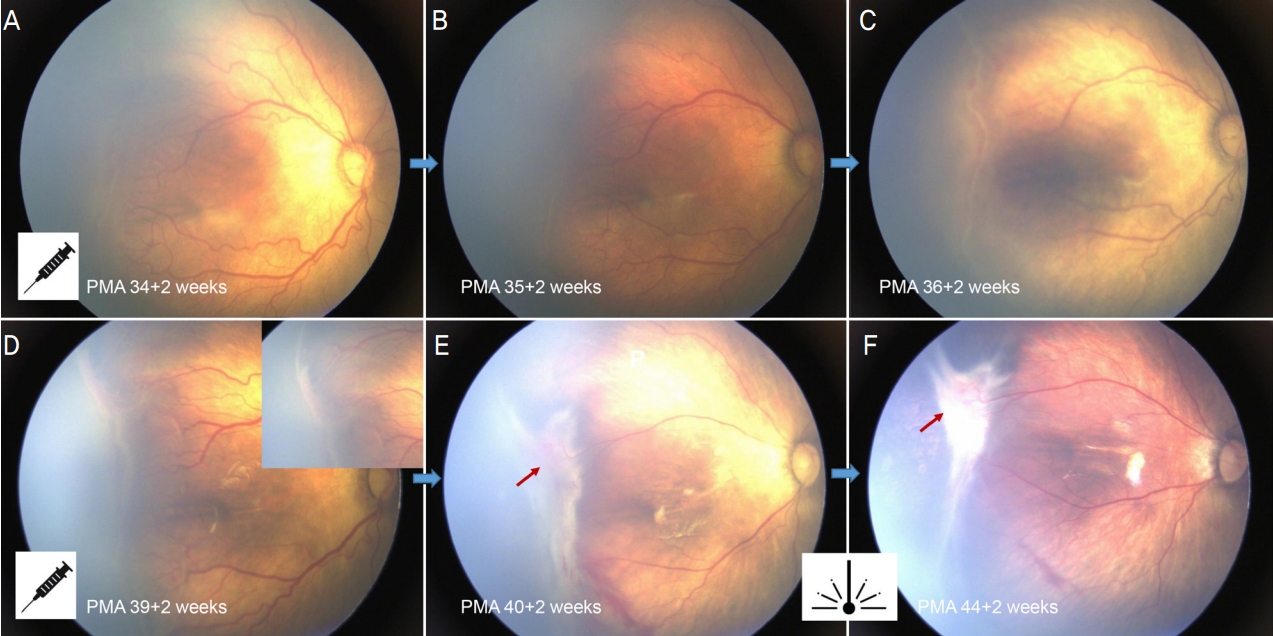
Figure┬Ā1.
A case of retinal detachment after intravitreal ranibizumab injection in type 1 retinopathy of prematurity. (A) Fundus image of the right eye during ranibizumab injection at 34 + 2 weeks of postmenstrual age (PMA). (B, C) Fundus images at 35 + 2 weeks and 36 + 2 weeks of PMA, demonstrating reactivation at original lesion. (D) Fundus image at additional injection of ranibizumab. (E) Fundus image at 40 + 2 weeks of PMA, demonstrating focal retinal detachment (red arrow) and vitreous traction. (F) Fundus image at 44 + 2 weeks of PMA shows further worsening of focal retinal detachment (red arrow) despite of additional laser ablation.
Table┬Ā1.
Demographic characteristics of subject patients
| Parameters | Type 1 ROP (n = 22, 42 eyes) | Aggressive ROP (n = 10, 19 eyes) | p-value* |
|---|---|---|---|
| Gender, men | 15 (68.2) | 6 (60.0) | 0.396 |
| Gestational age (weeks) | 27.1 ┬▒ 1.8 (23.6-30.3) | 25.9 ┬▒ 2.3 (23.7-31.0) | 0.028 |
| Birth weight (g) | 917.9 ┬▒ 241.3 (460-1,460) | 834.2 ┬▒ 370.2 (540-1,820) | 0.296 |
| PMA of initial examination (weeks) | 32.3 ┬▒ 1.2 (29.4-34.6) | 31.3 ┬▒ 1.3 (30.0-34.6) | 0.008 |
| PMA at primary treatment (weeks) | 38.5 ┬▒ 3.3 (34.3-47.9) | 35.1 ┬▒ 2.0 (32.9-40.6) | <0.001 |
| Anti-VEGF injection at primary treatment | 0.070 | ||
| ŌĆāBevacizumab (eyes) | 30 | 9 | |
| ŌĆāRanibizumab (eyes) | 12 | 10 |
Values of gestational age, birth weight, PMA of initial examination, PMA at primary treatment of each group are presented as mean ┬▒ standard deviation (minimum-maximum) and otherwise are presented as number (%).
ROP = retinopathy of prematurity; PMA = postmenstrual age; VEGF = vascular endothelial growth factor.
Table┬Ā2.
Comparison of treatment response of the anti-vascular endothelial growth factors agent in type 1 ROP and aggressive ROP
| Parameters | Type 1 ROP (n = 22, 42 eyes) | Aggressive ROP (n = 10, 19 eyes) | p-value* | |
|---|---|---|---|---|
| Periods of plus disease disappearance after the primary treatment (days) | 17.3 ┬▒ 16.2 | 13.5 ┬▒ 12.6 | 0.192 | |
| Reactivation, not requiring treatment | 14 (33.3) | 2 (10.5) | 0.114 | |
| Additional treatment (eyes) | 1 (2.4) | 8 (42.1) | <0.001 | |
| Insufficient treatment | 0 (0.0) | 2 (10.5) | 0.093 | |
| Reactivation, requiring treatment | 1 (2.4) | 6 (31.6) | 0.027 | |
| Additional treatment type | ||||
| Anti-VEGF injection | 1 | 0 | ||
| Lasers ablation | 0 | 8 | ||
| Primary treatment success (eyes) | 41 (97.6) | 11 (57.9) | <0.001 | |
| Finally treatment success (eyes) | 41 (97.6) | 19 (100.0) | 1.000 | |
| Reason for failure of treatment | ||||
| Progression to RD ROP | 1 | 0 | ||
| Invisible or hazy ocular media | 0 | 0 | ||
Table┬Ā3.
Comparison of bevacizumab injection subgroup and ranibizumab injection subgroup in type 1 ROP
| Parameters | Bevacizumab injection (30 eyes) | Ranibizumab injection (12 eyes) | p-value* | |
|---|---|---|---|---|
| Gestational age (weeks) | 27.5 ┬▒ 1.5 | 26.3 ┬▒ 2.4 | 0.135 | |
| Birth weight (g) | 953.7 ┬▒ 257.4 | 828.3 ┬▒ 173.6 | 0.130 | |
| PMA of initial examination (weeks) | 32.1 ┬▒ 1.3 | 32.6 ┬▒ 0.8 | 0.279 | |
| PMA at primary treatment (weeks) | 38.5 ┬▒ 2.4 | 38.5 ┬▒ 5.0 | 0.958 | |
| Periods of plus disease disappearance after the primary treatment (days) | 18.8 ┬▒ 17.5 | 13.5 ┬▒ 12.1 | 0.347 | |
| Reactivation, not requiring treatment | 10 (33.3) | 4 (33.3) | 1.000 | |
| Additional treatment (eyes) | 0 (0.0) | 1 (8.3) | 0.286 | |
| Insufficient treatment | 0 (0.0) | 0 (0.0) | - | |
| Reactivation, requiring treatment | 0 (0.0) | 1 (8.3) | 0.286 | |
| Primary treatment success (eyes) | 30 (100.0) | 11 (91.7) | 0.286 | |
| Finally treatment success (eyes) | 30 (100.0) | 11 (91.7) | 0.286 | |
Values of gestational age, birth weight, PMA of initial examination, PMA at primary treatment, periods of plus disease disappearance after primary treatment of each group are presented as mean ┬▒ standard deviation and otherwise are presented as number (%).
ROP = retinopathy of prematurity; PMA = postmenstrual age.
Table┬Ā4.
Comparison of bevacizumab injection subgroup and ranibizumab injection subgroup in aggressive retinopathy of prematurity
| Parameters | Bevacizumab injection (9 eyes) | Ranibizumab injection (10 eyes) | p-value* | |
|---|---|---|---|---|
| Gestational age (weeks) | 26.4 ┬▒ 2.3 | 25.5 ┬▒ 2.3 | 0.401 | |
| Birth weight (g) | 783.3 ┬▒ 133.4 | 880.0 ┬▒ 503.3 | 0.571 | |
| PMA of initial examination (weeks) | 30.1 ┬▒ 1.4 | 31.7 ┬▒ 1.0 | 0.218 | |
| PMA at primary treatment (weeks) | 35.9 ┬▒ 2.5 | 34.5 ┬▒ 1.1 | 0.151 | |
| Periods of plus disease disappearance after the primary treatment (days) | 17.9 ┬▒ 17.3 | 7.0 ┬▒ 5.2 | 0.079 | |
| Reactivation, not requiring treatment | 2 (22.2) | 0 (0.0) | 0.211 | |
| Additional treatment (eyes) | 4 (44.4) | 4 (40.0) | 1.000 | |
| Insufficient treatment | 2 (22.2) | 0 (0.0) | 0.211 | |
| Reactivation, requiring treatment | 2 (22.2) | 4 (40.0) | 0.628 | |
| Primary treatment success (eyes) | 5 (55.6) | 6 (60.0) | 1.000 | |
| Finally treatment success (eyes) | 9 (100.0) | 10 (100.0) | - | |
REFERENCES
1) Hartnett ME. Advances in understanding and management of retinopathy of prematurity. Surv Ophthlamol 2017;62:257-76.



2) Lepore D, Ji MH, Ying GS, et al. Early angiographic sings of retinopathy of prematurity requiting treatment. Eye (Lond) 2021;35:3094-101.


3) Norman M, Hellstr├Čm A, Hallberg B, et al. Prevalence of severe visual disability among preterm children with retinopathy of prematurity and association with adherence to best practice guidelines. JAMA Netw Open 2019;2:e186801.



4) Good WV. Final results of the Early Treatment for Retinopathy of Prematurity (ETROP) randomized trial. Trans Am Ophthalmol Soc 2004;102:233-50.


5) International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch Ophthalmol 2005;123:991-9.


6) Chiang MF, Quinn GE, Fielder AR, et al. International classification of retinopathy of prematurity, Third edition. Ophthalmology 2021;128:e51-68.

7) Kumawat D, Sachan A, Shah P, et al. Aggressive posterior retinopathy of prematurity: a review on current understanding. Eye (Lond) 2021;35:1140-58.




8) Dai C, Webster KA, Bhatt A, et al. Concurrent physiological and pathological angiogenesis in retinopathy of prematurity and emerging therapies. Int J Mol Sci 2021;22:4809.



9) Tsai AS, Chou HD, Ling XC, et al. Assessment and management of retinopathy of prematurity in the era of anti-vascular endothelial growth factor (VEGF). Prog Retin Eye Res 2022;88:101018.


10) Mintz-Hittner HA, Kennedy KA, Chuang AZ. Efficacy of intravitreal bevacizumab for stage 3+ retinopathy of prematurity. N Engl J Med 2011;364:603-15.



11) Stahl A, Lepore D, Fielder A, et al. Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (RAINBOW): an open-label randomised controlled trial. Lancet 2019;394:1551-9.


12) Pertl L, Steinwender G, Mayer C, et al. A systematic review and meta-analysis on the safety of vascular endothelial growth factor (VEGF) inhibitors for the treatment of retinopathy of prematurity. PLoS One 2015;10:e0129383.



13) Xu L, Lu T, Tuomi L, et al. Pharmacokinetics of ranibizumab in patients with neovascular age-related macular degeneration: a population approach. Invest Ophthalmol Vis Sci 2013;54:1616-24.


14) Chen SN, Lian I, Hwang YC, et al. Intravitreal anti-vascular endothelial growth factor treatment for retinopathy of prematurity: comparison between ranibizumab and bevacizumab. Retina 2015;35:667-74.

15) Kang HG, Choi EY, Byeon SH, et al. Anti-vascular endothelial growth factor treatment for retinopathy of prematurity: efficacy, safety and anatomical outcomes. Korean J Ophthalmol 2018;32:451-8.




16) Kimyon S, Mete A. Comparison of bevacizumab and ranibizumab in the treatment of type 1 retinopathy of prematurity affecting zone 1. Ophthalmologica 2018;240:99-105.



17) Wu Z, Zhao J, Lam W, et al. Comparison of clinical outcomes of conbercept versus ranibizumab treatment for retinopathy of prematurity: a multicenter prospective randomised controlled trial. Br J Ophthalmol 2022;106:975-9.



18) Stahl A, Sukgen EA, Wu WC, et al. Effect of intravitreal aflibercept vs laser photocoagulation on treatment success of retinopathy of prematurity. JAMA 2022;328:348-59.


19) Chung GC, Moon SH. Efficacy of primary intravitreal ranibizumab injection for treatment of type 1 retinopathy of prematurity. J Korean Ophthalmol Soc 2017;58:1080-6.


20) Jang JH, Kang YK, Park HS, et al. Primary and additional treatment preference in aggressive retinopathy of prematurity and type 1 retinopathy of prematurity. BMJ Open Ophthalmol 2023;8:e001166.



21) Toy BC, Schachar IH, Tan GSW, Moshfeghi DM. Chronic vascular arrest as a predictor of bevacizumab treatment failure in retinopathy of prematurity. Ophthalmology 2016;123:2166-75.


22) Mintz-Hittner HA, Geloneck MM, Chuang AZ. Clinical management of recurrent retinopathy of prematurity after intravitreal bevacizumab monotherapy. Ophthalmology 2016;123:1845-55.



23) Lyu J, Zhang Q, Chen CL, et al. Recurrence of retinopathy of prematurity after intravitreal ranibizumab monotherapy: timing and risk factors. Invest Ophthalmol Vis Sci 2017;58:1719-25.


24) Chang E, Josan AS, Purohit R, et al. A network meta-analysis of retreatment rates following bevacizumab, ranibizumab, aflibercept and laser for retinopathy of prematurity. Ophthalmology 2022;129:1389-401.


25) Mart├Łnez-Castellanos MA; Gonz├Īlez-H Le├│n A, Romo-Aguas JC, Gonzalez-Gonzalez LA. A proposal of an algorithm for the diagnosis and treatment of recurrence or treatment failure of retinopathy of prematurity after anti-VEGF therapy based on a large case series. Graefes Arch Clin Exp Ophthalmol 2020;258:767-72.



26) Garcia Gonzalez JM, Snyder L, Blair M, et al. Prophylactic peripheral laser and fluorescein angiography after bevacizumab for retinopathy of prematurity. Retina 2018;38:764-72.


27) Stahl A, Krohne TU, Eter N, et al. Comparing alternative ranibizumab dosages for safety and efficacy in retinopathy of prematurity: a randomized clinical trial. JAMA Pediatr 2018;172:278-86.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




