단안 망막정맥폐쇄환자 반대안의 빛간섭단층혈관조영술을 통한 망막모세혈관분포 분석
Retinal Capillary Network in Fellow Eyes with Unilateral Vein Occlusion Using Optical Coherence Tomography Angiography
Article information
Abstract
목적
단안 망막분지정맥폐쇄환자의 반대안과 대조군에서 빛간섭단층혈관조영술을 이용하여 망막모세혈관분포를 비교하고자 하였다.
대상과 방법
단안 망막분지정맥폐쇄로 진단 받은 환자(38명, 38안)와 검진 목적으로 검사를 시행 받았던 경우(37명, 37안)를 대조군으로 후향적으로 비교하였다. 스펙트럼영역 빛간섭단층촬영기를 이용하여 신경절세포-내망상층의 두께를 측정하였고 빛간섭단층혈관조영술을 이용하여 황반오목으로부터 반경 0.5 mm 이내의 중심 영역 및 반경 1-1.5 mm의 주변 영역, 반경 3 mm 이내의 총 영역 각각의 혈관밀도 및 관류밀도, 오목무혈관부위(FAZ)의 면적 및 둘레를 측정하여 비교 분석하였다.
결과
단안 망막분지정맥폐쇄가 있는 환자와 비교하였을 때 고혈압의 유병률은 단안 망막분지정맥폐쇄가 있는 환자에서 대조안보다 유의하게 많았으며(p=0.014), 신경절세포-내망상층의 두께를 비교하였을 때는 양 군의 의미 있는 차이를 보이지 않았다. 빛간섭단층혈관조영술 환자군 간의 혈관밀도와 관류밀도는 의미 있는 차이를 보이지 않았으나 중심오목무혈관부위의 넓이와 둘레는 단안 망막분지정맥폐쇄가 있는 환자에서 대조안보다 유의하게 넓게 나타났다(p=0.048, p=0.011).
결론
망막분지정맥폐쇄환자들의 반대안에서 정상 대조군에 비해 신경절세포-내망상층의 두께의 유의미한 변화는 없으나, 중심오목무혈관부위의 넓이와 둘레가 증가되어 있었으므로 단안에 국한된 망막정맥폐쇄환자에서도 반대안의 허혈성 질환에 대한 주의깊은 관찰이 필요하며, 위험 인자의 관리 및 혈류 개선을 위한 노력이 필요할 것으로 생각된다.
Trans Abstract
Purpose
To compare the thickness of the ganglion cell-inner plexiform layer (GCIPL) and the perifoveolar retinal capillary network between fellow eyes with unilateral branch retinal vein occlusion (BRVO) and healthy control eyes using optical coherence tomography angiography (OCTA).
Methods
Retrospective cross-sectional study including 38 patients diagnosed with unilateral BRVO and 37 control subjects. We investigated the thicknesses of the GCIPL layer using OCT, also the vascular density (VD), perfusion density (PD), area and perimeter of the foveal avascular zone (FAZ) using the OCTA.
Results
Patients with unilateral BRVO had a higher incidence of hypertension. In the fellow eyes of the unilateral BRVO patients, the area and perimeter of the FAZ were wider and longer than for the control eyes. There was no significant difference in the GCIPL thickness, VD and PD between the two groups.
Conclusions
There is no significant change in the thickness of GCIPL between 2 groups, the fellow eyes of the unilateral BRVO patients have the larger area and longer perimeter of the FAZ instead. This means macular ischemia in the follow eye when the BRVO existed. Therefore, ischemic diseases should be carefully monitored in the fellow eyes of unilateral BRVO patients.
망막정맥폐쇄는 당뇨망막병증에 이어 두 번째로 흔한 망막혈관질환으로[1] 고혈압, 당뇨, 고지혈증 등 다양한 전신질환이 발생 위험 인자로 알려져 있다[2-5]. 급성 망막허혈 후에는 망막내층, 특히 망막신경절세포가 영향을 많이 받으며[6,7] 망막신경섬유층은 신경절세포의 축삭을 포함하고 있고 신경절세포층과 내망상층은 망막신경절세포의 핵과 수상돌기로 이루어지며 황반의 망막신경절세포의 핵과 수상돌기의 손상이 망막신경섬유층의 손상과 비교하였을 때 더 빨리, 더 일관적으로 나타난다[8-10].
빛간섭단층혈관조영술은 고해상도의 망막모세혈관 구조에 대한 빠르고 비침습적인 검사를 가능하게 하며, 내장된 소프트웨어를 이용하여 혈관밀도(vessel density, VD), 관류밀도(perfusion density, PD), 오목무혈관부위(foveal avascular zone, FAZ)와 같은 수치를 통한 망막의 모세혈관분포와 관류에 대한 평가가 가능하고[11], 망막정맥폐쇄에서 일반적인 형광혈관조영술과 잘 일치하며 상세한 해부학적 정보 및 관류에 대한 정보를 제공한다[12].
만약 망막분지정맥폐쇄가 전신적인 혈관이상과 관련이 있다면, 망막분지정맥폐쇄를 앓고 있는 눈뿐만 아니라 망막분지정맥폐쇄환자의 반대안에도 영향을 미칠 것으로 가정하고, 단안 망막분지정맥폐쇄환자의 반대안과 정상 대조군에서 빛간섭단층촬영을 이용한 신경절세포-내망상층의 두께와 빛간섭단층혈관조영술에서 망막모세혈관분포 및 관류에 관한 여러 수치들을 비교해 보고자 하였다.
대상과 방법
의무기록을 후향적으로 조사하여 2016년 1월부터 2018년 12월까지 단일 기관에 내원하여 단안 망막정맥폐쇄로 진단 받은 환자를 대상으로 연구 기준에 적합한 38명과, 동일 기간 내에 동일 기관에서 검진 목적으로 안과적 검사를 시행 받은 적이 있는 대상자들 중에서 연구 기준에 적합한 37명을 대조군으로 하였다.
양군 모두 과거 병력 조사, 양안 시력, 굴절력, 골드만안압검사, 세극등검사, 전방각검사, 산동 후 안저검사, 빛간섭단층촬영 및 빛간섭단층조영술을 시행 받았던 경우를 포함시켰고, 교정시력이 Snellen 시력 기준 20/40 미만, 굴절률이 ±6D 이상인 경우, 전방각이 좁은 경우는 배제하였다. 본원에서 처음으로 단안망막정맥폐쇄로 진단 받은 환자를 환자군으로 하였고, 안과 검사와 병력상 안과적 질환이 없는 경우를 대조군으로 하였다. 환자군의 반대안과 대조군의 경우 이전 망막정맥폐쇄가 발생하였던 경우, 망막출혈이나 황반부종을 유발할 수 있는 망막질환, 포도막염 등의 질환이 있는 경우, 백내장수술 이외의 다른 안구내수술 기왕력이 있는 경우, 이전에 녹내장으로 진단 받고 치료를 받고 있는 경우, 시신경이나 망막에 영향을 줄 만한 신경과적 질환이 있는 경우를 제외하였다. 환자군에서 분석에 사용한 자료는 망막분지정맥폐쇄 진단 당시에 측정한 값을 사용하였고 대조군 중에서 양안 모두 조건에 맞을 경우에는 2안 중 1안만을 임의적으로 택했다.
스펙트럼영역 빛간섭단층촬영검사 및 빛간섭단층혈관조영술은 빛간섭단층촬영기(Cirrus™ HD-OCT, Carl Zeiss Meditec, Dublin, CA, USA)를 이용하여 산동 후 촬영하였다. 신호 강도가 총 10점 중 6점 미만이거나 눈 운동 등 환자로 협조도로 인한 촬영된 이미지의 질이 떨어지는 경우는 제외하였다. 모든 스캔은 Cirrus OCTA 소프트웨어(AngioPlex version 10.0, Carl Zeiss Meditec)를 사용하여 분석되었다. 6 × 6 mm 스캔의 측정 영역 중 황반오목 반경 0.5 mm 중심 영역 및 반경 0.5-1.5 mm의 주변 영역, 반경 3 mm 이내의 총 영역 각각의 혈관밀도(VD, 총 길이로 정의됨) 및 관류밀도(PD, 측정 영역에서 단위 면적당 관류 정맥류 총 면적으로 정의됨)를 자동 측정했다. 오목무혈관부위(FAZ)의 면적 및 둘레도 측정했다.
망막내층의 두께는 Ganglion cell analysis algorithm으로 분석한, 신경절세포층과 내망상층의 두께를 합한 신경절세포-내망상층(Ganglion cell-inner plexiform layer)으로 평가하였고, 평균 신경절세포-내망상층의 두께, 최소 신경절세포-내망상층의 두께, 상측, 상비측, 상이측, 하측, 하비측, 하이측 총 6방향의 신경절세포-내망상층의 두께를 측정하여 비교하였다.
통계적 분석은 Statistic package for social science version 22.0 program (IBM Corp., Armonk, NY, USA)을 이용하였으며 연속형 자료는 독립표본 Mann-Whitney의 U 검정을 사용하였고 범주형 자료는 chi 제곱 검정을 사용하여 비교하였다. 또한 유의수준 0.05 미만인 경우를 통계학적 의의가 있는 것으로 판정하였다. 본 연구는 헬싱키선언에 입각한 의학연구윤리심의위원회의 승인 아래 진행되었다(승인 번호: 2019-07-0231).
결 과
환자군 38명 중 남성이 16명, 여성이 22명이며 평균연령은 58.4 ± 9.6세, 정상 대조군 37명 중 남성이 21명, 여성이 16명이며, 평균연령은 54.9 ± 14.9세였다. 고혈압 병력이 있는 경우가 단안 망막분지정맥폐쇄환자 38명에서 16명으로 대조군 37명 중 6명과 비교하였을 때 유의한 차이를 보였으나(p=0.014), 나이, 성별, 굴절률, 최대교정시력, 평균 안압, 당뇨의 유병률은 양 군 간의 차이를 보이지 않았다(Table 1).
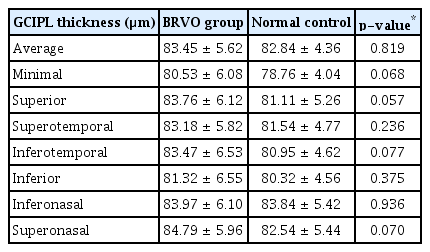
단안 망막정맥폐쇄가 있는 환자의 반대안과 대조군의 신경절세포-내망상층의 두께를 스펙트럼영역 빛간섭단층촬영검사를 이용하여 비교하였을 때는 평균 신경절세포-내망상층의 두께와 최소 신경절세포-내망상층의 두께, 신경절세포-내망상층의 두께 및 상비측, 상측, 상이측, 하비측, 하이측, 하측 신경절세포-내망상층의 두께 모두에서 양 군의 의미 있는 차이를 보이지 않았다(Table 2).
단안 망막정맥폐쇄가 있는 환자의 반대안과 대조군의 빛간섭단층혈관조영술검사에서 황반오목 중심으로부터 0.5 mm 이내, 3 mm 이내, 0.5 mm에서 1.5 mm의 범위의 혈관밀도와 관류밀도는 양 군에서 의미 있는 차이를 보이지 않았으나, 중심오목무혈관부위의 넓이는 단안 망막정맥폐쇄환자의 반대안은 0.314 ± 0.139 mm2와 대조군은 0.247 ± 0.089 mm2로 의미있는 차이를 보였으며(p=0.048) 중심오목무혈관부위의 둘레는 단안 망막정맥폐쇄환자의 반대안은 2.332 ± 0.569 mm와 대조군은 1.999 ± 0.450 mm로 의미있는 차이를 보였다(p=0.011) (Table 3).
고 찰
망막정맥폐쇄가 있는 눈에서, 병의 초기에는 망막부종이 발생하며, 후기에는 병변의 망막의 두께감소에 의하여 망막신경섬유층 및 신경절세포-내망상층의 두께를 정확하게 측정할 수 없다[13]. 또한 망막정맥폐쇄 발병 후 망막신경섬유층 두께의 유의미한 감소가 발생하는데 이는 망막정맥폐쇄의 자연 경과의 일부로 생각된다[14]. 따라서 병의 자연경과를 배제한 배경인자에 의한 영향을 고려할 때는 망막정맥폐쇄의 이환안이 아닌 반대안을 분석하는 것이 합리적이라고 생각된다.
단안 망막정맥폐쇄가 있는 환자의 반대안에서 빛간섭단층혈관조영술을 이용하여 정상 대조군과 비교하였을 때 안저검사상 이상이 관찰되지 않았음에도 황반부의 미세혈관의 밀도가 낮고 중심와 무혈관 부위가 더 넓다는 보고가 있다[15]. 이는 이환안 뿐만 아니라 안저검사상 이상이 없는 반대안에도 관류가 감소하였음을 시사하고 또한 망막정맥폐쇄의 발생이 단지 국한된 안구의 손상이 아니라 망막혈관에 영향을 주는 전신적인 변화가 양안 동시에 영향을 주었지만 단안에서만 망막정맥폐쇄가 일어난 것으로 해석할 수도 있을 것이다. 본 연구에서는 단안 망막정맥폐쇄가 있는 환자의 반대안에서 대조군과 비교 시 황반부의 관류밀도 및 혈관밀도의 유의미한 차이를 보이지 않았지만 오목무혈관부위의 넓이와 둘레가 증가되어 있었다. 이 역시 단안 망막정맥폐쇄가 있는 환자의 반대안에서도 허혈이 있는 것을 의미하는 것으로 해석할 수 있겠다.
망막정맥폐쇄가 있었던 눈과 망막정맥폐쇄가 있었던 반대안에도 신경절세포-내망상층의 두께가 감소하였다는 보고가 있고[16], 양 군 간 유의한 차이가 없었다는 연구도 있다[17]. 본 연구에서는 망막정맥폐쇄가 있었던 반대안과 정상 대조군과 비교하였을 때 신경절세포-내망상층의 두께는 유의미한 차이가 나지 않았다. 본 연구에서는 분지망막정맥폐쇄환자만을 대상으로 하였지만 망막정맥폐쇄가 있었던 눈과 망막정맥폐쇄가 있었던 반대안에도 신경절세포-내망상층의 두께가 감소하였다는 보고에서는 분지망막정맥폐쇄환자와 중심망막정맥폐쇄환자를 망막정맥폐쇄군으로 하였고 대상자 수도 많았다[16]. 또한 망막정맥폐쇄환자들에서 정상 대조군보다 고혈압이 있는 비율이 높았고 고혈압의 이환기간이 신경절세포-내망상층의 두께에 영향을 줄 수 있다는 보고가 있으므로 고혈압 같은 전신적인 혈액학적 위험 인자가 신경절세포-내망상층의 두께에 영향을 주었을 가능성도 해석 시 고려해야 할 것이다[18].
녹내장과 망막정맥폐쇄 사이의 연관성에 관한 여러 연구에서 녹내장성 시신경유두변화가 망막정맥폐쇄와 관련이 있으며 녹내장의 유병률은 일반 인구보다 망막정맥폐쇄환자에서 훨씬 더 높았으며 망막정맥폐쇄환자에서 안압이 높은 경향성을 보이며, 녹내장으로의 발전 위험성도 높다고 보고하였다[19,20]. 역으로 녹내장이 있는 환자에서 망막혈관폐쇄의 발병 위험성이 높다는 연구도 있다[21]. 정상안압녹내장을 포함한 개방각녹내장 이환안과 정상 대조안의 빛간섭단층혈관조영술검사 결과를 비교하였을 시에 혈관밀도의 감소와 중심오목무혈관부위 넓이 및 둘레가 증가되어 있고 개방각녹내장과 정상을 구분하는 데에 중심오목무혈관부위의 수치가 유용함을 주장하는 연구도 있다[22-24]. 또한 망막정맥폐쇄와 개방각녹내장은 고혈압, 당뇨 등의 전신적인 위험 인자를 공통적으로 가지는 것으로 보고되었다[25-29]. 이번 연구에서 단안 망막분지정맥폐쇄를 일으킨 환자에서 대조군보다 더 높은 고혈압의 비율을 보였으며 단안 망막분지정맥폐쇄 반대안의 중심오목무혈관부위 넓이 및 둘레가 증가되어 있었다. 하지만 녹내장과 망막정맥폐쇄는 여러가지 인자가 작용하는 질환으로 혈역학적 이상이 관여하는 것으로 생각되나 본 연구의 결과로 두 병의 관련성을 언급하기에는 한계가 있어 향후 녹내장과 망막정맥폐쇄에 관한 혈역학적 연구가 더 필요할 것이라 생각된다.
망막정맥폐쇄의 주요 위험 인자는 연령 증가, 고혈압, 당뇨, 고지혈증 같은 동맥경화성 혈관 위험 인자, 녹내장으로 각각의 위험 인자들은 공통적으로 초기 발병단계에서 반응성 산소(reactive oxygen)를 생산하는 무증상의 염증(subclinical inflammation)이 발생한다는 보고들과 무증상의 염증 반응이 모세혈관의 내피세포에 직접적인 손상과 막힘을 유발할 수 있다는 보고들이 있다[30-35]. 또한 염증 반응 동안 부착분자(adhesion molecules)의 발현이 증가되어 백혈구 정체증(leukostasis)을 유발하고 모세혈관 내강의 물리적 폐쇄를 유발할 수 있다는 보고도 있다[36]. 이런 무증상의 변화들로 망막정맥페쇄의 반대안의 미세혈관밀도 및 관류의 감소를 설명하기도 한다[37]. 본 연구에서 망막분지정맥폐쇄가 있었던 군에서 대조군에 비해 고혈압의 유병률이 유의하게 높았으므로 이것이 오목무혈관부위의 넓이와 둘레에 영향을 미쳤을 수 있을 것으로 생각된다.
본 연구의 결과를 종합해보면, 망막정맥폐쇄의 반대안과 정상 대조안 간의 신경절세포-내망상층의 두께의 차이는 보이지 않았으므로, 망막정맥폐쇄 자체가 반대안의 망막신경절세포의 손상을 유발하지 않는 것으로 사료된다. 하지만 빛간섭혈관조영촬영술 결과를 비교하면, 관류밀도 및 혈관밀도의 유의미한 차이가 없으므로 망막정맥폐쇄환자의 반대안에서 관류와 혈관의 거시적인 변화는 발생하지 않았으나, 오목무혈관부위의 넓이와 둘레가 대조안보다 증가한 소견은 황반허혈로 인한 오목무혈관부위의 변화가 있을 수 있음을 시사한다. 이러한 변화는 망막정맥폐쇄의 위험 인자인 전신적인 혈역학적 요인이 영향을 끼쳤을 것으로 생각된다.
본 연구에서 3차 상급종합의료기관에 내원하여 망막분지정맥폐쇄를 진단 받은 환자와 검진 목적으로 녹내장검사를 시행 받은 경우를 대상으로 하였고, 개체수가 상대적으로 적어 이로 인한 선택비뚤림(selection bias) 가능성이 있다. 또한 대상자 중 시야검사를 시행하지 않은 경우와 시야검사의 신뢰도가 떨어지는 경우가 있어 시야에 대한 분석은 시행하지 못하였으며, 모든 환자에서 시신경유두의 빛간섭단층촬영을 시행하지 못하여, 시신경유두주위 망막신경섬유층에 대한 분석을 시행하지 못하였다. 또한 망막정맥폐쇄진단 당시 시행한 빛간섭단층촬영 및 빛간섭단층혈관조영술로 측정한 수치를 단면적으로 분석하였으며 향후 추가 연구를 통하여 시간에 따른 경과의 변화를 확인해 보는 것이 필요할 것으로 사료된다.
결론적으로 본 연구에서 망막분지정맥폐쇄환자들의 반대안에서 정상 대조군에 비해 신경절세포-내망상층의 두께의 유의미한 변화는 없으나, 중심오목무혈관부위의 넓이와 둘레가 증가되어 있었다. 이는 망막분지정맥폐쇄가 단안에만 있을 경우에도 반대안의 중심오목에 허혈이 있음을 의미한다. 따라서 단안에 국한된 망막정맥폐쇄환자에서도 반대안의 허혈성 질환에 대한 주의 깊은 관찰이 필요하며, 위험 인자의 관리 및 혈류 개선을 위한 노력이 필요할 것으로 생각된다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
정우현 / Woo Hyun Jung
인제대학교 의과대학 부산백병원 안과학교실
Department of Ophthalmology, Inje University Busan Paik Hospital, Inje University College of Medicine