섬유주세포에서 혈관내피성장인자가 YAP/TAZ 신호전달에 미치는 영향
Effects of Vascular Endothelial Growth Factor on YAP/TAZ Signaling in Trabecular Meshwork Cells
Article information
Abstract
목적
본 연구에서는 인간섬유주세포에서 VEGF가 Hippo 신호전달 관련 전사인자 yes-associated protein (YAP)/transcriptional co-activator with PDZ-binding motif (TAZ) 신호전달에 영향을 미치는지 규명하고, 유도된 YAP/TAZ의 역할을 알아보고자 한다.
대상과 방법
다양한 VEGF 농도를 인간섬유주세포에 처리하여 CCK-8 용액으로 세포독성을 확인하였다. TGFβ2 (5 ng/mL)와 VEGF(30 ng/mL) 처리 후 western blot과 RT-qPCR, 면역세포화학염색으로 YAP/TAZ 발현을 확인하였다. Fibronectin, collagen1, myocilin 발현은 western blot으로 확인하였다. Alexa Fluor 488-phalloidin으로 세포를 염색하여 액틴필라멘트를 관찰하였다.
결과
YAP과 TAZ의 발현은 TGFβ2와 VEGF의 24시간 처리 후 증가하였다. 모든 실험군에서 fibronectin과 collagen1이 증가한 반면 myocilin은 TGFβ2와 TGFβ2+VEGF 처리군에서 증가하였다. 액틴필라멘트 염색으로 섬유주세포의 cross-linking을 확인하였다.
결론
VEGF가 YAP/TAZ 신호를 유도하여 섬유주세포의 섬유화를 증가시켰다. VEGF에 의한 기능적 변화가 확인된다면 섬유주세포의 방수유출저항 기전으로 VEGF와 YAP/TAZ를 제시할 수 있을 것이다.
Trans Abstract
Purpose
To investigate the effects of vascular endothelial growth factor (VEGF) on yes-associated protein (YAP)/transcriptional coactivator with a PDZ-binding motif (TAZ), a Hippo pathway-related transcription factor, and the role of YAP/TAZ induced by trabecular meshwork stimulation.
Methods
Human trabecular meshwork cells were cultured and treated with various VEGF concentrations to verify cell cytotoxicity using the CCK-8 solution. Transforming growth factor β-2 (TGFβ2; 5 ng/mL) and VEGF (30 ng/mL) were applied and YAP/TAZ expression was assessed by western blotting, reverse transcription quantitative polymerase chain reaction and immunocytochemistry. Fibronectin, collagen 1, and myocilin expression were also assessed by western blotting. The cells were stained using Alexa Fluor 488-phalloidin to observe F-actin changes.
Results
YAP and TAZ expression increased following TGFβ2 and VEGF treatment for 24 hours. Fibronectin and collagen 1 increased significantly in all three treatment groups, while myocilin increased in the TGFβ2 and TGFβ2+VEGF groups. The F-actin staining showed increased cross-linking in the trabecular meshwork cells.
Conclusions
VEGF induced YAP/TAZ signaling and increased trabecular meshwork cell fibrosis. Based on the functional changes caused by VEGF, it is suggested that VEGF and YAP/TAZ may increase aqueous humor outflow resistance in trabecular meshwork cells.
녹내장은 실명의 중요한 원인 중 하나이며, 현재 전 세계적으로 7천만 명 이상의 사람들이 녹내장으로 고통받고 있다.1,2 기존의 많은 연구들을 통해 녹내장 발병의 가장 중요한 원인이 안압상승임이 밝혀져 있다. 때문에 현재 이루어지고 있는 모든 녹내장 치료의 기본 원칙은 안압을 하강시키는 것이고, 안압하강만이 유일하게 녹내장의 진행을 억제하는 효과가 있는 것으로 밝혀져 있다.3,4 그중 가장 많이 사용되고 있는 방법이 점안제 사용을 통해 안압을 떨어뜨리는 것이다.
안압은 방수의 생성과 배출 사이의 균형에 의해 조절된다.5 비색소성 섬모체상피에서 생성된 방수는 안구의 여러가지 생리적 기능과 대사적 항상성을 유지하는 중요한 역할을 담당한 후 전방각에 위치한 섬유주세포를 경유하는 섬유주유출로나 포도막공막유출로를 통하여 혈액순환계로 배출된다. 생리적 상황에서는 섬유주세포를 경유하는 유출로가 방수유출의 가장 큰 부분을 담당하게 되는데, 녹내장과 같은 병적인 상황에서는 이러한 섬유주유출로의 기능이 떨어지게 되고, 이 때문에 안압상승이 발생하게 된다. 녹내장에서 섬유주유출로의 저항이 증가하는 이유는 아직 완전히 밝혀지지 않았다. 그러나 기존의 연구 결과들을 살펴보았을 때, 섬유주세포의 경도(stiffness) 증가와 섬유화, 세포 외기질(extracellular matrix)의 조성 변화 및 침착물 증가, 또는 쉴렘관(Schlemm’s canal) 내벽의 투과성 변화 등이 관여할 것으로 생각된다.6
현재 임상에서 사용 중인 안압하강제는 대부분 방수의 생성을 억제하거나 포도막공막유출로에서 방수유출을 증가시키는 기전으로 안압을 떨어뜨리게 된다. 실제 방수유출의 가장 많은 부분을 담당하고, 녹내장의 병인과도 밀접하게 연관되어 있는 섬유주유출로의 기능을 증가시키는 약물은 현재 널리 쓰이고 있지 못하고 있는데, 이는 아마도 녹내장 환자에서 섬유주유출로의 저항이 증가하는 원인이 아직 불분명하고 이를 개선시키는 약물에 대한 연구가 부족하기 때문일 것이다.7,8
Hippo pathway는 스트레스와 연관된 신호전달계 중의 하나로 Salvador-Warts-Hippo pathway라고도 알려져 있다.9 Hippo pathway의 하류에는 전사인자인 yes-associated protein (YAP)과 transcriptional coactivator with a PDZ-binding motif (TAZ)가 있는데, 최근 많은 연구들을 통해 이 두 전사인자가 세포의 수축성 및 세포외기질의 조성, 섬유화 과정 등의 조절에 중요한 역할을 하는 것으로 밝혀졌다.10,11 스트레스가 없는 상황에서는 인산화효소(kinase)반응이 활성화되고, YAP/TAZ가 단백분해효소에 의해 빠른 속도로 비활성화되지만, 스트레스 상황에서는 인산화효소가 비활성화되어 YAT/TAZ가 세포 핵 내로 이동하게 되고, 핵 내의 TEAD라는 전사인자와 함께 세포증식 및 섬유화와 관련된 유전자의 발현을 증가시키게 된다.12-14
Transforming growth factor β-2 (TGFβ2)는 성장인자 중 하나로 fibroblast 증식, collagen 축적, matrix 물질 생성 증가에 관여하며 그중 TGFβ2는 눈의 방수에 존재하며 흉터 작용에 관여한다.15 또한 개방각녹내장 환자의 방수에서 TGFβ2의 유의한 증가가 보고되었다.16,17 증가한 TGFβ2가 여러 신호와의 상호작용으로 fibronectin, collagen1, α-SMA 등 섬유화에 관여하는 세포외기질 관련 단백질의 발현과 cross-linked actin networks를 증가시켜 방수유출을 저하시키고 안압을 상승시킨다.18-22 TGFβ2와 상호작용하는 여러 신호들 가운데 최근 Hippo pathway와의 연관성이 연구되고 있으며, 특히 YAP/TAZ 발현 증가와 세포외기질 관련 단백질 증가로 섬유화가 발생하는 것이 보고되었다.14,23,24
한편 혈관내피성장인자(vascular endothelial growth factor, VEGF) 역시 내피세포 투과성을 조절하는 중요한 인자 중의 하나로, 스트레스 상황에서 분비되어 섬유주유출 능을 증가시키는 것으로 알려져 있다.25 또한, VEGF가 fibroblast 증식의 매개체 역할을 할 수 있다는 연구 결과가 있다.26-28 최근 다양한 망막 질환의 치료에 anti-VEGF의 유리체강 내 주사 요법이 이용되고 있는데, 이 때문에 VEGF가 섬유주세포에 어떠한 영향을 미치는지에 대한 관심이 증가하고 있다.
본 연구는 VEGF가 YAP/TAZ 신호전달에 영향을 미치는지 규명하고, VEGF로 인한 YAP/TAZ 신호전달체계가 인간섬유주세포에서 어떠한 역할을 하는지 알아보고자 하였으며 기존 연구들을 통하여 방수유출저하와 개방각녹내장과의 연관성이 확인된 TGFβ2의 병리적 농도를 함께 처리하여 VEGF로 인한 효과가 개방각녹내장을 예상할 정도로 나타날 수 있을지, 전방에 존재하는 두 물질이 병리적 농도가 되었을 때 시너지 효과를 보일지 확인하고자 하였다.
대상과 방법
세포배양과 약물처리
본 연구는 인체유래물을 직접 채취하지 않고 인체유래물로부터 분리·가공된 세포주를 사용하여 연구기관 내 생명의학연구윤리심의위원회(IRB)의 승인면제를 받아 시행하였다(CNUH-EXP-2022-377). 인간섬유주세포(Human Trabecular Meshwork Cells; ScienCell Research laboratories, Carlsbad, CA, USA)는 ScienCell Research Laboratories로부터 구매하여 실험을 진행하였다. 5% CO2를 함유한 37°C 배양기에서 2% 우태아혈청(fetal bovine serum [FBS]; Cat. #0010, ScienCell Research laboratories)과 항생제(penicillin/streptomycin solution [P/S]; Cat. #0503, ScienCell Research laboratories), 섬유주세포성장보조제(trabecular meshwork cell growth supplement [TMCGS]; Cat. #6592, ScienCell Research laboratories)를 포함한 섬유주세포배지(trabecular meshwork cell medium [TMCM]; Cat. #6591, ScienCell Research laboratories)로 배양하였다. 섬유주세포가 배양접시의 90% 이상을 차지하면, 트립신(Trypsine-EDTA, ScienCell Research laboratories)과 인산염 완충 식염수(PBS), 우태아혈청(FBS)을 1:1:1 비율로 처리하여 계대배양하였다. 섬유주세포를 배양접시에 분주 후 80% 이상 자란 것을 확인하고 기아 상태로 만들기 위해 우태아혈청과 항생제, 섬유주세포 성장보조제를 배제시킨 섬유주세포배지로 교체하였다. 24시간 기아상태 이후 TGFβ2 (R&D systems, Minneapolis, MN, USA)와 Recombinant Human VEGF 165 Protein (R&D systems)을 처리하였다.
세포 생존율 측정
96 well plate에 100 μL 배지를 넣고 well당 5×103의 cell을 분주하였다. 5% CO2를 함유한 37°C 배양기에서 24시간 동안 배양하였다. VEGF 10, 30, 50 ng/mL을 10 μL씩 처리하여 24시간 동안 배양하였다. CCK-8 용액(Dojindo Laboratories, Kumamoto, Kyushu, Japan)을 각 well에 10 μL씩 넣고, 4시간 동안 배양하였다. 샘플의 측정값 보정을 위한 blank값 측정을 위해 세포를 제외시킨 배지에 CCK-8 용액을 10 μL 넣고 샘플과 같은 조건으로 배양하였다. Microplate reader를 이용하여 450 nm에서 샘플의 흡광도와 blank 흡광도를 측정하였고, 세포 생존율은 [(샘플 흡광도 값 - blank 흡광도 값) / (대조군 흡광도 값 - blank 흡광도 값) × 100] (%)으로 계산하였다.
Western blot analysis
6-well plate에서 80% 이상 키운 섬유주세포에 TGFβ2를 기존 연구에서 사용되어 YAP/TAZ 발현과 섬유화가 확인된 5 ng/mL 농도로 처리하였고, VEGF는 세포독성 실험으로 도출한 30 ng/mL 농도로 처리하였다. 약물을 1, 6, 12, 24시간 처리한 후 RIPA 버퍼를 사용하여 세포에서 단백질을 추출하였다. 원심분리기에서 13,000 rpm, 4°C, 15분 동안 원심분리 후 단백질이 존재하는 상층액을 모았다. 단백질량은 Protein Assay Dye reagent concentrate (Bio-Rad Laboratories, Hercules, CA, USA)를 사용하여 Bradford assay로 측정하였다. 샘플은 1 μg/mL 농도로 재조합하였고, 10% Tris-Glycine gel에 로딩하여 전기 영동한 후 PVDF막으로 이동시켰다. 트리스버퍼식염수(tris-buffered saline, TBS)에 0.1% Tween-20 (BioShop, Burlington, Canada)을 넣고 5% 탈지분유(skim milk powder, BioShop)를 녹인 버퍼에 PVDF막을 1시간 동안 상온에서 배양하였다. 1차 항체 YAP (1:1000; Cell signaling Technology, Danvers, MA, USA; Cat#14074), YAP/TAZ (1:1000; Cell signaling Technology; Cat#8418)를 4°C에서 12-16시간 동안 반응시켰다. Anti-rabbit IgG, HRP-linked antibody (1:3000; Cell signaling Technology) 로 상온에서 1시간 동안 반응시킨 후 막에 chemiluminescent HRP substrate (Merck KGaA, Darmstadt, Germany)를 처리하여 화학발광영상장치(Alliance Mini HD9, UVITEC, Cambridge, UK)로 단백질 발현량을 확인하였다.
6-well plate에서 키운 섬유주세포에 TGFβ2 (5 ng/mL)와 VEGF (30 ng/mL)를 각각 처리한 군들과 TGFβ2 (5 ng/mL)와 VEGF (30 ng/mL)를 동시에 처리한 군을 나누어 실험을 진행하였다. 약물은 24시간 동안 처리하였고, RIPA 버퍼를 사용하여 단백질을 추출하였다. 전기 영동과 이동, 막차단 과정은 위와 같은 방법으로 진행하였다. YAP, YAP/TAZ, fibronectin (1:1000; NOVUS biologicals, Centennial, CO, USA), collagen1(1:5000; Abcam, Cambridge, UK), myocilin(1:200; R&D systems) 일차 항체를 4°C에서 12-16시간 동안 반응시킨 후 다음날 anti-rabbit IgG HRP-linked antibody(1:3000; Cell signaling Technology), anti-goat IgG (1:1000; R&D systems) 이차 항체를 상온에서 1시간 동안 반응시켰다. 동일한 방법으로 단백질 발현양을 확인하였다. 기준은 monoclonal Anti-β-Actin-peroxidase antibody (β-actin, Merck KGaA)로 사용하였다.
Quantitative reverse transcription polymerase chain reaction 분석
6-well plate에서 키운 섬유주세포에 TGFβ2 (5 ng/mL)와 VEGF (30 ng/mL) 약물을 1, 6, 12, 24시간 처리하고 RNAiso Plus (Takara biomedical, Kusatsu, Shiga, Japan)로 RNA를 분리하였다. Isopropanol로 응집시켜 RNA를 모아 DEPC water로 응집된 RNA를 재구성하였다. Nanodrop을 사용하여 RNA를 정량하고, PrimeScript 1st strand cDNA synthesis kit (Takara biomedical)를 이용하여 1 μg/μL 농도의 RNA로 cDNA를 합성하였다. TB Green Premix Ex Taq (Takara biomedical)와 10 pmol/μL Primer (YAP; forward primer, 5’-ACCCACAGCTCAGCATCTTCG-3’ ;reverse primer, 5’-TGGCTTGTTCCCATCCATCAG-3’, and TAZ; forward primer, 5’-GTATCCCAGCCAAATCTCGTGATC-3’; reverse primer, 5’-AGCGCATTGGGCATACTCATG-3’ and 18srRNA; forward primer, 5’-GGCCCTGTAATTGGAATGAGTC-3’; reverse primer, 5’-CCAAGATCCAACTACGAGCTT-3’)로 cDNA 를 Thermal cycler DiceII (Takara biomedical)에서 증폭시켰다. PCR은 95°C에서 10분 동안 반응시킨 후 95°C 10초, 56°C 15초, 72°C 20초를 1 cycle로 총 45 cycle 반응시키고 95°C 15초, 60°C 30초, 95°C 15초 동안 분리하였다. 반응이 끝난 후 샘플에서 수집된 Ct (tm) 값을 분석하였다.
면역세포화학 염색(immunocytochemical staining)
6-well plate에 cover glass (20×20)를 넣고 100% 에탄올로 1시간 동안 소독하였다. 에탄올을 제거하고 plate와 커버 글라스를 UV에서 15분 동안 멸균하였다. 증류수 3 mL에 poly-L-lysine (ScienCell Research laboratories)을 2 ug/cm2로 넣고 37°C에서 최소 1시간 이상 반응시켜 커버 글라스에서 세포가 자랄 수 있도록 코팅하였다. 코팅된 커버 글라스에 섬유주세포를 분주하여 70-80% 수준으로 배양하고, TGFβ2 (5 ng/mL)와 VEGF (30 ng/mL), TGFβ2 (5 ng/mL)+ VEGF (30 ng/mL) 세 개의 실험군에 약물을 처리하여 24시간동안 반응시켰다. 4% paraformaldehyde (Biosesang, Seongnam, Korea)에서 15분 동안 세포를 고정시키고 0.1% Triton X-100을 포함한 PBS에서 15분 동안 침투반응을 시킨 후 PBS로 세척하였다. 1% BSA를 포함한 PBS 버퍼로 blocking 후 1차 항체 YAP/TAZ (1:100; Cat#8418, Cell signaling technology) 를 4°C에서 12-16시간 동안 반응시켰다. 그 후 Goat anti-Rabbit IgG Cross-adsorbed Secondary Antibody, Alexa Fluor 488 (1:200; Cat#A-11008, Invitrogen, Carlsbad, CA, USA)을 실온에서 4시간 동안 반응시킨 후 VECTASHIELD Antifade mounting Medium with DAPI (Vector Laboratories, Newark, CA, USA)로 염색하였다. Blocking 과정까지 동일하게 진행 후 Alexa Fluor 488 Phalloidin (1:400; Cat#A12379, Invitrogen)을 PBS에 희석하여 1시간 동안 상온에서 반응시켰다. 세척 과정 후 VEC-TASHIELD Antifade mounting Medium with DAPI (Vector Laboratories)로 염색하였다.
통계적 처리
실험에 사용된 세포는 3계대에서 6계대 사이의 세포를 사용하였으며, 대조군은 약물처리를 하지 않았다. 모든 실험은 biological replication을 최소 3회 이상 반복하여 진행하였고, 측정값은 보정 후 평균 ± 표준편차로 나타내었다. 통계학적 분석에는 one-way analysis of variance (ANOVA)를 이용하였으며, Turkey multiple comparisons post hoc test를 이용하여 사후검정을 하였다. p값이 <0.05인 경우 통계학적으로 유의한 것으로 간주하였다.
결 과
VEGF 약물처리 후 섬유주세포 생존율
인간섬유주세포에 VEGF 약물을 10, 30, 50 ng/mL 농도로 처리하였을 때 세포생존율을 측정하기 위하여 CCK-8을 이용하여 세포생존율 및 세포독성 측정을 시행하였다. VEGF 10, 30, 50 ng/mL의 농도에서 각각 92.64 ± 26.19%, 96.73 ± 10.37%, 89.67 ± 24.21%의 생존율을 보였다. 대조군과 비교하였을 때 모든 농도에서 유의한 세포독성은 관찰되지 않았으나 50 ng/mL 농도에서 세포생존율이 다소 감소하였다(Fig. 1).

Effects of three concentration of vascular endothelial growth factor (VEGF) on the cell viability of human trabecular meshwork cells. Several concentration of VEGF (10, 30, and 50 ng/mL) were treated for 24 hours and incubate CCK-8 solution for 4 hours (n = 4). 10 and 30 ng/mL VEGF showed no toxicity in human trabecular meshwork cells. When 50 ng/mL VEGF was treated, cell viability was slightly lowered.
인간섬유주세포에서 VEGF 약물이 YAP/TAZ 발현에 미치는 영향
인간섬유주세포에서 TGFβ2와 VEGF 약물을 처리하였을 때 YAP/TAZ 발현양상을 확인하였다. 이때 본 연구에서 사용된 VEGF는 세포생존율에 영향이 없으면서 최대 효과를 기대할 수 있는 고농도 수치였던 30 ng/mL를 기준으로 하였다. 약물처리를 하지 않은 대조군과 비교하였을 때 TGFβ 2를 처리한 경우 YAP과 TAZ 모두 증가하였고, YAP은 12시간에서 1.61 ± 0.47 fold로 가장 높은 발현양을 보였으며 TAZ는 24시간에서 2.18 ± 0.52 fold로 가장 높은 발현량을 보였다(Fig. 2A, C). 30 ng/mL의 VEGF를 처리한 경우 YAP의 발현량이 증가하였고, 24시간에서 2.11 ± 0.5 fold로 가장 높은 발현량을 보였다. TAZ의 발현량은 1, 6, 12시간 처리 시 각각 0.98 ± 0.23, 1.19 ± 0.35, 1.22 ± 0.16 fold로 대조군과 비교하여 유의한 차이가 관찰되지 않았으나, 24시간 처리 시 2.15 ± 0.12 fold로 대조군과 비교하였을 때 유의한 증가를 보였다(Fig. 2B, D).
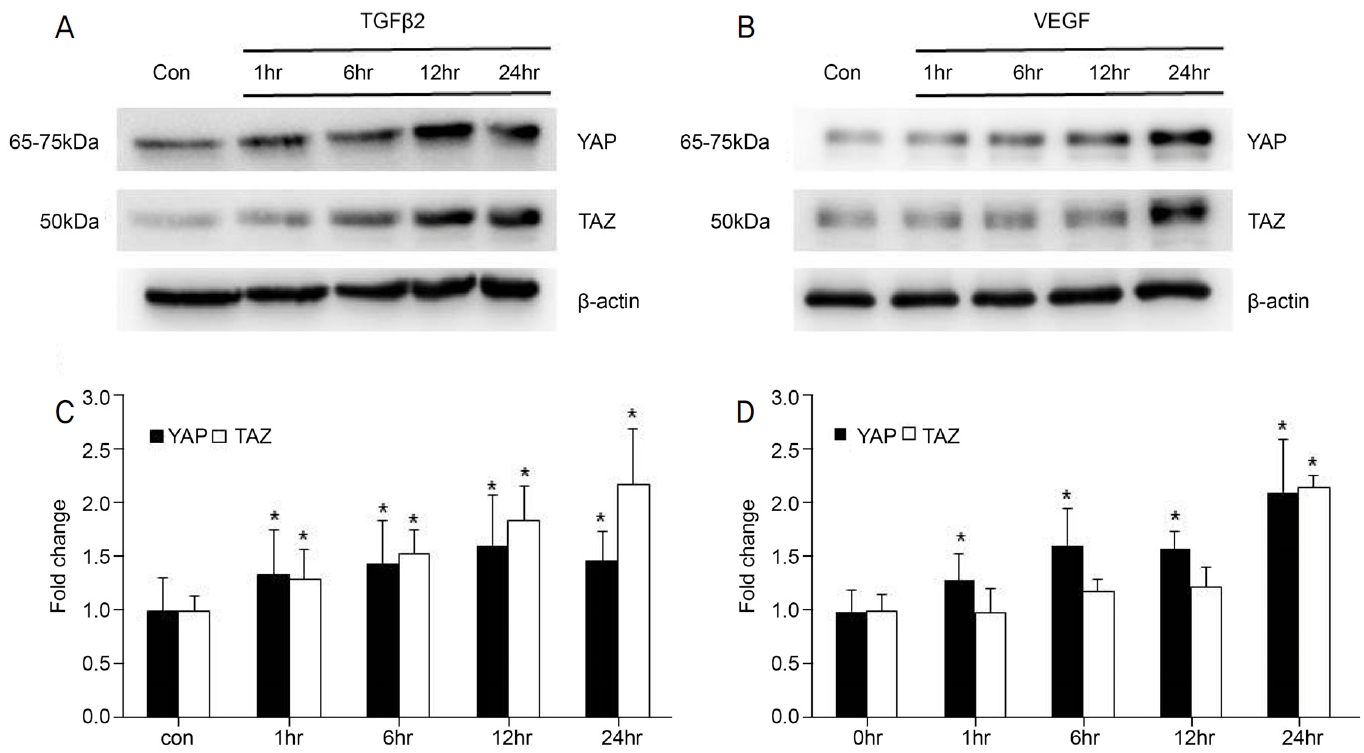
Effects of transforming growth factor β-2 (TGFβ2) and vascular endothelial growth factor (VEGF) treatment on YAP/TAZ expression by time period. (A, C) YAP/TAZ expression over time after TGFβ2 (5 ng/mL) treatment (n = 3). TGFβ2 significantly increased both YAP and TAZ expression. Especially, the highest TAZ expression was observed in 24 hours exposure. (B, D) YAP/TAZ expression over time after VEGF (30 ng/mL) treatment (n = 3). VEGF significantly increased YAP expression at all exposure time. TAZ expression did not significantly increase after 1, 6, and 12 hours of exposure but increased significantly after 24 hours exposure. The highest both YAP and TAZ expression was observed in 24 hours exposure. * p < 0.05, when compared with the control (con) group. hr = hour; YAP = yes-associated protein; TAZ = transcriptional coactivator with a PDZ-binding motif.
인간섬유주세포를 대조군, TGFβ2 처리군, VEGF 처리군, TGFβ+VEGF 처리군으로 나누어 24시간 동안 반응시킨 후 YAP/TAZ의 발현을 western blot과 면역세포화학염색으로 확인하였다. TGFβ2 처리군의 YAP과 TAZ의 발현량은 각각 1.22 ± 0.13, 1.58 ± 0.1 fold이고, VEGF 처리군의 YAP과 TAZ의 발현량은 각각 1.35 ± 0.1, 1.31 ± 0.28 fold로 두 실험군 모두 대조군과 비교하였을 때 YAP과 TAZ의 발현량이 유의하게 증가하였다. VEGF와 TGFβ2를 동시에 처리한 실험군 역시 대조군에 비하여 YAP과 TAZ 발현이 각각 1.25 ± 0.03 fold와 1.64 ± 0.35 fold로 유의하게 증가하였으나, VEGF와 TGFβ2를 각각 단독으로 처리한 군과 비교하였을 때 유의한 차이는 관찰되지 않았다(Fig. 3A, B). 면역세포화학염색으로 세포수준에서 YAP/TAZ 발현을 형광의 강도로 확인하였다. 대조군에서 YAP/TAZ 발현 강도에 비하여 3개의 실험군에서의 발현 강도가 증가하였고, 실험군 간의 확인된 강도는 비슷한 수준으로 나타났다(Fig. 3C).
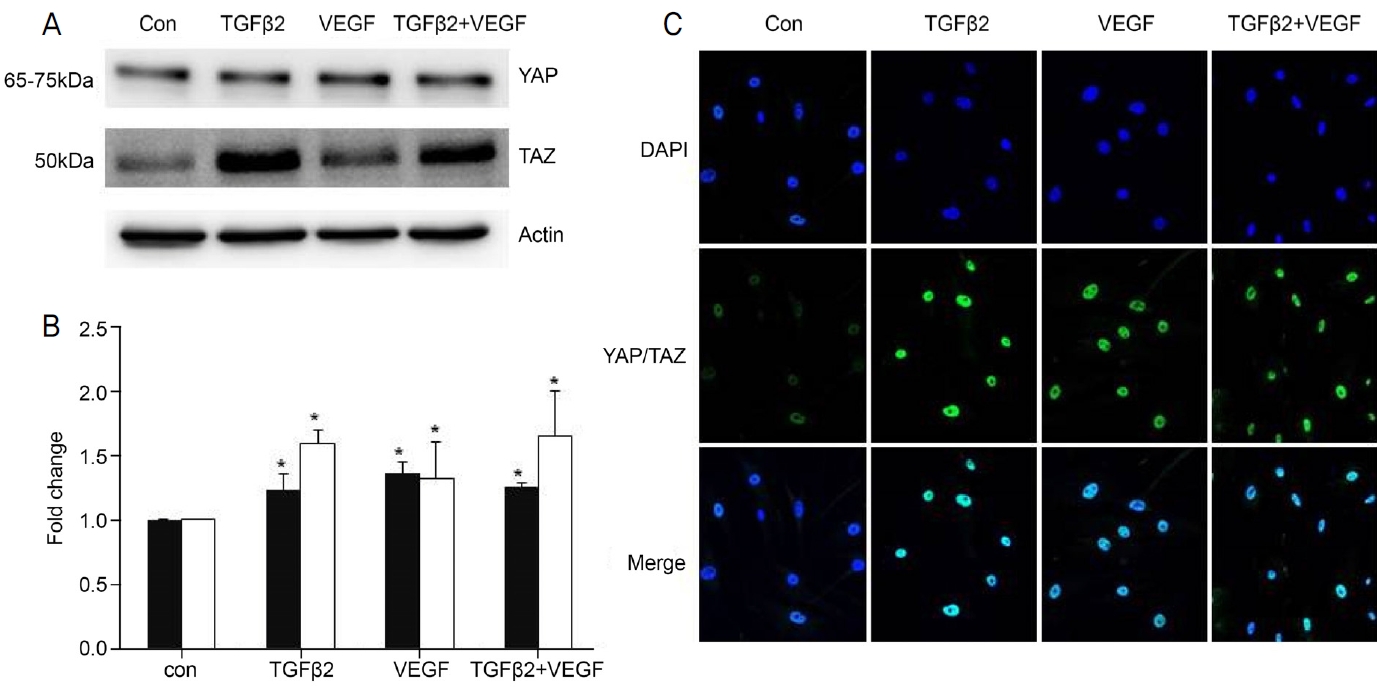
Effects of transforming growth factor β-2 (TGFβ2) and vascular endothelial growth factor (VEGF) on the YAP/TAZ in human trabecular meshwork cells. (A, B) YAP/TAZ expression on TGFβ2 (5 ng/mL) and VEGF (30 ng/mL) treatment for 24 hours by western blot (n = 4). YAP/TAZ expression was increased significantly in all groups. Expression of YAP showed similar patterns in all groups. Expression of TAZ showed similar patterns in TGFβ2 and TGFβ2+VEGF groups. (C) YAP/TAZ expression on TGF β2 and VEGF treatment by immunocytochemical staining. After treatment with TGFβ2 and VEGF and TGFβ2+VEGF for 24 hours, YAP/TAZ signals were strongly expressed in cells. Immunofluorescent images were magnify × 200. * p < 0.05 when compared with the control (con) group. YAP = yes-associated protein; TAZ = transcriptional co-activator with PDZ-binding motif. YAP/TAZ = green; DAPI = blue.
VEGF가 인간섬유주세포의 섬유화에 미치는 영향
인간섬유주세포의 섬유화 진행 확인을 위해 관련 단백질의 발현량을 western blot으로 확인하였다. 대조군, TGFβ2 처리군, VEGF 처리군, TGFβ+VEGF 처리군으로 나누어 세포외기질 단백질인 fibronectin, collagen1과 myocilin의 발현을 비교하였다.
Fibronectin은 약물처리 후 대조군과 비교하였을 때 TGF β2 처리군에서 1.79 ± 0.25 fold, VEGF 처리군에서 1.37 ± 0.2 fold로 발현이 유의하게 증가하였고, TGFβ+VEGF 처리군의 경우 마찬가지로 2.10 ± 0.5 fold로 발현량이 증가하였다(Fig. 4A, C). Collagen1은 약물처리 후 대조군과 비교하였을 때 TGFβ2 처리군에서 1.43 ± 0.56 fold, VEGF 처리군에서 1.63 ± 0.39 fold로 유의한 증가가 관찰되었고, TGFβ+VEGF 처리군에서 1.75 ± 0.3 fold로 대조군에 비하여 유의한 증가를 보였다(Fig. 4B, D). Fibronectin과 collagen1에서 TGFβ+VEGF 처리군의 발현량이 가장 높았지만, 각각의 약물을 따로 처리한 실험군과 비교하였을 때 유의한 차이는 관찰되지 않았다. Myocilin 발현량은 TGFβ2 처리군에서 1.53 ± 0.35 fold, VEGF 처리군에서 1.20 ± 0.15 fold, TGFβ+VEGF 처리군에서 1.57 ± 0.15 fold로 TGFβ2 처리군과 TGFβ2+VEGF 처리군에서는 유의한 증가를 보였지만, VEGF 처리군에서는 유의한 증가를 보이지 않았다(Fig. 5).

Effects of transforming growth factor β-2 (TGFβ2) and vascular endothelial growth factor (VEGF) on the fibronectin and collagen 1. Fibronectin and Collagen1 expressions on TGFβ2 (5 ng/mL), VEGF (30 ng/mL) and TGFβ2+VEGF treatment for 24 hours (n = 4). (A, C) Fibronectin, one of the important marker of fibrosis, was increased significantly in all groups. (B, D) Collagen 1 was increased significantly in all groups. The highest expression of fibronectin and collagen was observed when TGFβ2 and VEGF were treated at the same time, but it was not significant when compared with the groups treated with TGFβ2 and VEGF alone. * p < 0.05 when compared with the control (con) group.
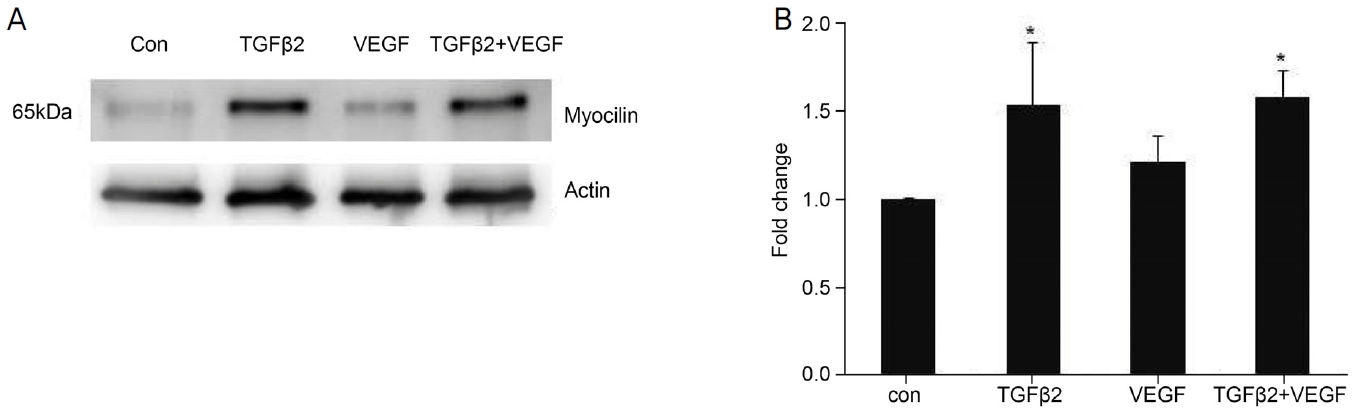
Effects of transforming growth factor β-2 (TGFβ2) and vascular endothelial growth factor (VEGF) on the myocilin. (A, B) Myocilin expression on TGFβ2 (5 ng/mL), VEGF (30 ng/mL) and TGFβ2+VEGF treatment for 24 hours (n = 4). When treated with only TGFβ2 and TGFβ2+VEGF significantly increased myocilin expression and showed a similar pattern. Whereas, myocilin was not increased significantly after VEGF treatment. * p < 0.05 when compared with the control (con) group.
VEGF가 액틴필라멘트(F-actin)에 미치는 영향
각각의 약물을 처리 후 세포의 섬유화 및 cross linked actin-networks를 볼 수 있는 액틴필라멘트의 변화를 확인하였다. TGFβ2와 VEGF를 단독으로 처리하였을 때 액틴필라멘트가 교차되는 부분이 대조군에 비하여 증가하였다. 두 약물을 동시에 처리하였을 경우 또한 액틴필라멘트의 교차가 증가하였으나, 각각의 약물을 단독으로 처리한 군들과 비교하였을 때에는 유의한 차이가 관찰되지 않았다(Fig. 6).
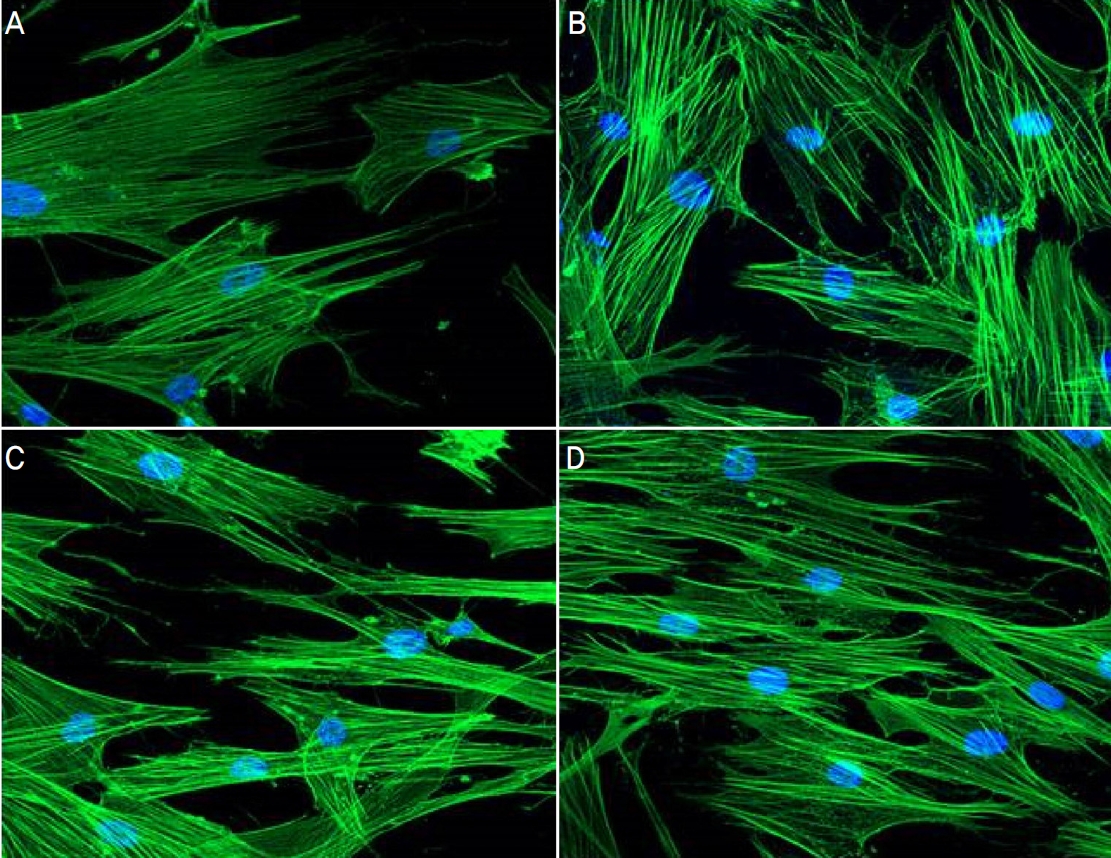
Effect of transforming growth factor β-2 (TGFβ2) and vascular endothelial growth factor (VEGF) on the shape of actin in human trabecular meshwork cells. Human trabecular meshwork cells were treated TGFβ2 (5 ng/mL), VEGF (30 ng/mL) and TGFβ 2+VEGF for 24 hours. Actin filaments were stained using immunocytochemical staining. Phalloidin (1:40) were incubated for 1 hour and stained mounting medium with DAPI. Increased cross-linked actin networks were observed after drug treatment. (A) Control. (B) TGFβ2. (C) VEGF. (D) TGFβ2+VEGF. Immunofluorescent images were magnify × 200. DAPI = blue; actin filament = green.
고 찰
섬유주세포의 세포외기질 구성물 축적으로 인한 섬유화는 녹내장에서 안압상승을 일으키는 주요 원인 중의 하나이다.29 TGFβ2는 섬유주세포의 섬유화를 증가시키는 물질이며 최근 연구에서는 피부와 신장세포, 혈관의 내피세포와 결막섬유아세포, 인간섬유주세포에서 YAP과 TAZ와의 연관성 및 혈관 신생과 섬유화에 대한 영향이 보고되고 있다.14,23,24,29-31
YAP/TAZ의 활성은 혈관신생, 이동, 세포골격 역학, 세포수송을 유도한다.32 이 중 연구를 통해 망막의 혈관과 뇌의 내피세포에서 VEGF가 YAP/TAZ 신호전달에 영향을 주고 혈관신생을 증가시키는 것이 증명되었다.27,33-36 또한 VEGF가 혈관내피세포에서 섬유화 관련 단백질의 발현 증가를 유도하고 섬유아세포 증식을 유도한다는 연구 결과가 보고되었고26-28 폐, 신장, 피부와 간의 조직 섬유화로 인한 다양한 질환에서 비정상적인 YAP/TAZ의 활성이 확인되고 있다.37 한편 YAP/TAZ는 F-actin cytoskeleton의 형성과 수축성을 조절한다. F-actin의 수축력이 증가하면 collagen의 침전이 촉진되어 세포외기질의 섬유경직을 증가시키고 YAP/TAZ가 세포핵 내로 들어가는 것을 촉진시켜 핵 내에서 YAP/TAZ의 활성을 유지시킨다.33,38 VEGF와 YAP/TAZ 그리고 섬유화 단백질 발현 및 F-actin의 변화가 상호간에 영향을 주는 것이 연구 결과로 확인되고 있지만, 섬유주세포에서 이들의 상호작용 및 신호전달이 어떠한지 확인된 연구 결과는 없다.
이에 본 연구에서는 인간섬유주세포에서 고농도 VEGF가 YAP/TAZ의 신호전달과 동시에 섬유화 관련 단백질 발현에 영향을 주는지 확인하고자 하였고 TGFβ2에 의한 YAP/TAZ 발현과 섬유화를 함께 확인하여 두 물질의 공존이 신호전달에 시너지 효과를 보일지 알아보고자 하였다.
TGFβ2와 VEGF를 처리하여 YAP/TAZ 발현 유도 여부를 확인하기 위해 시간대별로 YAP과 TAZ의 발현을 확인하였고, 기존의 연구 결과들과 동일하게 본 연구에서도 TGFβ2 처리 후 YAP과 TAZ가 유의하게 증가한 것을 확인할 수 있었다. VEGF 경우 YAP의 발현은 실험을 진행한 모든 시간대에서 대조군에 비해 증가한 양상임을 확인하였지만, TAZ의 발현은 24시간에서 유의하게 증가하였다. 결과적으로 24시간의 처리 시간을 주었을 때 TGFβ2와 VEGF 모두 YAP/TAZ 발현에 유의한 영향을 미쳤다. 또한 VEGF를 24시간보다 더 짧은 시간대로 처리하였을 때 YAP과 TAZ의 발현의 유의함이 각각 다른 것을 보았을 때 YAP과 TAZ가 받는 영향이 다른 것을 알 수 있고, YAP과 TAZ 발현이 모든 시간대에서 유의하게 증가한 TGFβ2가 YAP/TAZ의 발현에 미치는 영향이 더 크다고 생각해 볼 수 있다. 또한 동일 조건에서 공동전사조절인자로 알려져 있는 YAP/TAZ의 발현의 양상이 다르게 확인되는데 이는 비슷한 구조를 가지고 있지만 완벽히 같지 않고 구조적으로 다른 부분이 발현의 차이를 만드는 것으로 생각된다.39,40 최근 연구 중 HEK293A 세포에서 YAP/TAZ의 비활성화를 통한 인산화의 속도 및 기능의 차이에 대한 연구가 있다.41 섬유주세포에서 YAP과 TAZ의 siRNA 혹은 억제제를 이용한 두 인자의 발현과 기능에 대한 추가 실험을 통하여 차이를 비교할 수 있을 것이라 생각한다.
TGFβ2가 세포외기질 축적물과 myocilin 발현의 증가를 유도하여 섬유주세포와 결막세포에서 섬유화를 유도하는 것은 기존의 다른 연구들에서 관찰된 바 있다.14,42 본 연구에서도 기존 연구와 같이 TGFβ2 처리 후 섬유화 관련 단백의 발현이 증가하는 양상임을 확인하였다. VEGF를 처리한 경우 다른 혈관내피세포와 같이 fibronectin과 collagen1에서 유의한 증가 양상을 보였지만 myocilin에서는 유의한 증가가 관찰되지 않았다. Myocilin은 섬유주세포에서 특징적으로 분비되어 모양체와 방수에서 확인할 수 있고, 세포외 기질 단백질과의 상호작용을 통해 세포외기질 재배열을 유도한다. 돌연변이 myocilin의 경우 비정상적으로 섬유주세포에 축적되고, 결국 섬유주세포의 방수유출 기능을 손상시키게 된다.42,43 본 연구에서 TGFβ2와 달리 VEGF에서는 myocilin 단백질의 발현 증가가 확인되지 못하였는데, VEGF의 다양한 농도와 처리 시간에 따라 발현 양상을 확인하는 추가적인 실험이 필요할 것으로 생각된다.
TGFβ2와 VEGF 약물을 동시에 처리한 경우 대조군과 비교하였을 때 YAP/TAZ 및 섬유화 관련 단백의 발현이 유의하게 증가하였으나, 약물을 각각 처리한 실험군들에 비하여 유의한 증가는 없었다. TGFβ2와 VEGF 각각은 섬유주세포에서 YAP/TAZ 발현과 섬유화에 미치는 영향이 있지만, 동시에 자극이 주어졌을 때 각각 미치는 영향에 비하여 유의한 증가 혹은 감소가 확인되지 않는다. 두 물질이 YAP/TAZ 신호전달에 대하여 경쟁적으로 작용하여 발현량의 유의한 증가가 확인되지 않는 것인지 YAP/TAZ의 상위 신호인자인 LATS1/2와 하위신호인자인 CCN계통 단백질들의 발현을 통하여 신호전달 경로에 대한 추가적인 연구가 필요하다.
결론적으로, VEGF (30 ng/mL)는 섬유주세포에서 YAP/TAZ의 발현을 유도하였고, 세포외기질 단백질의 발현을 증가시켰다. 또한 F-actin에서 cross-linked actin networks의 증가는 섬유주세포의 세포경직(stiffness)의 증가로 이어지며 방수유출의 저하를 일으키는 환경을 만들 수 있다.
본 연구를 통해 고농도 VEGF가 YAP/TAZ 신호전달에 영향을 주며 이와 동시에 섬유주세포의 섬유화에도 영향을 주는 것을 확인할 수 있었다. 이러한 결과는 추후 고농도 VEGF에 의한 안압상승 환자에서 YAP/TAZ를 타깃으로 한 치료약제가 유효할 가능성이 있음을 시사하는 소견이라고 할 수 있겠다. 그러나 섬유주의 구조적인 변화가 방수유출의 저하라는 기능적 변화와 연관이 되는지 확인하기 위해서는 동물실험 및 다양한 농도의 VEGF가 섬유주세포에 미치는 영향에 대한 추가 실험 및 방수 유출량 변화에 대한 연구가 필요할 것이다.
본 연구에서 VEGF가 YAP/TAZ 발현에 영향을 미치는 것을 확인하였지만 30 ng/mL의 특정 농도에서만 진행이 되었다. 이번 연구에서는 한 가지의 농도로만 실험이 진행되었기에 생리적 농도와 병리적 농도를 포함한 다양한 VEGF 농도에 따른 발현의 비교가 필요하다. 또한, TGFβ2와 VEGF의 길항제 혹은 억제제를 통하여 Hippo pathway의 저하와 이에 따라 섬유화가 감소되는지 확인이 필요하다. 이는 두 물질의 신호전달 경로에 미치는 영향을 파악할 수 있을 것으로 보며 새로운 약물 후보군으로의 연구적 가치를 입증할 수 있을 것이라 생각된다.
Acknowledgements
This study was supported by 2020 Cheil-Nammyung Foundation Research.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
김소영 / So Young Kim
전남대학교 의과대학 안과학교실
Department of Ophthalmology, Chonnam National University Medical School
