안구건조증으로 내원한 류마티스 질환 환자에서 하이드록시클로로퀸 망막병증의 유병률 및 위험인자
Prevalence and Risk Factors of Hydroxychloroquine Retinopathy in Rheumatic Patients with Dry Eye Symptoms
Article information
Abstract
목적
본 연구는 안구건조증으로 전안부 외래에 내원한 hydroxychloroquine을 복용 중인 류마티스 질환 환자에서 관련 망막병증 선별검사를 시행하여 유병률 및 위험인자를 분석하고 대표 증례를 보고하고자 한다.
대상과 방법
2016년 4월부터 2021년 12월까지 안구건조 증상을 주소로 전안부 외래에 내원한 류마티스 질환 환자 중 hydroxychloroquine을 12개월 이상 복용한 133명을 대상으로 첫 선별검사를 시행하였고, 망막병증이 진단된 환자를 후향적으로 분석하여 유병률과 위험인자를 확인하였다.
결과
총 133명 환자 중 첫 선별검사에서 hydroxychloroquine 망막병증은 7명(5.2%)이 관찰되었다. 맨-휘트니 U 검정에서 나이, 평균 하루 복용량, 복용 기간, 누적 복용량, 단위 무게당 하루/누적 복용량이 유의한 차이를 보였고(all P<0.05), 다변량 회귀분석에서 평균 하루 복용량(odds ratio [OR], 6.02; 95% confidence interval [CI], 1.64-22.12, 100 mg increments), 복용 기간(OR, 3.39; 95% CI, 1.19-9.62, 5 year increments)이 유의한 차이를 보였다(P=0.021, P=0.007).
결론
안구건조증으로 전안부 외래에 내원한 류마티스 질환 환자에서 hydroxychloroquine 복용력 확인 및 망막검사를 간과하기 쉽다. 전안부 진료 시에도 해당 망막병증의 조기 진단 및 조기 중단을 위해 복용력 확인 및 주기적인 검사가 필요하며 특히 약물의 평균 하루 복용량, 복용 기간이 위험인자로 확인되어 이를 더욱 유의할 필요가 있겠다.
Trans Abstract
Purpose
Hydroxychloroquine is widely used for long-term treatment of rheumatic diseases, but the drug can trigger irreversible toxic retinopathy. We studied the prevalence of, and the risk factors for, hydroxychloroquine retinopathy in rheumatic patients with dry eye symptoms and we introduce a representative case.
Methods
We retrospectively studied a cohort of 133 rheumatological patients who had taken hydroxychloroquine for at least 12 months and who visited our ophthalmology clinic with dry eye symptoms from April 2016 to December 2021. Hydroxychloroquine retinopathy was diagnosed via fundus photography, spectral-domain optical coherence tomography, the Humphrey visual field test, autofluorescence fundus photography, and multifocal electroretinography. The principal outcomes were the prevalence of retinopathy at the first screening and the risk factors.
Results
Of the 133 patients, hydroxychloroquine retinopathy was diagnosed in seven (5.2%) at the first screenings. The Mann-Whitney U-test revealed that older age; higher daily doses; longer dosing duration; greater cumulative doses; and higher daily and cumulative doses/kg were statistically significant in terms of retinopathy development. On multivariate logistic regression analysis, the average daily dose (odds ratio [OR] 6.02; 95% confidence interval [CI] 1.64-22.12, 100 mg increments) and duration of dosing (OR 3.39; 95% CI 1.19-9.62, 5 years increments) remained statistically significant (P = 0.021, P = 0.007 respectively)
Conclusions
Ophthalmologists should enquire about any history of hydroxychloroquine therapy, and perform a retinal examination, when encountering dry eye in patients with rheumatic disease. Early detection of hydroxychloroquine retinopathy followed by discontinuation of hydroxychloroquine is the only way to prevent visual loss. High daily drug doses and long dosing durations are risk factors for retinopathy.
Hydroxychloroquine (HCQ) sulfate는 chloroquine의 독성을 줄인 아날로그 제제로서, 말라리아의 치료 및 예방 약제로 사용되어 왔으며, 루푸스, 류마티스 관절염을 비롯한 자가면역 질환의 장기 치료제로 사용되고 있다. 최근 사용 범주가 넓어져 보조 항암화학 용법 제제 및 당뇨와 심장질환의 새로운 치료제로 주목받고 있다.1 HCQ은 Toll-like receptor 7의 항원 인식 작용을 막아, 내재 면역 및 적응 면역을 억제함으로써, 자가면역 질환 치료 효과를 가지고 있으나, 장기 복용은 외망막층과 망막색소상피층의 변성을 일으켜 심한 시력손상을 야기하는 망막병증을 유발하기도 한다.2
HCQ이 망막 독성의 기전을 설명하려는 다양한 시도가 있었고, 명확한 기전은 밝혀지지 않았다. 기존 연구에 따르면 HCQ은 망막색소상피세포에서 all-trans-retinol의 대사와 연관된 organic anion transporting polypeptide 1A2의 흡수를 저해하여 망막색소상피세포에서 all-trans-retinol의 흡수를 막아 그로 인한 시각회로조절에 영향을 미친다는 것이 in-vivo 연구를 통해 보고되었다.3,4 후행 연구에서 HCQ은 망막색소상피 내 멜라닌색소와 결합하여 세포 내에 지질복합체를 축적시키고, 대사 효소의 작용을 저해하며, 유리기(free radical)를 생성하여 망막세포의 전해질 불균형을 야기한다는 보고도 있다.5-10
HCQ 망막병증은 빛간섭단층촬영에서 외망막층 및 망막색소상피층의 결손을 확인할 수 있으며, 자동시야검사에서 그에 상응하는 암점과 안저자가형광촬영상 고형광 또는 저형광 병변이 관찰된다.11 다초점망막전위도검사에서는 해당 영역 양성파의 진폭감소가 관찰된다.12
국외 연구에서 병변 부위는 중심와부근(parafovea)이 많으나, 국내 연구에 따르면 아시아인의 경우 혈관궁 근처의 황반 외 영역(pericentral)이 더 많은 것으로 보고되고 있다.13
HCQ의 적응증이 넓어짐에 따라, 안구건조증과 같은 전안부 관련 주소로 내원하는 환자들에서 HCQ을 복용 중인 환자가 많아지고 있으며, 따라서 이들 환자에게서 선별검사의 중요성이 점점 강조되고 있다.
본 연구는 안구건조 증상을 주소로 내원한 HCQ 복용 중인 류마티스 질환 환자에게, 처음으로 HCQ 망막병증 선별검사를 시행하고, 진단된 환자들을 대상으로 유병률 및 위험인자를 분석하고 대표 증례를 보고하고자 한다.
대상과 방법
2016년 4월부터 2021년 12월까지 안구건조 증상을 주소로 본원 안과에 내원한 류마티스 질환 환자 중 1년 이상 HCQ을 복용한 환자를 대상으로 의무기록 조회를 통해 후향적 조사를 시행하였다. 후부포도막염, 당뇨망막병증, 황반변성, 망막색소변성증 등 망막에 영향을 미칠 수 있는 안과적인 질환 및 외상력이 있었던 환자, 안과적인 수술을 받았던 환자는 연구 대상에서 제외하였다.
의무기록 조회를 통해 스넬렌 시력표를 이용한 최대교정시력, 안압검사, 세극등현미경검사, 안저검사, 안저촬영(Non-Mydriatic Fundus camera, CR-DGi, Canon, Tokyo, Japan), 안저자가형광촬영(Optomap 200Tx, Optos, Dunfermline, Scotland, UK), 스펙트럼영역 빛간섭단층촬영(Spectralis®, Heidelberg Engineering, Heidelberg, Germany), 표준 자동시야계검사(Humphrey Field Analyzer II, Central 24-2 SITA standard strategy: Carl Zeiss Meditec Inc., Dublin, USA), 다초점망막전위도검사(RETI scan, Roland Consult Instrument GmbH, Wiesbaden, Germany) 결과를 검토하여 HCQ 망막병증 유무를 평가할 수 있는 133명을 대상으로 하였다.
이 환자들의 HCQ 복용 기간 및 평균 하루 복용량, 복용 기간, 누적 복용량 및 단위 무게(kg)당 평균 하루 복용량, 단위 무게당 누적 복용량, 신기능저하(glomerular filtration rate <60 L/min per 1.75 m2) 유무 및 Tamoxifen 복용 여부를 확인하여 HCQ 망막병증 환자군과 정상군으로 나누어 비교하였다.
HCQ 망막병증의 진단은 자동시야검사에서 암점이 관찰되며, 스펙트럼영역 빛간섭단층촬영에서 그에 상응하는 외망막층, 망막색소상피세포층의 결손, 안저자가형광촬영에서 고형광 또는 저형광 병변이 관찰되는 경우에 진단하였으며, 다초점망막전위도검사를 보조적인 진단검사로 사용하였다.
HCQ 망막병증 환자군과 대조군 간의 비교 분석은 Fisher exact test와 Mann-Whitney U test를 이용하여 분석하였다. 또한 다변랑 회귀분석(multivariable logistic regression)을 이용하여 HCQ 망막병증의 위험인자를 분석하였다.
p-value가 0.05 미만인 경우 통계적으로 유의한 것으로 간주하였다. 통계분석은 SPSS ver. 17.0 software (SPSS Inc., Chicago, IL, USA)을 사용하였다. 모든 자료는 소수점 둘째 자리에서 내림하여 소수점 첫째 자리까지 표시하였다. 본 연구는 헬싱키선언을 준수하였으며 IRB의 승인(승인 번호: 2022-03-014)을 받았다.
결 과
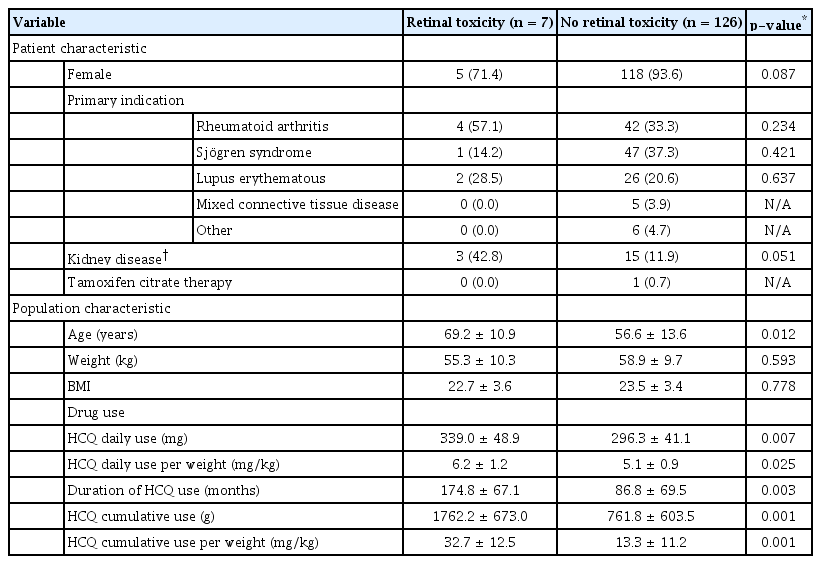
HCQ을 12개월 이상 복용 중인 안구건조증으로 안과에 내원한 133명 환자의 임상적 특징은 Table 1에 기술하였다. 환자는 총 123명의 여성과 10명의 남성이었으며, 기저 질환으로는 쇼그렌증후군이 가장 많았다(36.0%). 평균 나이는 57.3 ± 13.7세, HCQ 평균 하루 복용량은 298.5 ± 42.4 mg, 단위 무게당 평균 하루 복용량은 5.1 ± 1.0 mg/kg, 복용 기간은 91.4 ± 71.9개월, 누적 복용량은 814.4 ± 644.8 g, 단위 무게당 누적 복용량 14.3 ± 12.0 g였다.
전안부 외래 내원하여 첫 선별검사 시 HCQ 망막병증으로 진단된 환자는 133명 중 7명으로 유병률은 5.2%였다. Table 2에 진단된 환자 7명에 대한 HCQ 복용 특성 및 안과 검사 결과를 기술하였다. HCQ 망막병증 환자군과 정상군 사이에 임상적 특성을 Table 3에 비교하였다. 환자군과 정상군 사이에서 나이가 각각 69.2 ± 10.9세, 정상군 56.6 ± 13.6세(P=0.012), HCQ 평균 하루 복용량은 환자군 339.0 ± 48.9 mg, 정상군 296.3 ± 41.1 mg (P=0.007), 단위 무게당 평균 하루 복용량은 환자군 6.2 ± 1.2 mg/kg, 정상군 5.1 ± 0.9 mg/kg (P=0.025), 복용 기간은 환자군 174.8 ± 67.1개월, 정상군 86.8 ± 69.5개월(P=0.003), 누적 복용량은 환자군 1762.2 ± 673.0 g, 정상군 761.8 ± 603.5 g (P=0.001), 단위 무게당 누적 복용량 환자군 32.7 ± 12.5 g, 정상군 13.3 ± 11.2 g (P=0.001)로 통계적으로 유의한 차이를 보였다. 그 외 성별, 기저 류마티스 질환, 신기능저하 등 다른 변수는 두 군 사이에 유의한 차이를 보이지 않았다. P-value가 0.1 이하로 두 군 사이의 차이를 보인 성별, 신기능저하를 포함한 변수에 대하여 다변량 로지스틱 회귀분석을 시행하였고, 이를 Table 4에 기술하였다. 다변량 로지스틱 회귀분석 시 평균 하루 복용량(P=0.021)과 복용 기간(P=0.007)이 통계적으로 유의한 차이를 보인 위험인자였고, 단변량 분석 시 유의한 차이를 보였던 나이는 유의하지 않은 변수로 분석되었다. 신기능저하는 경계성의 유의한 차이를 보였다(P=0.055).
본 연구의 대표 증례를 보고하고자 한다. 평소 양안 건조감 및 이물감으로 1차 의료 기관에서 3년째 건성안 관련 진료를 보고 있던 66세 여환이 안구건조 증상 호전이 없어 내원하였다. 10년째 홍반성 루프스로 피부과에서 HCQ을 복용 중이었다. 그 외 특이 과거력 및 가족력은 없었고 내과 검사에서 신장의 기능은 정상이었다. 안과적 수술력 및 외상력은 없었다. 내원 당시 최대교정시력은 우안 20/50, 좌안 20/32였고, 세극등검사상 양안 점상 각막상피미란 및 경도의 백내장이 관찰되었다. 그 외 다른 전안부 특이 소견은 관찰되지 않았다. HCQ 망막병증의 선별검사로 시행한, 안저촬영검사상 황반 주변부 맥락막 혈관이 뚜렷하게 관찰되었다. 스펙트럼영역 빛간섭단층촬영에서 중심와부근부터 황반 외 영역까지 외망막층 결손과 소량의 낭성 망막내액이 보였고, 안저자가형광촬영상 중심와부근 과형광 병변과 황반 외 영역의 저형광 병변이 관찰되었다. 또한 24-2 자동시야검사에서 고리 모양의 암점이 관찰되었으며, 다초점망막전위도검사에서도 중심와에서부터 44도 영역까지의 양성파 진폭이 감소하여 있었다(Fig. 1). HCQ 망막병증 진단 하에 HCQ 복용 중단할 것을 피부과에 권고하여 복용을 중단하였다. 당시 평균 하루 복용량은 384.0 mg, 복용 기간은 225.9개월, 누적 복용량은 2602.3 g였다. 복용 중단 후 1년 뒤 검사에서 외망막층 결손과 고리 모양 암점 모두 진행되지 않고 유지되었다.
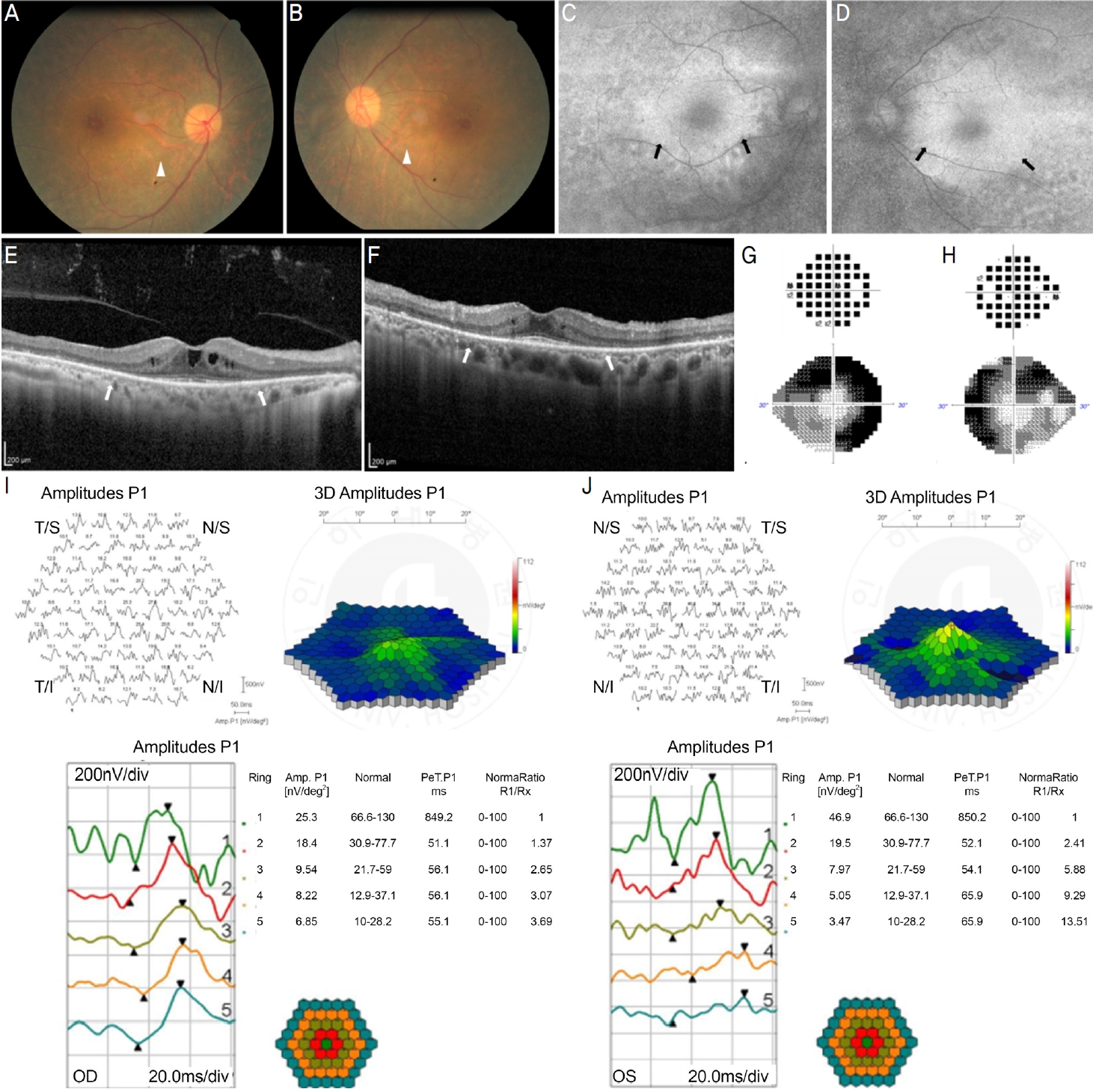
Findings of a 66-year-old woman showing hydroxychloroquine retinopathy. Prominent choroidal vasculature in fundus (white triangle) of right eye (A) and left eye (B). Autofluorescence fundus photography showing parafoveal hyperfluorescence (black arrow) and pericentral hypofluorescence of right eye (C) and left eye (D). Spectral-domain optical coherence tomography showing parafoveal and pericentral loss of outer segment (white arrow) with cystoid macular edema of right eye (E) and without macular edema of left eye (F). Complete ring scotoma in humphrey visual field test of right eye (G) and left eye (H). Decreased P1 amplitude on ring 1 to ring 5 in multifocal electroretinography of right eye (I) and left eye (J).OD = oculus dexter; OS = oculus sinister.
고 찰
본 연구에서 안구건조증으로 안과에 내원하였고, HCQ을 1년 이상 복용한 133명의 환자 중 7명이 망막병증으로 진단되었고, 유병률은 5.2%였다. 기존 문헌을 살펴보면, 5년 이상 HCQ을 복용한 2,361명의 환자를 대상으로 한 연구에서 HCQ 망막병증의 유병률은 7.5%였고,12 국내에서 3년 동안 218명을 대상으로 시행한 후향적 연구에서 유병률은 4.1%,13 또 다른 123명의 환자군을 대상으로 시행한 후향적 연구에서 유병률은 13.8%였다.14
미국안과학회에서 2016년 발표한 HCQ 망막병증 선별검사 가이드라인에 따르면, HCQ 망막병증 발생의 주요한 위험인자로 평균 하루 복용량이 5.0 mg/kg 초과, 5년 초과의 복용 기간, 신기능저하 및 Tamoxifen 복용력을 제시하였다.7 또 다른 연구에 의하면 하루 평균 800-1000 mg의 고용량을 복용한 환자의 25-40%에서 HCQ 망막병증의 징후가 복용 시작 2년 내에 관찰되었다는 보고도 있다.15,16 또한 복용 기간 또한 중요한 위험요인으로 제시되었는데 하루 5.0 mg/kg 이하로 복용한 환자들에게서도 10년 이상 복용을 한 환자군에서 위험도가 높아, 평균 하루 복용량과 복용 기간을 고려한 누적 복용량이 위험인자의 지표로 제시되었다.9 국내 한 연구에서도 마찬가지로 위험인자로서 평균 하루 복용량, 복용 기간 및 신기능저하를 제시하였고,14 또 다른 연구에서는 누적 복용량만을 위험인자로 제시하였다.13 본 연구에서는 HCQ의 평균 하루 복용량, 복용 기간, 누적 복용량과 더불어 단위 무게당 평균 하루 복용량, 단위 무게당 누적 복용량이 유의한 위험인자로 분석되었다. 나이의 경우 환자군과 정상군을 비교 시 통계적으로 유의한 차이가 있었지만, 다변량 로지스틱 회귀분석으로는 유의하지 않았다. 이는 고연령이 복용 기간 및 누적 복용량의 증가와 관련이 있었을 것으로 사료된다. 기존 국내 논문들의 HCQ 망막병증 환자군을 비교해보았을 때 Lee et al13에서 환자군의 평균 하루 복용량 4.2 ± 1.3 mg/kg, 평균 복용 기간 115.8 ± 30.8개월, 평균 누적 복용량은 991.9 ± 385.5 g, 유병률은 4.1%이고 Kim et al14에서 평균 하루 복용량 7.2 ± 1.2 mg/kg, 평균 복용 기간 182.4 ± 60.0개월, 누적 복용량은 1866.4 g (1458.2-2806.0), 유병률은 13.8%였으며 본 연구의 경우 평균 하루 복용량 6.2 ± 1.2, 평균 복용 기간 174.8 ± 67.1, 누적 복용량 1762.2 ± 673.0 g, 유병률 5.2%였다. HCQ 망막병증 선별검사가 아닌, 전안부 진료를 위해 내원한 환자들이라는 점에서 대상 환자군이 다소 차이가 있었지만, 공통적으로 위험인자로 제시하는 평균 하루 복용량, 복용 기간, 누적 복용량의 차이에 따라 유병률에도 차이가 있다고 해석할 수 있겠다.
HCQ 망막병증의 위치를 분석해 보았을 때, 본 연구에서는 황반 외 영역과 중심와부근 영역이 혼재되어 있는 혼합형이 가장 많았다(Table 2). 기저 질환군에 따른 차이는 보이지 않았으며, 평균 하루 복용량, 누적 복용량이 적고 복용 기간이 짧은 초기 발견 시 황반 외 영역이 많았고, 늦게 발견될수록 혼합형이 가장 많았다. 이는 기존 국내외 연구에서 아시안인의 초기 손상 위치는 혈관궁 근처의 황반 외 영역에 있다는 보고와 상응하는 내용이다.13,17 본 연구에서 망막병증 환자군의 영상검사들을 분석해 보았을 때, 외망막층의 손상 정도 및 위치에 따라 시야검사에서 상응하는 위치에 암점이 관찰되었으며, 망막병증이 진행될수록 고리 모양의 암점이 관찰되었다. 또한 안저자가형광촬영에서도 초기 시세포층의 손상을 의미하는 과형광에서 망막색소상피층의 손상을 의미하는 저형광으로 진행하는 양상이었으며, 다초점망막전위도검사에서도 외망막층이 손상된 영역에 한하여 양성파의 진폭이 감소하여 있었다.
이전 연구에서는 위험인자로 신기능저하 및 Tamoxifen 복용력이 포함되어 있었으나11 본 연구에서는 신기능저하는 경계성의 유의한 차이를 보였고, 다변량 로지스틱 회귀분석에서는 경계성의 위험인자에 해당했다. 하지만 Tamoxifen 복용력은 위험인자에 해당하지 않았다. 이는 이에 해당하는 연구 대상자 수 부족으로 결론을 내기에는 어려움이 있었다고 판단된다.
본 연구는 안구건조 증상을 주소로 전안부 외래에 내원하여 HCQ 망막병증 선별검사를 처음 시행받고, 진단받은 환자군들의 유병률과 위험인자를 분석한 연구이다. HCQ 복용자의 전수 조사가 아님에도 불구하고 진단 비율이 높았다는 점에서 전안부 의사들 또한 경각심을 가질 필요가 있다. 기저 류마티스 질환 중 루프스의 경우, 전신홍반성루프스 망막병증의 확인을 위해서 주기적인 안저검사를 시행하지만 쇼그렌증후군과 같은 다른 질환에서는 전안부 증상에만 진료 방향을 맞춰 진료를 하게 되면 타과 약물 복용력 및 안저평가를 간과하게 되는 경우가 많다. 하지만 쇼그렌증후군의 경우 근골격통증이 동반한 경우에도 HCQ가 1차 치료제로 사용되고 있으며,18 장기간의 치료를 요하는 질환이므로 HCQ 복용력을 간과할 수 없는 질환이다. 본 연구에서는 국내 외 다른 연구들에 비해 쇼그렌증후군 환자 비중이 높았고 국내 다른 연구들에서 보고되지 않은 쇼그렌증후군 환자 중 HCQ 망막병증이 진단된 환자도 포함되어 있다. 중심와에 침범하지 않는 한, 환자가 호소하는 시력 관련 증상이 없어 특별한 평가 없이 경과 관찰 중 진행한 뒤 시력저하가 저명한 상태로 망막 파트에 의뢰되는 경우가 많다. 따라서 전안부 진료 시 HCQ 복용력 확인 및 정기적인 선별검사를 통해 HCQ 조기 중단 필요성에 대한 인식 개선이 필요하다.
HCQ 망막병증의 치료를 위해서 선행된 연구들이 있다.3,19-21 HCQ은 약동학적으로 일부 간에 의해 대사체로 변형되며, 대부분 신장에서 체외로 배설되는데,19 ammonium chloride를 이용하여 소변을 산성화함으로써 배출을 유도하고, dimecaprol을 근육 주사를 통해 배출을 증가시키는 방법들이 선행 동물 연구를 통해 밝혀졌으나 실제 임상적인 효과는 입증하지 못하였다.20 즉각적인 약제 중단 외에 다른 입증된 치료법은 없으며, 중단 이후에도 망막병증은 지속될 수 있다. 중단 시기 관련하여 망막색소상피층의 결손이 오기 전 망막병증의 단계에 약을 중단할수록 망막병증의 진행이 감소한다는 보고가 있어,21 선별검사의 중요성이 강조되고 있다.
미국안과학회에서 2016년 개정되어 발표한 HCQ 망막병증 선별검사 가이드라인에 따르면, HCQ 복용 시작 후 1년 안에 안저검사를 포함한 기초검사를 시행하여 기존 망막조직 손상 여부를 확인한 후, 복용 5년 뒤부터 매년 선별검사를 권고한다. 평균 하루 복용량 5 mg/kg 초과 고용량 복용자, 신장질환 병력, Tamoxifen 복용 여부 등을 확인하여 선별검사 기간을 조정할 수 있다. 선별검사 목록으로는 자동시야검사와 스펙트럼영역 빛간섭단층촬영이 사용되고, 필요시 다초점망막전위도검사 또는 안저자가형광촬영이 권고된다. 또한 새로운 선별검사로 자동시야검사에 비해 특정 망막 영역에 해당하는 암점을 세밀하게 평가하는 microperimetry와 원추세포의 배열을 직접 촬영하여 원추세포의 손상 정도를 확인하는 adaptive optics retinal image가 소개되고 있다. 자동시야검사는 민감도가 높으며, 초기 상비측의 시야결손이 주로 관찰된다. 스펙트럼영역 빛간섭단층촬영의 경우 시세포층의 손상이 관찰되어 강력한 독성평가의 지표로 활용될 수 있다. 그 외 안저촬영, 시간영역 빛간섭단층촬영, 암슬러격자, 색각검사 및 눈전위도검사는 민감도가 낮아 선별검사로 권고되진 않는다.17
본 연구의 제한점으로는 연구 디자인이 후향적 기록 분석인 것에 따른 자료의 편향과 오류가 있을 수 있으며, 연구 대상자의 수가 부족하다는 점이다. 또한 HCQ 망막병증이 진단된 시점을 기준으로 누적 복용량과 평균 복용량을 계산하였는데, 첫 선별검사에서 진단된 경우, 실제 HCQ 망막병증의 발생시점 이후에도 복용한 약을 추가로 산정되기 때문에 분석에 편향이 발생할 수 있다. 기존 국내 연구들 모두 후향적 연구로 같은 제한점을 가지고 있으며, 추후 전향적 연구를 통해 정확한 유병률 및 위험인자 확인이 필요하다.
본 연구에서 전안부 진료에서 HCQ 망막병증 선별검사의 재검사 비율이 타 파트에 비해 높았다. 짧은 경과 관찰 주기와 안구건조감에 의한 불편감으로 지속적인 진료가 유지되는 점이 전안부 진료에서 HCQ 망막병증 선별검사의 재검사 비율이 높은 이유로 사료된다. HCQ 망막병증의 경우 병변이 망막에만 국한되어 선별검사가 망막파트에 의뢰되는 경우가 많으며, 전안부 진료 시 선별검사에 대한 중요성 및 효율성이 간과되는 경우가 많아 경각심을 강조한다는 점에서 본 연구의 의의를 둘 수 있다.
Acknowledgements
This work was supported by INHA UNIVERSITY Research Grant. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
민준기 / Joon Ki Mi
인하대학교 의과대학 안과학교실
Department of Ophthalmology, Inha University School of Medicine