뇌 자기공명영상에서 시신경교차의 조영증강을 보인 에탐부톨로 인한 독성시신경병증
Optic Chiasmal Enhancement Revealed by Magnetic Resonance Imaging in a Patient with Ethambutol-induced Toxic Optic Neuropathy
Article information
Abstract
목적
양이측반맹을 보인 에탐부톨로 인한 독성시신경병증 환자에서 시신경교차의 조영증강을 확인하였기에 이를 보고하고자 한다.
증례요약
53세 여자가 2달 전부터 서서히 진행된 양안 시력저하로 왔다. 폐결핵으로 10개월 동안 에탐부톨 800 mg 복용 중, 시력저하로 내원 1개월 전 약물을 중단하였다. Rifampicin 600 mg, clarithromycin 1,000 mg은 11개월간 매일 복용 중이었다. 교정시력은 우안 0.2, 좌안 0.1이었다. 양안 색각저하를 보였다. 시야검사에서 양이측반맹을 보였으며, 좌안 시야결손이 더 심하였다. 뇌 자기공명 영상에서 좌측이 더 심한 시신경교차의 조영증강을 확인하였고, 시야장애의 형태와 동일하게 좌측이 더 심하였다. 1달 뒤 경과 관찰에서 시력저하는 더 심해졌다. 3일간 고농도 스테로이드 정맥 주사 치료(methylprednisolone 1,000 mg)를 시행하였다. 경과 관찰 1년 후의 교정시력 우안 0.4, 좌안 0.1이었으며, 시야장애는 호전을 보였다.
결론
에탐부톨로 인한 독성시신경병증에서 양이측반맹이 나타날 수 있으며, 뇌 MRI를 통해 시야장애와 일치하는 시신경교차의 조영 증강을 확인할 수 있다.
Trans Abstract
Purpose
We report a bitemporal visual field defect accompanied by optic chiasmal enhancement in a patient with ethambutol (EMB)-induced toxic optic neuropathy.
Case summary
A 53-year-old woman presented with bilateral visual disturbance that had gradually worsened over the prior 2 months. She had been prescribed 800 mg EMB daily to treat pulmonary tuberculosis for the past 10 months but had stopped EMB 1 month prior because of visual disturbance. She had been prescribed 600 mg rifampicin and 1,000 mg clarithromycin daily for 11 months. Her visual acuity was 0.2 in the right eye and 0.1 in the left. Color vision was reduced. Automated perimetry demonstrated a bitemporal visual field defect, which was more severe in the left eye. Magnetic resonance imaging (MRI) of the optic chiasm revealed contrast enhancement in the body of the chiasm. The optic nerve of the left eye evidenced a higher signal intensity than did that of the right, consistent with the visual field test results. One month after her initial visit, the visual symptoms deteriorated further. We delivered high-dose, intravenous steroid pulse therapy (methylprednisolone 1,000 mg daily for 3 days). At the 1-year follow-up, the visual acuity was 0.4 in the right eye and 0.1 in the left.
Conclusions
Bitemporal hemianopia may develop in patients with EMB-induced toxic optic neuropathy. Enhancement of the optic chiasm, consistent with the visual field defect, could be observed in MRI.
에탐부톨(ethambutol)은 결핵 치료로 널리 사용되고 있으며, 합병증인 독성시신경병증(toxic optic neuropathy)의 발생이 잘 알려져 있다. 에탐부톨에 의한 독성시신경병증의 발생률은 1.2-1.5% 정도이며, 약물 중단 후에도 시력 및 시야장애가 영구히 남는 경우가 2/3 또는 그 이상으로 보고되고 있다[1,2]. 따라서, 결핵으로 약물 치료를 시작할 때, 환자에게 치료 중 주관적인 시력불편감이 발생하면 반드시 안과 진료를 받도록 설명하고 있다.
에탐부톨로 인한 독성시신경병증의 시야장애로 중심시야결손과 주시점맹점암점이 주로 발생하나, 드물게 양이측 반맹 시야결손이 보고되고 있다[3-5]. 양이측반맹은 시신경교차(optic chiasm)의 압박 병변, 대표적으로 뇌하수체종양에 의해 발생하는 것으로 알려져 있다. 에탐부톨로 인한 독성 시신경병증 환자에서 양이측반맹을 보이는 경우, 시야장애 부위와 일치하는 기능적 변화가 뇌 magnetic resonance imaging (MRI) 영상의 시신경교차 조영증강을 통해 확인된 증례가 해외에서 보고되었다[6,7].
그러나 국내에서는 아직까지 보고된 증례가 없었다. 이에 저자들은 양이측반맹으로 나타난 에탐부톨로 인한 독성 시신경병증에서 시신경교차의 조영증강을 확인한 증례를 경험하였기에 이를 보고하고자 한다.
증례보고
53세 여자가 2달 전부터 서서히 진행된 양안 시력저하로 왔다. 갑상선기능저하로 약물 복용 중이었고, 폐결핵으로 에탐부톨 800 mg (16 mg/kg)을 10개월 동안 복용하던 중 1달 전 시력저하로 중단하였다. 그 외 rifampicin 600 mg, clarithromycin 1,000 mg은 11개월간 매일 복용 중이었다. 안과 질환 및 안과 수술력은 없었고, 안통 및 두통은 없었다. 교정시력은 우안 0.2, 좌안 0.1이었으며, 동공반응검사에서 빛 및 근접반사 모두 이상은 없었다. 이시하라 색각검사(Ishihara’s test for color deficiency)에서 좌안이 더 심한 양안 색각저하를 보였다. 안구운동검사에서 이상은 없었다. 세극등현미경검사에서 경도의 핵백내장을 제외한 이상 소견은 없었다. 안저검사에서 시신경유두 및 시신경에 이상 소견은 없었다(Fig. 1A). 초진에서 optical coherence tomography (OCT)를 시행하지 못했다. 험프리자동시야검사(Humphrey field analyzer, Carl Zeiss Meditec, Dublin, CA, USA)에서 양이측반맹 소견을 보였으며, 좌안 시야결손이 더 심하였다(Fig. 1B). Aquaporin-4를 포함한 혈청학적 검사에 이상 소견 없었다. 체질량지수(body mass index, BMI)는 17.78 kg/m2였다. 혈액요소질소(blood urine nitrogen) 17 mg/dL (8-23 mg/dL) 및 혈청 크레아티닌(serum creatinine) 0.59 mg/dL (0.5-0.9 mg/dL)로 정상 범위 내였다. 뇌 MRI에서 시신경 교차의 조영증강을 확인하였으며, 좌측이 더 심했다(Fig. 2). 1달 뒤 경과 관찰에서 에탐부톨 중단은 2달 되었으나, 시력은 우안 0.3, 좌안 0.1로 주관적 불편감이 더 심해졌다. 결핵에 대한 약물 치료는 마친 상태였다. 환자와 상의 후, 입원하여 3일간 고농도 스테로이드 정맥 주사 치료(methylprednisolone 1,000 mg/day)를 시행하였다. 환자의 주관적인 시력저하는 호전을 보였다. 주사 치료 후 3개월째, 시야장애는 호전을 보였다(Fig. 3). 경과 관찰 1년 후의 교정시력 우안 0.4, 좌안 0.1이었다. 안저검사에서 좌안의 시신경유두 귀쪽 창백 소견을 보였으며, OCT (Carl Zeiss Meditec Inc.)에서 시야결손과 일치하는 양비측(binasal) 황반부 신경절세포층(macular ganglion cell complex)의 위축 소견을 보였다(Fig. 4).

Fundus photography of both eyes at the initial visit (A). Initial visual field test of both eyes. The visual field demonstrates bitemporal visual field defects, and it is more clearly visible in the left eye (B).
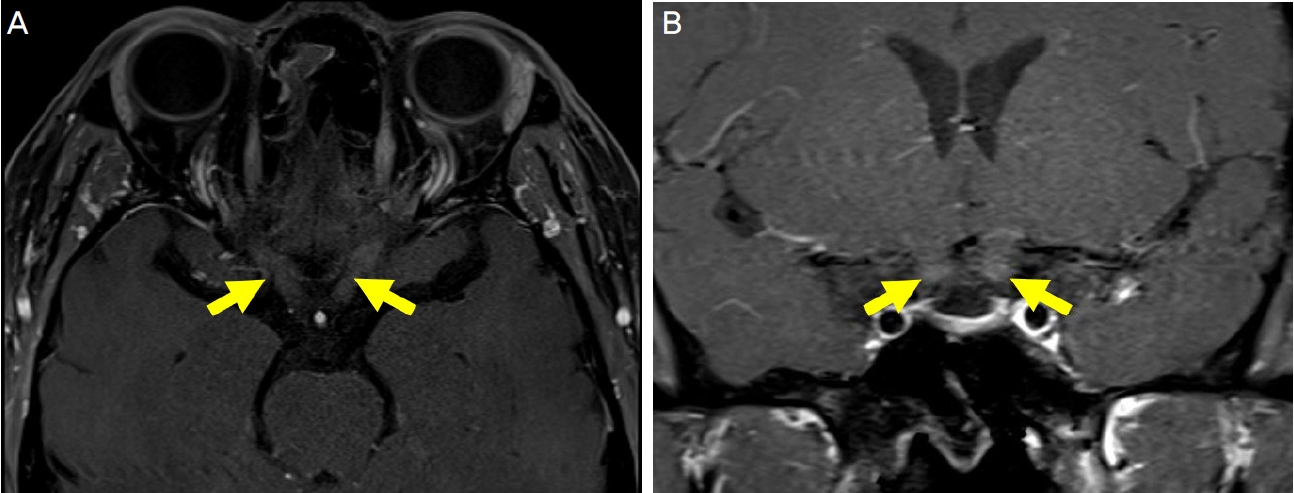
Magnetic resonance imaging (MRI) showing gadolinium contrast enhancement at the body of the optic chiasm (A: axial view, B: coronal view, arrows). The optic nerve of the left eye showed higher signal intensity compared with the right eye.
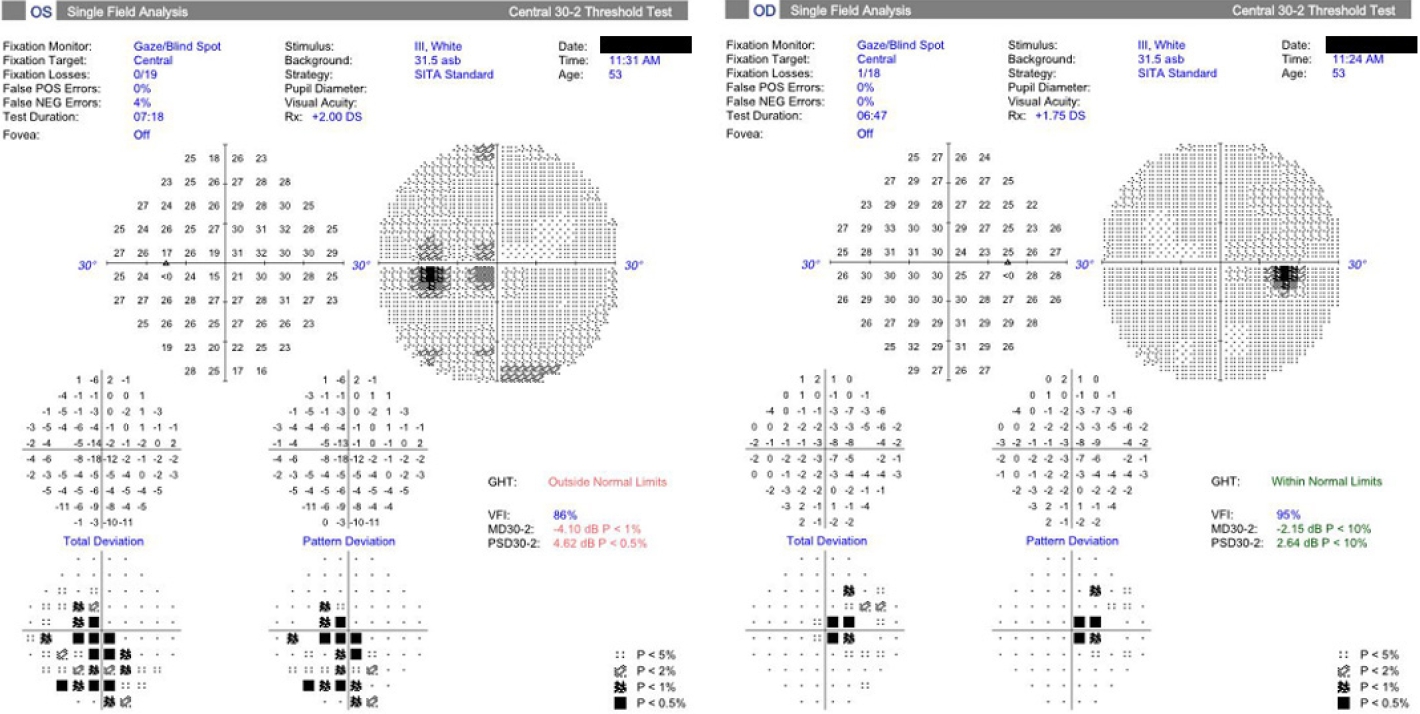
The visual field test at 3 months after high dose intravenous steroid pulse therapy. Visual field test showed nearly complete resolution of visual field defect compared to the initial test.

Fundus photography of both eyes at 1 year after high dose intravenous steroid pulse therapy. The optic disc of the left eye showed temporal pallor (A). There was binasal ganglion cell complex thinning on the optical coherence tomography (arrow). This was consistent with the direction of the visual field defect (B). OD = oculus dexter; OS = oculus sinister; GCL = ganglion cell layer; IPL = inner plexiform layer.
고 찰
이 증례에서 양이측반맹을 보인 에탐부톨로 인한 독성시신경병증에서 뇌 MRI를 통해 시야장애와 일치하는 구조 변화를 확인할 수 있었다.
에탐부톨로 인한 독성시신경병증은 시력저하, 시야장애, 색각장애 등의 다양한 임상 증상을 동반할 수 있다. 이전의 연구에서 에탐부톨 치료를 받은 환자 중 1.29% (62/4,803명)에서 독성시신경병증이 발생하였다[1]. 이들은 평균 16.06 mg/kg의 에탐부톨을 평균 5.9달 동안 복용하였다. 국내의 연구에서는 1.5% (13/857명)의 환자에서 독성시신경병증이 발생하였고, 이들은 평균 17.85 mg/kg/day의 에탐부톨을 평균 12.5달 복용하였다[2]. 이 중 시력저하(65.4%), 시야결손(65.4%), 색각이상(61.5%) 등이 가장 흔한 눈 증상이었다.
에탐부톨로 인한 독성시신경병증에서는 주로 중심암점 또는 주시점맹점 암점 등의 시야장애를 동반하나, 드물게 양이측반맹이 나타날 수 있다. 양이측반맹은 시신경교차의 압박 병변에 의해 발생하는 것으로 잘 알려져 있다[8]. 근래 영상 기술의 발전으로 양이측반맹이 생긴 독성시신경병증 환자에서 MRI를 통해 시야장애와 일치하는 시신경교차의 조영증강을 확인할 수 있었다. 이를 통해 시각경로(visual pathway)상 손상이 발생한 부위를 예측할 수 있다. 이전에 국내에서도 양이측반맹을 보이는 에탐부톨에 의한 독성시신경병증이 보고되었으나, MRI에서 시신경교차의 조영증강을 확인한 증례는 없었다[5].
에탐부톨은 축삭부종(axonal swelling), 탈수초(demyelinating), 신경아교세포 비대화(astrocytic hypertrophy)를 통해 신경에 변화를 일으킨다[9,10]. 결국 이는 미토콘드리아 기능장애(mitochondrial dysfunction) 및 신경절세포 기능장애(ganglion cell dysfunction)를 일으켜 혈액뇌장벽(blood brain barrier, BBB) 손상으로 이어지게 되고, 여기에 gadolinium 기반의 조영제가 침투되어 뇌 영상에서 조영증강이 발생하는 것이다[11]. 본 증례에서 시야결손과 조영증강은 모두 좌측에서 더 심하였고, 이는 시야검사에서 보인 기능적 변화와 뇌 MRI가 반영하는 구조적 변화가 일치함을 의미한다. 에탐부톨로 인한 독성시신경병증의 진단에서 뇌 영상검사보다 환자의 기저 질환, 약물복용력을 확인하는 것이 더 중요할 것이다. 하지만 시신경교차의 조영증강 소견을 통해 심한 손상의 발생을 알 수 있고, 이를 통해 약물 중단 후에도 눈 증상의 회복에 오랜 시간이 걸릴 수 있음을 예측하는 데 도움이 될 수 있다[12].
시야검사와 MRI뿐만 아니라 OCT에서도 시신경교차의 손상과 일치하는 시신경위축 소견을 확인할 수 있었다. 시신경교차의 압박 병변에 의해서 양비측의 황반부 신경절세포층의 손상이 생길 수 있다[13]. 이 증례에서도 시야는 회복되었으나 경과 관찰 1년의 OCT에서 양비측 시신경 손상을 확인할 수 있었다. 또한, 최근에는 에탐부톨로 인한 독성시신경병증에서 OCT뿐만 아니라 optical coherence tomography angiography (OCTA)도 중요한 진단 및 경과 관찰의 수단이 될 수 있다[14].
에탐부톨로 인한 독성시신경병증에서 2/3 또는 그 이상에서 약물 중단 후에도 시력 증상이 유지되거나 악화되는 것으로 알려져 있다[2]. 신장기능 부족, 흡연, 고령 등이 비가역적 시력손실의 위험인자로 알려져 있다[15]. 비록 이 환자에서 고농도 스테로이드 치료를 시행하였으나 독성시신경병증에서 스테로이드의 치료 효과에 대해서는 논란이 있을 것이다. 시신경교차의 조영증강을 보인 이전의 보고에서는 스테로이드 치료를 시행하지 않았다[6,7]. 본 증례에서 에탐부톨 중단 2개월 후에도 지속적으로 심한 시력저하 및 시야장애가 생겼고, 이로 인한 환자 불편감이 심하였다. 환자는 내과에서 결핵 치료를 마친 상태로 환자와 상의 후 스테로이드 치료를 시행하였다. 그러나 독성시신경병증에서 스테로이드 치료는 눈과 전신 상태를 모두 고려해야 하고, 모든 환자에서 치료 효과를 기대하기는 힘들 것이다. 독성시신경병증에서 스테로이드 치료의 효과를 명확하게 알기 위해서는 향후 이에 대한 추가 연구가 진행되어야 할 것이다.
결론적으로 에탐부톨로 인한 독성시신경병증에서 양이 측반맹이 발생할 수 있고, 뇌 MRI를 통해 시야장애와 일치 하는 시신경교차의 병변을 알 수 있었다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
임채원 / Chae Won Lim
영남대학교 의과대학 안과학교실
Department of Ophthalmology, Yeungnam University College of Medicine
