|
 |
| J Korean Ophthalmol Soc > Volume 63(6); 2022 > Article |
|
국문초록
목적
대비감도란 배경 또는 인접 사물로부터 특정 물체의 상대적 밝기 차이를 감지하는 기능(능력)으로 다양한 환경에서의 시기능을 평가할 수 있다. 제2형 과립각막이상증(granular corneal dystrophy type 2, GCD2)은 각막 기질의 혼탁으로 시기능의 저하를 일으킨다. 이에 본 저자들은 GCD2에서 치료레이저각막절제술(phototherapeutic keratectomy, PTK) 전후 대비감도를 비교하여, 치료 전후의 시기능을 비교하고자 하였다.
대상과 방법
22명의 GCD2 이형접합자를 대상으로, PTK 전과 후의 시력과 대비감도를 측정하였다. 대비감도는 야간(3 cd/m2)과 주간(85 cd/m2) 조도에서 눈부심 0, 1, 2단계(glare [G]; G0, G1, G2), 공간주파수 1.5, 3, 6, 12, 18 cycles per degrees (cpd)에 대하여 각각 검사하였다.
ABSTRACT
Purpose
Contrast sensitivity, the ability to distinguish the relative difference in luminance of an object from its surrounding or adjacent objects, is a useful measure of visual function. In granular corneal dystrophy type 2 (GCD2), opacity of the corneal stroma causes deterioration in visual function. We compared the contrast sensitivity of GCD2 patients before and after phototherapeutic keratectomy (PTK) to evaluate the perioperative visual function in these patients.
Methods
This study included 22 eyes of heterozygote GCD2 patients. The visual acuity and contrast sensitivity were measured before and after PTK. The contrast sensitivity was measured in mesopic and photopic background luminances, with glare (G) levels of 0-2 (G0, G1, and G2, respectively) and spatial frequencies at 1.5, 3, 6, 12, and 18 cycles per degree (cpd).
Results
The contrast sensitivity increased after PTK at 1.5 and 3 cpd in mesopic and photopic conditions with G0-2 glare (p < 0.05). At 6 cpd, the contrast sensitivity increased in the mesopic condition with G1 glare, and in the photopic condition with G0-2 glare (p < 0.05). However, there was no change in contrast sensitivity at any glare level at 12 and 18 cpd after PTK.
대비(contrast)란 특정 물체가 배경 또는 인접 사물로부터 지니는 상대적 밝기 차이를 말한다. 흰 바탕에 검은 글씨는 높은 대비를 갖는 반면, 흰 바탕에 회색 글씨는 낮은 대비를 보인다. 높은 대비를 지닌 시표는 알아보기 쉽고, 배경의 밝기와 거의 비슷한 명암을 가진 시표는 알아보기 힘들다. 한편 동일한 대비를 나타내는 시표라도 크기가 작아질수록 구분하기 어려워진다. 어떤 환자가 일정한 크기의 물체를 인식하기 위해 그 물체가 배경과 비교하여 지녀야 하는 최소한의 명암 차이를 그 환자의 “대비 역치(contrast threshold)”라고 정의하며, 이것의 역을 “대비감도(contrast sensitivity)”라고 정의한다[1,2].
한편, 특정 시각(visual angle) 안에 검고 밝은 선의 반복이 이루어지는 개수를 “공간주파수(spatial frequency)”라 한다. 즉 얇고 빽빽한 선들을 구분하는 것은 높은 공간주파수 영역에 해당하고, 굵은 선이 듬성듬성 있는 경우는 낮은 공간주파수 영역에 해당한다[1,3]. 시력(visual acuity) 측정에 사용되는 시력표는 높은 대비를 가진 기호를, 공간주파수를 점차 높여가며 시력을 측정하는 형태로서, 높은 대비 영역에서의 시기능만을 평가할 수 있다. 환자가 일상에서 마주하게 되는 환경은 다양한 크기와 대비를 보이는 물체들로 이루어져 있다. 그래서 익숙한 크기로 이루어진 도로에서 운전할 때도, 맑은 날과 흐린 날은 대비라는 관점에서는 전혀 다른 환경이 된다. 이를 감안한 결과, 다양한 대비와 다양한 공간주파수 영역에서 측정한 대비감도가 전체적인 시기능을 평가할 수 있는 지표로 알려져 있다[3-7]. 최근 들어 대비감도는 백내장, 건성안, 황반변성, 녹내장 등 다양한 질환군에서의 시기능 평가에서 사용되고 있다[4-6,8-13].
과거 아벨리노 각막이상증으로 불리기도 한 적이 있는 제 2형 과립각막이상증(Granular corneal dystrophy type 2, GCD2)은 침투율이 매우 높은 상염색체 우성질환이다. 국내에서는 동형접합자 수를 근거로 한 Hardy-Weinberg 공식에 따른 산출의 경우 이형접합자의 빈도가 1만 명당 11.5명[14], 일부 혈액원에 수집된 제대혈 전수검사에 의한 연구에서는 1만 명당 29.1명의 유병률[15]을 보이는 드물지 않은 질환이다. 각막에 과립형 침착물(granular deposit)과 격자형 침착물(lattice deposit or linear deposit)이 생기고, 후기에는 보우만층 바로 아래 광범위한 각막 실질 흐림(diffuse stromal haze)이 발생하며 시력이 감소하게 된다[16-18]. 시력 소실의 주요 원인은 후기에 발생하는 보다 얕은 층의 광범위 각막 실질 흐림으로, 이는 과립형과 격자형 침착물보다 얕은 층에 생기는 특징이 있다[19,20]. 따라서 GCD2 환자에서 시력이 저하되었을 때, 치료레이저각막절제술(phototherapeutic keratectomy, PTK)을 시행하여 각막 실질 흐림을 제거하는 것이 현재 사용되는 방법이다[21-26].
PTK를 통한 시력 향상은 현재까지 입증되어 왔지만[23,25-27], 대비감도에 있어서는 아직 연구가 없었다. 이에 본 연구는 GCD2 환자에서 대비감도를 측정하여 종합적인 시기능에 대한 평가를 하고, PTK 전과 후의 대비감도를 비교하여 시기능에 있어 PTK의 효과에 대해 알아보고자 하였다.
본 연구는 2021년 4월부터 2021년 9월까지 본원에서 PTK를 시행받은 GCD2 환자 22명의 22안을 대상으로 후향적 분석을 하였다. 본 연구는 임상연구심의위원회(Institutional Review Board)의 승인에 따라 진행되었다(승인 번호: 202201-002-01). 유전자 검사로 확진된 GCD2 이형접합자를 대상으로 하였다. 과거 PTK 후 재발하여 재수술을 받는 2안을 포함하였으며, PTK 이전에 이미 백내장수술을 받은 2안도 PTK 전후의 대비감도 비교에 영향을 미치지 않는 경우이므로 포함시켰다. 심한 핵백내장(Lens opacity classification system, LOCS N4)과 후낭하백내장이 있는 경우는 백내장에 의한 대비감도 저하가 전체 대비감도에 미치는 영향이 너무 크다고 생각되어 대상에서 제외하였다[3,9].
PTK는 숙련된 1명의 술자(E.K.K.)에 의해 시행되었다. 수술 전 세극등현미경으로 병변의 범위를 촬영하였다. Proparacine 0.5% (Paracaine®; Hanmi, Seoul, Korea) 점안액을 3회 투여한 후 개검기를 삽입하고 주걱을 이용하여 각막 상피를 기계적으로 벗겨냈다. 엑시머레이저(WaveLight® EX500; Alcon, Fort Worth, TX, USA)의 방사선 조사 강도는 160 mJ/cm2였다. 시축을 중심으로 직경 6.0 mm 범위에 10 Hz의 파장으로 레이저를 조사하였다. 첫 번째 레이저 조사는 20-30 μm 깊이로 절제하였고, 절제 후 환자를 세극등 현미경으로 관찰하여 추가 레이저 여부를 결정하였다. 추가 레이저 조사는 매번 5-10 μm 깊이로 시행하였으며, 경우에 따라 여러 번 반복하였다[23]. 추가 절제 정도는 매번 절제 시마다 직전의 잔여 혼탁 정도를 세극등현미경으로 관찰하여 결정함으로써, 과도한 절제를 예방하였다. 매 10 μm 절제 시마다 preservative-free carboxymethylcellulose sodium 0.5% (Refresh Plus®; Allergan, Irvine, CA, USA)를 도포하여 절제 표면의 불규칙성을 줄이도록 지속적으로 노력하였다. 광범위한 각막 실질의 흐림이 제거될 때까지 절제를 진행하였다. 단, 깊숙이 위치한 과립형과 격자형의 각막침착물은 남겨두었다[20,23-25]. 본 연구에서 사용된 엑시머레이저 기기는 PTK 소프트웨어의 구성상 주변부의 절제량이 중심부의 절제량보다 많아 술 후 근시가 유발되는 특징이 있어, 근시화를 막기 위해 적은 양의 굴절교정레이저각막절제술(photorefractive keratectomy, PRK)이 필요하였다. 따라서 과도한 근시화가 유발될 것으로 예상되는 12안에서는 PTK와 함께 PRK를 추가적으로 시행하였다. 이때 수행된 PRK의 깊이는 매우 작았고(3.5-9.7 μm), PTK 깊이에 포함하여 표시하였다. 수술 후 자가혈청안약과 Ofloxacin 0.3% (Tarivid® ointment, Taejoon, Seoul, Korea)를 점안한 후 압박 안대를 착용케 하였다. 수술 후 1일째부터 3일째까지는 하루 1회 자가혈청안약, Ofloxacin 0.3% (Taejoon, Seoul, Korea), dexamethasone, neomycin sulfate, polymyxin B sulfate 혼합 연고(Forus® ointment; Samil, Seoul, Korea)를 점안하도록 하였고, 압박 안대는 4일째부터 제거하였다. 수술 후 4일째부터는 moxifloxacin 0.5% (Vigamox®; Novartis, Seoul, Korea), fluorometholone 0.1% (Flumetholone® 0.1%; Taejoon, Seoul, Korea)을 하루 4회씩 4주간 투여, 그 후에는 3회씩 4주, 2회씩 4주, 1회씩 4주를 원칙으로 줄여 나갔다. 자가혈청안약은 각막 상피의 원활한 회복을 돕고자 사용하였다.
대비감도는 수술 전과 후에 OPTEC 6500® (Stereo Optic Co, Inc., Chicago, IL, USA)을 이용하여 측정하였다. 검사기기는 연구 직전에 관리 업체로부터의 정도 관리상 보증된 기기를 사용하였으며, 정상인을 상대로 점검한 결과 이상이 없는 것으로 나타났다. 검사기기에 기본으로 설정된 총 6가지 상황을 이용하여 측정하였다. 배경 조도는 주간 시(photopic condition, 85 cd/m²)와 야간 시(mesopic condition, 3 cd/m²) 상황으로 나누어 설정하였고, 각각에 대해 눈부심(glare) 단계를 3가지로 눈부심 없음(no glare, G0), 눈부심 1단계(glare level 1, G1), 눈부심 2단계(glare level 2, G2)로 설정하였다. 눈부심이란 시 대상물 주변에 추가적인 광원에 의한 빛으로, 빛의 산란을 유발하는데, OPTEC 6500®에서는 시표가 있는 중심부 주변에 LED 등을 둘러 이 등의 밝기를 조절함으로써 눈부심 정도를 조절하였다. 이를 종합하여 본 연구는 주간 시와 야간 시 조도에 각각 눈부심의 3단계를 설정하여 총 6가지 단계에서 대비감도를 측정하였다. 또한 각각의 단계에서, 1.5, 3, 6, 12, 18 cycles per degree (cpd)의 공간주파수에 대해 최대교정시력을 보이는 안경을 착용하게 한 후 대비감도를 측정하였다.
대비감도를 측정한 후 통계적으로 용이한 처리를 위해 밑이 10인 로그로 변환하여 표시하였는데, 결국 log contrast sensitivity (log CS)가 1인 환자의 대비역치는 log CS가 2인 환자의 대비역치의 10배가 된다. 또한 area under the log contrast sensitivity function (AULCSF)을 계산하였는데, log로 변환한 공간주파수를 x축으로, log로 변환한 대비감도 값을 y축으로 두는 그래프를 그리고, 대비감도의 값을 3차 방정식화하여 그 아래의 면적을 구한 값이며 그 방식은 Applegate et al [28]을 참고하였다. 또한, 수술 전과 후에 4 m 거리의 진용한시력표를 이용하여 최대교정시력을 측정하여 logarithm of minimal angle of resolution (logMAR)으로 환산하였다. 자료분석은 SPSS statistics ver. 17.0(SPSS Inc., Chicago, IL, USA)를 사용하였고, Wilcoxon-signed rank test로 치료 전후 변화를 비교하였다. Kruskal-Wallis test로 세 단계의 눈부심 환경에서 AULCSF의 차이가 있는지 검정한 후, 사후 분석은 Mann-Whiteny test를 이용하였다. Wilcoxon-signed rank test와 Kruskal-Wallis test는 p값이 0.05 미만인 경우, Mann-Whiteny test의 경우 Bonferroni’s method를 적용하여 p값이 0.017 미만인 경우 통계적으로 유의하다고 정의하였다.
더불어, 시력 향상이 크지 않은 환자군을 따로 모아 AULCSF에 대한 추가 분석을 시행하였다. Jung et al [23]의 연구에서 본 연구와 동일한 술자가 GCD2 환자의 43안을 대상으로 시행하였던 PTK 결과, 평균 약 0.218 logMAR의 시력 향상이 있었던 바, 본 연구에서 0.218 logMAR 이하의 시력 향상을 보인 12안을 시력 향상이 적었던 군으로 설정하여 치료 전후의 AULCSF 변화를 Wilcoxon-signed rank test로 비교하였다.
PTK 수술을 받은 GCD2 이형접합자 22명의 22안을 대상으로 하였다. 참여 환자들의 연령은 평균 67.68 ± 7.97세였으며, 남성이 8명, 여성이 14명이었다. 평균 추적 관찰 기간, 즉 PTK 후 대비감도 검사를 시행하기까지의 기간은 평균 38 ± 28일로 1주부터 4개월까지 다양하였다. 본 연구진은 PTK 후 재발은 통상 32-38개월 후에 관찰되는 것을 고려하여, PTK 후 1주-4개월 내에 수행한 시력 및 대비감도는 각막 투명도에 있어 영향을 받지 않았다고 판단하고 자료를 수집하였다[29,30]. PTK 수행 시 절제의 깊이는 평균 66.61 ± 13.27 μm였고, 22안 중 13안에 대하여 PRK를 동시에 시행하였다(3.5-9.7 μm, 평균 7.97 μm). 수술 전 최대교정시력은 0.48 ± 0.18 logMAR였으며, 수술 후 최대교정시력은 0.27 ± 0.10 logMAR로 수술 전과 후에 통계적으로 유의한 시력의 호전을 보였다(p<0.0001) (Table 1).
Table 2와 Table 3은 각각 야간 시와 주간 시 배경조도 상황 하에 GCD2 환자에서 PTK 수행 전과 후의 대비감도를 비교한 표이다. 야간 시 조도 하, 모든 눈부심 단계(G0, G1, G2)에서 1.5 cpd와 3 cpd의 낮은 공간주파수 영역의 대비감도가 통계적으로 유의하게 향상되었다(G0: 1.5 cpd, p<0.000; 3 cpd, p<0.002; G1: 1.5 cpd, p<0.000; 3 cpd, p<0.002; G2: 1.5 cpd, p<0.003; 3 cpd, p<0.007; by Wilcoxon-signed rank test). 또한, 눈부심 1단계(G1)에서는 6 cpd의 중간 공간주파수 영역에서도 대비감도의 통계적으로 유의한 증가를 확인하였다(p<0.039). 주간 시 조도 하, 모든 눈부심 단계에서 1.5 cpd, 3 cpd의 낮은 공간주파수 영역과 6 cpd의 중간 공간주파수 영역에서 대비감도가 향상되었다(G0: 1.5 cpd, p<0.000; 3 cpd, p<0.001; 6 cpd, p<0.003; G1: 1.5 cpd, p<0.000; 3 cpd, p<0.001; 6 cpd, p<0.032; G2: 1.5 cpd, p<0.000; 3 cpd, p<0.000; 6 cpd, p<0.003; by Wilcoxon-signed rank test). 다만 모든 상황에서 12 cpd와 18 cpd에서는 수술 후 대비감도가 향상되지 않았다(Fig. 1).
눈부심 정도에 따른 대비감도를 비교하였을 때, PTK 수술 전, 야간 시와 주간 시 배경조도 상황에서 G0, G1, G2의 세 그룹의 AULCSF 사이에 유의한 차이가 있었고(야간 시 p<0.000, 주간 시 p<0.000 by Kruskal-Wallis test), Mann- Whitney test를 이용한 사후 분석에서 G1과 G2, 그리고 G0와 G2 사이에 유의한 차이가 있었다(야간 시 G1 & G2 p<0.000, 야간 시 G0 & G2 p<0.000, 주간 시 G1 & G2 p<0.000, 주간 시 G0 & G2 p<0.000) (Table 4). PTK 수술 후에는, 야간 시 배경조도에서는 G0, G1, G2 세 그룹의 AULCSF 사이에 유의한 차이가 있었지만(p<0.001), 주간 시 배경조도에서는 세 그룹 간 유의한 차이가 없었다(p=0.272). PTK 수술 후, 야간 시 배경조도 상황에서 사후 분석 결과, G1과 G2, 그리고 G0과 G2 사이에 통계적으로 유의한 차이가 있었다(G1 & G2, p<0.001; G0 & G2, p<0.002) (Table 5).
시력 향상이 0.218 logMAR 이하로 적었던 12안에 대한 추가 분석 결과, 수술 전 시력은 0.35 ± 0.09 logMAR, 수술 후 시력은 0.27 ± 0.10 logMAR였으며 시력 변화량은 평균 0.08 ± 0.08 logMAR였다. 시력 향상은 적었던 반면, AULCSF는 야간 시와 주간 시, 모든 눈부심 단계에서 통계적으로 유의하게 상승하였다(야간 시 G0 p<0.047, G1 p<0.047, G2 p<0.028; 주간 시 G0 p<0.017, G1 p<0.037, G2 p<0.008) (Table 6).
본 연구 결과 수술 전 최대교정시력은 0.48 ± 0.18 logMAR, 수술 후 최대교정시력은 0.27 ± 0.10 logMAR로 다른 연구들과[23,25-27] 마찬가지로 수술 전과 후에 통계적으로 유의한 시력의 호전을 보였다(p<0.0001). 본 연구는 현재까지 보고된 바가 없는, GCD2 환자의 대비감도를 평가하고, PTK 수술 전과 후를 비교하여 시기능에 있어서의 PTK의 효과를 알아보고자 하였다. 현 연구에서, GCD2 환자에서의 PTK 수술 전 대비감도는 AULCSF로 치환하였을 때 야간 시 0.234, 주간 시 0.327로, 이전 연구31에서 알려진 정상치(야간 시 1.34, 주간 시 1.53)에 비해 현저하게 저하되어 있었으며, 특히 눈부심 정도가 강할 때(G2) 저하되어 있었다(Fig. 1). 또한, PTK 수술 후 대비감도는 AULCSF로 치환하였을 때 야간 시 0.548, 0.885로 정상치에 비하여 낮지만 수술 전보다 크게 향상됨을 확인하였다. 본 연구에서는 대비감도검사 시, 시표의 주변부에 10개의 LED 광원을 둘러, LED 전구의 밝기를 조절하여 눈부심을 유발하였다. 그 결과 수술 전, 주간 조도와 야간 조도 환경하에서, 그리고 수술 후에는 야간 조도 하에서, 눈부심 0단계나 눈부심 1단계보다, 눈부심 2단계에서 대비감도가 저하됨을 확인하였다.
눈부심은 시선 방향의 주변에 위치한, 지나치게 밝은 광원에 의해 시력이 저해되는 현상을 의미한다. 불필요한 밝은 빛은 안구 내에서 산란되는데, 산란된 빛이 망막 앞에 커튼처럼 드리워진다 하여 이를 “광막 휘도(veiling luminance)” 라고 부르며, 결과적으로 망막에 맺히는 상의 대비를 감소시킨다. 또한, 보고자 하는 시 대상물과 산란을 유발하는 광원이 인접할수록 대비감도의 감소가 더욱 심화된다고 보고되고 있다[32-35]. Paulsson and Sjöstrand [36]은 안구 내 매체의 어떤 불규칙성이라도 대비감도의 감소를 초래할 수 있다고 하였고, 각막 부종 없이 구타타만 있는 초기 푹스각막이상증에서 대비감도의 손실이 관찰되었으며[8,37], Oie et al [38]은 푹스각막이상증에서 대비감도 손실의 원인이 구타타에 의한 빛의 산란 때문이라고 설명하였다. Koh et al [13]은 표층점상각막염이 동반된 건성안 환자에서 20/20의 좋은 시력에도 불구하고 대비감도가 저하되는 것을 보고하며 불안정한 눈물막으로 인해 불규칙해진 안구 표면이 그 원인이라고 하였다. Koh et al [39]은 체내 리소좀에 sphingolipid가 축적되는 성염색체 유전질환인 Fabry 병에서의 대비감도 저하에 대해서도 발표하였는데, Fabry 병의 주요 증상인 corneal verticillate는 시력과는 무관하다고 알려져 있지만, 각막의 투명도에 영향을 미쳐 빛의 산란을 증가시키고 대비감도를 떨어뜨린다고 설명하였다. GCD2에서 대비감도가 저하되는 원인은 아직 밝혀진 바가 없지만, 상기 질환에 관한 참고문헌을 고려하면, 각막의 혼탁에 의해 망막에 맺히는 빛이 산란되기 때문일 가능성이 높다고 생각되고, PTK 후에 광범위 실질 흐림이 제거되면서 대비감도가 향상되는 것으로 여겨진다. 또한, 일부 예시에서 PTK 전후 시력 변화가 적은 것은 수술 전 혼탁 사이의 작은 투명공간이 제공하는 바늘구멍 효과(pinhole effect)로 인하여 수술 전 시력이 극대화되었기 때문으로 생각된다.
Ginsburg [3]는 백내장에서 수정체의 혼탁이 빛의 산란을 일으켜 대비감도가 떨어진다고 설명하며, 백내장 환자들이 눈부신 햇빛 아래에서나 야간의 헤드라이트 불빛에 의해 심한 눈부심 증상을 느끼는 것도 빛의 산란과 연관이 있다고 하였다. 한편 백내장 혼탁이 심할수록 눈부심에 의한 대 비감도 저하가 증가함을 보고한 바가 있으며[33,40], 이는 빛의 진행 상 매체의 혼탁이 존재할 경우, 빛의 산란이 촉진되어 눈부심에 의한 시기능 저하가 더욱 심화되는 것으로 설명된다. 본 연구에서는 동일한 안구에서 수개월 내에 PTK 전후의 대비감도만을 비교하였기 때문에, PTK 전 GCD2에서 각막의 혼탁으로 인한 대비감도 저하와 각막혼탁을 제거한 후 PTK의 대비감도 향상 효과를 관찰할 수 있었다.
본 연구에서, GCD2 환자에서 PTK에 의해 주간 시와 야 간 시의 대비감도가 모두 크게 증가되었으며, 특히 비교적 큰 물체를 인식하는 것에 속하는 낮은 공간주파수와 중간 공간주파수 영역에서 대비감도 개선의 효과가 뚜렷함을 확 인하였다. 작고 세밀한 물체를 구분하는 능력을 대변하는 높 은 공간주파수 영역에서의 대비감도는 PTK 전후로 차이가 없었다. 20/20의 시력은 30 cpd, 20/40의 시력은 약 15 cpd, 20/600의 시력은 1 cpd에 상응하는데,41,42 본 연구에서 PTK 후 시력이 0.27 logMAR (약 20/37)이기 때문에 높은 공간주 파수 영역의 대비감도 검사에 제한이 있었을 것이라 예측할 수 있다. 20/20을 보는 환자의 시력은 높은 공간주파수 영역 에서의 시기능만을 대변하며, 20/20보다 크기는 크지만, 대 비는 낮은 실세계의 물체를 보는 능력은 시력만으로는 측정 하기가 어렵다고 보고되고 있다.1,43 즉, 기존 여러 연구에서 저-중등도의 공간주파수인 3-6 cpd 사이의 공간주파수 영역 에 대비감도의 정점(peak)이 존재한다는 것이 밝혀졌고, 이 런 영역의 대비감도가 일상생활을 영위하는 데 필요한 시 기능(움직임 감지, 운전이나 보행 중의 물체 식별 등)을 가 장 잘 예측할 수 있다고 알려져 있다.1,7,9,44-46 본 연구진은 GCD2 환자에서 PTK를 통해 시력의 향상과, 저-중등도 공 간주파수 영역의 대비감도의 향상 두 가지를 모두 확인하였 으며, 시력 향상이 크지 않은 경우에도 대비감도는 개선된다 는 것을 확인하였다. 이를 통해 PTK가 시력검사만으로는 미처 평가하지 못하는 종합적인 시기능의 향상을 가져온다 는 것을 관찰하게 되었다.
GCD2 이형접합자에서, 질환의 초기에 생기는 과립형과 격자형의 침착물은 그 사이에 투명한 공간이 있어 비교적 시력이 유지되지만, 후기에는 과립형과 격자형의 침착물 사이에 각막 실질 흐림이 발생하여 본격적인 시력저하가 초래된다[20,23]. 반면 GCD2에서 각막의 혼탁은 PTK 후에 재발하며, GCD2 이형접합자에서 PTK 후 재발까지의 기간은 연구에 따라 32개월[29], 38.4개월[30] 등으로 보고되었다. PTK 후 잔여 각막이 얇아지는 상황과 재발로 인한 PTK의 반복 필요성을 고려하면, 가능하면 생애에서 늦은 시기에 PTK를 시행하는 것이 바람직하다고 생각된다[25,26,29,30,47]. 이에 따라 본 연구에서 PTK를 받은 환자의 평균 연령은 67.88세 였으며, 기존 PRK, 라식, 라섹 등 레이저를 이용한 굴절 수술로 중심 각막의 혼탁이 심한 경우이거나, 기존 수술 없이도 각막혼탁이 심하여 일상생활에 지장이 많은 일부 환자의 경우는 각막 이식을 연기하기 위하여 40대 후반부터 PTK를 시행하였다[48].
본 연구의 제한점으로는 수술 후 관찰 기간이 일정하지 않고 최대 4개월로 짧다는 것이다. 원거리에서 방문하는 환자의 특성상 술 후 검사 시까지의 기간이 다양하였으나, GCD2 이형접합자의 PTK 후 혼탁의 재발은 약 3년 후 시작된다는 것을 고려할 때[29,30], 결과를 도출하는 것에는 문제가 없었다. 또한, Watanabe et al [49]은 푹스각막이상증에서 구타타의 넓이가 클수록 대비감도가 감소함을 보고하였다. 본 연구는 동공 내에 각막혼탁이 진행되어 PTK가 필요한 GCD2 환자들의 대비감도를 측정하였는데, 동공 내의 각막 혼탁에 있어 그 크기나 위치 변화에 따른 대비감도의 차이는 측정하지 못했다는 제한점이 있다. 더불어, 동공의 크기가 대비감도에 영향을 미치는 보고에서는 작은 동공은 회절에 의해, 큰 동공은 구면 수차의 증가에 의해 대비감도가 저하될 수 있다고 언급되고 있으나[50], 본 연구에서는 환자의 동공 크기를 따로 측정하지는 않았다. 다만 본 연구에 사용된 OPTEC 6500®은 검사 시 외부의 빛이 거의 차단될 정도로 이마를 기계 안으로 넣어야 진행이 가능한 검사기기로, 모든 검사 시 주변의 조도는 거의 일정하였다고 볼 수 있다. 마지막으로, 환자의 주관적인 만족도를 설문지 등의 항목을 통해 평가하지 않은 것이 제한점이 될 것이다. 하지만 본 연구는 GCD2 환자의 PTK 전후 대비감도를 객관적인 방법으로 최초로 조사하였다는 의의가 있으며 공간주파수와 배경 조도, 눈부심 정도를 세분하여 상황별로 세밀한 대비감도를 평가하였다는 장점이 있다고 생각한다.
결론적으로, 제2형 과립각막이상증 환자에서 정상인에 비해 대비감도가 저하되어 있었으며, 유발된 눈부심 정도가 심할 때 대비감도 손실의 정도가 심하였다. 치료레이저 각막절제술을 통해 대비감도가 크게 향상되었으며, 특히 저-중등도의 공간주파수 영역에서 그 효과가 뚜렷하였다. 더불어, 시력 향상이 크지 않았던 환자들에서도 대비감도가 향상됨을 확인하였다. 즉, 제2형 과립각막이상증 환자에서 대비감도검사를 통해 환자의 시기능이 저하된 것을 측정하였고, 치료레이저각막절제술로 재발 전까지의 시기능을 향상시킬 수 있음을 관찰하였다.
Figure 1.
Contrast sensitivity comparison between before and after phototherapeutic keratectomy in granular corneal dystrophy type 2. Blue line means preoperative values and red line means postoperative values. cpd = cycles per degrees.
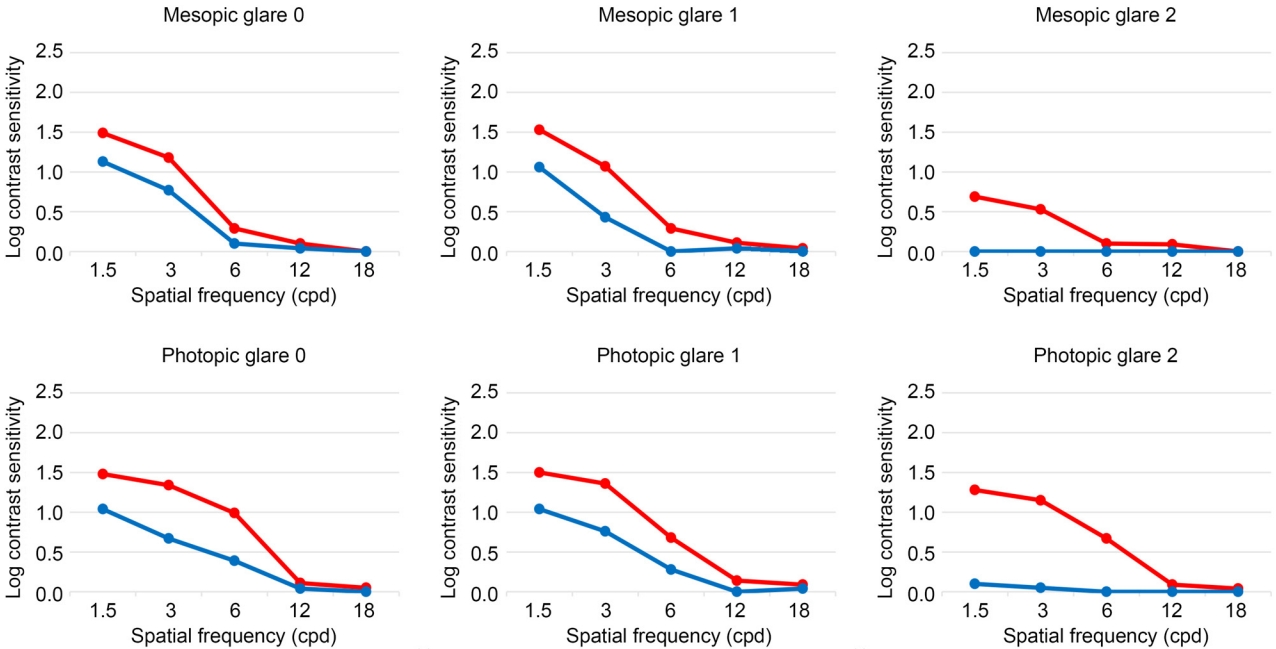
Table 1.
Demographic and clinical data of 22 eyes
Table 2.
Comparison of log contrast sensitivity under mesopic condition, between preoperative versus postoperative phototherapeutic keratectomy
| Spatial frequency (cpd) | Pre-PTK | Post-PTK | p-value* |
|---|---|---|---|
| No glare (G0) | |||
| 1.5 | 1.13 ± 0.47 | 1.49 ± 0.24 | 0.001 |
| 3 | 0.77 ± 0.54 | 1.18 ± 0.50 | 0.002 |
| 6 | 0.10 ± 0.33 | 0.29 ± 0.55 | 0.074 |
| 12 | 0.04 ± 0.21 | 0.10 ± 0.33 | 0.655 |
| 18 | 0 | 0 | 1.000 |
| Glare 1 (G1) | |||
| 1.5 | 1.06 ± 0.45 | 1.53 ± 0.23 | 0.000 |
| 3 | 0.43 ± 0.52 | 1.07 ± 0.60 | 0.002 |
| 6 | 0 | 0.29 ± 0.54 | 0.039 |
| 12 | 0.04 ± 0.18 | 0.11 ± 0.35 | 0.285 |
| 18 | 0 | 0.04 ± 0.16 | 0.317 |
| Glare 2 (G2) | |||
| 1.5 | 0 | 0.69 ± 0.71 | 0.003 |
| 3 | 0 | 0.53 ± 0.65 | 0.007 |
| 6 | 0 | 0.10 ± 0.33 | 0.180 |
| 12 | 0 | 0.09 ± 0.28 | 0.180 |
| 18 | 0 | 0 | 1.000 |
Table 3.
Comparison of log contrast sensitivity under photopic condition, between preoperative versus postoperative phototherapeutic keratectomy
| Spatial frequency (cpd) | Pre-PTK | Post-PTK | p-value* |
|---|---|---|---|
| No glare (G0) | |||
| 1.5 | 1.04 ± 0.44 | 1.48 ± 0.26 | 0.000 |
| 3 | 0.67 ± 0.63 | 1.34 ± 0.38 | 0.001 |
| 6 | 0.39 ± 0.57 | 0.99 ± 0.70 | 0.003 |
| 12 | 0.04 ± 0.19 | 0.11 ± 0.36 | 0.285 |
| 18 | 0 | 0.05 ± 0.17 | 0.157 |
| Glare 1 (G1) | |||
| 1.5 | 1.04 ± 0.45 | 1.50 ± 0.22 | 0.000 |
| 3 | 0.76 ± 0.54 | 1.36 ± 0.37 | 0.001 |
| 6 | 0.28 ± 0.52 | 0.68 ± 0.70 | 0.032 |
| 12 | 0 | 0.14 ± 0.34 | 0.102 |
| 18 | 0.04 ± 0.16 | 0.09 ± 0.23 | 0.577 |
| Glare 2 (G2) | |||
| 1.5 | 0.10 ± 0.31 | 1.28 ± 0.53 | 0.000 |
| 3 | 0.05 ± 0.24 | 1.15 ± 0.57 | 0.000 |
| 6 | 0 | 0.67 ± 0.69 | 0.003 |
| 12 | 0 | 0.09 ± 0.30 | 0.180 |
| 18 | 0 | 0.04 ± 0.19 | 0.317 |
Table 4.
Comparison of the average of AULCSF under mesopic and photopic condition, at G0, G1, and G2 in pre-operative patients
| G0 (AUCSF) | G1 (AUCSF) | G2 (AUCSF) | p-value* | p-value† (G0 vs. G1) | p-value† (G1 vs. G2) | p-value† (G0 vs. G2) | |
|---|---|---|---|---|---|---|---|
| Mesopic | 0.428 | 0.274 | 0 | 0.000 | 0.056 | 0.000 | 0.000 |
| Photopic | 0.482 | 0.472 | 0.029 | 0.000 | 0.962 | 0.000 | 0.000 |
Table 5.
Comparisons of the average of AULCSF under mesopic and photopic condition, at G0, G1, and G2 in post-operative patients
| G0 (AUCSF) | G1 (AUCSF) | G2 (AUCSF) | p-value* | p-value† (G0 vs. G1) | p-value† (G1 vs. G2) | p-value† (G0 vs. G2) | |
|---|---|---|---|---|---|---|---|
| Mesopic | 0.684 | 0.654 | 0.307 | 0.001 | 0.778 | 0.001 | 0.002 |
| Photopic | 0.983 | 0.888 | 0.782 | 0.272 |
Table 6.
Comparison of AULCSF among 12 patients whose visual acuity improvement was not more than 0.218 logMAR
|
AULCSF |
p-value* | ||
|---|---|---|---|
| Pre-PTK, average | Post-PTK, average | ||
| Mesopic | |||
| G0 | 0.428 | 0.652 | 0.047 |
| G1 | 0.336 | 0.650 | 0.047 |
| G2 | 0.000 | 0.316 | 0.028 |
| Photopic | |||
| G0 | 0.592 | 1.008 | 0.017 |
| G1 | 0.588 | 0.940 | 0.037 |
| G2 | 0.052 | 0.863 | 0.008 |
REFERENCES
1) Richman J, Spaeth GL, Wirostko B. Contrast sensitivity basics and a critique of currently available tests. J Cataract Refract Surg 2013;39:1100-6.


3) Ginsburg AP. Contrast sensitivity: determining the visual quality and function of cataract, intraocular lenses and refractive surgery. Curr Opin Ophthalmol 2006;17:19-26.

4) Vasavada VA, Praveen MR, Vasavada AR, et al. Contrast sensitivity assessment in pediatric cataract surgery: comparison of preoperative and early postoperative outcomes. J Cataract Refract Surg 2014;40:1862-7.


6) Faria BM, Duman F, Zheng CX, et al. Evaluating contrast sensitivity in age-related macular degeneration using a novel computer-based test, the spaeth/richman contrast sensitivity test. Retina 2015;35:1465-73.


7) Owsley C, Sloane ME. Contrast sensitivity, acuity, and the perception of 'real-world' targets. Br J Ophthalmol 1987;71:791-6.



8) Augustin VA, Weller JM, Kruse FE, Tourtas T. Influence of corneal guttae and nuclear cataract on contrast sensitivity. Br J Ophthalmol 2021;105:1365-70.


9) Bal T, Coeckelbergh T, Van Looveren J, et al. Influence of cataract morphology on straylight and contrast sensitivity and its relevance to fitness to drive. Ophthalmologica 2011;225:105-11.


10) Keane PA, Patel PJ, Ouyang Y, et al. Effects of retinal morphology on contrast sensitivity and reading ability in neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci 2010;51:5431-7.



11) Hawkins AS, Szlyk JP, Ardickas Z, et al. Comparison of contrast sensitivity, visual acuity, and humphrey visual field testing in patients with glaucoma. J Glaucoma 2003;12:134-8.


12) Lahav K, Levkovitch-Verbin H, Belkin M, et al. Reduced mesopic and photopic foveal contrast sensitivity in glaucoma. Arch Ophthalmol 2011;129:16-22.


13) Koh S, Maeda N, Ikeda C, et al. The effect of ocular surface regularity on contrast sensitivity and straylight in dry eye. Invest Ophthalmol Vis Sci 2017;58:2647-51.


14) Lee JH, Cristol SM, Kim WC, et al. Prevalence of granular corneal dystrophy type 2 (avellino corneal dystrophy) in the Korean population. Ophthalmic Epidemiol 2010;17:160-5.


15) Park JE, Yun SA, Roh EY, et al. Prevalence of granular corneal dystrophy type 2-related TGFBI p.R124H variant in a South Korean population. Mol Vis 2021;27:283-7.


16) Han KE, Kim TI, Chung WS, et al. Clinical findings and treatments of granular corneal dystrophy type 2 (avellino corneal dystrophy): a review of the literature. Eye Contact Lens 2010;36:296-9.


17) Jun I, Jung JW, Choi YJ, et al. Long-term clinical outcomes of phototherapeutic keratectomy in corneas with granular corneal dystrophy type 2 exacerbated after LASIK. J Refract Surg 2018;34:132-9.


18) Kim SW, Hong S, Kim T, et al. Characteristic features of granular deposit formation in granular corneal dystrophy type 2. Cornea 2011;30:848-54.


19) Kim HS, Rim TH, Kim TI, Kim EK. Association between visual acuity and the corneal area occupied by granular lesions, linear lesions, or diffuse haze in patients with granular corneal dystrophy type 2. Cornea 2018;37:542-7.


20) Hong JP, Kim TI, Chung JL, et al. Analysis of deposit depth and morphology in granular corneal dystrophy type 2 using fourier domain optical coherence tomography. Cornea 2011;30:729-38.


21) Nakamura T, Kataoka T, Kojima T, et al. Refractive outcomes after phototherapeutic refractive keratectomy for granular corneal dystrophy. Cornea 2018;37:548-53.


22) Fagerholm P. Phototherapeutic keratectomy: 12 years of experience. Acta Ophthalmol Scand 2003;81:19-32.


23) Jung SH, Han KE, Stulting RD, et al. Phototherapeutic keratectomy in diffuse stromal haze in granular corneal dystrophy type 2. Cornea 2013;32:296-300.


24) Wilson SE, Marino GK, Medeiros CS, Santhiago MR. Phototherapeutic keratectomy: science and art. J Refract Surg 2017;33:203-10.


25) Han KE, Choi SI, Kim TI, et al. Pathogenesis and treatments of TGFBI corneal dystrophies. Prog Retin Eye Res 2016;50:67-88.


26) Das S, Langenbucher A, Seitz B. Excimer laser phototherapeutic keratectomy for granular and lattice corneal dystrophy: a comparative study. J Refract Surg 2005;21:727-31.


27) Rapuano CJ. Phototherapeutic keratectomy: who are the best candidates and how do you treat them? Curr Opin Ophthalmol 2010;21:280-2.


28) Applegate RA, Howland HC, Sharp RP, et al. Corneal aberrations and visual performance after radial keratotomy. J Refract Surg 1998;14:397-407.


29) Dinh R, Rapuano CJ, Cohen EJ, Laibson PR. Recurrence of corneal dystrophy after excimer laser phototherapeutic keratectomy. Ophthalmology 1999;106:1490-7.


30) Inoue T, Watanabe H, Yamamoto S, et al. Recurrence of corneal dystrophy resulting from an R124H Big-h3 mutation after phototherapeutic keratectomy. Cornea 2002;21:570-3.


31) Hohberger B, Laemmer R, Adler W, et al. Measuring contrast sensitivity in normal subjects with OPTEC 6500: influence of age and glare. Graefes Arch Clin Exp Ophthalmol 2007;245:1805-14.


32) Aslam TM, Haider D, Murray IJ. Principles of disability glare measurement: an ophthalmological perspective. Acta Ophthalmol Scand 2007;85:354-60.


33) Abrahamsson M, Sjöstrand J. Impairment of contrast sensitivity function (CSF) as a measure of disability glare. Invest Ophthalmol Vis Sci 1986;27:1131-6.

34) Patterson EJ, Bargary G, Barbur JL. Understanding disability glare: light scatter and retinal illuminance as predictors of sensitivity to contrast. J Opt Soc Am A Opt Image Sci Vis 2015;32:576-85.


35) Mainster MA, Turner PL. Glare's causes, consequences, and clinical challenges after a century of ophthalmic study. Am J Ophthalmol 2012;153:587-93.


36) Paulsson LE, Sjöstrand J. Contrast sensitivity in the presence of a glare light. theoretical concepts and preliminary clinical studies. Invest Ophthalmol Vis Sci 1980;19:401-6.

37) Cabrerizo J, Livny E, Musa FU, et al. Changes in color vision and contrast sensitivity after descemet membrane endothelial keratoplasty for fuchs endothelial dystrophy. Cornea 2014;33:1010-5.


38) Oie Y, Watanabe S, Nishida K. Evaluation of visual quality in patients with fuchs endothelial corneal dystrophy. Cornea 2016;35 Suppl 1:S55-8.


39) Koh S, Haruna M, Asonuma S, et al. Quantitative evaluation of visual function in patients with cornea verticillata associated with Fabry disease. Acta Ophthalmol 2019;97:e1098-104.


40) Lasa MS, Datiles MB 3rd, Podgor MJ, Magno BV. Contrast and glare sensitivity. association with the type and severity of the cataract. Ophthalmology 1992;99:1045-9.


41) Kalloniatis M, Charles Luu. Visual acuity [Internet]. Salt Lake City (UT): WEBVISIOIN; c2017 [cited 2022 Mar 1]. Available from: https://webvision.med.utah.edu/book/part-viii-psychophysics-of-vision/visual-acuity/.
42) Iyer KK, Bradley AP, Wilson SJ. Conducting shorter VEP tests to estimate visual acuity via assessment of SNR. Doc Ophthalmol 2013;126:21-8.


43) Elliott DB, Bullimore MA. Assessing the reliability, discriminative ability, and validity of disability glare tests. Invest Ophthalmol Vis Sci 1993;34:108-19.

44) Legge GE, Rubin GS, Pelli DG, Schleske MM. Psychophysics of reading--II. Low vision. Vision Res 1985;25:253-65.


45) Marron JA, Bailey IL. Visual factors and orientation-mobility performance. Am J Optom Physiol Opt 1982;59:413-26.


46) Regan D, Neima D. Low-contrast letter charts as a test of visual function. Ophthalmology 1983;90:1192-200.


47) Moon JW, Kim SW, Kim TI, et al. Homozygous granular corneal dystrophy type II (avellino corneal dystrophy): natural history and progression after treatment. Cornea 2007;26:1095-100.

48) Jun I, Ji YW, Choi SI, et al. Compound heterozygous mutations in TGFBI cause a severe phenotype of granular corneal dystrophy type 2. Sci Rep 2021;11:6986.



-
METRICS

- Related articles
-
Phototherapeutic Keratectomy for Granular Corneal Dystrophy.2003 November;44(11)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print