|
 |
| J Korean Ophthalmol Soc > Volume 63(4); 2022 > Article |
|
국문초록
목적
재발성 눈근육마비 환자에서 methylenetetrahydrofolate reductase (MTHFR) 유전자 다형성에 의한 고호모시스테인혈증이 진단되어 이를 보고하고자 한다.
증례요약
기저질환이 없는 40세 남자가 복시로 내원하였다. 2년 전 좌측 제6번뇌신경마비를 진단받은 병력이 있었다. 좌안 상사시 및 경미한 내전시상전을 보였다. 뇌/안와 자기공명영상은 정상이었으나 혈액검사상 적혈구침강속도 및 호모시스테인 상승을 보여 고호모시스테인혈증에 의한 좌측 제4번뇌신경마비로 진단하였다. 2년 뒤 복시가 재발하였고, 우안 내사시 및 외전장애를 보여 우측 제6번뇌신경마비로 진단하였다. ESR 및 호모시스테인은 정상이었다. 고호모시스테인혈증의 가변적 유발 원인인 MTHFR 유전자 다형성검사를 시행하였고, 677TT 동형접합성변이를 보여 변동성 고호모시스테인혈증에 의한 재발성 마비사시로 진단하였다. 1달째 눈근육마비는 완전한 호전을 보였고, 6개월째 경과 관찰에서도 재발은 없었다.
ABSTRACT
Purpose
This report describes a case of recurrent ophthalmoplegia associated with hyperhomocysteinemia due to methylenetetrahydrofolate reductase (MTHFR) gene polymorphism.
Case summary
A 40‐year‐old healthy man presented with acute diplopia. He had a history of diplopia due to left sixth nerve palsy 2 years ago. Prism and alternate cover tests revealed left hypertropia in the primary position. Examination of ductions and versions showed mild elevation of the left eye on adduction. Brain and orbit magnetic resonance imaging were normal. Laboratory studies revealed an elevated level of erythrocyte sedimentation rate (ESR) and homocysteine. A diagnosis of left fourth nerve palsy associated with hyperhomocysteinemia was made. Symptoms were completely resolved within 2 weeks. Two years later, the patient again had diplopia associated with esotropia and limited abduction of the right eye. ESR and homocysteine level were normal. Analysis for MTHFR gene polymorphisms, which contribute to variable hyperhomocysteinemia, revealed 677TT homozygote variant. A diagnosis of recurrent paralytic strabismus associated with hyperhomocysteinemia, caused by MTHFR gene polymorphism, was made. Symptoms resolved within 1 month, and the patient did not have any further recurrence in 6 months.
바깥눈근육을 지배하여 안구운동에 관여하는 제3, 4, 6번 뇌신경마비의 원인과 빈도는 보고자마다 상이하나, 후천성 원인으로 두개 내 종양, 두부 외상, 미세혈관질환, 동맥류 등이 대표적으로 알려져 있다[1]. 그중 미세혈관질환은 임상적으로 대개 허혈성 원인으로 분류되는 것으로, 미세혈관경색을 유발할 수 있는 당뇨, 고혈압 등의 전신질환과 더불어 미세혈관의 혈액순환장애를 유발할 수 있는 고지혈증, 허혈성심질환 등이 포함된다[2]. 최근 후천성 제3, 4, 6번 뇌신경마비를 일으킬 수 있는 잠재적 허혈성 위험인자로 고호모시스테인혈증(hyperhomocysteinemia)이 제시된 바 있으나[3-5], 아직은 보고된 증례의 빈도가 많지 않고 다른 기저 질환이 동반된 경우가 많아 독립적인 병인으로서의 직접적인 연관성이 명확히 확립되지는 않았다.
고호모시스테인혈증은 죽상동맥경화증의 강력한 유발요인으로서 관상동맥질환, 심부정맥혈전증, 특발성 폐색전증, 말초동맥폐쇄질환, 뇌졸중의 독립적인 위험인자로 잘 알려져 있다[6,7]. 안과적으로는 특히 젊은 연령에서의 중심망막동맥폐쇄나 중심망막정맥폐쇄와 같은 혈관폐쇄성 질환, 시신경혈류 순환장애와 관련된 비동맥염성 앞허혈시신경병증, 녹내장 등과의 연관성이 제시되었다[6,7]. 저자들은 다른 허혈성 위험인자가 없었던 건강한 성인에서 고호모시스테인혈증에 의한 마비사시가 한 차례 진단된 이후 고호모시스테인 혈증의 동반 없이도 마비사시가 또다시 재발된 증례에서 고호모시스테인혈증을 가변적으로 유발할 수 있는 methylenetetrahydrofolate reductase (MTHFR) 유전자 다형성을 진단하였으며 이를 관련 병인으로 생각하여 보고하고자 한다.
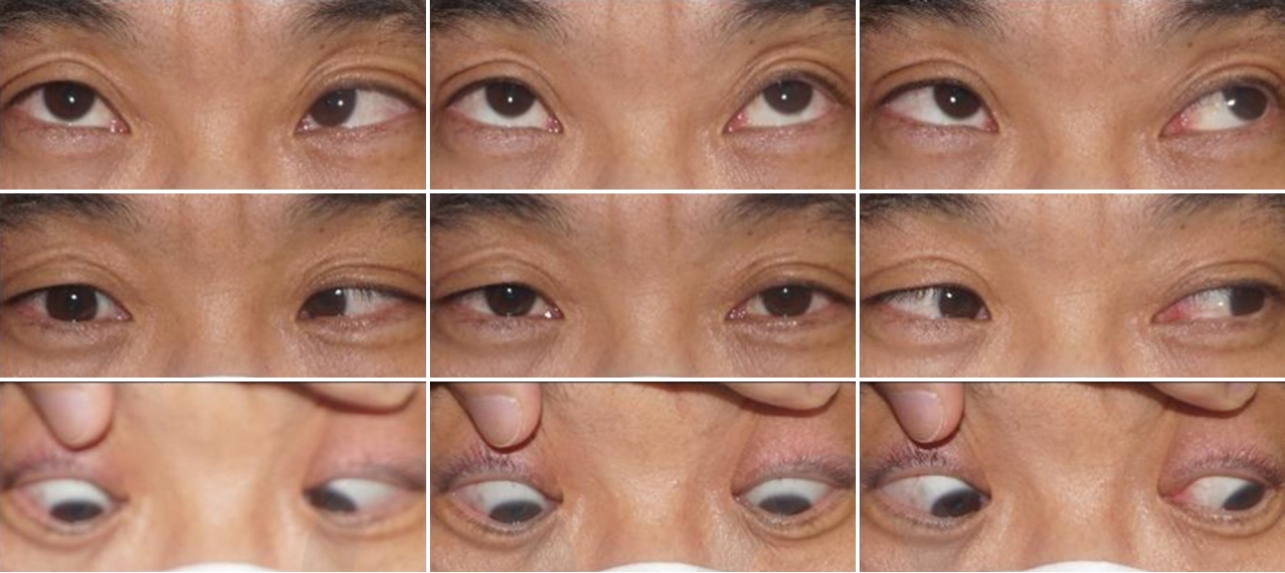
40세 남자 환자가 급성 복시 증상을 주소로 내원하였다. 기저질환은 없었고, 최근 감염이나 외상 병력도 없었으며, 복시 외에 다른 전신증상이나 신경학적 이상은 없었다. 엽산 및 비타민 B6와 B12 등이 포함된 종합 영양제 외에 다른 투약력은 없었다. 과거력상 2년 전에도 유사하게 다른 증상 없이 복시만 발생한 적이 있었다고 하였으며 신경과를 내원하여 좌측 6번 뇌신경마비로 진단받은 병력이 있었다. 당시에는 뇌영상검사만 시행받았고 이상 소견이 없다고 들었으며 이후 자연 호전되었다고 하였다. 안과검사상 최대교정시력 우안 1.0, 좌안 1.0, 안압 우안 15 mmHg, 좌안 15 mmHg였고, 동공부등이나 상대구심동공운동장애는 없었으며 눈꺼풀처짐도 없었다. 프리즘교대가림검사상 정면에서 좌안의 2 prism diopter (PD)의 상사시를 보였고 우측 주시 시 좌안의 2 PD의 상사시가 있었으나 좌측 주시 시에는 정위, 우측 기울임 시 정위였으나 좌측 기울임 시에는 4 PD의 상사시를 보여 ‘3단계 검사(three step test)’에서 모두 양성 소견을 보였다. 안구운동검사상 좌안의 경미한 내전시 상전이 관찰되었으며(Fig. 1), 안구운동 시 통증이나 안구돌출은 없었다. 세극등검사상 전안부에 특이 소견은 없었으며, 안저는 정상이었다. 뇌/안와 자기공명영상에서도 정상 소견을 보였다. 얼음을 위눈꺼풀에 2분간 댄 후 위눈꺼풀테‐각막반 사거리(marginal reflex distance1, MRD1)의 변화는 없었으며, 얼음을 위눈꺼풀에 5분간 댄 후 정면에서의 사시각에도 변화가 없어 얼음검사는 음성으로 정의하였다. 전체 혈구 계산, 혈액생화학검사, C반응성 단백질(C-reactive protein, CRP)등을 포함한 혈액검사는 정상 범위였으며, 류마티스인자(rheumatoid factor), 항핵항체(anti‐nuclear antibodies), 루푸스 항응고인자(lupus anticoagulant), 항중성구세포질항체(antineutrophil cytoplasmicantibody) 등의 자가항체검사도 모두 음성 소견을 보였다. 혈청 venereal disease research laboratory 등 감염 관련 혈액검사도 모두 음성이었다. 혈청 항아세틸콜린수용체항체(antiacetylcholine recepter antibody)는 <0.02 nmol/L로 음성이었고, 항GQ1b항체(anti‐GQ1b antibody)도 음성이었다. 반면 적혈구침강속도(erythrocyte sedimentation rate, ESR)가 42 mm/hr (참고치 ≤20 mm/hr)로, 호모시스테인이 49.40 μmol/L (참고치 ≤15 μmol/L)로 상승된 소견을 보여 고호모시스테인혈증에 의한 좌측 제4번 뇌신경마비로 진단하였다. 2주 뒤 눈근육마비는 자연 호전되었고 이후 환자가 내원하지 않아 추적 관찰은 이루어지지 않았다. 2년 뒤 복시가 재발하여 환자가 내원하였다. 내원하지 않은 기간 동안 새롭게 진단받은 기저질환은 없었으며, 최근에 발생한 감염이나 외상 병력도 없었고, 복시 외에는 다른 전신증상이나 신경학적 이상도 동반되지 않았다. 종합 영양제 외에 다른 투약력은 없었다. 우안에 20 PD의 내사시 및 심한 외전장애 소견을 보여 우측 제6번뇌신경마비로 진단하였다(Fig. 2). 안저검사상 망막 및 망막혈관에 이상 소견은 없었다. 뇌/안와 자기공명영상은 정상이었고, 눈꺼풀처짐과 안구운동장애에 대한 얼음검사도 음성이었으며 ESR 및 호모시스테인을 포함한 혈액검사는 모두 정상수치를 보였다. 혈청 항아세틸콜린수용체항체는 <0.02 nmol/L로 음성이었고, 항GQ1b항체 수치도 음성이었다. 고호모시스테인혈증을 유발할 수 있는 관련 보조인자인 비타민 B6는 40.51 μg/L (참고치 5‐50 μg/L), 비타민 B12는 642 pg/mL(참고치 187‐883 pg/mL), 엽산은 6.2 ng/mL (참고치 3.1‐20.5 ng/mL)로 모두 정상 범위였다. 그 외 고호모시스테인혈증을 가변적으로 유발할 수 있는 MTHFR C677T의 돌연변이를 검사하기 위해서 환자의 혈액에서 추출한 백혈구로부터 DNA 추출 키트(extraction column, QIAmp blood kit, Qiagen, Hilden, Germany)를 사용하여 제조자의 프로토콜에 따라 DNA 분리를 분리하였고, 분리한 DNA 표본은 PCR‐Hybridization 방법을 이용해 변이 상태를 관찰하였다. MTHFR 유전자의 677번째 nucleotide에서 동형접합성변이(TT)가 발견되어 MTHFR C677T 유전자 다형성에 의한 변동성 고호모시스테인혈증과 연관된 재발성 마비사시로 진단하였다. 내과와 협의 진료하여 뇌/심혈관계 합병증 발생 예방을 위한 아스피린 투약을 시작하였다. 호모시스테인 대사와 관련된 보조인자에 대해서는 환자가 기존에 종합 영양제를 복용하고 있었던 점 및 혈액검사상 수치가 모두 정상 범위였다는 점을 고려하여 추가적인 투여를 시행하지는 않았다. 발병 1달째 경과 관찰에서 눈근육마비는 완전한 호전을 보였고 6개월째 경과 관찰에서도 재발은 없었다.
고호모시스테인혈증을 유발하는 선천적 효소 유전자의 돌연변이 중 가장 흔하며 임상적으로 중요한 형태는 MTHFR의 C677T 유전자 다형성(677 C→T mutation)이다[8-10]. MTHFR은 5, 10‐methylenetetrahydrofolate를 5‐methylenetetrahydrofolate로 전환시키면서, 메틸기를 호모시스테인에 제공하여 체내에서 메티오닌을 합성하는 대사 과정에 관여하는 효소로서, 돌연변이에 의해 효소 활성도가 감소하면 메티오닌으로 대사되지 않고 남아있는 호모시스테인의 수치가 증가하여 고호모시스테인혈증이 발생하게 된다[8]. 특히 MTHFR 유전자의 677번째 nucleotide에서 동형접합성변이(TT)를 가진 경우에는 정상 유전자(CC)를 가진 경우보다 MTHFR 효소 활성도가 50% 이상 감소하며 불충분한 엽산 섭취 시 혈중 호모시스테인 농도는 25% 이상 상승할 수 있다[8]. MTHFR의 C677T 유전자 다형성은 경도(13‐24 μmol/L) 내지 중증도(26‐60 μmol/L) 고호모시스테인혈증을 유발하는 것으로 알려져 있다[10].
고호모시스테인혈증과 관련된 허혈성 뇌신경마비로 인해 마비사시가 발생한 기존의 보고들을 고찰해보면, 환자의 평균 발병 나이는 25‐45세로 통상적인 허혈성 뇌신경마비에 비해 상대적으로 젊은 연령에서 발생하는 경향을 보였고, 10세 미만 소아에서 발병된 증례도 있었으며 성별이나 발병 방향의 차이는 없었다[3,5]. 침범된 뇌신경은 제3, 4, 6번 뇌신경으로 다양한 분포를 보였으나 동시에 2개 이상의 다수 신경 침범은 없었고, 마비의 지속 기간은 평균 29일(3‐90일)이었으며 본 보고와 같이 재발된 증례에 대한 보고는 없었다[3,5]. 60세 이상 고령의 환자는 2명으로 각각의 환자 모두 고혈압과 당뇨의 기저질환이 있었으나 그 외 환자들은 기저질환이 없었으며 ESR, CRP, 혈중 지질은 정상이었다[3,5]. 혈중 호모시스테인의 농도는 16.07‐24.25 μmol/L로 경도의 상승을 보였다[3,5]. 그러나 고호모시스테인혈증의 주요 원인인 혈중 엽산 및 비타민 B6와 B12 등이 보조인자들의 수치나 MTHFR 유전자 다형성 유무에 대한 검사는 시행되지 않아 선천적 혹은 후천적 요인의 관련성 등 구체적인 병인에 대한 분석은 이루어지지 않았다는 한계가 있었다.
MTHFR C677T 유전자 다형성은 고호모시스테인혈증 외에도 메틸기 공급 부족에 의한 메티오닌 합성의 저하, DNA methylation, deoxythymidine monophosphate 합성 등에 이상을 초래하여 그 자체로도 여러 가지 혈관성 질환의 원인으로 작용할 수 있다[11]. MTHFR 유전자 다형성이 고호모시스테인혈증과 관련이 있음은 입증되어 있지만, 독립적 요인으로서 이러한 효소 유전자 다형성과 여러 혈관성 질환과의 직접적인 관련성에 대해서는 보고자 및 대상으로 하는 연구 집단 간 결과가 상이하여 아직 이견이 있다[10,12,13]. 그러나 다수의 한국인을 대상으로 한 대조군 연구에서 MTHFR 677TT 동형접합성 변이형은 정상 유전자인 CC형에 비해 2.2배의 허혈성 뇌졸중 위험도를 보여 MTHFR 유전자 다형성 자체가 허혈성 뇌졸중의 독립적인 위험인자로 해석될 수 있음이 보고되었다[12]. MTHFR 677TT 동형접합성 변이형 환자에서 혈중 호모시스테인의 농도가 높을 경우(>11.8 μmol/L)는 정상 유전자인 CC형에서 호모시스테인의 농도가 정상인 경우에 비해 허혈성 뇌졸중 위험도가 5.7배 상승하는 것으로 보고되었다[12]. MTHFR C677T 유전자 변이가 없고 같은 정도의 고호모시스테인혈증(>11.8 μmol/L)만 단독으로 존재하는 경우에서 허혈성 뇌졸중 위험도가 3.6배인 것을 고려하면 MTHFR 677TT 동형접합성변이형과 고호모시스테인혈증은 각각 단독의 허혈성 위험요인인 동시에 상호 간에 상승 효과를 나타내는 것으로 생각된다[12]. 같은 아시아인인 중국의 한족을 대상으로 한 최근 보고에서도 국내 보고와 유사하게 MTHFR C677T 유전자 다형성은 허혈성 뇌졸중 위험도 상승과 유의한 연관성이 확인되었고, 유전자 다형성과 그로 의한 혈중 호모시스테인 농도의 변동 자체가 허혈성 뇌졸중 발생에 있어 상승 효과를 나타내는 것으로 보고되었다[13].
허혈성 뇌신경마비에 의한 마비사시에 있어 MTHFR 유전자 다형성 및 호모시스테인 관련 연구는 아직 시행된 바 없다. 그러나 허혈성 뇌신경마비는 허혈성 뇌졸중과 근본적으로 유사한 기전에 의해 발생한다는 점과 더불어 본 증례 환자의 세번째 재발 시 시행한 혈액검사에서 호모시스테인과 엽산 및 비타민 B6와 B12 등의 수치가 모두 정상 범위였던 것을 고려할 때 허혈성 뇌졸중에서와 같이 MTHFR 677TT 동형접합성 변이 자체 혹은 이차적인 변동성 고호모시스테인혈증이 허혈성 뇌신경마비의 발생에 있어 유의미한 위험인자로 작용했을 가능성이 있을 것으로 생각된다.
본 증례보고의 한계는 환자의 최초 마비사시 발병 시 타 과에서 적절한 혈액검사가 시행되지 않았었기에 당시의 위험인자를 고호모시스테인혈증이나 MTHFR C677T 유전자 다형성으로 특정할 수 없었다는 점이다. 그러나 당시 환자가 38세로 젊은 연령이었던 점, 기저질환이나 외상 및 감염 등 특별한 병력이 전혀 없었고 환자가 평소에도 엽산 및 비타민 B6와 B12 등이 다량 포함된 종합 비타민제를 꾸준히 복용해왔던 점을 미루어 볼 때 이후 두 차례의 마비사시에서의 발병 기전과 유사한 맥락에서 발생되었을 것으로 추정된다.
결론으로, MTHFR C677T 유전자 다형성은 변동성 고호모시스테인혈증을 유발하며 허혈성 뇌신경마비 발생과 연관될 수 있다. 마비사시가 발병할 당시에 고호모시스테인혈증이 동반되지 않을 수 있으므로, 특히 허혈성 위험인자가 없으면서 마비사시와 관련된 통상적인 검사에서도 구체적인 원인 규명이 불분명한 경우에는 정확한 감별진단을 위해 혈중 호모시스테인 농도뿐 아니라 MTHFR 유전자 다형성에 대한 분석을 함께 시행하는 것이 도움이 될 것으로 생각된다.
Acknowledgments
This study was presented as a poster at the 125th Annual Meeting of the Korean Ophthalmological Society 2021.
REFERENCES
1) Park UC, Kim SJ, Yu YS. Clinical features and natural history of the acquired third, fourth, and sixth cranial nerve palsy. J Korean Ophthalmol Soc 2005;46:1555-62.
2) Chun JW, Kim DH. Risk factors and prognosis of isolated ischemic 3rd, 4th, 6th cranial nerve palsy. J Korean Ophthalmol Soc 2014;55:740-5.

3) Sachdeva V, Mittal V, Pathengay A, et al. Isolated abducens nerve palsy with hyperhomocysteinemia: association and outcomes. Indian J Ophthalmol 2013;61:598-600.



4) Badshah A, Humayun M, Haider I. A case of homocystinuria presenting with sixth nerve palsy. J Med Sci 2016;24:280-2.
5) Sharma P, Vashist U. Hyperhomocysteinemia in acquired non‐traumatic paralytic strabismus: a case series. J Clin Diagn Res 2020;14:1-3.

9) Austin RC, Lentz SR, Werstuck GH. Role of hyperhomocysteinemia in endothelial dysfunction and atherothrombotic disease. Cell Death Differ 2004;11 Suppl 1:S56-64.


10) Ganguly P, Alam SF. Role of homocysteine in the development of cardiovascular disease. Nutr J 2015;14:6.



11) Kim NK, Kang GD, Kim HJ, et al. Genetic polymorphisms of 5 , 10 ‐ methylenetetrahydrofolate reductase (MTHFR C677T and A1298C) in healthy Korean. Genes & Genomics 2002;24:227-34.
12) Choi BO, Kim HJ, Cho HJ, et al. Association between MTHFR C677T polymorphism and ischemic stroke. J Korean Neurol Assoc 2005;23:607-13.
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,596 View
- 55 Download
- Related articles
-
Treatment of Bilateral Tonic Pupil Associated with Syphilis.2018 July;59(7)
Clinical Features of Acute Opthalmoplegia Associated with Anti-GQ1b Antibody.2019 December;60(12)
Bilateral Optic Disc Edema Associated with Hypocalcemia.2017 May;58(5)
A Case of Recurrent Scleritis Associated with Menstrual Cycle.2017 June;58(6)





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print