기증각막 관련 미생물학적 검사 결과 분석
Analysis in Results of Microbiologic Exam Related to Donor Corneas
Article information
Abstract
목적
기증각막과 관련해 시행한 미생물학적 검사에서 동정된 미생물 및 임상적 중요성에 대해 알아보고자 하였다.
대상과 방법
본 병원에서 2008년 10월부터 2020년 12월까지 각막이식을 받은 환자 중 기증각막 관련 미생물학적 검사를 시행한 94명 114안을 대상으로 의무기록을 후향적으로 분석하였다. 각막이식 수술 중 공여자의 각공막 테두리와 보존액인 OptisolTM -GS (Bausch & Lomb, Rochester, NY, USA)를 대상으로 미생물학적 검사를 하였고, 배양에서 동정된 세균에 대한 항생제 감수성 검사를 시행하였다.
결과
미생물 검사에서 균이 동정된 경우는 모두 국내 기증각막이었고, 수입한 각막에서는 검출되지 않았다. 각공막 테두리에서 그람 음성 간균이 발견된 환자가 3안(2.6%)이고, 그중 배양 검사에서 Acinetobacter baumanii/hemolyticus가 2예, Pseudomonas aeruginosa가 1예가 동정되었다. 각공막 테두리에서는 균이 검출되지 않고 보존액에서만 Acinetobacter baumanii/hemolyticus가 동정된 1안이 있었다(0.9%). 항생제 감수성 검사에서 Colistin 이외의 다른 항균제에 다약제 내성을 가지고 있었다. 균이 발견된 모든 증례에서 각막이식 수술 후 각막염이나 안내염은 발생하지 않았다.
결론
각막이식술 시 사용하는 기증각막 또는 보존액에서 드물지만 균이 동정되는 경우가 있으므로 기증각막을 다루는 모든 과정에서 오염에 주의하여야 하겠다. 각막이식 수술 시 사용하는 경험적 항생제는 다약제 내성균을 억제하기에 충분한 항균력을 가지는 약제를 선택하여야 한다.
Trans Abstract
Purpose
This study analyzed the microorganisms identified in donor corneas and their clinical significance.
Methods
The medical records of 94 patients (114 eyes) who underwent keratoplasty and microbiological tests of the donor corneas from October 2008 to December 2020 at our hospital were reviewed retrospectively. During keratoplasty, we conducted microbiological tests of the corneoscleral rim of the donor cornea and preserving solution Optisol™-GS (Bausch & Lomb, Rochester, NY, USA), and examined the antibiotic susceptibility of bacterial isolates from the cultures.
Results
Some isolates of domestic donor corneas revealed bacteria, but none of the imported corneas did. Gram-negative bacilli were detected from the corneoscleral rim in three eyes (2.6%): two cases of Acinetobacter baumannii/haemolyticus and one case of Pseudomonas aeruginosa. In one case (0.9%), Acinetobacter baumannii/haemolyticus was identified from preserving solution, with no bacteria found in the corneoscleral rim. Antibiotic susceptibility tests showed multi-drug resistance, except to colistin. In all cases where bacteria were detected, there was no keratitis or endophthalmitis after corneal transplantation.
Conclusions
Although rare, bacteria can be identified from donor corneas or the preserving solution used in corneal transplantation. Therefore, caution is needed in all processes dealing with donor corneas. Empirical antibiotics that have sufficient antimicrobial activity to suppress multi-drug resistant bacteria should be selected in corneal transplantation.
각막이식은 여러 가지 원인으로 인하여 발생한 각막혼탁 환자에서 투명한 각막편을 이식하여 시력을 회복하는 시술이다. 전체층 각막이식술은 1906년 Edward Zirm에 의해 처음 보고된 이후, 현재까지도 활발하게 시행되고 있으며 각막 질환을 앓고 있는 환자들에서 시력 호전에 큰 효과를 보이고 있다[1]. 전통적으로 전체층 각막이식(penetrating keratoplasty)이 시행되어 왔으나, 근래에는 부분층 각막이식으로 심부앞층판각막이식(deep anterior lamella keratoplasty, DALK) [2,3] 및 데스메막박리내피각막이식(descemet-stripping endothelial keratoplasty, DSEK), 데스메막내피각막이식 (descemet membrane keratoplasty, DMEK) [4-6] 등이 수술 후 시력 호전의 정도를 높이고 각막이식편에 대한 거부반응을 줄이기 위해 시행되고 있다.
감염성 각막염은 각막이식술 후의 주요한 합병증으로 알려져 있으며, 최대교정시력의 감소 및 각막이식편 거부반응까지 유발할 수 있다[7]. 수술 후의 감염성 각막염 발생 비율은 선진국에서는 1.8-7.4%, 개발도상국에서는 11.9-25.0% 정도 발생한다고 알려져 있다[8-13]. 수술 후 안내염의 발생 비율은 비록 매우 적으나 발생 시 이식편 거부반응 및 안전 수지 이하의 불량한 시력 예후를 보이며[14], 각막이식술 환자 중 약 0.018-0.68%에서 발생하는 것으로 알려져 있다[15-18]. 따라서 수술 성공률을 높이고 좋은 시력 예후를 위해서는 감염성 각막염 및 안내염의 발생을 최소화하는 것이 중요하다.
각막 적출 후 보존 및 이식 시 오염(contamination) 여부는 각막이식술의 성공률 및 술 후 예후에 있어 중요한 인자인데, 각막이식술 시 오염률에 대한 연구는 국외에서 다수 이루어져 있으나, 한국인을 대상으로 한 연구는 자세히 보고된 바가 없다[19-26].
이에 저자들은 한국인 대상의 각막이식 수술 중 기증각막과 관련해 시행한 미생물학적 검사에서 동정된 균주의 종류 및 항생제 감수성 검사 결과에 대해 고찰하고자 하였다.
대상과 방법
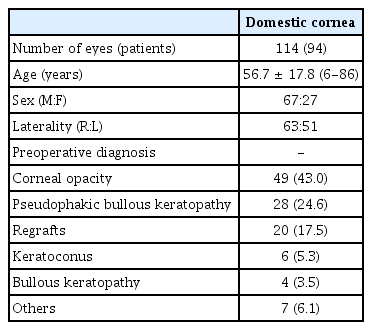
2008년 10월부터 2020년 12월까지 본원에서 각막이식을 받은 환자 중 기증각막 관련 미생물학적 검사를 시행한 94명 114안을 대상으로 의무기록을 후향적으로 분석하였다. 수입 각막은 미국의 Eversight Eye Bank, Lions Eye Institute, Miracles In Sight, Southern Eye Bank 등에서 제공되었고, gentamicin sulfate 100 μg/mL와 streptomycin sulfate 200 μg/mL 이 포함되어 있는 보존액인 Optisol-GS (Bausch & Lomb Inc., Bridgewater, NJ, USA)에 담겨 4℃ 냉장 상태로 국내에 반입, 수술 직전까지 4℃의 냉장 상태로 보관되었으며, 당일 수술을 시행하는 것을 원칙으로 하였다. 성별, 나이, 안질환 병력 및 이식 수술을 하게 된 원인, 진균 및 세균 도말과 배양 검사, 항생제 감수성 검사 결과 항목에 대하여 조사하였고(Table 1), 본 연구는 건양대학교병원의 연구윤리위원회 심의(승인 번호: 0000- 2021-07-013)를 거쳐 승인된 연구계획에 따라 수행되었다.
국내 기증 각막은 기증 전 시행한 기증자 혈액검사에서 B형 및 C형 간염, 후천성 면역결핍증후군, 매독 혈청검사에서 음성이며 다른 혈액검사에서도 특이 소견이 없는 경우로, 이동형 세극등현미경으로 관찰하여 각막에 혼탁이나 감염 징후가 없는 투명한 각막으로 각막이식에 적합한 눈을 선정하였다. 안구 적출은 사후 1시간 내에 시행되었으며, 수술은 5% polyvinylpyrrolidone-iodine (PVP-I)으로 눈 주위와 결막낭을 소독하고 0.9% 식염수로 세척한 후 개검기로 안검을 벌리고 일회용 공포로 눈을 제외한 얼굴 부위를 가린 상태에서 시행하였고, 무균적인 수술 도구를 사용하였다. 각막 주위 결막을 절제한 뒤, Westcott scissors를 이용하여약 15 mm 직경의 각공막이식편을 만들었고, OptisolTM-GS에 보관하였다.
이식 대상자의 선정은 본원의 각막이식 대기자 장부에 등재된 순서대로 연락하여 이식 수술을 받겠다는 의사를 밝힌 환자를 대상자로 선정하였고, 각막은 48시간 이내에 이식되었다. 모든 수술은 전신마취하에 시행되었고 수술시 기증각막편은 수여각막 절제보다 0.25 mm 크게 하거나 동일한 크기로 시행하는 것을 원칙으로 하였으며, 단속봉합을 하거나 단속봉합과 연속봉합을 병행하여 시행하였다. 수술 시 기증각막의 각공막절편과 보존액에서 검체를 얻어서 Gram stain, KOH 도말 검사 및 blood agar, chocolate agar, Sabouraud agar 배지에 세균 배양 검사, 진균 배양 검사를 시행하였다. 도말 검사 및 배양 검사에서 양성인 경우 항생제 감수성 검사를 시행하였다. 모든 약제는 본원 안과의 각막이식환자 프로토콜에 의해 투약되었다. 수술 후 0.1% fluorometholone (Flumetholone®; Santen, Osaka, Japan), 0.5% moxifloxacin hydrochloride (Vigamox®; Novartis, Basel, Switzerland)을 1시간 간격, 1% cyclopentolate hydrochloride (Cyclogyl®; Alcon, Geneva, Switzerland)를 하루 3회 점안하였으며 prednisolone (Solondo®; Yuhan, Seoul, Korea)을 1 mg/kg 용량으로 경구 투여하였고, 경과를 관찰하면서 감량하였다. 수술 시 시행한 기증각막 및 보존액 도말 검사에서 양성인 경우에도 수술 후 각막염이나 안내염이 발생하지 않아 특별한 처치를 시행하지 않았다.
결 과
본 연구에 포함된 94명 114안은 남성 67명 84안, 여성 27명 30안이었고, 평균 연령은 57.9 ± 17.8세(범위 6-86세)였으며, 우안이 63안, 좌안이 51안이었다. 각막이식 수술 전 진단명 중에서 각막혼탁이 가장 많았고, 다음으로 인공수정 체수포각막병증, 원추각막 순이었다(Table 1).
수술 중 시행한 공여자 각공막 테두리 도말 검사는 114안중 2012년에 1안, 2014년에 2안으로, 총 3안(2.6%)에서 그람음성 간균이 검출되었고, 그람양성 및 진균은 검출되지 않았다(Table 2). 배양 검사에서 Acinetobacter baumanii/hemolyticus가 2예, Pseudomonas aeruginosa가 1예로 동정되었다(Table 2).
수술 중 시행한 기증각막 보존액 도말 검사는 114안 중 2013년에 1안(0.9%)에서 그람음성 간균이 검출되었고, 그람양성 및 진균은 검출되지 않았다. 배양 검사에서는 Acinetobacter baumanii/hemolyticus로 동정되었다.
균이 동정된 4안에서 항생제 감수성 검사 결과, amikacin, mezlocillin, piperacillin, piperacillin/tazobactam, cefepime, cefotaxime, ceftazidime, gentamicin, fosfocmycin, tobramycin, imipenem, meropenem, ciprofloxacin, levofloxacin에 다약제 내성을 보였고 collistin에만 감수성을 보였다.
미생물 검사에서 균이 동정된 경우는 모두 국내기증 각막을 사용한 경우였고, 수입 각막에서는 균이 검출되지 않았다. 공여자 각공막 테두리와 보존액 모두에서 균이 검출된 경우는 없었고, 두 종류 이상의 세균이 복합 오염된 증례도 없었다. 균이 발견된 모든 증례에서 수술 후 입원 기간 중 각막염이나 안내염은 발생하지 않았다.
고 찰
각막이식 수술의 성공률을 높이기 위해서는 이식거부반응의 예방과 더불어 감염성 각막염 및 술 후 안내염의 발생을 최소화하는 것이 중요하다. Okonkwo et al은 각막이식술 후 감염성 각막염이 발생한 경우, 각막 반흔 및 한 달 이상의 지속적인 상피결손이 각각 39%에서 나타났으며, 각막 신생혈관, 이식거부, 재이식거부, 천공 등의 합병증이 생겼음을 보고하였다. 또한 각막염으로 진단된 41안에서, 9개월간 경과 관찰 시 11안(26.8%)에서 2회 이상의 각막염이 발생하였고, 22안(53.7%)에서 이식거부반응을 보였다[7]. Chen et al은 1999년부터 2006년까지 각막이식술을 받은 11,320안을 대상으로 술 후 안내염 발생을 분석하여, 안내 염이 생긴 경우 이식편의 5년생존율이 27%로 매우 낮음을 보고하였다[15]. 따라서 각막 적출, 재단 및 이식 시에 각막염이나 안내염을 야기할 수 있는 오염을 최소화하는 것이 수술 성공률을 높이는 데 중요하다고 생각된다.
본 연구의 114안 중 4안(3.5%)에 있어 미생물이 발견되었는데, 이는 국외에서 보고된 오염률인 0.53-19.4%와 부합하는 결과이다[19-26]. 국내에서 수입 각막을 대상으로 시행한 연구에서 보고한 13.5%보다는 낮은 오염률이다[27]. Polack et al [28]은 사망 이후 안구 세균총이 그람음성균으로 전환된다고 보고하였는데, 기존 연구에서도 오염 균주로 그람음 성균이 가장 많은 비율을 차지하였다[20,24,29]. 본 연구에서도 도말 검사 및 배양 검사에서 4안 모두 그람음성 간균이 동정되었다. 저자들의 연구에서는 균이 동정된 4안 모두 항생제 감수성 검사에서 colistin 외의 다른 항생제에 다약제 내성 소견을 보였으나, 다행히 각막염 및 안내염이 발병하지 않아 기존 처방을 유지하였다. 하지만 임상 경과에서 이러한 감염 소견이 있을 경우, 항생제 감수성 검사 결과를 참고하여 적절한 항생제를 투여하는 치료가 필요하리라 생각된다. 기증각공막과 보존액에서 동정된 Acinetobacter baumanii는 그람음성 호기성 구간균으로 숙주의 면역능력이 저하된 경우 기회감염을 일으키며, 외국에서는 전체층 각막이식과 관련된 Acinetobacter baumanii 각막염이 보고된 바가 있다[30]. Acinetobacter baumanii는 거의 모든 항생제에 내성을 가지고 있어 각막염이 발생할 경우 치료가 어려우며 본 연구에서도 colistin을 제외한 다른 항생제에 다약제 내성을 보여 더욱 주의가 필요할 것으로 생각된다.
문헌들에 따르면, 소독을 비롯한 다른 처치 없이 기증자 각공막 테두리에 대한 도말 검사를 하였을 경우 52-100% 의 오염률을 보였다[28,31-33]. Pels and Vrensen은 PVP-I로 충분한 소독 및 식염수 세척을 시행하였을 경우 세균의 총량이 최대 98%까지 감소함을 보고하였다[34]. Gruenert et al [35]은 각막이식술 시 기증자의 사인이 패혈증인 경우 통계적으로 유의하게 높은 17.3%의 높은 오염률을 보였음을 보고하였다. 이와 달리 기증자의 패혈증과 각막이식에서의 오염이 유의한 연관성이 없다는 연구 결과들도 있고[24,26,36], Spelsberg et al [26]은 오염된 보존액에서 동정된 균과 기증자에서 패혈증을 유발한 균에 있어 유의한 연관성이 없음을 보고하였다. 그럼에도 불구하고, 각공막이식편의 재단을 시행하기 전에 기증자의 눈 주위와 결막낭을 충분히 소독하는 것이 각막이식술 시 오염을 낮추는 데 중요한 역할을 하리라 생각하므로, 저자들은 기증각막 적출 시 5% PVP-I로 눈 주위와 결막낭을 소독한 후 0.9% 식염수로 세척을 시행하고 있다.
Linke et al [24]은 적출 시 개검기 사용 및 결막 구조도 오염과 연관이 있다고 보고하였는데, 양안 적출 시, 하나의 개검기를 사용하였을 때, 두 번째 적출안의 오염률은 첫 번째 적출안에 비해 2-3배 정도 높게 측정되었다. 또한 눈꺼풀결막은 수많은 주름 구조를 가지고 있어, 소독 시 PVP-I와 접촉하지 않는 면을 통해 미생물이 중심부쪽 각막으로 이동하는 가능성을 제시하였다. 따라서 오염률을 낮추기 위해 결막부 소독 시에 최소 2분 이상의 충분한 시간이 필요하며, 양안 적출 시 서로 다른 개검기를 사용하는 것이 바람직하다고 생각한다.
각막이식술 후 진균 감염은 10,000안 중 1.4안에서 발생 하는 것으로 보고될 정도로 매우 드물지만, 심각한 합병증을 유발할 수 있다[36]. 진균에 의한 오염을 억제하기 위해 보존액에 Voriconazole (Vfend®; Pfizer, New York City, NY, USA) 을 첨가하였을 경우 유의한 효과가 없었으나, Amphotericin B (Fungizone; Abbott, Chicago, IL, USA)를 추가하였을 경우 Candida 균에 의한 오염을 제거할 수 있고 낮은 농도로 보존액에 추가된 Amphotericin B는 각막 내피 손상을 일으키지 않는다는 보고가 있다[37]. 본 연구에서는 진균이 동정되지 않았으나, 보존액에 amphotericin B를 첨가하여 진균에 의한 오염을 줄일 수 있을 것으로 생각된다. 그러나 각막 내피 손상을 일으키지 않고 효과적으로 진균을 억제할 수 있는 적절한 농도에 대해서는 추가적인 연구가 필요할 것으로 생각한다.
본 연구는 단일 기관을 대상으로 한 후향적 연구라는 제한점이 있다. 또한 매우 적은 오염 발생 건수(4건)로 인해 오염에 영향을 미칠 수 있는 요인들에 따른 통계적인 분석이 불가능한 점이 있다.
결론적으로 국내 기증각막을 이식에 사용할 경우 기증각막 또는 보존액에서 균이 동정되는 경우가 있으므로, 각막 구득을 포함한 기증각막을 다루는 모든 과정에서 오염에 주의하여야 하고, 기증각막과 보존액에 대한 미생물학적 검사를 시행하는 것이 바람직하다. 또한 균주가 동정되었을 경우, 임상 소견 및 항생제 감수성 검사 결과를 고려하여 적절한 약제를 선택하여야 할 것이다. 향후에 각막이식을 시행하는 국내 병원들을 대상으로 저자들의 결과를 검증하는 다기관 연구가 필요할 것으로 사료된다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
정 일 / Il Jung
건양대학교 의과대학 안과학교실
Department of Ophthalmology, Konyang University College of Medicine