ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן(normal tension glaucoma, NTG)ņØĆ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśņØ┤Ļ│Ā ņĀäļ░®Ļ░üņØĆ ņŚ┤ļĀż ņ׳ņ£╝ļ®░[
1], ĒŖ╣ņ¦ĢņĀüņØĖ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓Į ņåÉņāüĻ│╝ ĻĘĖņŚÉ ņāüņØæĒĢśļŖö ņŗ£ņĢ╝Ļ▓░ņåÉņØä ņ£Āļ░£ĒĢśļŖö ņ¦äĒ¢ēņä▒ ņ¦łĒÖśņ£╝ļĪ£[
2] ļ│æĒā£ņāØļ”¼ĒĢÖņĀüņØĖ ņøÉņØĖņØĆ ņÖäņĀäĒ׳ ĻĘ£ļ¬ģļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņ¦Ćļ¦ī ĒśłĻ┤Ćņä▒ ņ×Éņ£©ņĪ░ņĀłņןņĢĀ(vascular dysregulation), ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļ░Å ņŻ╝ļ│ĆļČĆņØś ĒĢ┤ļČĆĒĢÖņĀü ņ░©ņØ┤, ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ ĒśłĻ┤Ćņ¦łĒÖś, ņĀäņŗĀņĀüņØĖ ņĀĆĒśłņĢĢĻ│╝ Ļ░ÖņØĆ ņĀäņŗĀņĀüņØĖ ĒśłĻ┤ĆņØś ņØ┤ņāüņØ┤ ņ¦Ćļ¬®ļÉ£ ļ░ö ņ׳ļŗż[
3].
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØĆ ļ¦Øļ¦ēļ¬©ņäĖĒśłĻ┤Ć ĻĄ¼ņĪ░ļź╝ ļ╣Āļź┤Ļ│Ā ļ╣äņ╣©ņŖĄņĀüņ£╝ļĪ£ Ļ▓Ćņé¼ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļŗ©ņ£ä ļ®┤ņĀüņŚÉņä£ ĒśłĻ┤ĆņØś ĻĖĖņØ┤ļĪ£ Ēæ£ņŗ£ļÉśļŖö ĒśłĻ┤Ćļ░ĆļÅä(vessel density, VD), ĒĢ┤ļŗ╣ ļ®┤ņĀüņŚÉņä£ ļ¦Øļ¦ē ĒśłĻ┤Ć ļé┤ņØś ņĀüĒśłĻĄ¼ņØś ņøĆņ¦üņ×äņØä ļ│┤ņØĖ ļ®┤ņĀüņØä ļéśĒāĆļé┤ļŖö Ļ┤Ćļźśļ░ĆļÅä(perfusion density, PD), ņśżļ¬®ļ¼┤ĒśłĻ┤ĆļČĆņ£ä(foveal avascular zone, FAZ)ņÖĆ Ļ░ÖņØĆ ņłśņ╣śļź╝ ĒåĄĒĢ£ ļ¦Øļ¦ēņØś ĒśłļźśņŚÉ ļīĆĒĢ£ ĒÅēĻ░ĆĻ░Ć Ļ░ĆļŖźĒĢśļŗż[
4]. ņØ┤ļ¤¼ĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒåĄĒĢśņŚ¼ ņ¢╗ņØĆ Ļ▓░Ļ│╝ļŖö ņĪ░ņśüņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ĻĖ░ņĪ┤ņØś ĒśĢĻ┤æĒśłĻ┤ĆņĪ░ņśüņłĀĻ│╝ ņØ╝ņ╣śĒĢśļŖö ņåīĻ▓¼ņØä ļ│┤ņØĖļŗż[
5]. ļśÉĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØĆ ļ¦Øļ¦ēņ¦łĒÖśņØś ņ¦äļŗ© ļ░Å Ļ▓Ćņé¼ ļ┐Éļ¦ī ņĢäļŗłļØ╝, ļģ╣ļé┤ņןņØä ņ¦äļŗ©ĒĢśĻ│Ā ņ¦äĒ¢ēņØä Ļ░Éņ¦ĆĒĢśļ®░, ņ¦äĒ¢ē ņ£äĒŚśņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż[
6]. ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ļōżņŚÉņä£ ļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś Ļ┤ĆļźśĻ░Ć Ļ░ÉņåīļÉśņ¢┤ ņ׳ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņ¦Ćļ¦ī[
7,
8], ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒåĄĒĢ£ ĒÖ®ļ░śļČĆ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłļźśņØĖņ×ÉņØś ņŚ░ĻĄ¼, ĒŖ╣Ē׳ ņĀĢņāü ļīĆņĪ░ĻĄ░Ļ│╝ ļģ╣ļé┤ņןņŚÉ ņØ┤ĒÖśļÉ£ ļ░śļīĆņĢłņØś ņŚ░ĻĄ¼ļŖö ņāüļīĆņĀüņ£╝ļĪ£ ĻĄŁļé┤ņÖĖ ļ│┤Ļ│ĀĻ░Ć ļō£ļ¼╝ļŗż.
ņØ┤ņŚÉ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░£ļ│æĻ│╝ ļ¦Øļ¦ēņØś Ēśłļźś ņé¼ņØ┤ņŚÉ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗżļ®┤, ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņØ┤ĒÖśņĢł ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ░śļīĆņĢłņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ Ļ░ĆņĀĢĒĢśĻ│Ā, ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłĻ│╝ ļ░śļīĆņĢł, ļīĆņĪ░ĻĄ░ņŚÉņä£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒÖ®ļ░śļČĆ ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ļ¦Øļ¦ēļ¬©ņäĖĒśłĻ┤Ć ņØĖņ×ÉļōżņØä ļ╣äĻĄÉĒĢ┤ ļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņŚ¼ 2017ļģä 1ņøöļČĆĒä░ 2020ļģä 6ņøöĻ╣īņ¦Ć ļŗ©ņØ╝ ĻĖ░Ļ┤ĆņŚÉ ļé┤ņøÉĒĢśņŚ¼ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņ£╝ļĪ£ ņ¦äļŗ© ļ░øņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ ĻĖ░ņżĆņŚÉ ņĀüĒĢ®ĒĢ£ 24ļ¬ģĻ│╝, ļÅÖņØ╝ ĻĖ░Ļ░ä ļé┤ņŚÉ ļÅÖņØ╝ ĻĖ░Ļ┤ĆņŚÉņä£ Ļ▓Ćņ¦ä ļ¬®ņĀüņ£╝ļĪ£ ņĢłĻ│╝ņĀü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ē ļ░øņØĆ ņĀüņØ┤ ņ׳ļŖö ļīĆņāüņ×Éļōż ņżæņŚÉņä£ ņŚ░ĻĄ¼ ĻĖ░ņżĆņŚÉ ņĀüĒĢ®ĒĢ£ 29ļ¬ģņØä ņĀĢņāü ļīĆņĪ░ĻĄ░ņ£╝ļĪ£ ĒĢśņśĆļŗż. ļ│ĖņøÉņŚÉņä£ ņ▓śņØīņ£╝ļĪ£ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņ£╝ļĪ£ ņ¦äļŗ© ļ░øņØĆ ĒÖśņ×Éļź╝ ĒÖśņ×ÉĻĄ░ņ£╝ļĪ£ ĒĢśņśĆĻ│Ā ņĢłĻ│╝ Ļ▓Ćņé¼ņÖĆ ļ│æļĀźņāü ņĢłĻ│╝ņĀü ņ¦łĒÖśņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļź╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ņ£╝ļĪ£ ĒĢśņśĆļŗż.
ņ¢æĻĄ░ ļ¬©ļæÉ Ļ│╝Ļ▒░ ļ│æļĀź ņĪ░ņé¼, ņ¢æņĢł ņŗ£ļĀź, ĻĄ┤ņĀłļĀź, Ļ│©ļō£ļ¦īņĢłņĢĢĻ▓Ćņé¼, ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼, ņĀäļ░®Ļ░üĻ▓Ćņé¼, ņé░ļÅÖ Ēøä ņĢłņĀĆĻ▓Ćņé¼, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄņĪ░ņśüņłĀņØä ņŗ£Ē¢ē ļ░øņĢśļŹś Ļ▓ĮņÜ░ļź╝ ĒżĒĢ©ņŗ£ņ╝░Ļ│Ā ĻĄÉņĀĢņŗ£ļĀźņØ┤ Snellen ņŗ£ļĀź ĻĖ░ņżĆ 20/40 ļ»Ėļ¦ī, ĻĄ┤ņĀłļźĀņØ┤ ┬▒6ļööņśĄĒä░ ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ļŖö ļ░░ņĀ£ĒĢśņśĆļŗż. ņĀäļ░®Ļ░üņØ┤ ņóüĻ▒░ļéś ņāēņåīņä▒ ņ╣©ņ░® ļō▒ņØś ņØ┤ņāüņØ┤ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņØ┤ņÖĖņØś ņØ┤ņĀä Ļ░üļ¦ē, ļ¦Øļ¦ē, ĒżļÅäļ¦ē, ņŗ£ņŗĀĻ▓Į ļō▒ņØś ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ļ░▒ļé┤ņןņłśņłĀ ņØ┤ņÖĖņØś ļŗżļźĖ ņĢłĻĄ¼ļé┤ ņłśņłĀ ĻĖ░ņÖĢļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņŗ£ņŗĀĻ▓ĮņØ┤ļéś ļ¦Øļ¦ēņŚÉ ņśüĒ¢źņØä ņżä ļ¦īĒĢ£ ņŗĀĻ▓ĮĻ│╝ņĀü ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļź╝ ņĀ£ņÖĖĒĢśņśĆļŗż. ĒÖśņ×ÉĻĄ░ņŚÉņä£ ļČäņäØņŚÉ ņé¼ņÜ®ĒĢ£ ņ×ÉļŻīļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņ¦äļŗ© ļŗ╣ņŗ£ņŚÉ ņĖĪņĀĢĒĢ£ Ļ░ÆņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉ ņØ┤ĒÖśļÉ£ ņØ┤ĒÖśņĢłĻ│╝ ĻĘĖļĀćņ¦Ć ņĢŖņØĆ ļ░śļīĆņĢł, ņĀĢņāü ļīĆņĪ░ĻĄ░ ņżæņŚÉņä£ ņ¢æņĢł ļ¬©ļæÉ ņĪ░Ļ▒┤ņŚÉ ļ¦×ņØä Ļ▓ĮņÜ░ņŚÉļŖö 2ņĢł ņżæ 1ņĢłņØä ņ×äņØśņĀüņ£╝ļĪ£ ĒāØĒĢśņŚ¼ 3ĻĄ░ņ£╝ļĪ£ ļéśļłäņŚłļŗż.
ņŖżĒÄÖĒŖĖļ¤╝ņśüņŚŁ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØĆ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻĖ░(CirrusŌäó HD-OCT, Carl Zeiss Meditec, Dublin, CA, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņé░ļÅÖ Ēøä ņ┤¼ņśüĒĢśņśĆļŗż. ņŗĀĒśĖ Ļ░ĢļÅäĻ░Ć ņ┤Ø 10ņĀÉ ņżæ 6ņĀÉ ļ»Ėļ¦īņØ┤Ļ▒░ļéś ļłłņÜ┤ļÅÖ ļō▒ ĒÖśņ×ÉņØś ĒśæņĪ░ļÅäļĪ£ ņØĖĒĢśņŚ¼ ņ┤¼ņśüļÉ£ ņØ┤ļ»Ėņ¦ĆņØś ņ¦łņØ┤ ļ¢©ņ¢┤ņ¦ĆļŖö Ļ▓ĮņÜ░ļŖö ņĀ£ņÖĖĒĢśņśĆļŗż. ļ¬©ļōĀ ņŖżņ║öņØĆ Cirrus OCTA ņåīĒöäĒŖĖņø©ņ¢┤(AngioPlex version 10.0, Carl Zeiss Meditec, Dublin, CA, USA)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļČäņäØļÉśņŚłļŗż.
ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ņØś Ļ▓ĮņÜ░ ņåīĒöäĒŖĖņø©ņ¢┤ņŚÉņä£ ņ×ÉļÅÖņĀüņ£╝ļĪ£ ņĖĪņĀĢļÉ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒĢ©ļ¬░ļ╣ä ļ░Å ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņŻ╝ļ│ĆļČĆņØś ĒÅēĻĘĀ, ņāüņĖĪ, ĒĢśņĖĪ, ļ╣äņĖĪ, ņØ┤ņĖĪ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śļź╝ ļČäņäØĒĢśņśĆļŗż. ļ¦Øļ¦ēļé┤ņĖĄņØś ļæÉĻ╗śļŖö ĒÖ®ļ░śļČĆ ņŗĀĻ▓ĮņĀłņäĖĒżņĖĄĻ│╝ ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗śļź╝ ĒĢ®ĒĢ£ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄ(ganglion cell-inner plexiform layer, GCIPL)ņ£╝ļĪ£ ĒÅēĻ░ĆĒĢśņśĆĻ│Ā, ĒÅēĻĘĀ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗ś, ņĄ£ņåī ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗ś, ņāüņĖĪ, ņāüļ╣äņĖĪ, ņāüņØ┤ņĖĪ, ĒĢśņĖĪ, ĒĢśļ╣äņĖĪ, ĒĢśņØ┤ņĖĪ ņ┤Ø 6ļ░®Ē¢źņØś ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗śļź╝ ņĖĪņĀĢĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż.
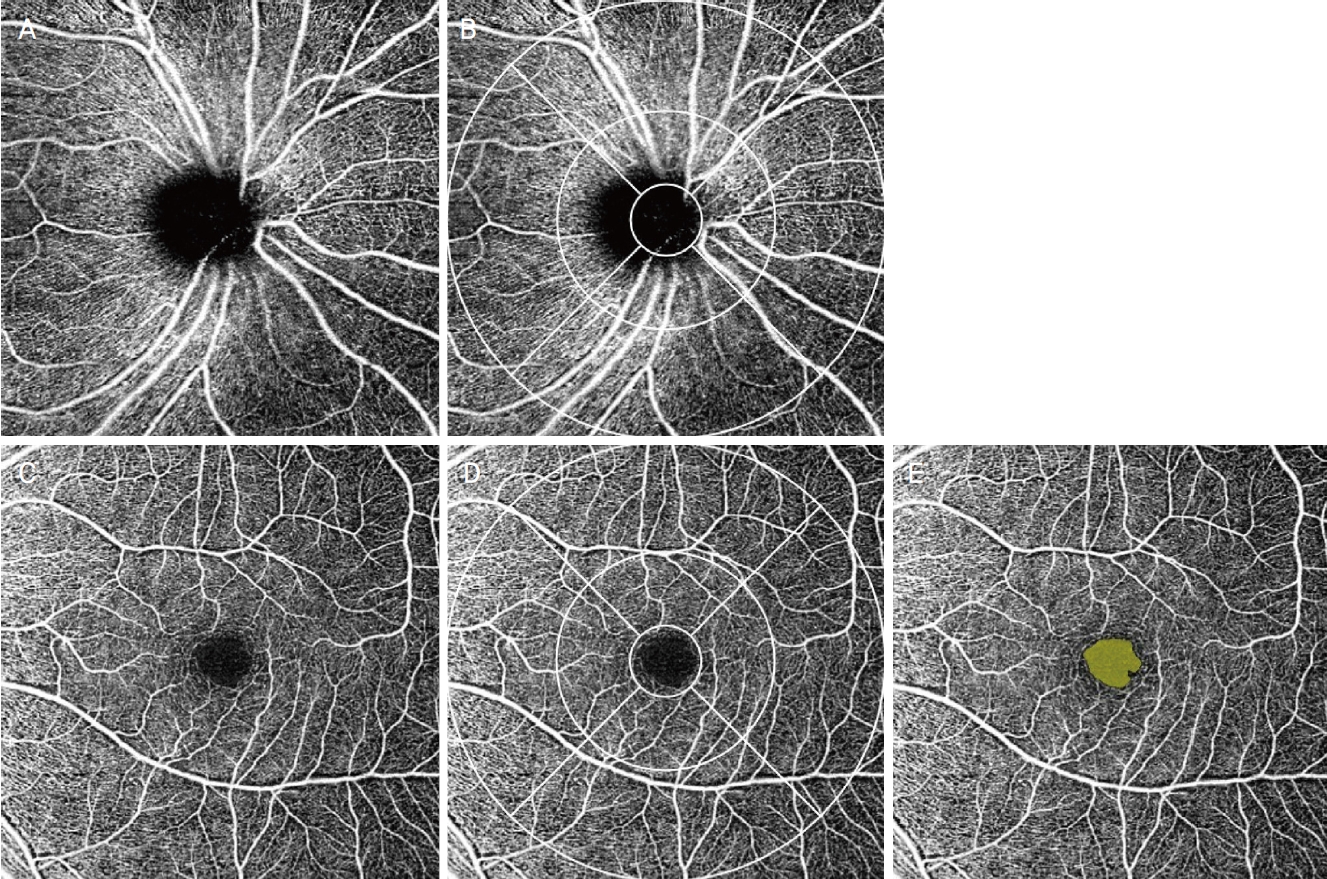
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØś Ļ▓ĮņÜ░, ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤ņŚÉņä£ ņĀ£Ļ│ĄļÉśļŖö early treatment diabetic retinopathy study (ETDRS) ņśüņŚŁņØä ņĀüņÜ®ĒĢśņŚ¼ 6 ├Ś 6 mm ņŖżņ║ö ņśüņŚŁņØä ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś ļĖīļŻ©Ēü¼ļ¦ē Ļ░£ļ░®(Bruch membrane opening) ņżæņŗ¼Ļ│╝ ĒÖ®ļ░śņśżļ¬®ņØś ņżæņŗ¼ņ£╝ļĪ£ļČĆĒä░ ļ░śĻ▓Į 0.5 mm ņØ┤ļé┤ņØś ņżæņŗ¼ ņśüņŚŁ(center), ļ░śĻ▓Į 0.5-1.5 mm ļ▓öņ£äņØś Ļ│Āļ”¼ ļ¬©ņ¢æ ļé┤ņĖĪ ņśüņŚŁ(inner), ļ░śĻ▓Į 1.5-3.0 mm ļ▓öņ£äņØś Ļ│Āļ”¼ ļ¬©ņ¢æ ņÖĖņĖĪ ņśüņŚŁ(outer), ļ░śĻ▓Į 3 mm ņØ┤ļé┤ņØś ņĀäņ▓┤ ņśüņŚŁ(total)ņ£╝ļĪ£ ļéśļłäĻ│Ā, ļé┤ņĖĪĻ│╝ ņÖĖņĖĪ ņśüņŚŁņØś Ļ▓ĮņÜ░ ĒĢ£ ļ▓ł ļŹö ņāüņĖĪ, ņØ┤ņĖĪ, ļ╣äņĖĪ, ĒĢśņĖĪņ£╝ļĪ£ ļéśļłäņ¢┤ Ļ░üĻ░üņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(superficial capillary plexus, SCP)ņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ Ļ┤Ćļźśļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, ĒÖ®ļ░śļČĆ FAZņØś ļ®┤ņĀüĻ│╝ ļæśļĀłļź╝ ĒÖĢņØĖĒĢśņśĆļŗż(
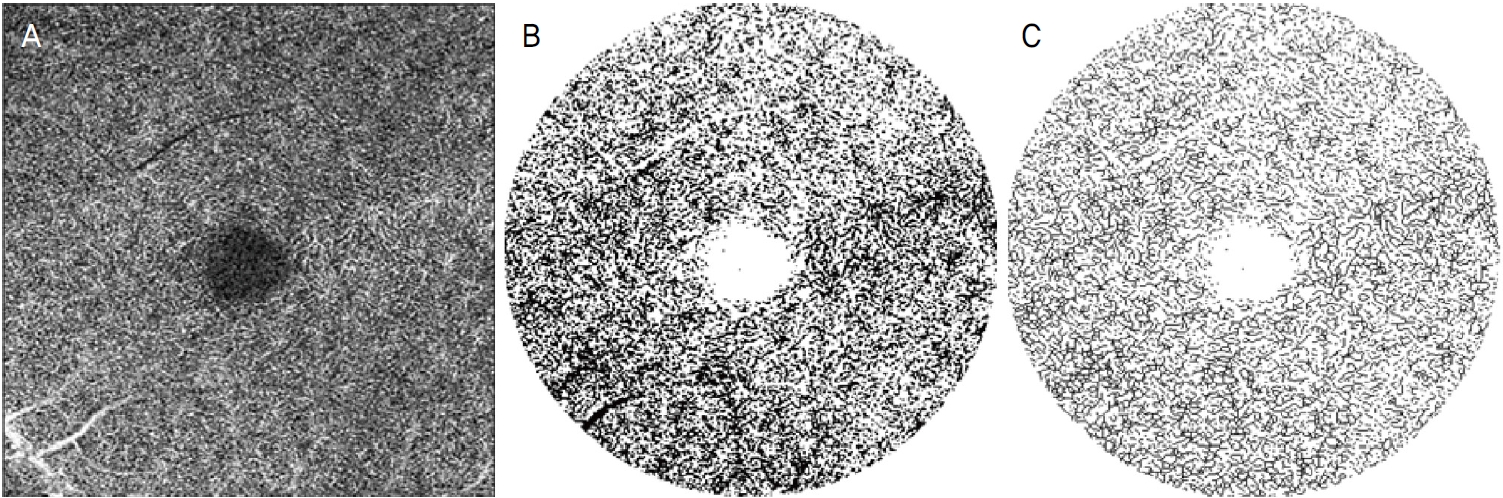
Fig. 1). ļśÉĒĢ£, ņØ┤ņĀä ņŚ░ĻĄ¼ļź╝ ņ░ĖĻ│ĀĒĢśņŚ¼ ļé┤ņןļÉ£ ņåīĒöäĒŖĖņø©ņ¢┤ņŚÉņä£ ņĀ£Ļ│ĄļÉśļŖö Ēł¼ņé¼ ĒÜ©Ļ│╝(projection artifact) ņĀ£Ļ▒░ļź╝ ņŗ£Ē¢ēĒĢ£ ĒÖ®ļ░śļČĆņØś ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(deep capillary plexus, DCP)ņØś ņŖżņ║ö ņØ┤ļ»Ėņ¦Ćļź╝ Image J (National Institutes of Health, Bethesda, MD, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļČäņäØ, ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż(
Fig. 2) [
9,
10].
ĒåĄĻ│äņĀü ļČäņäØņØĆ Statistic package for social science version 22.0 program (IBM Corp., Armonk, NY, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ¬©ļōĀ Ļ▓ĆņĀĢņŚÉņä£ ņ£ĀņØśņłśņżĆ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äĒĢÖņĀü ņØśņØśĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ĒīÉņĀĢĒĢśņśĆļŗż. ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņÖĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ņåŹĒĢ£ ļīĆņāüņ×ÉņØś ļ▓öņŻ╝ĒśĢ ņ×ÉļŻīļŖö chi ņĀ£Ļ│▒ Ļ▓ĆņĀĢņØä ņé¼ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż. ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ļŗ©ņĢłņŚÉļ¦ī ļ░▒ļé┤ņןņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŹś Ļ▓ĮņÜ░Ļ░Ć ņŚåņ¢┤, ļ░▒ļé┤ņןņłśņłĀņØś Ļ│╝Ļ▒░ļĀźņØĆ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņÖĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ņåŹĒĢ£ ļīĆņāüņ×É Ļ░äņØś Ļ▓ĮņÜ░ļ¦ī ļČäņäØĒĢśņśĆļŗż. ņłśņ╣śĒśĢ ņ×ÉļŻī ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒåĄĒĢśņŚ¼ ĻĄ¼ĒĢ£ ņĖĪņĀĢņ╣śļŖö ļ¬©ļōĀ ĻĄ░ņŚÉ ļīĆĒĢśņŚ¼ Kruskal-Wallis Ļ▓ĆņĀĢņØä ĒåĄĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆņ£╝ļ®░, Kruskal-Wallis Ļ▓ĆņĀĢņŚÉņä£ ņ£ĀņØśĒĢ£ Ļ▓ĮņÜ░ Bonferroni ņé¼ĒøäĻ▓ĆņĀĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņØ┤ĒÖśņĢłĻĄ░Ļ│╝ ņĀĢņāüņĢłĻĄ░, ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāüņĢłĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆĻ│Ā, ņØ┤ĒÖśņĢłĻĄ░Ļ│╝ ļ░śļīĆņĢłĻĄ░ ļ╣äĻĄÉ ņŗ£ Wilcoxon signed rank Ļ▓ĆņĀĢņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗ©, ņŚ░ļĀ╣ņØś Ļ▓ĮņÜ░ņŚÉļŖö ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņÖĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ņåŹĒĢ£ ļīĆņāüņ×É Ļ░äņØś Ļ▓ĮņÜ░ņŚÉ ļīĆĒĢśņŚ¼ Mann-Whitney U test Ļ▓ĆņĀĢņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņŚÉ ņ×ģĻ░üĒĢ£ ņØśĒĢÖ ņŚ░ĻĄ¼ ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜīņØś ņŖ╣ņØĖ ņĢäļל ņ¦äĒ¢ēļÉśņŚłņ£╝ļ®░, ļ│Ė ņŚ░ĻĄ¼ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņØ┤ĒĢ┤Ļ┤ĆĻ│äņØś ņāüņČ®ņØĆ ņŚåļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: 2021-03-014).
Ļ▓░ Ļ│╝
ĒÖśņ×ÉĻĄ░ 24ļ¬ģ ņżæ ļé©ņä▒ņØ┤ 11ļ¬ģ, ņŚ¼ņä▒ņØ┤ 13ļ¬ģņØ┤ļ®░ ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 51.83 ┬▒ 14.20ņäĖ, ņĀĢņāü ļīĆņĪ░ĻĄ░ 29ļ¬ģ ņżæ ļé©ņä▒ņØ┤ 13ļ¬ģ, ņŚ¼ņä▒ņØ┤ 16ļ¬ģņØ┤ļ®░, ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 52.90 ┬▒ 13.68ņäĖņśĆļŗż. ļéśņØ┤, ņä▒ļ│ä, ĻĄ┤ņĀłļźĀ, ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź, ĒÅēĻĘĀ ņĢłņĢĢ, ļŗ╣ļć©, Ļ│ĀĒśłņĢĢņØś ņ£Āļ│æļźĀņØĆ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņÖĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ņåŹĒĢ£ ļīĆņāüņ×É Ļ░äņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(
Table 1).
ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ĒåĄĒĢśņŚ¼ ĻĄ¼ĒĢ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒĢ©ļ¬░ļ╣äļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢīņŚÉļŖö ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż(
p=0.020). ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śļź╝ ļČäņäØĒĢśņśĆņØä ļĢīņŚÉļŖö ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒÅēĻĘĀ, ņāüņĖĪ, ĒĢśņĖĪ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļæÉĻ╗śņØś Ļ░Éņåīļź╝ ļ│┤ņśĆņ£╝ļ®░(Ļ░üĻ░ü
p<0.001,
p=0.007,
p<0.001), ļ░śļīĆņĢłĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ Ļ░äņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(
Table 2).
ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢīļŖö ĒÅēĻĘĀ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗ś ļ░Å ņāüņĖĪ, ņāüņØ┤ņĖĪ, ĒĢśļ╣äņĖĪ, ĒĢśņĖĪ, ĒĢśņØ┤ņĖĪ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗ś ļ¬©ļæÉ ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░(Ļ░üĻ░ü
p<0.001,
p=0.022,
p=0.008,
p<0.001,
p<0.001,
p<0.001), ņāüļ╣äņĖĪ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗śņØś Ļ▓ĮņÜ░ ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż(
p=0.030). ĒÅēĻĘĀ ļ░Å ļ¬©ļōĀ ņśüņŚŁņŚÉņä£ ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņØś ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(
Table 3).
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀĻ▓Ćņé¼ņŚÉņä£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ēśłļźś Ļ┤ĆļĀ© ņłśņ╣śļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ņ׳ļŖö ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ņĀäņ▓┤, ļé┤ņĖĪ ĒÅēĻĘĀ, ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ĒÅēĻĘĀ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäņØś Ļ░Éņåī(Ļ░üĻ░ü
p=0.014,
p=0.011,
p<0.001,
p=0.010,
p<0.001) ļ░Å ņĀäņ▓┤, ļé┤ņĖĪ ĒÅēĻĘĀ, ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåī(Ļ░üĻ░ü
p=0.017,
p=0.023,
p<0.001,
p=0.001)ļź╝ ļ│┤ņśĆļŗż. ļśÉĒĢ£, ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ņÖĖņĖĪ ņśüņŚŁ ĒÅēĻĘĀņØś Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåī(
p=0.003)ļź╝ ļ│┤ņśĆļŗż(
Table 4).
ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀĻ▓Ćņé¼ņŚÉņä£ ĒÖ®ļ░śļČĆņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ēśłļźś Ļ┤ĆļĀ© ņłśņ╣śļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ņ׳ļŖö ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅä Ļ░Éņåī(
p<0.001) ļ░Å ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ĒÅēĻĘĀ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåī(Ļ░üĻ░ü
p<0.001,
p=0.001,
p<0.001)ļź╝ ļ│┤ņśĆņ£╝ļ®░, ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ņĀäņ▓┤, ņÖĖņĖĪ ņśüņŚŁ ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäņØś Ļ░Éņåī(
p=0.006,
p=0.041) ļ░Å ņĀäņ▓┤, ņÖĖņĖĪ ņżæ ņØ┤ņĖĪ ņśüņŚŁ Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåī(
p=0.013,
p=0.003)ļź╝ ļ│┤ņśĆļŗż(
Fig. 3). ļśÉĒĢ£ ņØ┤ĒÖśņĢłĻĄ░ ļ░Å ļ░śļīĆņĢłĻĄ░ņŚÉņä£ ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ļé┤ņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅä Ļ░Éņåī(
p=0.008) ļ░Å ļé┤ņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁ ļ░Å ņÖĖņĖĪ ņśüņŚŁ ĒÅēĻĘĀņØś Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåī(
p<0.001,
p=0.001)ļź╝ ļ│┤ņśĆļŗż. ņżæņŗ¼ņśżļ¬®ļ¼┤ĒśłĻ┤ĆļČĆņ£äņØś ļäōņØ┤ņÖĆ ļæśļĀłļŖö ņØ┤ĒÖśņĢłĻĄ░ ļ░Å ļ░śļīĆņĢłĻĄ░ ņé¼ņØ┤, ļ░śļīĆņĢłĻĄ░ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ ņé¼ņØ┤ņØś ņ¢æ Ļ▓ĮņÜ░ ļ¬©ļæÉņŚÉņä£ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(
Table 5). ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀĻ▓Ćņé¼ņŚÉņä£ ĒÖ®ļ░śļČĆņØś ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ēśłļźś Ļ┤ĆļĀ© ņłśņ╣śļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ņ׳ļŖö ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłĻĄ░Ļ│╝ ļ░śļīĆņĢłĻĄ░ ļ░Å ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņŚÉņä£ ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(
Table 6).
Ļ│Ā ņ░░
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņØ┤ĒÖśņĢłĻĄ░ņØĆ ļ░śļīĆņĢłĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ ņĀäņ▓┤, ļé┤ņĖĪ ĒÅēĻĘĀ, ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåī, ĒÖ®ļ░śļČĆ ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåīļź╝ ļ│┤ņśĆĻ│Ā, ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ ņĀäņ▓┤, ļé┤ņĖĪ ĒÅēĻĘĀ, ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ĒÅēĻĘĀ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåī ļ░Å ĒÖ®ļ░śļČĆ ņĀäņ▓┤, ļé┤ņĖĪ ņżæ ĒĢśņĖĪ, ņÖĖņĖĪ ĒÅēĻĘĀ, ņÖĖņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒåĄĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņÖĆ ĒÖ®ļ░śļČĆņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØä ņāüņĖĪ, ĒĢśņĖĪ, ļ╣äņĖĪ, ņØ┤ņĖĪņ£╝ļĪ£ ļéśļłäņ¢┤ ņØ┤ĒÖśņĢłĻ│╝ ļ░śļīĆņĢł, ņØ┤ĒÖśņĢłĻ│╝ ņĀĢņāüņĢłņØä Ļ░üĻ░ü ļ╣äĻĄÉĒĢĀ ņŗ£ ņŻ╝ļĪ£ ĒĢśņĖĪņØś ņśüņŚŁņŚÉņä£ ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåīļź╝ ļ│┤ņśĆņ£╝ļ®░, ņØ┤ļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņŚÉ ļ╣äĒĢ┤ ĒĢśņĖĪĻ│╝ ĒĢśņØ┤ņĖĪ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒģī ļæÉĻ╗śņØś ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżĻ│╝[
11,
12] ĒĢśņĖĪ ņŗ£ņŗĀĻ▓ĮĒģīņØś ļäłļ╣äĻ░Ć ņ¢ćņØĆ ņŗ£ņŗĀĻ▓ĮņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░£ņāØ ņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢ£ļŗżļŖö ņØ┤ņĀäņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļōżĻ│╝ ļ╣äņŖĘĒĢ£ ņ¢æņāüņØä ļ│┤ņØĖļŗż[
13,
14].
ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņĢłņĢĢņāüņŖ╣ņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā, Collaborative Normal Tension Glaucoma Study (CNTGS)ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ņØś ņĢłņĢĢĒĢśĻ░ĢņØś ņØ┤ņĀÉņØä ļ░ØĒśĆļéĖ ņØ┤ļל[
15], Ēśäņ×¼ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņ╣śļŻīļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןĻ│╝ ņ£Āņé¼ĒĢśĻ▓ī ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņĢłņĢĢĒĢśĻ░ĢņØä ļ¬®Ēæ£ļĪ£ ĒĢśĻ│Ā ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņĢ×ņä£ ĻĖ░ņłĀĒĢśņśĆļō»ņØ┤, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉņä£ ņĢłņĢĢ ņØ┤ņÖĖņØś ņØĖņ×ÉļĪ£ ņØĖĒĢ£ ņøÉņØĖņØ┤ ņ׳ņØä ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņØ┤ļōżņŚÉ ļīĆĒĢ£ ņ╣śļŻīņØś ņżæņÜöņä▒ņØ┤ ļČĆĻ░üļÉśĻ│Ā ņ׳ļŗż. Low-Pressure Glaucoma Treatment Study (LoGTS)ļŖö ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņ╣śļŻīņŚÉ ņ׳ņ¢┤ ņŗĀĻ▓Į ļ│┤ĒśĖ ĒÜ©Ļ│╝ņÖĆ Ļ░ÖņØĆ ņĢłņĢĢĻ│╝ ļÅģļ”ĮņĀüņØĖ ņÜöņåīņØś ņżæņÜöņä▒ņŚÉ ļīĆĒĢśņŚ¼ ļ░ØĒ×ī ļ░ö ņ׳ļŗż[
16]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢłĻĄ░ ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ļ│┤ļŗż ļ¦Øļ¦ēĒśłļźś Ļ┤ĆļĀ© ņ¦ĆĒæ£Ļ░Ć Ļ░ÉņåīļÉśņŚłņ£╝ļ»ĆļĪ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņ¦äļŗ© ļ░Å ņ╣śļŻīņŚÉ ņ׳ņ¢┤ ĒśłļźśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņÜöņåīņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżĻ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ņØ┤ņĀä ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņØ┤ĒÖśņĢłņŚÉņä£ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļ╣äņĖĪņØä ņĀ£ņÖĖĒĢ£ ņśüņŚŁņØś ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņ£╝ļĪ£ņØś ļ¦Øļ¦ēĒśłļźśņÖĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│Ć ņĀäņ▓┤ ņśüņŚŁņØś ļ¬©ņäĖĒśłĻ┤Ć ļ░ĆļÅäņØś ņĀĆĒĢśĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņØ┤ļŖö ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ļ░Å ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś Ļ▓░Ļ│╝ņÖĆļÅä ņØ╝ņ╣śĒĢśļŖö ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż[
17]. ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņØ┤ĒÖśņĢłņŚÉņä£ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅäņØś Ļ░ÉņåīĻ░Ć Ļ┤Ćņ░░ļÉ©ņØä ļ│┤ņśĆļŗż[
18]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņØ┤ņĀä ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ļ╣äņŖĘĒĢśĻ▓ī Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłļźśņØĖņ×ÉņØś Ļ░ÉņåīĻ░Ć ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłņŚÉņä£ ļéśĒāĆļé©ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░śļīĆņĢłņŚÉņä£ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļ░Å ļ¦Øļ¦ēņŗĀĻ▓ĮņĀłņäĖĒżņØś ņåÉņāüņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśĻ│Ā ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņØś ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄ ļ░Å ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄņØś ļæÉĻ╗śņØś ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ»ĆļĪ£ ĻĄ¼ņĪ░ņĀüņ£╝ļĪ£ ņĀĢņāü ļīĆņĪ░ĻĄ░Ļ│╝ ņ░©ņØ┤Ļ░Ć ņŚåļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż. ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØä ļ╣äĻĄÉĒĢśļ®┤, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░śļīĆņĢł ĻĄ░ņØĆ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäņØś ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ®░, ĒÖ®ļ░śļČĆņØś ļé┤ņĖĪ ņżæ ĒĢśņĖĪ ņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäņÖĆ Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåī, ņÖĖņĖĪ ņśüņŚŁ ĒÅēĻĘĀņØś Ļ┤Ćļźśļ░ĆļÅä Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ņØ┤ļŖö ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś ļ¬©ņäĖĒśłĻ┤Ćļ¦ØņØĆ ĒśłĻ┤ĆĻ│╝ ļČäņ¦ĆļōżņØ┤ ļ░Ćņ¦æļÉśņ¢┤ ņ׳ņ¢┤ Ļ▓Įļ»ĖĒĢ£ ĒŚłĒśłņä▒ ņåÉņāüņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ¢┤ļĀżņÜĖ ņłś ņ׳Ļ│Ā, ĒÖ®ļ░śļČĆļŖö ļ¦Øļ¦ēļÅÖļ¦źņŚÉ ņØśĒĢ┤ņä£ļ¦ī ĒśłņĢĪ Ļ│ĄĻĖēņØä ļ░øĻ│Ā ļŗżļźĖ ņĪ░ņ¦üņŚÉ ļ╣äĒĢ┤ ņé░ņåīņåīļ╣äļ¤ēņØ┤ ļåÆņĢä ļ╣äĻĄÉņĀü ĒŚłĒśłņä▒ ņåÉņāüņŚÉ ņĘ©ņĢĮĒĢ£ ĒŖ╣ņä▒ņØ┤ ņśüĒ¢źņØä ņŻ╝ņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż[
19,
20]. ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöĻ░Ć ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░£ņāØĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖöņ¦ĆņŚÉ Ļ┤ĆĒĢ┤ņä£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļŗ©ņĢł ļģ╣ļé┤ņןņØś ļ░śļīĆņĢłĻ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ļōżņØä ņé┤ĒÄ┤ļ│┤ļ®┤, ļŗ©ņĢł ņŗ£ņĢ╝ņĀäļŗ©Ļ│ä ļģ╣ļé┤ņןņŚÉņä£ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀņØä ĒåĄĒĢśņŚ¼ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ ļ¬©ņäĖĒśłĻ┤ĆņØś ĒśłĻ┤Ćļ░ĆļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ļŗ©ņĢł ņŗ£ņĢ╝ņĀäļŗ©Ļ│ä ļģ╣ļé┤ņן ņØ┤ĒÖśņĢłĻĄ░ņØĆ ļ░śļīĆņĢłĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłĻ┤Ćļ░ĆļÅäņØś Ļ░Éņåīļź╝ ļ│┤ņśĆņ£╝ļéś, ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłĻ┤Ćļ░ĆļÅäņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö ļ│Ė ņŚ░ĻĄ¼ņÖĆ ņØ╝ņ╣śĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆņ¦Ćļ¦ī ĒĢ┤ļŗ╣ ņŚ░ĻĄ¼ņŚÉņä£ ļģ╣ļé┤ņן ņØ┤ĒÖśņĢłņØś ņ╣śļŻī ņĀä ĒÅēĻĘĀ ņĢłņĢĢņØĆ 23.0 ┬▒ 1.8 mmHgņśĆņ£╝ļ®░, ņØ┤ĒÖśņĢłĻ│╝ ļ░śļīĆņĢłņØś ņĢłņĢĢņØś ļ╣äļīĆņ╣ŁņØä ņŚ░ĻĄ¼ ļīĆņāüņØś ĒżĒĢ© ĻĖ░ņżĆņØś ĒĢśļéśļĪ£ ĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØ┤ ņĢäļŗī ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØä ĒżĒĢ©ĒĢ£ Ļ▓░Ļ│╝ņØĖ ņĀÉņØä Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż[
21]. ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņØ┤ĒÖśņĢłĻĄ░ ļ░Å ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļģ╣ļé┤ņן ņØ┤ĒÖśņĢłĻĄ░ņØĆ ļ░śļīĆņĢłĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłĻ┤Ćļ░ĆļÅäņØś Ļ░Éņåīļź╝ ļ│┤ņśĆņ£╝ļéś, ļ░śļīĆņĢłĻĄ░Ļ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆņØś ĒśłĻ┤Ćļ░ĆļÅäņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░ ņØ┤ļŖö ļ│Ė ņŚ░ĻĄ¼ņÖĆ ņØ╝ņ╣śĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż[
22]. ĒĢśņ¦Ćļ¦ī ĒÖ®ļ░śļČĆņØś ļČäņäØņØä ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņĢä ļ│Ė ņŚ░ĻĄ¼ņØś ĒÖ®ļ░śļČĆ Ļ▓░Ļ│╝ņÖĆļŖö ļ╣äĻĄÉĒĢĀ ņłś ņŚåņŚłļŗż.
ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ļ▓ĮņÜ░, ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņØ┤ĒÖśņĢłĻ│╝ ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņŚÉ Ļ┤Ćļźśļ░ĆļÅä ļ░Å ĒśłĻ┤Ćļ░ĆļÅäņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā[
22], ņØ┤ļŖö ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļŖö ņ¢æņāüņØä ļ│┤ņśĆļŗż. ļ░śļīĆņĢłņØś Ļ▓ĮņÜ░ņŚÉļÅä ņĀĢņāü ļīĆņĪ░ĻĄ░ Ļ░äņŚÉ Ļ┤Ćļźśļ░ĆļÅä ļ░Å ĒśłĻ┤Ćļ░ĆļÅäņØś ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ļ▓ĮņÜ░ ĒĢśļéśņØś ņäĖļÅÖļ¦ź ļ░Å ņäĖņĀĢļ¦ź ņé¼ņØ┤ņŚÉ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ņ£╝ļéś ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ļ▓ĮņÜ░ ĒĢśļéśņØś ņäĖļÅÖļ¦ź ļ░Å ņäĖņĀĢļ¦ź ņé¼ņØ┤ņŚÉ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ļŖö ļÅÖņŗ£ņŚÉ ļŗżļźĖ ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø Ļ░äņØś ļ¼ĖĒĢ®ņØ┤ ĒśĢņä▒ļÉśņ¢┤ ņ׳ņ¢┤ ļŗżļźĖ ņäĖļÅÖļ¦ź ļ░Å ņäĖņĀĢļ¦źĻ│╝ļÅä ņŚ░Ļ▓░ļÉśļŖö ĒŖ╣ņä▒ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üĒĢ┤ ļ│╝ ņłś ņ׳ņ£╝ļéś[
23], ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļØ╝ ņāØĻ░üĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ 3ņ░© ņāüĻĖēņóģĒĢ®ņØśļŻīĻĖ░Ļ┤ĆņŚÉ ļé┤ņøÉĒĢśņŚ¼ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņ£╝ļĪ£ ņ¦äļŗ© ļ░øņØĆ ĒÖśņ×ÉņÖĆ Ļ▓Ćņ¦ä ļ¬®ņĀüņ£╝ļĪ£ ļģ╣ļé┤ņן Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ē ļ░øņØĆ Ļ▓ĮņÜ░ļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆĻ│Ā, ļīĆņāüņ×ÉņØś ņłśĻ░Ć ņāüļīĆņĀüņ£╝ļĪ£ ņĀüņ¢┤ ņØ┤ļĪ£ ņØĖĒĢ£ ļ╣äļÜżļ”╝ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ļśÉĒĢ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ņ¦äļŗ© ļŗ╣ņŗ£ ņŗ£Ē¢ēĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśü ļ░Å ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśüņłĀļĪ£ ņĖĪņĀĢĒĢ£ ņłśņ╣śļź╝ ļŗ©ļ®┤ņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆņ£╝ļ®░ Ē¢źĒøä ņČöĻ░Ć ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ņŗ£Ļ░äņŚÉ ļö░ļźĖ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░£ļ│æ ņ£Āļ¼┤ ļ░Å Ļ▓ĮĻ│╝ņØś ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢ┤ ļ│┤ļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ Ļ░ü ĻĄ░ Ļ░äņØś ļ╣äĻĄÉ ņŗ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØĖ ņśüņŚŁņŚÉņä£ļŖö ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäĻ░Ć Ļ░ÖņØ┤ Ļ░ÉņåīĒĢśņśĆņ£╝ļéś ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņØ┤ĒÖśņĢłņØä ļ░śļīĆņĢł ļ╣äĻĄÉ ņŗ£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ ņÖĖņĖĪ ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä, ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉ ņŗ£ ĒÖ®ļ░śļČĆ ņØ┤ņĖĪ ņśüņŚŁņØś Ļ┤Ćļźśļ░ĆļÅä, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ļ░śļīĆņĢłĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ ļ╣äĻĄÉ ņŗ£ ĒÖ®ļ░śļČĆ ņÖĖņĖĪ ņśüņŚŁ ĒÅēĻĘĀņØś Ļ┤Ćļźśļ░ĆļÅäĻ░Ć ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņØ┤ļŖö ņØ╝ņĀĢĒĢ£ Ļ▓ĮĒ¢źņØä ļ│┤ņØ┤ņ¦Ć ņĢŖĻ│Ā ņé░ļ░£ņĀüņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ»ĆļĪ£ ĒĢ┤ņäØ ņŗ£ ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢśĻ▓Āļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØś ņØ┤ĒÖśņĢłĻĄ░ņŚÉņä£ ļ░śļīĆņĢł ļ░Å ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņŻ╝ļ│ĆļČĆ ļ░Å ĒÖ®ļ░śļČĆ Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś Ļ┤Ćļźśļ░ĆļÅäņÖĆ ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć Ļ░ÉņåīļÉ©ņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£ ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ļ░śļīĆņĢłĻĄ░ņØĆ ņĀĢņāü ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒÖ®ļ░śļČĆ ļé┤ņĖĪ ņĢäļלņ¬Į ņśüņŚŁņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅä ļ░Å Ļ┤Ćļźśļ░ĆļÅäņØś Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ļö░ļØ╝ņä£ ļŗ©ņĢł ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ļÅä ņČöĒøä ļ░śļīĆņĢłņŚÉ ļģ╣ļé┤ņןņØ┤ ļ░£ņāØĒĢśļŖö ņ¦ĆņŚÉ Ļ┤ĆĒĢ£ ņŻ╝ņØśĻ╣ŖņØĆ Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļ®░, ņĀĢņāüņĢłņĢĢļģ╣ļé┤ņןņØś ņ¦äļŗ© ļ░Å ņ╣śļŻīņŚÉ ņ׳ņ¢┤ņä£ļÅä ļ¦Øļ¦ēĒśłļźśņÖĆ Ļ┤ĆļĀ©ļÉ£ ņÜöņØĖņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżĻ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
Figure┬Ā1.
Image analysis of superficial capillary plexus. Superficial retinal layer, which extends from the internal limiting membrane (ILM) to the inner plexiform layer. The superficial retinal layer images of peripapillary area (A) and macular area (C), extend from the ILM to the inner plexiform layer, was obtained by optical coherence tomography angiography. With BruchŌĆÖs membrane opening as the center of the grid, the early treatment diabetic retinopathy study grid subfield was applied to the peripapillary image. (B) It was applied to macular area also with fovea as the center of the grid. (D) Each area is divided by 3 concentric circles and each circle indicates the boundary of 0.5, 1.5, 3 mm radius from the center. The outer ring-shaped area is segmented into 4 quadrants (superior, nasal, inferior, temporal). Vessel densities and perfusion densities in peripapillary area and macular area were calculated by built-in software. The margin of foveal avascular zone was automatically demarcated, area and perimeter were calculated (E).
Figure┬Ā2.
Image analysis of deep capillary plexus. The deep layer image of macular area, extend from the inner nuclear layer to the outer plexiform layer, was obtained by optical coherence tomography angiography, with removing projection artifacts using the built-in software (A). The obtained image was binarized to measure the perfusion density (B). Blood vessel density was measured by skeletonizing the binarized image (C).
Figure┬Ā3.
Example of the superficial capillary plexus images analysis. The example of the superficial capillary plexus images of patient with right unilateral normal tension glaucoma (NTG) and normal control patient, the vessel density of the outer-inferior macular area of the NTG affected eye (15.3 mm-1) (A) was decreased compared to the NTG patientŌĆÖs fellow eye (18.8 mm-1) (B) and the normal control eye (19.7 mm-1) (C).

Table┬Ā1.
Demographics characteristics
|
Characteristic |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
p-value* (1, 2 & 3) |
|
Sex (M/F) |
11/13 |
11/13 |
13/16 |
0.942 |
|
Pseudophakia |
1 (4.17) |
1 (4.17) |
3 (10.34) |
0.397 |
|
DM |
1 (4.17) |
1 (4.17) |
6 (20.69) |
0.084 |
|
HTN |
7 (29.17) |
7 (29.17) |
4 (13.79) |
0.170 |
|
Age (years) |
51.83 ┬▒ 14.20 |
51.83 ┬▒ 14.20 |
52.90 ┬▒ 13.68 |
0.681 |
|
|
|
|
(1) & (2) & (3) |
|
BCVA (logMAR) |
0.04 ┬▒ 0.09 |
0.03 ┬▒ 0.77 |
0.02 ┬▒ 0.10 |
0.797 |
|
S.E. (diopters) |
-2.30 ┬▒ 2.49 |
-2.15 ┬▒ 2.51 |
-1.25 ┬▒ 1.59 |
0.155 |
|
IOP (mmHg) |
15.17 ┬▒ 3.00 |
15.83 ┬▒ 2.91 |
15.62 ┬▒ 2.98 |
0.729 |
Table┬Ā2.
Comparison between RNFL thickness & C/D ratio
|
Parameters |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
Kruskal-Wallis test (1 & 2 & 3) |
Bonferroni post-hoc analysis* (1 & 3) |
Bonferroni post-hoc analysis* (2 & 3) |
Wilcoxon signed rank test* (1 & 2) |
|
C/D ratio |
0.70 ┬▒ 0.10 |
0.60 ┬▒ 0.13 |
0.64 ┬▒ 0.15 |
0.020ŌĆĀ
|
0.321 |
1.000 |
<0.001ŌĆĀ
|
|
RNFL |
|
|
|
|
|
|
|
|
ŌĆā |
Average (╬╝m) |
78.54 ┬▒ 8.38 |
91.13 ┬▒ 7.9 |
94.21 ┬▒ 12.23 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.815 |
<0.001ŌĆĀ
|
|
Superior (╬╝m) |
99.42 ┬▒ 19.57 |
110.13 ┬▒ 13.58 |
117.66 ┬▒ 21.03 |
0.007ŌĆĀ
|
0.002ŌĆĀ
|
0.459 |
0.013ŌĆĀ
|
|
Temporal (╬╝m) |
68.75 ┬▒ 13.32 |
77.17 ┬▒ 15.54 |
72.17 ┬▒ 13.79 |
0.292 |
|
|
|
|
Inferior (╬╝m) |
84.21 ┬▒ 15.79 |
115.71 ┬▒ 15.82 |
123.00 ┬▒ 20.64 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.448 |
<0.001ŌĆĀ
|
|
Nasal (╬╝m) |
59.75 ┬▒ 9.21 |
61.00 ┬▒ 7.69 |
64.79 ┬▒ 10.97 |
0.193 |
|
|
|
Table┬Ā3.
Comparison between GCIPL thickness
|
GCIPL thickness |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
Kruskal-Wallis test (1 & 2 & 3) |
Bonferroni post-hoc analysis* (1 & 3) |
Bonferroni post-hoc analysis* (2 & 3) |
Wilcoxon signed rank test* (1 & 2) |
|
Average (╬╝m) |
71.79 ┬▒ 6.20 |
81.17 ┬▒ 5.62 |
82.79 ┬▒ 5.29 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.940 |
<0.001ŌĆĀ
|
|
Superior (╬╝m) |
76.00 ┬▒ 9.94 |
81.79 ┬▒ 6.24 |
82.72 ┬▒ 5.64 |
0.022ŌĆĀ
|
0.006ŌĆĀ
|
1.000 |
0.002ŌĆĀ
|
|
Superotemporal (╬╝m) |
75.50 ┬▒ 10.40 |
80.50 ┬▒ 6.01 |
82.62 ┬▒ 5.61 |
0.008ŌĆĀ
|
0.004ŌĆĀ
|
0.962 |
<0.004ŌĆĀ
|
|
Inferotemporal (╬╝m) |
64.13 ┬▒ 10.04 |
80.88 ┬▒ 5.49 |
83.45 ┬▒ 5.41 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.624 |
<0.001ŌĆĀ
|
|
Inferior (╬╝m) |
64.00 ┬▒ 11.57 |
77.92 ┬▒ 6.50 |
81.24 ┬▒ 5.86 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.467 |
<0.001ŌĆĀ
|
|
Inferonasal (╬╝m) |
71.92 ┬▒ 10.38 |
81.83 ┬▒ 6.51 |
83.00 ┬▒ 5.92 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
1.000 |
<0.001ŌĆĀ
|
|
Superonasal (╬╝m) |
79.42 ┬▒ 9.10 |
84.17 ┬▒ 6.76 |
84.52 ┬▒ 6.31 |
0.030ŌĆĀ
|
0.051 |
1.000 |
0.001ŌĆĀ
|
Table┬Ā4.
Comparison of SCP OCTA parameters in peripapillary area
|
OCTA parameters |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
Kruskal-Wallis test (1 & 2 & 3) |
Bonferroni post-hoc analysis* (1 & 3) |
Bonferroni post-hoc analysis* (2 & 3) |
Wilcoxon signed rank test* (1 & 2) |
|
VD center (mm-1) |
2.30 ┬▒ 2.19 |
3.48 ┬▒ 2.75 |
3.36 ┬▒ 3.57 |
0.368 |
|
|
|
|
VD inner (mm-1) |
|
|
|
|
|
|
|
|
ŌĆā |
Average |
15.35 ┬▒ 2.15 |
17.16 ┬▒ 1.63 |
16.63 ┬▒ 1.62 |
0.011ŌĆĀ
|
0.041ŌĆĀ
|
0.907 |
<0.001ŌĆĀ
|
|
Superior |
17.58 ┬▒ 2.36 |
17.40 ┬▒ 2.74 |
17.40 ┬▒ 2.94 |
0.931 |
|
|
|
|
Temporal |
13.27 ┬▒ 4.71 |
15.25 ┬▒ 4.18 |
15.11 ┬▒ 3.83 |
0.258 |
|
|
|
|
Inferior |
13.26 ┬▒ 3.62 |
17.76 ┬▒ 3.58 |
16.71 ┬▒ 2.74 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.671 |
<0.001ŌĆĀ
|
|
Nasal |
17.33 ┬▒ 2.07 |
18.22 ┬▒ 2.07 |
17.32 ┬▒ 2.31 |
0.265 |
|
|
|
|
VD outer (mm-1) |
|
|
|
|
|
|
|
|
Average |
17.50 ┬▒ 2.85 |
18.54 ┬▒ 1.06 |
18.89 ┬▒ 1.28 |
0.010ŌĆĀ
|
0.030ŌĆĀ
|
1.000 |
0.040ŌĆĀ
|
|
Superior |
17.70 ┬▒ 2.78 |
18.63 ┬▒ 1.01 |
18.78 ┬▒ 1.58 |
0.213 |
|
|
|
|
Temporal |
16.98 ┬▒ 2.91 |
19.64 ┬▒ 1.12 |
19.88 ┬▒ 1.15 |
0.089 |
|
|
|
|
Inferior |
16.97 ┬▒ 3.42 |
18.70 ┬▒ 1.81 |
19.10 ┬▒ 1.09 |
<0.001ŌĆĀ
|
0.001ŌĆĀ
|
1.000 |
0.003ŌĆĀ
|
|
Nasal |
17.70 ┬▒ 2.78 |
17.26 ┬▒ 2.33 |
17.78 ┬▒ 1.89 |
0.753 |
|
|
|
|
VD total (mm-1) |
16.59 ┬▒ 2.39 |
17.78 ┬▒ 1.00 |
17.94 ┬▒ 1.06 |
0.014ŌĆĀ
|
0.011ŌĆĀ
|
1.000 |
0.003ŌĆĀ
|
|
PD center (ratio) |
0.059 ┬▒ 0.060 |
0.087 ┬▒ 0.075 |
0.093 ┬▒ 0.105 |
0.444 |
|
|
|
|
PD inner (ratio) |
|
|
|
|
|
|
|
|
Average |
0.404 ┬▒ 0.059 |
0.450 ┬▒ 0.046 |
0.440 ┬▒ 0.045 |
0.023ŌĆĀ
|
0.041ŌĆĀ
|
1.000 |
<0.001ŌĆĀ
|
|
Superior |
0.473 ┬▒ 0.065 |
0.466 ┬▒ 0.085 |
0.456 ┬▒ 0.101 |
0.864 |
|
|
|
|
Temporal |
0.325 ┬▒ 0.121 |
0.358 ┬▒ 0.109 |
0.373 ┬▒ 0.102 |
0.287 |
|
|
|
|
Inferior |
0.354 ┬▒ 0.114 |
0.429 ┬▒ 0.102 |
0.453 ┬▒ 0.076 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
1.000 |
<0.001ŌĆĀ
|
|
Nasal |
0.456 ┬▒ 0.065 |
0.464 ┬▒ 0.061 |
0.458 ┬▒ 0.069 |
0.444 |
|
|
|
|
PD outer (ratio) |
|
|
|
|
|
|
|
|
Average |
0.444 ┬▒ 0.077 |
0.468 ┬▒ 0.031 |
0.481 ┬▒ 0.035 |
0.003ŌĆĀ
|
0.036ŌĆĀ
|
1.000 |
0.128 |
|
Superior |
0.457 ┬▒ 0.077 |
0.481 ┬▒ 0.033 |
0.489 ┬▒ 0.043 |
0.143 |
|
|
|
|
Temporal |
0.454 ┬▒ 0.086 |
0.482 ┬▒ 0.027 |
0.487 ┬▒ 0.029 |
0.411 |
|
|
|
|
Inferior |
0.442 ┬▒ 0.080 |
0.479 ┬▒ 0.050 |
0.496 ┬▒ 0.031 |
0.001ŌĆĀ
|
0.003ŌĆĀ
|
0.837 |
0.014ŌĆĀ
|
|
Nasal |
0.421 ┬▒ 0.091 |
0.435 ┬▒ 0.065 |
0.450 ┬▒ 0.051 |
0.556 |
|
|
|
|
PD total (ratio) |
0.424 ┬▒ 0.065 |
0.453 ┬▒ 0.029 |
0.460 ┬▒ 0.029 |
0.017ŌĆĀ
|
0.012ŌĆĀ
|
1.000 |
0.009ŌĆĀ
|
Table┬Ā5.
Comparison of SCP OCTA parameters in macular area
|
OCTA parameters |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
Kruskal-Wallis test (1 & 2 & 3) |
Bonferroni post-hoc analysis* (1 & 3) |
Bonferroni post-hoc analysis* (2 & 3) |
Wilcoxon signed rank test* (1 & 2) |
|
VD center (mm-1) |
9.45 ┬▒ 3.19 |
8.50 ┬▒ 2.82 |
9.88 ┬▒ 3.47 |
0.253 |
|
|
|
|
VD inner (mm-1) |
|
|
|
|
|
|
|
|
ŌĆā |
Average |
18.32 ┬▒ 1.46 |
17.88 ┬▒ 1.32 |
18.58 ┬▒ 0.75 |
0.183 |
|
|
|
|
Superior |
18.76 ┬▒ 1.33 |
18.10 ┬▒ 1.34 |
18.46 ┬▒ 0.88 |
0.075 |
|
|
|
|
Temporal |
17.85 ┬▒ 2.16 |
17.57 ┬▒ 1.56 |
18.61 ┬▒ 0.84 |
0.019ŌĆĀ
|
0.254 |
0.058 |
0.084 |
|
Inferior |
17.78 ┬▒ 1.88 |
17.69 ┬▒ 2.09 |
18.91 ┬▒ 0.81 |
0.008ŌĆĀ
|
0.045ŌĆĀ
|
0.027ŌĆĀ
|
0.489 |
|
Nasal |
18.85 ┬▒ 1.26 |
18.16 ┬▒ 1.34 |
18.48 ┬▒ 1.23 |
0.146 |
|
|
|
|
VD outer (mm-1) |
|
|
|
|
|
|
|
|
Average |
17.53 ┬▒ 1.57 |
18.02 ┬▒ 1.54 |
18.77 ┬▒ 0.62 |
0.006ŌĆĀ
|
0.003ŌĆĀ
|
0.129 |
0.235 |
|
Superior |
18.47 ┬▒ 1.36 |
18.20 ┬▒ 1.98 |
18.84 ┬▒ 0.87 |
0.517 |
|
|
|
|
Temporal |
16.36 ┬▒ 2.54 |
16.49 ┬▒ 2.69 |
17.51 ┬▒ 1.08 |
0.141 |
|
|
|
|
Inferior |
15.99 ┬▒ 2.42 |
17.63 ┬▒ 2.30 |
18.76 ┬▒ 0.94 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.127 |
0.016ŌĆĀ
|
|
Nasal |
19.25 ┬▒ 1.40 |
19.93 ┬▒ 0.93 |
19.88 ┬▒ 0.93 |
0.191 |
|
|
|
|
VD total (mm-1) |
17.48 ┬▒ 1.54 |
17.73 ┬▒ 1.44 |
18.47 ┬▒ 0.59 |
0.041ŌĆĀ
|
0.018ŌĆĀ
|
0.108 |
0.502 |
|
PD center (ratio) |
0.214 ┬▒ 0.075 |
0.192 ┬▒ 0.063 |
0.221 ┬▒ 0.090 |
0.347 |
|
|
|
|
PD inner (ratio) |
|
|
|
|
|
|
|
|
Average |
0.446 ┬▒ 0.036 |
0.431 ┬▒ 0.032 |
0.451 ┬▒ 0.021 |
0.054 |
|
|
|
|
Superior |
0.461 ┬▒ 0.031 |
0.445 ┬▒ 0.034 |
0.442 ┬▒ 0.055 |
0.136 |
|
|
|
|
Temporal |
0.441 ┬▒ 0.055 |
0.429 ┬▒ 0.040 |
0.450 ┬▒ 0.021 |
0.080 |
|
|
|
|
Inferior |
0.428 ┬▒ 0.049 |
0.420 ┬▒ 0.051 |
0.461 ┬▒ 0.022 |
<0.001ŌĆĀ
|
0.017ŌĆĀ
|
0.002ŌĆĀ
|
0.361 |
|
Nasal |
0.452 ┬▒ 0.030 |
0.433 ┬▒ 0.040 |
0.443 ┬▒ 0.032 |
0.156ŌĆĀ
|
|
|
|
|
PD outer (ratio) |
|
|
|
|
|
|
|
|
Average |
0.437 ┬▒ 0.039 |
0.437 ┬▒ 0.066 |
0.470 ┬▒ 0.018 |
0.001ŌĆĀ
|
0.030ŌĆĀ
|
0.031ŌĆĀ
|
0.376 |
|
Superior |
0.444 ┬▒ 0.089 |
0.459 ┬▒ 0.051 |
0.475 ┬▒ 0.022 |
0.222 |
|
|
|
|
Temporal |
0.381 ┬▒ 0.092 |
0.407 ┬▒ 0.069 |
0.437 ┬▒ 0.028 |
0.003ŌĆĀ
|
0.011ŌĆĀ
|
0.336 |
0.176 |
|
Inferior |
0.391 ┬▒ 0.095 |
0.440 ┬▒ 0.059 |
0.475 ┬▒ 0.028 |
<0.001ŌĆĀ
|
<0.001ŌĆĀ
|
0.187 |
0.016ŌĆĀ
|
|
Nasal |
0.460 ┬▒ 0.093 |
0.495 ┬▒ 0.024 |
0.493 ┬▒ 0.025 |
0.351 |
|
|
|
|
PD total (ratio) |
0.433 ┬▒ 0.038 |
0.438 ┬▒ 0.036 |
0.459 ┬▒ 0.016 |
0.013ŌĆĀ
|
0.010ŌĆĀ
|
0.061 |
0.449 |
|
FAZ area (mm2) |
0.297 ┬▒ 0.109 |
0.331 ┬▒ 0.105 |
0.291 ┬▒ 0.121 |
0.422 |
|
|
|
|
FAZ perimeter (mm) |
2.246 ┬▒ 0.147 |
2.429 ┬▒ 0.582 |
2.187 ┬▒ 0.448 |
0.419 |
|
|
|
Table┬Ā6.
Comparison of DCP OCTA parameters in macular area
|
OCTA parameters |
NTG-affected eyes (1, n = 24) |
Fellow eyes (2, n = 24) |
Normal control (3, n = 29) |
Kruskal-Wallis test (1 & 2 & 3) |
|
PD total (ratio) |
0.229 ┬▒ 0.028 |
0.229 ┬▒ 0.029 |
0.236 ┬▒ 0.040 |
0.455 |
|
VD total (mm-1) |
9.00 ┬▒ 1.00 |
8.99 ┬▒ 0.98 |
9.20 ┬▒ 1.34 |
0.522 |
REFERENCES
2) Lee BL, Bathija R, Weinreb RN. The definition of normal-tension glaucoma. J Glaucom 1998;7:366-71.

3) Trivli A, Koliarakis I, Terzidou C, et al. Normal-tension glaucoma: pathogenesis and genetics. Exp Ther Med 2019;17:563-74.

4) Spaide RF, Klancnik JM Jr, Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomography angiography. JAMA Ophthalmol 2015;133:45-50.


7) Jia Y, Wei E, Wang X, et al. Optical coherence tomography angiography of optic disc perfusion in glaucoma. Ophthalmology 2014;121:1322-32.


10) Tepelus TC, Song S, Borrelli E, et al. Quantitative analysis of retinal and choroidal vascular parameters in patients with low tension glaucoma. J Glaucoma 2019;28:557-62.


11) Menke MN, Berisha F, Trempe CL, Feke GT. Different patterns of retinal nerve fiber loss in patients with normal tension glaucoma versus patients with inflammatory optic neuropathy demonstrated with OCT. Invest Ophthalmol Vis Sci 2006;47:1082.
12) Baniasadi N, Paschalis EI, Haghzadeh M, et al. Patterns of retinal nerve fiber layer loss in different subtypes of open angle glaucoma using spectral domain optical coherence tomography. J Glaucoma 2016;25:865-72.


14) Tuulonen A, Takamoto T, Wu DC, Schwartz B. Optic disk cupping and pallor measurements of patients with a disk hemorrhage. Am J Ophthalmol 1987;103:505-11.


15) Normal Tension Glaucoma Study. Collaborative normal tension glaucoma study. Curr Opin Ophthalmol 2003;14:86-90.


16) Krupin T, Liebmann JM, Greenfield DS, et al. The Low-pressure Glaucoma Treatment Study (LoGTS) study design and baseline characteristics of enrolled patients. Ophthalmology 2005;112:376-85.


18) Rao HL, Pradhan ZS, Weinreb RN, et al. Vessel density and structural measurements of optical coherence tomography in primary angle closure and primary angle closure glaucoma. Am J Ophthalmol 2017;177:106-15.


19) Browning DJ. Retinal vein occlusions, 1st ed. Cham: Springer, 2012;1-31.
20) Shweiki D, Itin A, Soffer D, Keshet E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature 1992;359:843-5.


21) Mangouritsas G, Koutropoulou N, Ragkousis A, et al. Peripapillary vessel density in unilateral preperimetric glaucoma. Clin Ophthalmol 2019;13:2511-9.


Biography
ņĪ░ņ░ĮņÜ░ / Chang Woo Cho
ņØĖņĀ£ļīĆĒĢÖĻĄÉ ņØśĻ│╝ļīĆĒĢÖ ļČĆņé░ļ░▒ļ│æņøÉ ņĢłĻ│╝ĒĢÖĻĄÉņŗż
Department of Ophthalmology, Busan Paik Hospital, Inje University College of Medicine









 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




