 |
 |
| J Korean Ophthalmol Soc > Volume 62(10); 2021 > Article |
|
국문초록
대상과 방법
2009년 2월부터 2020년 3월까지 본원에서 안와내용적출술을 시행받은 14명 환자들의 임상 결과(종양의 원발 병변, 종양의 병리조직학적 진단, 국소 재발 또는 전신 전이의 비율, 종양 절제면의 잔존 종양 유무에 따른 전신 전이 발생률과 생존율, 전체 생존율과 무병 생존율, 수술 후 항암 또는 방사선 보조요법 유무)를 후향적으로 조사하였다.
결과
총 14명의 환자 중 남자는 7명, 여자는 7명이었으며 수술을 시행 받을 당시의 평균 연령은 68세(37-80세)였고 평균 추적 관찰 기간은 44.6개월(10-133개월)이었다. 눈꺼풀이 원발 병변인 것이 7예(50.0%)로 가장 많았고, 병리조직 진단으로는 악성 흑색종이 5건(35.7%)으로 가장 많았다. 수술 후 종양의 국소적 재발은 없었으며 원격 전이는 총 7예에서 발생하였는데 악성 흑색종 5예 중 4예에서 발생하여 가장 많았다. 6예(42.9%)에서 수술 후 절제면에서 잔존 종양이 관찰되었으며 이들의 전신 전이 발생률은 42.9%, 전체 생존율은 60%였다. 1년 전체 생존율은 100%, 2년 전체 생존율은 81.8%, 5년 전체 생존율은 56.1%였으며, 1년 무병 생존율은 100%, 2년 무병 생존율은 72.7%, 5년 무병 생존율은 49.9%였다. 수술 후 9예에서 방사선 또는 항암 보조요법을 시행하였으며 이 중 6예에서는 전신 항암요법과 방사선 보조요법을 병행하였다.
ABSTRACT
Purpose
We report the clinical outcomes of Korean patients who were diagnosed with orbital malignancies and underwent orbital exenteration.
Methods
We retrospectively reviewed the tumor origins, histopathological diagnoses, local/regional recurrences, distant metastases, surgical margin clearances, overall and event-free survivals, and adjuvant chemotherapy or radiation therapy statuses of 14 patients who underwent orbital exenteration in our center from February 2009 to March 2020.
Results
We enrolled seven men and seven women of mean age at the time of exenteration of 68 years (range, 37 to 80 years). The mean follow-up period was 44.6 months (range, 10 to 133 months). Most tumors had arisen in the eyelid (seven cases, 50.0%). The most common pathological diagnosis was malignant melanoma (five cases, 35.7%). We observed no local or regional recurrence after exenteration, but distant metastases developed in seven cases, of which four were malignant melanomas (80% of all melanomas). Positive surgical margins were observed in six cases (42.9%). The distant metastasis rate was 42.9%; the overall survival rate was 60%. The 1-year overall survival rate was 100%, the 2-year survival rate was 81.8%, and the 5-year survival rate was 56.1%. The 1-year event-free survival (EFS) rate was 100%, the 2-year EFS rate was 72.7%, and the 5-year EFS rate was 49.9%. Nine patients received adjuvant radiation or chemotherapy and six patients received combined chemoradiation.
안와내용적출술(exenteration)은 안구뿐만 아니라 안와골막에 둘러싸여 있는 안검, 안와격벽, 안와주위조직을 포함한 안와 내용물을 광범위하게 제거하는 수술로서 안와 조직의 악성종양이나 실명을 수반한 심한 진균성 안내염 또는 안와염에서 단순절제나 방사선치료만으로 완치가 힘들 때 환자의 생존율 향상을 위하여 최종적으로 고려되는 수술이다. 광범위한 수술 범위로 인하여 심각한 미용적 합병증이 남기 때문에 안검을 남겨두는 변형된 수술법[1]이나 수술 후 결막[2]이나 안와골막[3]의 재건술에 대한 연구도 이루어져있다.
안와 조직까지 침범한 악성종양의 빈도가 매우 낮기 때문에 안와내용적출술의 결과에 대한 보고도 적으며 국내 보고는 1건에 불과하다[4]. 해외의 경우, 1989년에 Bartley et al [5]에 의해 보고된 20년간 시행된 102건에 대한 결과와 2018년에 Zhang et al [6]에 의해 보고된 10년간의 102건에 대한 결과가 현재까지 가장 큰 표본 수 연구로 알려져 있으며 그 외에 Levin and Dutton [7]에 의해 보고된 20년간의 99건의 결과, Mohr and Esser [8]에 의해 보고된 20년간의 77건의 결과, Rahman et al [9]에 의해 보고된 13년간의 69건의 결과, Nagendran et al [10]에 의해 보고된 10년간의 25건의 결과, Naquin [11]에 의해 보고된 25년간의 48건의 결과, Rathbun et al [12]에 의해 보고된 30년간의 48건의 결과 등이 있다. 저자들은 안와를 침범한 악성종양 환자들에게 시행한 안와내용적출술의 임상 결과에 대해 보고하고자 한다.
본 연구에 포함된 환자들은 모두 조직검사를 통해 안와를 침범한 악성종양으로 진단된 경우였으며, 2009년 2월부터 2020년 3월까지 본원에서 안와내용적출술을 시행받은 14명의 환자들의 의무기록을 후향적으로 분석하였다. 추적 관찰이 중단된 환자의 경우 유선으로 연락하여 현재 생존 유무, 재발 여부 및 추가 항암 또는 방사선 보조 요법 유무를 확인하였다. 환자들의 성별, 나이, 수술 전 시력, 종양의 병리조직학적 진단 및 원발지를 분석하였으며 안와내용적출술의 임상 결과로 수술 후 국소적 재발 혹은 전신 전이의 유무, 종양 절제면의 잔존 종양 유무에 따른 전신 전이 발생률과 생존율, 수술 환자들의 전체 생존율과 무병 생존율, 종양의 병리조직학적 진단에 따른 수술 후 항암 또는 방사선 보조 요법 유무가 포함되었다. 전체 생존율과 무병 생존율 통계는 카플란-마이어 생존분석을 이용하였다. 본 연구는 헬싱키선언에 입각한 연구윤리심의위원회(IRB)의 승인을 받아(심사 번호: KC21RASI0482) 진행되었다.
총 14명의 환자 중 남자는 7명, 여자는 7명이었다. 안와내용적출술을 시행 받을 당시의 환자 나이는 37세에서 80세였고 평균 연령은 68세였다. 추적 관찰 기간은 10개월에서 133개월까지였으며 평균 기간은 44.6개월이었다. 14명 중 6명의 진단 당시 나안시력은 0.63 이상이었고 6명의 나안 시력은 0.2 이하였으며, 1명은 본원 내원 전 녹내장으로 인한 안구위축으로 타병원에서 안구내용제거술을 시행 받은 상태였고 1명은 광범위한 종양 크기와 이로 인한 안검하수로 시력측정이 불가능하였다(Table 1).
종양의 원발지로는 안검을 원발지로 하는 것이 7예(50.0%)로 가장 많았고, 누선이 3예(21.4%), 결막이 2예(14.3%), 구후조직과 누낭이 각각 1예(7.1%)씩을 차지하였다(Table 2). 종양의 병리조직학적 진단으로는 악성흑색종(malignant melanoma)이 5예(35.7%)로 가장 많았으며 그 외에 편평세포암종(squamous cell carcinoma) 4예(28.6%), 피지샘암종(sebaceous gland carcinoma) 2예(14.3%), 샘낭암종(adenoid cystic carcinoma) 2예(14.3%), 바닥세포암종(basal cell carcinoma) 1예(7.1%)가 있었다(Table 1).
14명의 환자 중 2명은 수술 전 시행한 영상학적 검사에서 각각 뇌, 천골로의 전이가 이미 이루어진 상태였으며 2명 모두 조직검사 결과 악성흑색종으로 진단되었다. 이들에서 모두 안와내용적출술을 시행한 이후에도 추가적인 원격전이가 발생하였다. 5명의 환자는 본원에서 안와내용적출술을 시행 받기 전 본원 또는 타병원에서 안검이나 결막의 종양을 진단받고 국소적 제거 또는 방사선치료 후 경과 관찰하던 중 재발하여 본원에 내원한 경우로 수술 전 국소적 재발로 분류하였다(Table 3). 본원에서의 안와내용적출술 이후 종양의 국소적 재발은 어느 경우에서도 발생하지 않았다. 수술 후 원격전이는 총 7예(50.0%)에서 발생하였는데 이 중 악성흑색종이 4예로 57.1%을 차지하였으며 그 외 편평세포암종이 2예(28.6%), 샘낭암종이 1예(14.3%)을 차지하였다. 종양의 조직학적 분류별 원격전이의 비율은 악성 흑색종 5예 중 4예에서 원격전이가 발생하여(80%) 그 비율이 가장 높았다(Table 3).
14명의 환자 중 6명에서 수술 후 절제면에서 종양세포의 잔존이 있었는데 편평세포암종, 샘낭암종, 악석흑색종이 각각 2예씩 차지하였으며 이 중 샘낭암종 1예(50%)와 악석흑생종 2예(100%)에서 수술 후 원격전이가 발생하였고 3예 모두 항암 방사선 병합 요법을 받던 중 사망하였다. 절제면에서 잔존 종양세포가 관찰된 경우의 전신 전이 발생률은 42.9%였고 종양세포가 관찰되지 않은 경우의 전신 전이 발생률은 57.1%였다. 전체 생존율의 경우, 잔존 종양세포가 있었던 경우는 60%, 그렇지 않은 경우는 40%였다.
환자들의 1년 전체 생존율은 100%, 2년 전체 생존율은 81.8%, 5년 전체 생존율은 56.1%였으며, 1년 무병 생존율은 100%, 2년 무병 생존율은 72.7%, 5년 무병 생존율은 49.9%였다(Fig. 1). 본 연구에 포함된 14명의 환자 중 9명이 생존해 있으며(Table 3), 사망한 5명 중 4명은 종양의 원격전이로 인하여 사망하였고 1명은 수술 후 수술과 무관하게 발생한 관상동맥질환으로 스텐트 시술 도중 사망한 것으로 확인되었다.
총 9예에서 수술 후 방사선 또는 항암 보조요법을 시행하였는데, 8예에서 수술 후 방사선 보조요법을 시행하였으며 이 중 6예에서는 전신적 항암요법까지 병행하였다. 악성흑색종 1예에서는 전신적 항암요법만 시행하였다. 병행치료를 받았던 6예 중 악성흑색종이 3예로 가장 많은 비중(50%)을 차지하였으며 그 외 샘낭암종이 2예(33%)를 차지하였다(Table 4).
안와내용적출술은 안와를 침범한 악성종양이나 생명을 위협할 정도의 심한 진균 감염에서 생존율 향상을 위하여 시행할 수 있으며, 드물게는 신경섬유종증과 같이 심한 안면변형을 해결하기 위하여 시행할 수 있다[4,5,8,11,13]. 대부분의 안와내용적출술은 악성종양의 제거를 위하여 시행되며 이전 국내 보고에서의 18건 모두 악성종양의 제거를 위하여 수술을 받은 환자들이었다[4]. 해외 연구에서도 Bartley et al [5]은 20년간 시행한 안와내용적출술 102건 중 100건이 악성종양의 제거를 위하여 시행한 경우였으며, Levin and Dutton [7]의 연구에서는 99명 중 93명이, Mohr and Esser [8]의 연구에서는 77명 중 74명이, Rahman et al [9]의 연구에서는 69명 중 64명이 악성종양의 제거를 위하여 안와내용적출술을 시행하였음을 알 수 있었다. 본 연구에 포함된 14명의 환자들도 모두 악성종양의 제거를 목적으로 수술을 받았던 환자였다.
본 연구에서 가장 많은 비율을 차지한 암종은 악성흑색종(35.7%)으로 이는 기존의 연구들과 상이한 결과였다. 많은 연구에서 안와내용적출술을 시행하는 안와 악성종양으로 바닥세포암종이 가장 흔하고, 두 번째로 편평세포암종이 흔하다고 보고하고 있으며[5,7-9,14,15], 일부 연구에서는 편평세포암종이 가장 많은 비율을 차지했다고 보고하고 있다[6,16,17]. 지역이나 인종에 따라 암종의 분포가 다를 수 있기 때문에 인도인을 대상으로 한 일부 연구에서는 편평세포암종과 피지샘암종이 가장 흔하다고 보고되기도 하였다[18-20]. 악성흑색종의 수술적 치료로 안와내용적출술을 일차적으로 선택하는 것은 일반적으로 권고되지 않는데 그 이유는 종양을 국소적으로 제거하거나 종양감량술을 우선 시행한 뒤, 재발 또는 진행 소견이 관찰될 때 안와내용적출술을 시행해도 될 뿐만 아니라 일부 연구에서는 악성흑색종의 치료로 안와내용적출술을 시행하는 것이 생존율 향상에 명확한 이점이 없으며 오히려 질병의 진행을 가속화할 수 있다고 보고하고 있기 때문이다[21-25]. 본 연구에 포함된 5예의 악성흑색종 중 3예에서 타병원 또는 본원에서 국소적 종양절 제술을 우선 시행한 뒤 경과 관찰하던 중 재발 또는 안구내 침범 소견이 관찰되어 안와내용적출술을 시행하였으며, 1예에서는 수술 전 타 장기로의 원격전이 소견이 있어 광범위한 안와내용적출술을 계획하였다.
본 연구에서 수술 후 사망한 5명의 환자 중 3명은 악성흑색종으로 진단된 경우였는데 그 중 1명은 신생혈관녹내장으로 인한 안구황폐로 본원 내원 1년 전 타병원에서 안구내용제거술을 시행 받은 상태였으며 이후 발생한 안구돌출로 조직검사 결과 악성흑색종이 진단되어 본원에 내원한 경우였다. 수술 전 평가에서 이미 우측 천골로의 전신 전이가 발견되었으며 수술 후에도 척추로의 전이가 추가적으로 발생하여 방사선치료와 전신 화학요법을 병행하였으나 수술 52개월 후 사망하였다. 악성흑색종 중에서도 포도막에서 기원하여 공막 외로 침범한 악성흑색종의 경우 예후가 매우 불량하다고 알려져 있는데[21,26-28], 본 환자의 경우 과거 신생혈관녹내장이 포도막 기원의 악성흑색종이었을 가능성이 있으며, 이것이 공막 외로 침범하여 안검으로 종양이 나타나 안구돌출이 발생한 것일 수 있다. 이와 매우 유사한 증례가 2000년에 1예 보고된 바 있다[4]. 추가적으로, 포도막 기원의 악성흑색종에서는 단순안구제거 및 주위조직제거술을 시행하는 것과 비교하여 안와내용적출술을 시행하는 것의 생존율 차이가 크지 않다는 보고가 있어[9,21,26-28], 본 환자에서도 안와내용적출술이 반드시 생존 기간 연장에 도움이 되지는 않았을 것이라고 생각된다.
그 외 사망한 악성흑색종 2명에서는 수술 전 전이는 없었으나 수술 후 각각 좌측 이하선, 척추로의 전이가 발견되어 방사선 화학 병합요법을 진행하였으며 각각 수술 13, 15개월 후 사망하였다. 악성흑색종은 안와에서 발생하는 악성종양 중 1% 미만에서 발생하여 빈도는 매우 낮지만 안검종양으로 인한 전체 사망 중 2/3를 차지할 정도로 예후가 좋지 않은 암종으로 알려져 있다[29-31]. 악성흑색종의 예후에 있어 종양의 침윤 두께를 나타내는 Clark’s level과 Breslow 두께가 가장 중요하다고 알려져 있으며[31-33], 같은 악성흑색종이라도 두께가 0.76 mm보다 작은 경우 적절한 치료를 받았다면 5년 생존율이 100%인 반면 종양의 두께가 1.5 mm보다 큰 경우 5년 생존율이 50-60%라는 보고도 있다[31]. 본 연구에서 사망한 총 3예의 악성흑색종 환자들의 Breslow 두께는 각각 4.0 mm, 2.0 mm, 4.0 mm로 모두 1.5 mm보다 커 그 예후가 얼마나 불량한지 알 수 있었으며, 생존해 있는 2예의 악성흑색종 환자들의 Breslow 두께는 각각 1.0 mm, 6.0 mm였으나 6.0 mm 두께의 환자는 추적 관찰 기간이 13개월 밖에 되지 않아 지속적인 경과 관찰이 필요하다.
수술 후 사망하였던 다른 한 명은 샘낭암종 환자로 수술 전 뇌 전이 의심 소견이 있어 안와내용적출술을 시행하며 동시에 신경외과에서 개두술 및 뇌 종양 제거술을 같이 시행하였으며, 수술 이후 경과 관찰하던 중 다발성 뼈 전이가 확인되어 방사선 항암 병합요법을 받던 중 뇌 전이까지 발생하여 얼마 후인 수술 133개월에 사망하였다. 사망한 마지막 한 명은 피지샘암종 환자였는데 본원 내원 2년 전 타병원에서 피지샘암종을 진단 받고 종양제거술을 받은 뒤 경과 관찰하던 중 재발 소견으로 본원으로 의뢰되었으며 우측 하안검의 2.0 × 1.4 cm 크기, 0.7 cm 깊이의 재발성 피지샘암종에 대해 종양제거술 시행 도중 동결절편검사에서 양성이 확인되어 안와내용적출술까지 시행한 경우로, 수술 이후 국소적 재발이나 전신 전이 없이 경과 관찰하던 중 관상동맥질환으로 타병원에서 관상동맥 스텐트 시술 중 사망하였다.
절제면의 잔존 종양 유무에 따른 국소적 재발 또는 전신 전이의 발생률이나 전체 생존율의 차이를 분석하는 것 역시 중요하다. 본 연구에서는 14예 중 6예(42.9%)에서 절제면 양성이었는데 이 중 수술 후 국소적 재발은 없었으나 3예(50%)에서 전신 전이가 관찰되었으며 이들 모두 사망하였다. 해외 문헌에 따르면, 절제면의 잔존 종양 유무에 따라 국소적 재발 또는 전신 전이의 발생률은 유의미한 차이를 보이는 한편 생존율에는 유의미한 차이가 없다고 되어있다[14,17,34,35]. 본 연구에서는 절제면에서 잔존 종양이 관찰되었던 경우와 그렇지 않은 경우를 비교하였을 때, 전신 전이의 발생률은 각각 42.9%와 57.1%로 기존 문헌과 상이한 결과였으며 전체 생존율은 각각 60%와 40%였다. 단, 본 연구의 경우 표본수가 14명으로 작아 위 결과가 통계적으로 유의미한지에 대해서는 지속적인 연구를 통한 분석이 필요할 것이다.
안와 악성종양에서 안와내용적출술 후 1년 생존율과 5년 생존율을 분석한 보고로는 본 연구가 국내에서는 처음이다. 본 연구에서는 사망률만을 반영하는 전체 생존율(overall survival)과 사망 외에 국소적 재발 또는 전신 전이까지 포함하는 무병 생존율(event free survival)을 따로 분석하였다. 해외 연구에서 1년 전체 생존율은 69.1-93%, 5년 전체 생존율은 41.1-64%, 1년 무병 생존율은 66.6%, 5년 무병 생존율은 37.8-48.3%까지 다양하게 보고되고 있다[5,8,14,17,34-36]. 본 연구에서는, 1년 전체 생존율 100%, 1년 무병 생존율 100%, 5년 무병 생존율 49.9%로 기존의 연구들에 비하여 높았음을 알 수 있으며, 5년 전체 생존율은 56.1%로 다른 연구들과 유사하게 나왔음을 확인할 수 있었다(Fig. 1). 하지만 다른 연구들에 비하여 표본 수가 작아 이를 해석하는 데는 주의가 필요하며 미래에는 많은 표본 수 확보를 통해 동일 암종 간의 생존율 비교, 종양의 크기 또는 절제면의 잔존 종양 여부에 따른 생존율 비교, 전신 전이 유무에 따른 생존율 비교 등을 추가적으로 해보는 것이 바람직하겠다.
안와를 침범한 악성종양 환자에서 수술 후 항암화학요법 또는 방사선치료에 대한 지침이 전 세계적으로도 명확하지 않은 것이 현실이다[6,37]. 이는 안와 악성종양 자체의 빈도가 낮기 때문에 환자 수가 적어서일 수도 있으며, 방사선 용량 결정이나 양식에도 차이가 있기 때문일 것이다[6,37]. 본 연구에서는 수술 후 국소적 방사선 보조요법의 방사선 용량으로 55-66 Gy을 사용하였으며 수술 후 국소적 재발은 발생하지 않았다는 점에서 그 의미를 가진다. 단, 수술 후 방사선 보조요법이나 전신 항암화학요법에도 불구하고 전신 전이가 77.7%에서 발생하였으며 이 중 57.1%가 사망하였다는 점을 고려하였을 때 수술 후 방사선 또는 항암화학 보조요법이 전신 전이 발생률이나 생존율에 미치는 영향은 추가적인 고찰의 여지가 있다[38].
안와내용적출술 후 발생할 수 있는 합병증으로 부비동 간의 누공 또는 수술 부위의 감염이 흔한 것으로 보고되는데[5,7-9,19,39], 본 연구에서도 사골동으로의 누공이 수술 후 20개월에서 1예(7.1%) 관찰되었으며 안연고 점안을 통해 감염을 방지하며 방사선치료 후 자연적으로 폐쇄되었다. 그 외 감염 등의 합병증은 나타나지 않았다.
본 연구의 평균 추적 관찰 기간은 44.6개월로 그 기간이 길지 않지만 2000년 이후로 국내에서 보고하는 안와내용적출술의 첫 결과로 의미가 있으며 앞으로도 지속적인 추적 관찰과 큰 표본 수 확보를 통해 동일 암종 내에서의 생존율 비교 및 5년 생존율을 넘어 10년 생존율에 대해서도 보고할 예정이다. 안와내용적출술은 수술 후 큰 결손 부위로 인한 외관상 문제를 수반하지만 생존율 향상을 위하여 불가피하게 시행할 수 있으며 수술 전 충분한 사전 설명과 동의 획득, 수술 후 안와보조구 착용 및 항암 보조요법을 통하여 비교적 만족스러운 결과를 얻을 수 있음을 본 연구를 통해 확인할 수 있었다.
Figure 1.
Kaplan-Meier survival analysis for 14 cases. (A) Overall survival (OS). (B) Event-free survival (EFS).
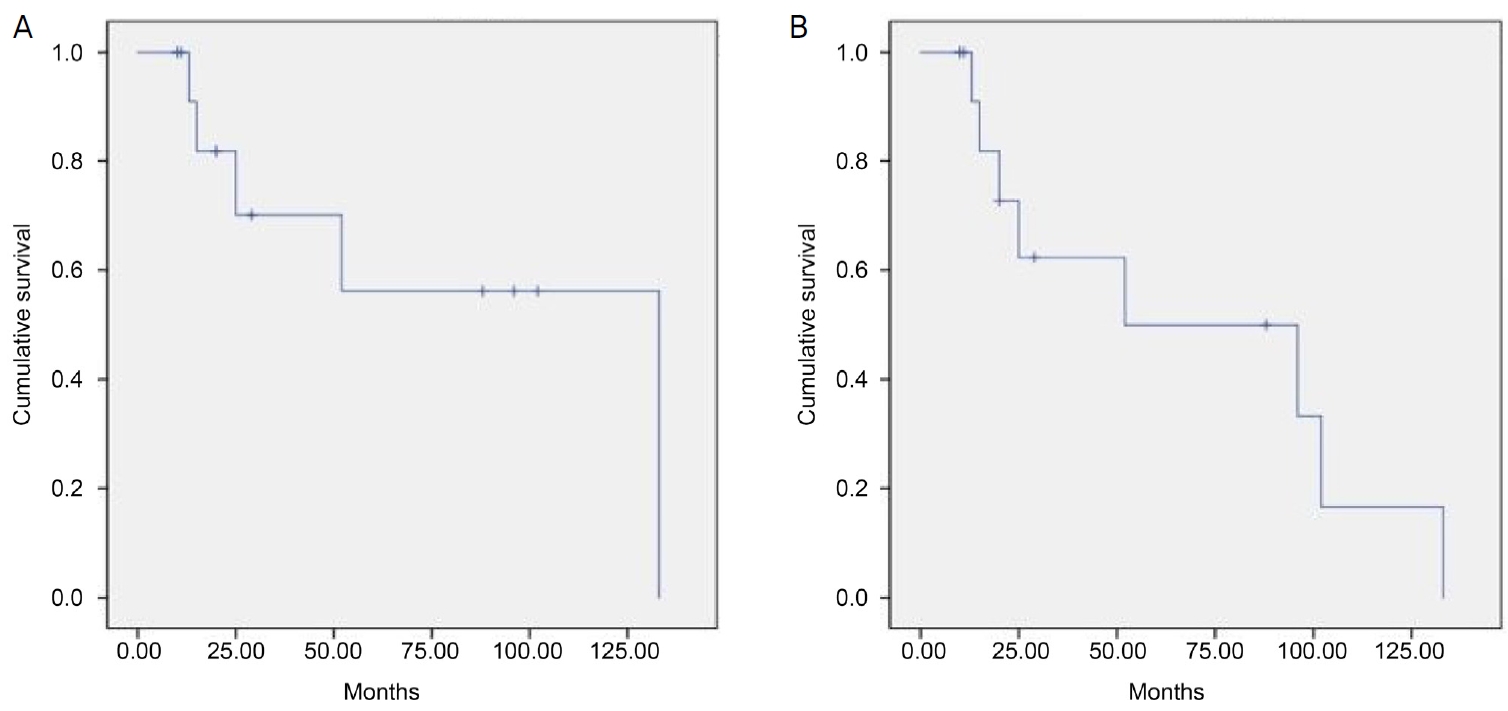
Table 1.
Demographic profile of exenterated patients
Table 2.
Tumor origin and histopathological diagnosis
Table 3.
Tumor types and recurrence of disease
Table 4.
Post-operative adjuvant treatment after exenteration
REFERENCES
1) Shields JA, Shields CL, Suvarnamani C, et al. Orbital exenteration with eyelid sparing: indications, technique, and results. Ophthalmic Surg 1991;22:292-7.


2) Frezzotti R, Nuti A. Repair after orbital exenteration. Personal technique. Acta Neurochir (Wien) 1982;60:119-24.

3) Shore JW, Burks R, Leone CR Jr, McCord CD Jr. Dermis-fat graft for orbital reconstruction after subtotal exenteration. Am J Ophthalmol 1986;102:228-36.


4) Lee SY, Lee JH, Jang JW, Kim JY. A 6-year series of orbital exenteration. J Korean Ophthalmol Soc 2000;41:1102-11.
5) Bartley GB, Garrity JA, Waller RR, et al. Orbital exenteration at the Mayo Clinic. 1967-1986. Ophthalmology 1989;96:468-73.


6) Zhang Z, Ho S, Yin V, et al. Multicentred international review of orbital exenteration and reconstruction in oculoplastic and orbit practice. Br J Ophthalmol 2018;102:654-8.


8) Mohr C, Esser J. Orbital exenteration: surgical and reconstructive strategies. Graefes Arch Clin Exp Ophthalmol 1997;235:288-95.


9) Rahman I, Cook AE, Leatherbarrow B. Orbital exenteration: a 13 year Manchester experience. Br J Ophthalmol 2005;89:1335-40.



10) Nagendran ST, Lee NG, Fay A, et al. Orbital exenteration: the 10-year Massachusetts eye and ear infirmary experience. Orbit 2016;35:199-206.


12) Rathbun JE, Beard C, Quickert MH. Evaluation of 48 cases of orbital exenteration. Am J Ophthalmol 1971;72:191-9.


13) Schwartz JN, Donnelly EH, Klintworth GK. Ocular and orbital phycomycosis. Surv Ophthalmol 1977;22:3-28.


14) Wong JC, Thampy R, Cook A. Life expectancy following orbital exenteration. Br J Ophthalmol 2015;99:1-4.


15) Kasaee A, Eshraghi B, Nekoozadeh S, et al. Orbital exenteration: a 23-year report. Korean J Ophthalmol 2019;33:366-70.



16) Ben Simon GJ, Schwarcz RM, Douglas R, et al. Orbital exenteration: one size does not fit all. Am J Ophthalmol 2005;139:11-7.


17) Aryasit O, Preechawai P, Hirunpat C, et al. Factors related to survival outcomes following orbital exenteration: a retrospective, comparative, case series. BMC Ophthalmol 2018;18:186.



18) Maheshwari R. Review of orbital exenteration from an eye care centre in western India. Orbit 2010;29:35-8.


19) Pushker N, Kashyap S, Balasubramanya R, et al. Pattern of orbital exenteration in a tertiary eye care centre in India. Clin Exp Ophthalmol 2004;32:51-4.


20) Sihota R, Tandon K, Betharia SM, Arora R. Malignant eyelid tumors in an Indian population. Arch Ophthalmol 1996;114:108-9.


21) Paridaens AD, McCartney AC, Minassian DC, Hungerford JL. Orbital exenteration in 95 cases of primary conjunctival malignant melanoma. Br J Ophthalmol 1994;78:520-8.



22) Shields CL, Shields JA, Gündüz K, et al. Conjunctival melanoma:risk factors for recurrence, exenteration, metastasis, and death in 150 consecutive patients. Arch Ophthalmol 2000;118:1497-507.


23) Shields JA, Shields CL, Gündüz K, Cater J. Clinical features predictive of orbital exenteration for conjunctival melanoma. Ophthalmic Plast Reconstr Surg 2000;16:173-8.


24) Rose AM, Luthert PJ, Jayasena CN, et al. Primary orbital melanoma: presentation, treatment, and long-term outcomes for 13 patients. Front Oncol 2017;7:316.



25) Rose AM, Cowen S, Jayasena CN, et al. Presentation, treatment, and prognosis of secondary melanoma within the orbit. Front Oncol 2017;7:125.



26) Rini FJ, Jakobiec FA, Hornblass A, et al. The treatment of advanced choroidal melanoma with massive orbital extension. Am J Ophthalmol 1987;104:634-40.


27) Pach JM, Robertson DM, Taney BS, et al. Prognostic factors in choroidal and ciliary body melanomas with extrascleral extension. Am J Ophthalmol 1986;101:325-31.


28) Kersten RC, Tse DT, Anderson RL, Blodi FC. The role of orbital exenteration in choroidal melanoma with extrascleral extension. Ophthalmology 1985;92:436-43.


29) Shan Y, Xu Y, Lu Y, et al. Epidemiology and survival outcomes for eyelid primary malignant melanoma: an analysis of 1397 cases in the SEER database. J Ophthalmol 2020;2020:4858636.



30) Malhotra R, Chen C, Huilgol SC, et al. Mapped serial excision for periocular lentigo maligna and lentigo maligna melanoma. Ophthalmology 2003;110:2011-8.


31) Cook BE Jr, Bartley GB. Epidemiologic characteristics and clinical course of patients with malignant eyelid tumors in an incidence cohort in Olmsted County, Minnesota. Ophthalmology 1999;106:746-50.


32) Breslow A. Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg 1970;172:902-8.



33) Esmaeli B, Wang B, Deavers M, et al. Prognostic factors for survival in malignant melanoma of the eyelid skin. Ophthalmic Plast Reconstr Surg 2000;16:250-7.


34) Rahman I, Maino A, Cook AE, Leatherbarrow B. Mortality following exenteration for malignant tumours of the orbit. Br J Ophthalmol 2005;89:1445-8.



35) Mouriaux F, Martinot V, Pellerin P, et al. Survival after malignant tumors of the orbit and periorbit treated by exenteration. Acta Ophthalmol Scand 1999;77:326-30.


36) Nemet AY, Martin P, Benger R, et al. Orbital exenteration: a 15-year study of 38 cases. Ophthalmic Plast Reconstr Surg 2007;23:468-72.


37) Skinner HD, Garden AS, Rosenthal DI, et al. Outcomes of malignant tumors of the lacrimal apparatus: the University of Texas MD Anderson Cancer Center experience. Cancer 2011;117:2801-10.


-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,910 View
- 47 Download
- Related articles
-
Clinical Features of Iridocorneal Endothelial Syndrome in Korean Patients2024 March;65(3)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



