 |
 |
| J Korean Ophthalmol Soc > Volume 62(8); 2021 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
Ēü¼ļĪĀļ│æņ£╝ļĪ£ infliximab ņ╣śļŻīļź╝ ļ░øļŖö ĒÖśņ×ÉņŚÉņä£ ļ░£ņāØĒĢ£ ņŗ£ņŗĀĻ▓ĮņŚ╝ 1ņśłļź╝ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņ”ØļĪĆņÜöņĢĮ
22ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć 2-3ņŻ╝ ņĀäļČĆĒä░ ņóīņĢłņØś ņŗ£ņĢ╝Ļ░Ć ĒØÉļĀżņ¦ĆļŖö ņ”Øņāüņ£╝ļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņóīņĢłņØś ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØ┤ 0.4ļĪ£ ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ņāüļīĆĻĄ¼ņŗ¼ļÅÖĻ│ĄņÜ┤ļÅÖņןņĢĀĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś, ņĢłĻĄ¼ņÜ┤ļÅÖ ņŗ£ņØś ĒåĄņ”ØĻ│╝ ļÅÖĻ│ĄļČĆļō▒ņØĆ ņŚåņŚłļŗż. ņóīņĢłņØś ņāēĻ░üņØ┤ ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ņŗ£ņĢ╝Ļ▓Ćņé¼ņāü ņóīņĢłņØś ņżæņŗ¼ĒĢśņĖĪņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ļ│┤ņśĆņ£╝ļéś, ņĢłņĀĆĻ▓Ćņé¼ņāü ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļ░Å ĒÖ®ļ░śņØś ĒŖ╣ņØ┤ ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØś ņøÉņØĖ Ļ░Éļ│äņØä ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ ņĢłņÖĆ ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ ņóīņĖĪ ņŗ£ņŗĀĻ▓ĮņØ┤ ņĪ░ņśüņ”ØĻ░ĢļÉśņŚłĻ│Ā, ĻĘĖ ņÖĖ ļŗżļźĖ ļ¼ĖņĀ£ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒÖśņ×ÉļŖö Ēü¼ļĪĀļ│æņ£╝ļĪ£ ņóģņ¢æĻ┤┤ņé¼ņØĖņ×É(tumor necrosis factor, TNF)-╬▒ ņ¢ĄņĀ£ņĀ£ ņżæ ĒĢśļéśņØĖ infliximab 600 mgņØä 2Ļ░£ņøöļ¦łļŗż ņŻ╝ņé¼ņ╣śļŻī ņżæņØ┤ņŚłĻ│Ā, ņØ┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ĻĄ¼Ēøäņŗ£ņŗĀĻ▓ĮņŚ╝ņ£╝ļĪ£ ņØśņŗ¼ĒĢśņŚÉ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ ņĀĢļ¦źņŻ╝ņé¼ ļ░Å Ļ▓ĮĻĄ¼ļ│ĄņÜ®ņØä ĒĢśņśĆĻ│Ā, ņØ┤ Ēøä 3Ļ░£ņøöņ¦Ė ņŗ£ļĀź ļ░Å ņŗ£ņĢ╝Ļ░Ć ĒśĖņĀäļÉśņŚłļŗż.
ABSTRACT
Purpose
We report a case of optic neuritis related to infliximab treatment in a patient with CrohnŌĆÖs disease, along with a review of the relevant literature.
Case summary
A 22-year-male patient complained of blurred vision in the left eye for 2-3 weeks. His best-corrected visual acuity was 8/20 in the left eye. Relative afferent pupillary defect was detected in the left eye and the pupils were of equal size. There was no pain on ocular movement. The results of slit-lamp and fundus examinations were normal. A visual field test revealed a central to inferior visual field defect in the left eye. Orbit magnetic resonance imaging revealed perineural enhancement of the left optic nerve. He had a 5-year history of CrohnŌĆÖs disease and had been treated with intravenous infliximab (600 mg every 2 weeks). A diagnosis of retrobulbar optic neuritis associated with infliximab was made. He was infused with high-dose methylprednisolone, which was changed to per oral administration. His visual acuity and visual field defect improved after 3 months.
ņŗ£ņŗĀĻ▓ĮņŚ╝ņØĆ ņŗ£ņŗĀĻ▓ĮņØś ņŚ╝ņ”Ø ļ░Å Ēāłņłśņ┤łĒÖöļĪ£ ļ░£ņāØĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£, ņŻ╝ļĪ£ ļŗ©ņĢłņØś ĒåĄņ”ØņØä ļÅÖļ░śĒĢ£ ņŗ£ļĀźņĀĆĒĢś, ņŗ£ņĢ╝Ļ░Éņåī ļ░Å ņāēĻ░üņØ┤ņāüņ£╝ļĪ£ ļéśĒāĆļé£ļŗż. ņĀäĒśĢņĀüņØĖ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØĆ 20-40ļīĆ ņŚ¼ņ×ÉņŚÉņä£, ņĢłĻĄ¼ņÜ┤ļÅÖ ņŗ£ ņŗ¼ĒĢ┤ņ¦ĆļŖö ĒåĄņ”ØĻ│╝ ĒĢ©Ļ╗ś ļŗ©ņĢłņØś ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņłśņØ╝ņŚÉ Ļ▒Ėņ│É ļ░£ņāØĒĢśļ®░ ņØ┤Ēøä ņä£ņä£Ē׳ ĒśĖņĀäļÉśļŖö ĒŖ╣ņ¦ĢņØä ļ│┤ņØĖļŗż. ĻĘĖ ņøÉņØĖņØĆ ļīĆļČĆļČä ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤łĒÖöĻ░Ć ņ░©ņ¦ĆĒĢśĻ│Ā, ĻĘĖņÖĖ ļ░öņØ┤ļ¤¼ņŖż Ļ░ÉņŚ╝ņä▒ ņ¦łĒÖś, ļćīļ¦ēņØ┤ļéś ļłł ņŻ╝ņ£ä ņĪ░ņ¦ü ļ░Å ļČĆļ╣äļÅÖ ņŻ╝ņ£äņØś ņŚ╝ņ”ØņØś ĒīīĻĖē, ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖś ļō▒ņØ┤ ņ׳ļŗż[1].
Ļ▓░ĒĢĄņĢĮņĀ£ ņżæņŚÉņä£ EthambutolņŚÉ ņØśĒĢ£ ļÅģņä▒ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØĆ ļäÉļ”¼ ņĢīļĀżņĀĖ ņ׳ņ¢┤ Ļ▓░ĒĢĄņ╣śļŻī ņżæ ņŗ£ļĀźņĀĆĒĢśĻ░Ć ļ░£ņāØĒĢĀ Ļ▓ĮņÜ░ ņĢĮņĀ£ļź╝ ņżæļŗ©ĒĢśĻ│Ā ļé┤ņøÉĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒ׳ ņ׳ļŗż[2]. ĻĘĖļ¤¼ļéś ĻĘĖ ņÖĖņØś ņĢĮņĀ£ļōżņØ┤ ņŗ£ņŗĀĻ▓ĮņŚÉ ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ│┤Ļ│ĀĻ░Ć ļ¦Äņ¦Ć ņĢŖĻ│Ā, ņØ┤ņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØ┤ ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ļŗż.
ņóģņ¢æĻ┤┤ņé¼ņØĖņ×É(tumor necrosis factor, TNF)-╬▒ņŚÉ ļīĆĒĢ£ ļŗ©ņØ╝ Ēü┤ļĪĀņä▒ ĒĢŁņ▓┤ņØĖ infliximab (Remicade┬«, Schering-Plough, Welwyn Garden City, UK)ņØĆ TNF-╬▒ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ ņŚ╝ņ”Øļ░śņØæņØä ņ¢ĄņĀ£ĒĢśņŚ¼ Ēü¼ļĪĀļ│æ, ņŚ╝ņ”Øņä▒ ņןņ¦łĒÖś, ļźśļ¦łĒŗ░ņŖżņä▒ Ļ┤ĆņĀłņŚ╝ ļō▒ņØś ņĀäņŗĀ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņØś ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļ®░[3,4], ņĢłĻ│╝ņĀüņ£╝ļĪ£ļŖö ĒżļÅäļ¦ēņŚ╝, Ļ│Ąļ¦ēņŚ╝ ļō▒ ļ¦īņä▒ ņ×¼ļ░£ņä▒ ņŚ╝ņ”Øņ¦łĒÖśņŚÉņä£ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[4].
ļ░śļ®┤ TNF-╬▒ ņ¢ĄņĀ£ņĀ£ļŖö ņŗĀĻ▓ĮĻ│äĒåĄņØś Ēāłņłśņ┤łĒÖöļź╝ ņ£Āļ░£ĒĢśņŚ¼, ņŗ£ņŗĀĻ▓ĮņŚ╝, ļŗżļ░£Ļ▓ĮĒÖöņ”Ø ļō▒ņØś ļČĆņ×æņÜ®ņØä ļ░£ņāØņŗ£Ēé¼ ņłś ņ׳ļŗż[5]. ĻĘĖļ¤¼ļéś, ĻĄŁļé┤ņŚÉņä£ļŖö ņĢäņ¦üĻ╣īņ¦Ć infliximabĻ│╝ Ļ┤ĆļĀ©ĒĢ£ ņŗ£ņŗĀĻ▓ĮņŚ╝ņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀĻ░Ć ņŚåņ¢┤, ņĀĆņ×ÉļōżņØĆ Ēü¼ļĪĀļ│æņŚÉņä£ ņŻ╝ĻĖ░ņĀüņ£╝ļĪ£ TNF-╬▒ ņ╣śļŻīļź╝ ļ░øņĢäņś© ņĀŖņØĆ ļé©ņ×ÉņŚÉņä£ ņĢĮņĀ£ņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ▓āņ£╝ļĪ£ ņØśņŗ¼ņØ┤ ļÉśļŖö ņŗ£ņŗĀĻ▓ĮņŚ╝ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņ╣śļŻīĒĢ£ Ļ▓ĮņÜ░ļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ņØ┤ļź╝ ļ¼ĖĒŚī Ļ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
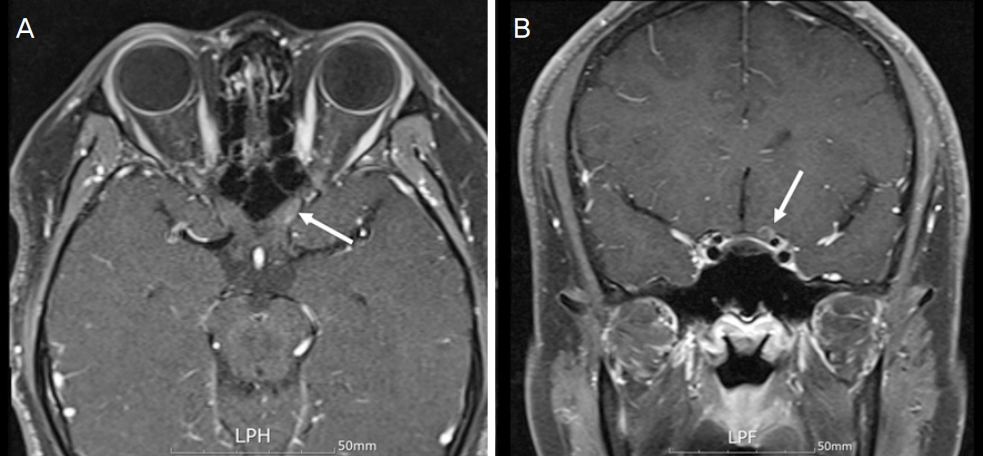
22ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć 2-3ņŻ╝ ņĀäļČĆĒä░ ņóīņĢłņØś ņŗ£ņĢ╝Ļ░Ć ĒØÉļĀżņ¦ĆļŖö ņ”Øņāüņ£╝ļĪ£ ļ│ĖņøÉ ņØæĻĖēņŗżļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ņÜ░ņĢł 1.0, ņóīņĢł 0.4ļĪ£ ņĖĪņĀĢļÉśņŚłĻ│Ā, ļÅÖĻ│ĄļČĆļō▒ņØĆ ņŚåņŚłņ£╝ļ®░, ņóīņĢłņØś ņāüļīĆĻĄ¼ņŗ¼ļÅÖĻ│ĄņÜ┤ļÅÖņןņĢĀĻ░Ć Ļ▓Įļ»ĖĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśņŚłļŗż. ņĢłĻĄ¼ņÜ┤ļÅÖņŗ£ņØś ņ£Āļ░£ļÉśļŖö ĒåĄņ”ØņØĆ ņŚåņŚłĻ│Ā, ņāēĻ░üĻ▓Ćņé¼ņŚÉņä£ ņÜ░ņĢłņØĆ 21Ļ░£ ļ¬©ļæÉ, ņóīņĢłņØĆ 21Ļ░£ ņżæ 12Ļ░£ļź╝ ļ¦×ņČöņ¢┤ ņāēĻ░üņØ┤ ņĀĆĒĢśļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, ņŗ£ņĢ╝Ļ▓Ćņé¼ņāüņŚÉņä£ ņóīņĢłņØś ņżæņŗ¼ĒĢśņĖĪņØś ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ļ│┤ņśĆļŗż(Fig. 1A). ņĢłņĀĆĻ▓Ćņé¼ņāü ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ļ░Å ļ¦Øļ¦ēņŚÉļŖö ĒŖ╣ņØ┤ ņåīĻ▓¼ņØ┤ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░, ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ĒÖ®ļ░śļČĆ ņŗĀĻ▓ĮņĀłņäĖĒż-ļé┤ļ¦ØņāüņĖĄ(ganglion cell-inner plexiform layer)ņØś ļæÉĻ╗śĻ░Ć Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłļŗż(Fig. 1B). ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØś ņøÉņØĖ Ļ░Éļ│äņØä ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ ņĢłņÖĆ ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(magnetic resonance imaging, MRI)ņŚÉņä£ ņóīņĖĪ ņŗ£ņŗĀĻ▓ĮņØś ņĢłņÖĆļé┤, Chiasm ņĢ×ņ¬Į ņĪ░ņśüņ”ØĻ░ĢņØ┤ ļ│┤ņśĆĻ│Ā, ļćīņŗżņ¦łņØś ļŗżļźĖ ļ¼ĖņĀ£ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 2). ņ£ĀņĀäņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”Ø ĒÖĢņØĖņØä ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ leber hereditary optic neuropathy ņ£ĀņĀäņ×É(LHON gene)ļŖö Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņĢśļŗż. ĒÖśņ×ÉļŖö Ēü¼ļĪĀļ│æņ£╝ļĪ£ ĒāĆļ│æņøÉņŚÉņä£ 2016ļģäļČĆĒä░ infliximab (Remicade┬«, Schering-Plough) ņ╣śļŻīļź╝ ļ░øļŹś ļČäņ£╝ļĪ£, 2019ļģäļČĆĒä░ļŖö ņÜ®ļ¤ēņØä ļæÉ ļ░░ļĪ£ ņ”Øļ¤ēĒĢśņŚ¼ 2Ļ░£ņøöļ¦łļŗż 600 mg (10 mg/kg)ņ£╝ļĪ£ ņĀĢļ¦źņŻ╝ņé¼ ņ╣śļŻīļź╝ ļ░øņĢśņ£╝ļ®░, ņÜ®ļ¤ē ņ”ØĻ░ĆĒĢ£ Ēøä 8ļ▓łņ¦Ė ņŻ╝ņé¼ļź╝ ļ¦×Ļ│Ā ļé£ Ēøä 2ņØ╝ņ¦Ė ņŗ£ļĀźņĀĆĒĢś ņ”ØņāüņØ┤ ņŗ¼ĒĢ┤ņĀĖ ļ│ĖņøÉ ņØæĻĖēņŗżļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņØ┤ņŚÉ, infliximabĻ│╝ ņŚ░Ļ┤ĆļÉ£ ĻĄ¼Ēøäņŗ£ņŗĀĻ▓ĮņŚ╝ņØä ņØśņŗ¼ĒĢśĻ│Ā, Ļ│ĀņÜ®ļ¤ēņŖżĒģīļĪ£ņØ┤ļō£ 1 g ņĀĢļ¦źņŻ╝ņé¼ļź╝ 3ņØ╝ ļÅÖņĢł ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, 3ņØ╝ņ¦Ė ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ 0.8ļĪ£ ĒśĖņĀäļÉśņŚłĻ│Ā, Ļ▓ĮĻĄ¼ņĢĮņ£╝ļĪ£ Ļ░Éļ¤ēĒĢśļ®┤ņä£ ņ╣śļŻī 1Ļ░£ņøöņ¦Ė ņŗ£ļĀźņØĆ 1.0ņ£╝ļĪ£, ņāēĻ░ü ļ░Å ņŗ£ņĢ╝ļŖö ļČĆļČäņĀüņ£╝ļĪ£ ĒśĖņĀäņØ┤ ļÉśņŚłņ£╝ļ®░, ņ╣śļŻī 3Ļ░£ņøöņ¦ĖņŚÉļŖö ļ¬©ļæÉ ĒśĖņĀäļÉśņŚłļŗż(Fig. 3). ņ╣śļŻī 2Ļ░£ņøöņ¦ĖņŚÉļŖö infliximab ņŻ╝ņé¼ ņ╣śļŻīļź╝ ņ×¼ņŗ£ņ×æĒĢśņśĆņ£╝ļéś, Ēśäņ×¼Ļ╣īņ¦Ć ņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ņ×¼ļ░£ ņ¢æņāüņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
ņóģņ¢æĻ┤┤ņé¼ņØĖņ×ÉļŖö 1975ļģä ņĢöņäĖĒżļź╝ ņäĀĒāØņĀüņ£╝ļĪ£ Ļ┤┤ņé¼ņŗ£ĒéżļŖö ņé¼ņØ┤ĒåĀņ╣┤ņØĖņ£╝ļĪ£ ņ▓śņØī ņåīĻ░£ļÉ£ ņØ┤Ēøä, ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć Ļ░ÉņŚ╝ņØ┤ļéś ņóģņ¢æņŚÉ ļīĆĒĢ£ ņĀĢņāüņĀüņØĖ ņŚ╝ņ”Øļ░śņØæ ļ░Å ļ®┤ņŚŁņ▓┤Ļ│äņŚÉņä£ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ļŗ┤ļŗ╣ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ TNFĻ░Ć ļČĆņĀüņĀłĒĢśĻ▓ī Ļ│╝ļÅä ņāØņé░ļÉĀ Ļ▓ĮņÜ░ ļ®┤ņŚŁņ▓┤Ļ│äņØś ļŗżņ¢æĒĢ£ ņäĖĒżļź╝ ĒÖ£ņä▒ĒÖöņŗ£ņ╝£ ņäĖĒż ļÅģņä▒ ĒÜ©Ļ│╝ļź╝ ņ£Āļ░£ĒĢśĻ│Ā, ņĪ░ņ¦üņØś ņåÉņāüņØä ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŗż[3].
ņóģņ¢æĻ┤┤ņé¼ņØĖņ×É ņ¢ĄņĀ£ņĀ£(TNF-╬▒ inhibitor)Ļ░Ć ņŚ╝ņ”Øļ░śņØæņØś Ļ░ĢļĀźĒĢ£ ļ¦żĻ░£ņ▓┤ņØĖ TNF-╬▒ņØś ņ×æņÜ®ņØä ņ¢ĄņĀ£ņŗ£Ēé┤ņ£╝ļĪ£ņŹ©, ļ¦īņä▒ ņŚ╝ņ”Øļ░śņØæņØä Ļ░Éņåīņŗ£ĒéżĻ│Ā, ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņØä ĒśĖņĀäņŗ£Ēé¼ ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤ ļ░ØĒśĆņ¦Ćļ®┤ņä£, ļźśļ¦łĒŗ░ņŖżņä▒ Ļ┤ĆņĀłņŚ╝, Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝, Ļ▒┤ņäĀ Ļ┤ĆņĀłņŚ╝, ņŚ╝ņ”Øņä▒ ņןņ¦łĒÖś, ĒżļÅäļ¦ēņŚ╝ ļō▒ņŚÉņä£ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[4]. Ēśäņ×¼Ļ╣īņ¦Ć ņāüņÜ®ĒÖöļÉśĻ│Ā ņ׳ļŖö TNF-╬▒ ņ¢ĄņĀ£ņĀ£ļŖö infliximab (Remicade┬«, Schering-Plough), etanercept (Enbrel┬«), adalimumab (Humira┬«), golimumab (Simponi┬«), certolizumab (Cimzia┬«) 5Ļ░Ćņ¦Ć ņóģļźśĻ░Ć ņ׳ņ£╝ļ®░[6], ņØ┤ļōżņØĆ ņĀäĒåĄņĀüņØĖ ĒĢŁļźśļ¦łĒŗ░ņŖż ņĢĮņĀ£ņØĖ methotrexate, hydroxychloroquine, sulfasalazine ļō▒ disease modifying antirheumatic drugs (DMARDs)ņØś ņ╣śļŻīņŚÉļÅä ĒÜ©Ļ│╝Ļ░Ć ļ»ĖĒØĪĒĢĀ Ļ▓ĮņÜ░ ņé¼ņÜ®ļÉśļ®░, Ļ░Ćņן ĒÜ©Ļ│╝Ļ░Ć ņóŗņØĆ ĒĢŁļźśļ¦łĒŗ░ņŖż ņ╣śļŻīņĀ£ļĪ£ņä£ ĻĄ¼ņĪ░ņĀüņØĖ ņåÉņāüņØś ļ░£ņāØņØä ņśłļ░®ĒĢ┤ņŻ╝ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĪīļŗż[7]. ĻĘĖļ¤¼ļéś, ņØ┤ļ¤¼ĒĢ£ ņ£ĀņÜ®ņä▒ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĀäņŗĀņä▒ ļŻ©ĒæĖņŖż, ĒśłĻ┤ĆņŚ╝ ļō▒ņØś ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņØś ļ░£ņāØ, Ļ▓░ĒĢĄņØś ņ£äĒŚśļÅä ņ”ØĻ░Ć, ņ╣©ņ£żņä▒ ņ¦äĻĘĀ Ļ░ÉņŚ╝ņØś ļ░£ņāØ, ņÜĖĒśłņä▒ ņŗ¼ļČĆņĀäņØś ņĢģĒÖö, Ļ░äļÅģņä▒, ļ”╝Ēöäņóģ ļō▒ ņóģņ¢æ ļ░£ņāØ ņ£äĒŚśļÅä ņ”ØĻ░ĆņÖĆ ĒĢ©Ļ╗ś ņżæņČöņŗĀĻ▓ĮĻ│äņØś Ēāłņłśņ┤łĒÖöņÖĆ Ļ┤ĆļĀ©ļÉ£ ļČĆņ×æņÜ®ņØĖ ņŗ£ņŗĀĻ▓ĮņŚ╝, ļ¦īņä▒ ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤łņä▒ ļŗżļ░£ņä▒ ņŗĀĻ▓Įļ│æņ”Ø, ĻĖĖļ”¼ņĢł ļ░öļĀł ņ”ØĒøäĻĄ░ ļō▒ņØś ļČĆņ×æņÜ®ņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[5,8,9]. ĻĘĖ ņÖĖņŚÉ ņĢłĻ│╝ņĀüņ£╝ļĪ£ļŖö ņŚ╝ņ”Øņä▒ ļłł ņ¦łĒÖś, ĒżļÅäļ¦ēņŚ╝, Ļ│Ąļ¦ēņŚ╝, ņÖĖņĢłĻĘ╝ņŚ╝, ņĢłļé┤ņŚ╝, ļ¦Øļ¦ēĒśłĻ┤ĆņŚ╝, ņé¼ļź┤ņĮöņØ┤ļō£ ļō▒ņØś ļČĆņ×æņÜ®ņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[6].
TNF ņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®Ļ│╝ Ļ┤ĆļĀ©ļÉ£ ņŗ£ņŗĀĻ▓ĮņŚ╝ņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀļŖö 2002ļģä ņØ┤Ēøä Ēśäņ×¼Ļ╣īņ¦Ć Pubmed Ļ▓ĆņāēņØä ĒĢ£ Ļ▓░Ļ│╝ 43ņśłĻ░Ć ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[10-37], ņØ┤ ņżæ infliximab Ļ┤ĆļĀ©ļÉ£ ļ│┤Ļ│ĀĻ░Ć 21ņśł, etanercept Ļ┤ĆļĀ©ĒĢśņŚ¼ 6ņśł, adalimumab Ļ┤ĆļĀ© 5ņśł, golimumab Ļ┤ĆļĀ© 1ņśłĻ░Ć ĒżĒĢ©ļÉśņŚłļŗż. ņŗ£ņŗĀĻ▓ĮļČĆņóģņØä ļÅÖļ░śĒĢ£ Ēāłņłśņ┤łņä▒ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØ┤ 17ņśł, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņØś ļ│ĆĒÖöļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŹś ĻĄ¼Ēøäņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ĒśĢĒā£Ļ░Ć 18ņśł, ĻĘĖ ņÖĖ ļÅģņä▒ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØ┤ 4ņśł ĒżĒĢ©ļÉśņŚłĻ│Ā, ņŗ£ņŗĀĻ▓ĮņŚ╝ ĒśĢĒā£ņŚÉ ļīĆĒĢ£ ņ¢ĖĻĖēņØ┤ ņŚåļŖö ļ│┤Ļ│ĀļÅä ĒżĒĢ©ļÉśņŚłļŗż. Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ ņĀĢļ¦źņŻ╝ņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░Ļ░Ć 31ņśł, Ļ▓ĮĻĄ¼ņŖżĒģīļĪ£ņØ┤ļō£ ļ│ĄņÜ®ĒĢ£ Ļ▓ĮņÜ░Ļ░Ć 5ņśł, ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░Ļ░Ć 3ņśł ņ׳ņŚłĻ│Ā, ņŗ£ļĀźņØ┤ ļ¬©ļæÉ ĒśĖņĀäļÉ£ Ļ▓ĮņÜ░Ļ░Ć 20ņśł, ļČĆļČäņĀüņ£╝ļĪ£ ĒśĖņĀäļÉ£ Ļ▓ĮņÜ░Ļ░Ć 13ņśł, ĒśĖņĀäņØ┤ ņŚåņŚłļŹś Ļ▓ĮņÜ░Ļ░Ć 10ņśłĻ░Ć ņ׳ņŚłļŗż. ņØ┤ ņżæ ņ╣śļŻī ņŚåņØ┤ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ņŗ£Ē¢ēĒĢ£ 3ņśł ļ¬©ļæÉ 3Ļ░£ņøö ņØ┤ļé┤ ņÖäņĀä ĒÜīļ│ĄļÉśņŚłļŗż(Table 1).
Safety assessment of biologic ThERapy studyņŚÉ ļö░ļź┤ļ®┤, DMARDļź╝ ņé¼ņÜ®ĒĢśļŖö ĻĄ░Ļ│╝ TNF-╬▒ ņ¢ĄņĀ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśļŖö ĻĄ░ņŚÉņä£ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ļ░£ņāØ ļ╣łļÅäĻ░Ć ļ╣äņŖĘĒĢśļ»ĆļĪ£, TNF-╬▒ ņ¢ĄņĀ£ņĀ£ņØś ņé¼ņÜ®ņØ┤ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ļ░£ļ│æņØä ņ┤ēņ¦äņŗ£Ēé©ļŗżļŖö ĻĘ╝Ļ▒░Ļ░Ć ņŚåļŗżĻ│Ā ĒĢśņśĆļŗż[38]. ņØ┤ņÖĆ ļ░śļīĆļĪ£, 2014ļģä ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ 77ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ TNF-╬▒ ņ¢ĄņĀ£ņĀ£ ņ╣śļŻī ņĀäĒøä ņŗĀĻ▓ĮĒĢÖņĀü ņØ┤ņāü ņŚ¼ļČĆļź╝ ĒÖĢņØĖĒĢ£ Ļ▓░Ļ│╝, ņ╣śļŻī Ēøä ņŗĀĻ▓ĮĒĢÖņĀü ļČĆņ×æņÜ®ņØ┤ 3ļ¬ģņŚÉņä£ ļéśĒāĆļé¼ņ£╝ļ®░, ņØ┤ ņżæ 2ļ¬ģņŚÉņä£ ņ╣śļŻī ņżæļŗ©Ļ│╝ ĒĢ©Ļ╗ś ĒśĖņĀäļÉśņŚłļŗżĻ░Ć, ņ╣śļŻī ņ×¼ņŗ£ņ×æĻ│╝ ĒĢ©Ļ╗ś ļČĆņ×æņÜ®ņØ┤ ņ×¼ļ░£ĒĢśņŚ¼, TNF-╬▒ ņ¢ĄņĀ£ņĀ£ņØś ņ╣śļŻīĻ░Ć Ēāłņłśņ┤łĒÖöļź╝ ņ£Āļ░£ĒĢśņŚ¼, ņŗĀĻ▓ĮĻ│äĒåĄ ļČĆņ×æņÜ®ņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ĒĢśņśĆļŗż[39].
ļ│Ė ņ”ØļĪĆ ĒÖśņ×ÉņŚÉņä£ ņŗ£Ļ░äņāü ņÜ░ņŚ░ņØś ņØ╝ņ╣śļĪ£ ņĢĮņĀ£ļź╝ ņé¼ņÜ®ĒĢśļŖö ĒÖśņ×ÉņŚÉņä£ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØ┤ ļ░£ņāØĒĢśņśĆņØä Ļ░ĆļŖźņä▒ņØä ņÖäņĀäĒ׳ ļ░░ņĀ£ĒĢśĻĖ░ļŖö ņ¢┤ļĀżņÜ░ļéś, ņĢłĻĄ¼ņÜ┤ļÅÖ ņŗ£ ĒåĄņ”ØņØ┤ ņŚåļŗżļŖö ņĀÉņŚÉņä£ ņĀäĒśĢņĀüņØĖ ņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ņ”ØņāüņØä ļö░ļź┤ņ¦Ć ņĢŖņĢśĻ│Ā, ņŗ£ļĀźņĀĆĒĢśĻ░Ć ņŗ¼ĒĢ┤ņ¦ä ņŗ£ņĀÉņØ┤ infliximab ņŻ╝ņé¼ņ╣śļŻī 2ņØ╝ ļÆżņśĆļŗżļŖö ņĀÉņŚÉņä£, ņĢĮņĀ£ Ļ┤ĆļĀ© Ļ░ĆļŖźņä▒ņØä ņŚ╝ļæÉņŚÉ ļæś ņłś ņ׳ņŚłļŗż.
ļŗ©ņĢłņØś ņŗ£ļĀź ļ░Å ņāēĻ░üņĀĆĒĢśņÖĆ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ņĢłņĀĆĻ▓Ćņé¼ņāü ņØ┤ņāüņØ┤ ņŚåņ£╝ļ®┤ņä£ ņāüļīĆĻĄ¼ņŗ¼ļÅÖĻ│ĄņÜ┤ļÅÖņןņĢĀĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ ĻĄ¼Ēøäņŗ£ņŗĀĻ▓ĮņŚ╝, ļÆżĒŚłĒśłņŗ£ņŗĀĻ▓Įļ│æņ”Ø, ņĢĢļ░Ģņŗ£ņŗĀĻ▓Įļ│æņ”Ø ļō▒ņØä Ļ░Éļ│äĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņ”ØļĪĆņØś Ļ▓ĮņÜ░ ņŗ£ļĀźņĀĆĒĢśĻ░Ć ĻĖēņä▒ņ£╝ļĪ£ ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśĻ│Ā, Ļ│ĀĒśłņĢĢ, ļŗ╣ļć©, Ļ│ĀļĀ╣ ļō▒ ņ£äĒŚśņØĖņ×ÉņÖĆ ļ¦×ņ¦Ć ņĢŖņĢä ļÆżĒŚłĒśłņŗ£ņŗĀĻ▓Įļ│æņ”ØņØä ļ░░ņĀ£ĒĢśņśĆļŗż. ņĢłĻĄ¼ņÜ┤ļÅÖ ņŗ£ ĒåĄņ”ØņØ┤ ņŚåņŚłĻ│Ā, ĒśłņĢĪ Ļ▓Ćņé¼ņāü ņĀüĒśłĻĄ¼ ņ╣©Ļ░Ģ ņåŹļÅä(erythrocyte sedimentation rate), C-ļ░śņØæņä▒ ļŗ©ļ░▒ ņŗ£ĒŚś(C-reactive protein) ņāüņŖ╣ ļō▒ņØś ņŚ╝ņ”Ø ņāüĒā£ļź╝ ņŗ£ņé¼ĒĢśļŖö ņåīĻ▓¼ņØ┤ ņŚåņŚłņ£╝ļ®░, MRIņŚÉņä£ ņĢĢļ░Ģņä▒ ļ│æļ│Ć ņŚåņØ┤ ĻĄ¼Ēøäņŗ£ņŗĀĻ▓ĮņŚÉ ņĪ░ņśüņ”ØĻ░Ģ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ņĢĮņĀ£ ņé¼ņÜ®ņØś ļ│æļĀźņ£╝ļĪ£ ļ»ĖļŻ©ņ¢┤ ļ│┤ņĢä, infliximab Ļ┤ĆļĀ© ņŗ£ņŗĀĻ▓ĮņŚ╝ņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż. ļÅģņä▒ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØ┤ļéś ņśüņ¢æ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØĆ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ĻĖ░ļŖźņןņĢĀļź╝ ņ£Āļ░£ĒĢśņŚ¼ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳Ļ│Ā, ņ¢æņĢłņä▒ņØĖ Ļ▓ĮņÜ░Ļ░Ć ļ¦ÄĻ│Ā, ļ¼┤ĒåĄņä▒ ņŗ£ļĀźņĀĆĒĢś ļ░Å ņāēĻ░üņĀĆĒĢśĻ░Ć ņ¦äĒ¢ēņä▒ņ£╝ļĪ£ ļ░£ņāØĒĢśļ®░, ņ£ĀļæÉĒÖ®ļ░śņŗĀĻ▓Įņä¼ņ£Āļŗżļ░£(papillomacular bundle)ņØś ņåÉņāüņ£╝ļĪ£ ņżæņŗ¼(central) ļśÉļŖö ļ¦╣ņĀÉņżæņŗ¼ņĢöņĀÉ(cecocentral scotoma)ņØä ņ£Āļ░£ĒĢśļŖö ĒŖ╣ņ¦ĢņØ┤ ņ׳ļŗż. ņŗ£ļĀźņØĆ ņłśņŻ╝ Ēś╣ņØĆ ņłśĻ░£ņøöņŚÉ Ļ▒Ėņ│É ņä£ņä£Ē׳ ĒÜīļ│ĄļÉśļ®░, ļÅģņä▒ņØä ņØ╝ņ£╝Ēé© ļ¼╝ņ¦łņØś ņóģļźśļéś ņ¢æ, ņåÉņāüņØś ņĀĢļÅäņŚÉ ļö░ļØ╝, ņśüĻĄ¼ņĀüņØĖ ņŗ£ļĀźņןņĢĀļź╝ ļé©ĻĖ░ĻĖ░ļÅä ĒĢ£ļŗż[39]. ļ│Ė ņ”ØļĪĆņØś Infliximab Ļ┤ĆļĀ© ņŗ£ņŗĀĻ▓ĮņŚ╝ņØĆ ļŗżļźĖ ņĢĮņĀ£ Ļ┤ĆļĀ© ļÅģņä▒ņŗ£ņŗĀĻ▓Įļ│æņ”ØĻ│╝ļŖö ļŗ©ņĢłņä▒ņØ┤ļØ╝ļŖö ņĀÉ, ņŗ£ļĀźĒÜīļ│ĄņØ┤ ļ╣Āļź┤ļŗżļŖö ņĀÉņŚÉņä£ ņ░©ņØ┤ņĀÉņØ┤ ņ׳ņŚłļŗż.
TNF ņ¢ĄņĀ£ņĀ£ Ļ┤ĆļĀ© ņŗ£ņŗĀĻ▓ĮņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░, ņØ┤ņĀä ļ│┤Ļ│ĀļōżņŚÉņä£ ņøÉņØĖņØ┤ ļÉśļŖö ņĢĮņĀ£ļź╝ ņżæļŗ©ĒĢśĻ│Ā ņŖżĒģīļĪ£ņØ┤ļō£ Ļ│ĀņÜ®ļ¤ē ņ╣śļŻīļź╝ ĒĢ£ Ēøä, ņøÉļלņØś ņ¦łĒÖś ņ╣śļŻīļź╝ ņ£äĒĢ┤ ļŗżļźĖ ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ļĪ£ ņĢĮņĀ£ļź╝ ļ│ĆĻ▓ĮĒĢśļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗżĻ│Ā ĒĢśņśĆņ£╝ļ®░, ļīĆĻ░£ ņ╣śļŻī Ēøä 1-3Ļ░£ņøöņ¦Ė ņŗ£ļĀź ļ░Å ņŗ£ĻĖ░ļŖźņØ┤ ĒÜīļ│ĄļÉ£ļŗżĻ│Ā ĒĢśņśĆļŗż[10-12,40]. ņŗ£ņŗĀĻ▓ĮņŚ╝ņØś ļ░£ņāØņØ┤ TNF-╬▒ ņ¢ĄņĀ£ņĀ£ ņ╣śļŻīņŚÉ ņØśĒĢ£ Ēāłņłśņ┤łĒÖöņŚÉņä£ ĻĖ░ņØĖĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£, ņŗ£ņŗĀĻ▓ĮņŚ╝ ĒÖśņ×É ļé┤ņøÉ ņŗ£ ņ×ÉņäĖĒĢ£ ļ│æļĀźņ▓ŁņĘ©ļź╝ ĒåĄĒĢśņŚ¼ ņĢĮņĀ£ Ļ┤ĆļĀ© ņ£Āļ¼┤ļź╝ ĒīÉļŗ©ĒĢśĻ│Ā, ņØ┤ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņ¦łĒÖśņ£╝ļĪ£ ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░ ĒāĆĻ│╝ņÖĆņØś Ēśæņ¦äņØä ĒåĄĒĢ┤ TNF-╬▒ ņ¢ĄņĀ£ņĀ£ņØś ņé¼ņÜ® ņżæļŗ©ņØä Ļ│ĀļĀżĒĢśļ®┤ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīļź╝ ĒĢ©ņ£╝ļĪ£ņŹ© ņ¢æĒśĖĒĢ£ ņŗ£ļĀźĒÜīļ│ĄņØä ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
Figure┬Ā1.
Humphrey visual field test and optical coherence tomography (OCT) in the patient. (A) Visual field test demonstrates inferior and central field defect on total and pattern-deviation plot in the left eye, and (B) OCT map shows decreased ganglion cell-inner plexiform layer (GC-IPL) thickness in the left eye. OD = oculus dexter; OS = oculus sinister; GHT = glaucoma Hemifield test; VFI = visual field index; MD = mean deviation; PSD = pattern standard deviation.

Figure┬Ā2.
Orbit magnetic resonance images. The axial section (A) and coronal section (B) shows perineural enhancement of left optic nerve (intraorbital-intracranial segment) (arrows).
Figure┬Ā3.
Humphrey visual field (VF) test 1 month and 3 months after treatment. (A) VF test at 1 month demonstrates partial improvement on pattern-deviation plot in the left eye, and (B) VF test at 3 months shows complete recovery on pattern deviation plot in the left eye. GHT = glaucoma Hemifield test; VFI = visual field index; MD = mean deviation; PSD = pattern standard deviation.

Table┬Ā1.
Characteristics of previous reported TNF-╬▒ associated optic neuritis cases
REFERENCES
2) Grzybowski A, Z├╝lsdorff M, Wilhelm H, Tonagel F. Toxic optic neuropathies: an updated review. Acta Ophthalmol 2015;93:402-10.


3) Kalliolias GD, Ivashkiv LB. TNF biology, pathogenic mechanisms and emerging therapeutic strategies. Nat Rev Rheumatol 2016;12:49-62.


4) Lin J, Ziring D, Desai S, et al. TNFalpha blockade in human diseases: an overview of efficacy and safety. Clin Immunol 2008;126:13-30.

5) Thomas CW Jr, Weinshenker BG, Sandborn WJ. Demyelination during anti-tumor necrosis factor alpha therapy with infliximab for CrohnŌĆÖs disease. Inflamm Bowel Dis 2004;10:28-31.

6) Nicolela Susanna F, Pavesio C. A review of ocular adverse events of biological anti-TNF drugs. J Ophthalmic Inflamm Infect 2020;10:11.



7) Flouri I, Markatseli TE, Voulgari PV, et al. Comparative effectiveness and survival of infliximab, adalimumab, and etanercept for rheumatoid arthritis patients in the Hellenic Registry of Biologics: low rates of remission and 5-year drug survival. Semin Arthritis Rheum 2014;43:447-57.


8) Borchers AT, Leibushor N, Cheema GS, et al. Immune-mediated adverse effects of biologicals used in the treatment of rheumatic diseases. J Autoimmun 2011;37:273-88.


9) Sfikakis PP. The first decade of biologic TNF antagonists in clinical practice: lessons learned, unresolved issues and future directions. Curr Dir Autoimmun 2010;11:180-210.


10) Alexandre B, Vandermeeren Y, Dewit O, et al. Optic neuritis associated or not with TNF antagonists in patients with inflammatory bowel disease. J Crohns Colitis 2016;10:541-8.



11) Strong BY, Erny BC, Herzenberg H, Razzeca KJ. Retrobulbar optic neuritis associated with infliximab in a patient with Crohn disease. Ann Intern Med 2004;140:W34.


12) Foroozan R, Buono LM, Sergott RC, Savino PJ. Retrobulbar optic neuritis associated with infliximab. Arch Ophthalmol 2002;120:985-7.

13) ten Tusscher MP, Jacobs PJ, Busch MJWM, et al. Bilateral anterior toxic optic neuropathy and the use of infliximab. BMJ 2003;326:579.

15) Tran TH, Milea D, Cassoux N, et al. Optic neuritis associated with infliximab. J Fr Ophtalmol 2005;28:201-4.

16) Simsek I, Erdem H, Pay S, et al. Optic neuritis occurring with antitumour necrosis factor alpha therapy. Ann Rheum Dis 2007;66:1255-8.


17) Tauber T, Turetz J, Barash J, et al. Optic neuritis associated with etanercept therapy for juvenile arthritis. J AAPOS 2006;10:26-9.


18) Noguera-Pons R, Borr├Īs-Blasco J, Romero-Crespo I, et al. Optic neuritis with concurrent etanercept and isoniazid therapy. Ann Pharmacother 2005;39:2131-5.


19) Chung JH, Van Stavern GP, Frohman LP, Turbin RE. Adalimumabassociated optic neuritis. J Neurol Sci 2006;244:133-6.


20) Bidaguren A, M├╝ller-Thyssen A, Blanco A, et al. Retrobulbar optic neuritis associated with infliximab. Arch Soc Esp Oftalmol 2007;82:109-12.

21) Hejazi R, Colombel JF, Peyrin-Biroulet L. Retrobulbar optic neuritis during infliximab treatment for ulcerative colitis. Gastroenterol Clin Biol 2008;32:162-3.

23) Ouakaa-Kchaou A, Gargouri D, Trojet S, et al. Retrobulbar optic neuritis associated with infliximab in a patient with Crohn's disease. J Crohns Colitis 2009;3:131-3.


24) Felekis T, Katsanos K, Christodoulou D, et al. Reversible bilateral optic neuritis after Infliximab discontinuation in a patient with Crohn's disease. J Crohns Colitis 2009;3:212-4.


25) Aasly JO. Bilateral optic neuritis associated with the use of infliximab. Case Rep Ophthalmol Med 2011;2011:232986.



26) Minami-Hori M, Tsuji H, Takahashi H, et al. Optic neuritis in a psoriatic arthritis patient treated by infliximab. J Dermatol 2013;40:298-9.


27) Silva LG, Sasso LS, Nelli CJ, et al. Optic neuritis due to immunobiologics: first Brazilian case report. An Bras Dermatol 2013;88(6 Suppl 1):162-5.

28) Faillace C, de Almeida JR, de Carvalho JF. Optic neuritis after infliximab therapy. Rheumatol Int 2013;33:1101-3.


29) Clemmensen K, Akrawi N, Stawowy M. Irreversible optic neuritis after infliximab treatment in a patient with ulcerative colitis. Scand J Gastroenterol 2015;50:1508-11.


30) Garcia-Medina JJ, Pastor-Grau A, del-Rio-Vellosillo M, et al. Unilateral and irreversible optic neuropathy associated to infliximab treatment: 3-year follow-up. Scand J Gastroenterol 2016;51:765-6.


31) Mumoli N, Niccoli G, Scazzeri F, et al. Infliximab-induced retrobulbar optic neuritis. QJM 2007;100:531.


32) Li SY, Birnbaum AD, Goldstein DA. Optic neuritis associated with adalimumab in the treatment of uveitis. Ocul Immunol Inflamm 2010;18:475-81.


33) Komandur A, MacIntosh P, Moss H. Acute inflammatory optic neuritis associated with a self-taper of oral prednisone in a patient taking adalimumab. Neuroophthalmology 2019;44:186-9.



34) Kim A, Saffra N. A case report of adalimumab-associated optic neuritis. J Ophthalmic Inflamm Infect 2012;2:145-7.



35) Saffra N, Astafurov K. Visual loss induced by adalimumab used for plaque psoriasis. Case Rep Dermatol 2017;9:60-4.

36) de Frutos-Lezaun M, Bidaguren A, de la Riva P, et al. Bilateral retrobulbar optic neuropathy associated with Golimumab. Clin Neuropharmacol 2017;40:149-51.


37) Chan JW, Castellanos A. Infliximab and anterior optic neuropathy: case report and review of the literature. Graefes Arch Clin Exp Ophthalmol 2010;248:283-7.


-
METRICS

-
- 1 Crossref
- 0 Scopus
- 2,369 View
- 76 Download
- Related articles
-
Unilateral Retinitis Pigmentosa: A Case Series and Literature Review.2015 April;56(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



