|
 |
| J Korean Ophthalmol Soc > Volume 62(6); 2021 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü Ļ▓░Ļ│╝ļź╝ ņĀĢļ¤ē ļČäņäØĒĢśĻ│Ā ĻĘĖ ĒŖ╣ņ¦ĢņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ļŗ©ņĢł ĒŚłĒśłņä▒ ĻĖēņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäļĪ£ ņ¦äļŗ©ļÉśņ¢┤ ĻĖēņä▒ĻĖ░ ņ╣śļŻī ņØ┤Ēøä 6Ļ░£ņøö ļÅÖņĢł ņ×¼ļ░£ĒĢśņ¦Ć ņĢŖņØĆ 48ņĢłņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ĒÖ®ļ░śļČĆ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņśüņāüņ£╝ļĪ£ļČĆĒä░ Ēæ£ņĖĄ ļ░Å ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁĻ│╝ ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØä ļČäĒĢĀĒĢ£ Ēøä Ļ░ü ņśüņŚŁņØś ļ®┤ņĀü, ĒśłĻ┤Ćļ░ĆļÅä, ļ¦Øļ¦ēĒÅēĻĘĀļæÉĻ╗śļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ļČäĒĢĀ ņśüņŚŁņØś ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņØĖņ×ÉļōżĻ│╝ ĻĖ░ļ│Ė ņØĖņ×ÉņÖĆņØś ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ĒÅēĻĘĀ ļéśņØ┤ļŖö 63.8ņäĖļĪ£ Ļ│ĀĒśłņĢĢņØĆ 56.3%ņŚÉņä£ ļÅÖļ░śļÉśņŚłļŗż. ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØĆ Ēæ£ņĖĄļ│┤ļŗż ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ļäōĻ▓ī ņĖĪņĀĢļÉśņ¢┤(p<0.001) ĻĘĖ ņé¼ņØ┤ ņØ┤Ē¢ēņśüņŚŁņØ┤ ĒśĢņä▒ļÉśņŚłļŗż. ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØĆ 2/3ņŚÉņä£ ņØ┤Ē¢ēņśüņŚŁņŚÉ ļČäĒżĒĢśņśĆĻ│Ā, ĒśłĻ┤Ćļ░ĆļÅäļŖö Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņĀĢņāüņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäļ│┤ļŗż ļåÆņĢśņ£╝ļ®░(ļ¬©ļæÉ, p<0.001), ļ¦Øļ¦ēĒÅēĻĘĀļæÉĻ╗śļŖö Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤Ć ņśüņŚŁļ│┤ļŗż ļæÉĻ║╝ņøĀņ¦Ćļ¦ī(ļ¬©ļæÉ, p<0.001) ņĀĢņāüĒśłĻ┤Ć ņśüņŚŁĻ│╝ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüņśüņŚŁņŚÉ ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØ┤ ļŹö ļ¦ÄņØ┤ ļČäĒżĒĢĀņłśļĪØ ņĢłņĀĢĒÖö ņŗ£ņĀÉņŚÉ ļÅäļŗ¼ĒĢśļŖö ņŻ╝ņé¼ ĒÜīņłśĻ░Ć ņ×æņĢśļŗż(r=-0.314, p=0.030).
Ļ▓░ļĪĀ
ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ļåÆĻ│Ā ņØ┤Ē¢ēņśüņŚŁņŚÉ ņŻ╝ļĪ£ ļČäĒżĒĢśņśĆļŗż. ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ ņāüņŖ╣ĒĢ£ ņĀĢļ¦źļé┤ ņĢĢļĀźņŚÉ ļīĆĒĢŁĒĢśņŚ¼ ņĄ£ņåī ņĀĆĒĢŁņ£╝ļĪ£ Ēśłļźśļź╝ ļ░░ņČ£ĒĢśļŖö Ļ▓ĮļĪ£ļĪ£ ņČöņĀĢļÉśļ®░ ņØ┤ļŖö ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņä▒ņØä ņ£Āņ¦ĆĒĢśļŖö ļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ABSTRACT
Purpose
To investigate characteristics of optical coherence tomography angiography (OCTA) findings in chronic inactive branch retinal vein occlusion (BRVO) with quantitative analysis.
Methods
The medical records of 48 eyes diagnosed with unilateral ischemic acute BRVO, and without recurrence for 6 months after the acute treatment, were reviewed retrospectively. We manually segmented the abnormal vessels of the superficial and deep capillary plexus (SCP-AV and DCP-AV, respectively) and vascular congestion of DCP (DCP-VC) from 6 ├Ś 6 mm2 macular OCTA images and automatically calculated the area, vessel density, and average retinal thickness of each corresponding region. Correlations were analyzed between the OCTA parameters of the segmentation area and the baseline characteristics.
Results
The DCP-AV area was always wider than that of the SCP-AV (p < 0.001), with a transitional zone (TZ) between the two areas. About two-thirds of the DCP-VC area was distributed in the TZ. The vessel density of the DCP-VC was higher than that of the normal capillary plexus (all, p < 0.001). The average retinal thickness of the DCP-VC was greater than those of SCP-AV and DCP-AV areas (all, p < 0.001), but not different from the normal capillary plexus. The greater the extent of the DCP-VC distribution under the SCP-AV, the fewer the number of injections required to reach stabilization (r = -0.314, p = 0.030).
ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäļŖö ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”ØņŚÉ ņØ┤ņ¢┤ ļæÉ ļ▓łņ¦ĖļĪ£ ĒØöĒĢ£ ļ¦Øļ¦ēĒśłĻ┤Ć ņ¦łĒÖśņØ┤ļ®░[1], ĒÅÉņćä ļČĆņ£äņŚÉ ļö░ļØ╝ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä, ļ¦Øļ¦ēņĀłļ░śņĀĢļ¦źĒÅÉņćä, ļ¦Øļ¦ēņżæņŗ¼ņĀĢļ¦źĒÅÉņćäļĪ£ ļČäļźśĒĢ£ļŗż. ĻĖēņä▒ĻĖ░ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäļŖö ĒÅÉņćäĻ░Ć ļ░£ņāØĒĢ£ ļÅÖņĀĢļ¦źĻĄÉņ░© ņøÉņ£äļČĆ ĒśłĻ┤Ć ĻĄ¼ĒÜŹņØś ļ¦Øļ¦ē ņĀĢļ¦źņĢĢ ņāüņŖ╣ņ£╝ļĪ£ ņØĖĒĢ£ ļ¦Øļ¦ē ņČ£Ēśł, ļ®┤ĒÖöļ░ś, ļ░Å ĒÖ®ļ░śļČĆņóģ ļō▒ņØś ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö ņ¦łĒÖśņ£╝ļĪ£[2], ļ¦īņä▒ ĒÖ®ļ░śļČĆņóģ, ĒÖ®ļ░śļČĆ ĒŚłĒśł ļ░Å ņŗĀņāØĒśłĻ┤ĆņØĆ ĻĖēņä▒ĻĖ░ ņØ┤Ēøä ņŗ£ļĀźņØä ņ£äĒśæĒĢśļŖö ņŻ╝ļÉ£ ņøÉņØĖņØ┤ļŗż. ĻĘĖļ¤╝ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ĻĖēņä▒ĻĖ░ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś ļ░ś ņØ┤ņāüņŚÉņä£ ņ╣śļŻī ņŚåņØ┤ 20/40 ņØ┤ņāüņØś ņóŗņØĆ ņŗ£ļĀźņØä ņ£Āņ¦ĆĒĢśĻ│Ā[3-6], ĒÖ®ļ░śļČĆņóģņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŹś ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ņŚåņØ┤ 7.5Ļ░£ņøö ļÆż 41%ņŚÉņä£ ĒśĖņĀäļÉśļŖö ņ¢æĒśĖĒĢ£ Ļ▓░Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż[2].
ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņØĆ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ņŗĀņāØĒśłĻ┤ĆņØś ļÅÖļ░ś ņ£Āļ¼┤ņÖĆ ĒŚłĒśł ļ¦Øļ¦ēņØś ļ▓öņ£äļź╝ ĒÖĢņØĖĒĢśņŚ¼ ņ╣śļŻī ļ░®Ē¢źĻ│╝ ņśłĒøäļź╝ Ļ▓░ņĀĢĒĢśļŖö ņżæņÜöĒĢ£ ņ¦äļŗ© ĻĖ░ļ▓ĢņØ┤ļŗż. ņĄ£ĻĘ╝ ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü(optical coherence tomographic angiography, OCTA)ņØś ļÅäņ×ģņ£╝ļĪ£ ņ╣©ņŖĄņĀüņ£╝ļĪ£ ņĪ░ņśüņĀ£ļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ĒÖ®ļ░śļČĆ ĒŚłĒśł ņśüņŚŁņØä Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄ ļ¦Øļ¦ēņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłļŗż. ĻĘĖņŚÉ ļö░ļØ╝ ĻĖēņä▒ĻĖ░ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ņśżļ¬®ļ¼┤ĒśłĻ┤ĆļČĆņ£ä(fovea avascular zone, FAZ) ĒÖĢņן, ļ¬©ņäĖĒśłĻ┤Ćļ╣äĻ┤Ćļźś(capillary nonperfusion), ļ¦Øļ¦ē ļé┤ Ļ│Āļ”¼ĒśłĻ┤Ć(intraretinal loop), ņÜĖĒśł(vascular congestion)ņØś ņØ┤ņāüĒśłĻ┤Ć ņåīĻ▓¼ļōżņØ┤ ļ│┤Ļ│Ā ļÉśņŚłļŗż[7]. ļ░śļ®┤ ļ¦īņä▒ ļ╣äĒÖ£ņä▒(chronic inactive) ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉļōżņØĆ ņĢłņĀĆĻ▓Ćņé¼ņŚÉņä£ ĒÖ®ļ░śņŚÉ Ļ▓ĮĒÖöļÉ£ ļ¦Øļ¦ēņĀĢļ¦ź(sclerosed retinal vein) ļ░Å ņĀĢļ¦ź Ļ│üņł£ĒÖś(venous collateral formation) ņÖĖ ļŗżļźĖ ĒŖ╣ļ│äĒĢ£ ņØ┤ņāü ņåīĻ▓¼ņØä ļé©ĻĖ░ņ¦Ć ņĢŖĻ│Ā ņóŗņØĆ ņŗ£ļĀźĻ│╝ ņĢłņĀĢņĀüņØĖ ĒĢ┤ļČĆĒĢÖņĀü ņāüĒā£ļź╝ ņ£Āņ¦ĆĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ĻĖēņä▒ ļ░Å ļ¦īņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ņØ┤ĒÖś ļ░Å ņĀĢņāü ņśüņŚŁ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅä(vessel density) ļ╣äĻĄÉ ņŚ░ĻĄ¼[8], ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäļĪ£ ņØĖĒĢ£ ņ×¼ļ░£ņä▒ ĒÖ®ļ░śļČĆņóģņØś OCTAĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņ£äĒŚśņØĖņ×É ņŚ░ĻĄ¼ ļō▒ ļ¬ćļ¬ć ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłņ¦Ćļ¦ī[9], ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ņĢłņĀĢņĀüņØĖ ĒĢ┤ļČĆĒĢÖņĀü ņāüĒā£ļź╝ ņ£Āņ¦ĆĒĢśļŖö ņøÉņØĖĻ│╝ ĻĖ░ņĀäņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ĒĢ┤ļČĆĒĢÖņĀüņ£╝ļĪ£ ņĢłņĀĢļÉ£ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉļōżņØś OCTA ņśüņāüņØä Ēæ£ņĖĄĻ│╝ ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤ØņŚÉņä£ ņĀĢļ¤ē ļČäņäØĒĢśĻ│Ā ĻĘĖ ņ░©ņØ┤ņÖĆ ĒŖ╣ņ¦ĢņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņŚ¼ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņä▒ņØä ņ£Āņ¦ĆĒĢśļŖö ĻĖ░ņĀäņØä ņĀ£ņŗ£ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
2017ļģä 1ņøöļČĆĒä░ 2020ļģä 12ņøöĻ╣īņ¦Ć ņ¢æņé░ļČĆņé░ļīĆĒĢÖĻĄÉļ│æņøÉņŚÉņä£ ļŗ©ņĢł ĒŚłĒśłņä▒ ĻĖēņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×Éļōż ņżæ ĻĖēņä▒ĻĖ░ ņ╣śļŻī ņØ┤Ēøä ĒÖ®ļ░śļČĆņóģ, ļ¦Øļ¦ēņČ£Ēśł, ļ®┤ĒÖöļ░śņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖö ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ņāüĒā£Ļ░Ć 6Ļ░£ņøö ļÅÖņĢł ņ£Āņ¦ĆļÉ£ ĒÖśņ×ÉļōżņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ĒŚłĒśł ņ£Āļ¼┤ļŖö ņ┤łņ¦ä Ēøä 3Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņŗ£Ē¢ēĒĢ£ ĒśĢĻ┤æņĢłņĀĆĒśłĻ┤ĆņĪ░ņśüņŚÉņä£ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉ ņ¦üĻ▓ĮņØś ļŗżņä» ļ░░ ņØ┤ņāü ļ¬©ņäĖĒśłĻ┤Ćļ╣äĻ┤ĆļźśĻ░Ć Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.1 ĒÖ®ļ░śļČĆļź╝ ņ╣©ļ▓öĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░, ņĪ░ņé¼ ĻĖ░Ļ░ä ņżæ ļ░śļīĆņĢł Ēś╣ņØĆ ņĪ░ņé¼ņĢłņØś ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ņČöĻ░ĆļĪ£ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░, ļ¦Øļ¦ēĒśłĻ┤ĆņŚ╝ņØś ļÅÖļ░ś, ļ¦Øļ¦ēļČäņ¦ĆļÅÖļ¦źĒÅÉņćä ļÅÖļ░ś, -6.0ļööņśĄĒä░ ņØ┤ĒĢśņØś Ļ│ĀļÅäĻĘ╝ņŗ£, ņĪ░ņé¼ ņŗ£Ļ░ä ļ¦Øļ¦ē Ēś╣ņØĆ ļģ╣ļé┤ņןņłśņłĀļ│æļĀź, ņĢłĻĄ¼ ņØ┤ļÅÖ ļ░Å ņČöņĀü ņśżņ░©ņŚÉ ņØśĒĢ£ ĒśłĻ┤Ć ņżæņ▓® Ēś╣ņØĆ ļ¦żņ▓┤ Ēś╝Ēāüņ£╝ļĪ£ ņ×ĪņØīņØ┤ ņŗ¼ĒĢ┤ ņĀĢļ¤ēļČäņäØņØ┤ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░ ņŚ░ĻĄ¼ ļīĆņāüņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņśĆĻ│Ā ļ│ĖņøÉ ņāØļ¬ģņ£żļ”¼ņ£äņøÉĒÜīņØś ņŗ¼ņé¼ ļ░Å ņŖ╣ņØĖ Ēøä ņŗ£Ē¢ēĒĢśņśĆļŗż(IRB ņŖ╣ņØĖ ļ▓łĒśĖ: 05-2020-262).
ļ¬©ļōĀ ļīĆņāü ĒÖśņ×ÉņØś ļéśņØ┤, ņä▒ļ│ä, Ļ│ĀĒśłņĢĢ ņ£Āļ¼┤, ņ╣©ļ▓ö ļ░®Ē¢ź, ņ┤łņ¦ä ļ░Å ņĪ░ņé¼ņŗ£ņĀÉ ņŗ£ļĀźĻ│╝ ņżæņŗ¼ĻĄ¼ņŚŁĒÖ®ļ░śļæÉĻ╗ś, ņ£Āļ”¼ņ▓┤Ļ░Ģ ļé┤ ņŻ╝ņé¼ ĒÜīņłś, ņŻ╝ļ│ĆļČĆ Ļ┤æņØæĻ│Ā ņ╣śļŻī ņ£Āļ¼┤ļź╝ ĻĖ░ļ│Ė ņØĖņ×ÉļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗż. ĒīīņןĻ░Ćļ│Ć(swept-source) ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻĖ░ĻĖ░(DRI OCT-1 Atlantis; Topcon Corp., Tokyo, Japan)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņłÖļĀ©ļÉ£ Ļ▓Ćņé¼ņ×ÉļōżņŚÉ ņØśĒĢ┤ 6 ├Ś 6 mm2 ĒÖ®ļ░ś ņśüņŚŁņØś OCTAņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļé┤ņן ņåīĒöäĒŖĖņø©ņ¢┤(IMAGEnet 6 ver. 1.24; Topcon Corp., Tokyo, Japan)ņØś ņäżņĀĢ Ļ░Æņ£╝ļĪ£ ņŖżņ║ö ņśüņŚŁņØś Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(superficial capillary plexus, SCP) ļ░Å ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤Ø(deep capillary plexus, DCP) ņśüņāü, ļ¦Øļ¦ēļæÉĻ╗śņ¦ĆļÅä(retinal thickness map) ņśüņāü, SCP ļ░Å DCP ĒśłĻ┤Ćļ░ĆļÅä ņśüņāüņØä 600 ├Ś 600 ĒĢ┤ņāüļÅäņØś ņ╣╝ļØ╝ ņśüņāüņ£╝ļĪ£ ņČöņČ£ĒĢśņśĆļŗż. ņĀĢļ¤ēņĀüņØĖ ļČäņäØņØä ņ£äĒĢ┤ ņĀ£ņĪ░ņé¼ņŚÉņä£ ņĀ£ņŗ£ĒĢ£ ņāēņāü ļ│ĆĒÖśĒæ£ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ņāēļČĆĒśĖĒÖö ļ¦Øļ¦ēļæÉĻ╗śņ¦ĆļÅä ņśüņāüĻ│╝ ĒśłĻ┤Ćļ░ĆļÅä ņśüņāüņØä 16ļ╣äĒŖĖ ĒØæļ░▒ ņśüņāüņ£╝ļĪ£ ļ│ĆĒÖśĒĢśņśĆļŗż(Fig. 1).
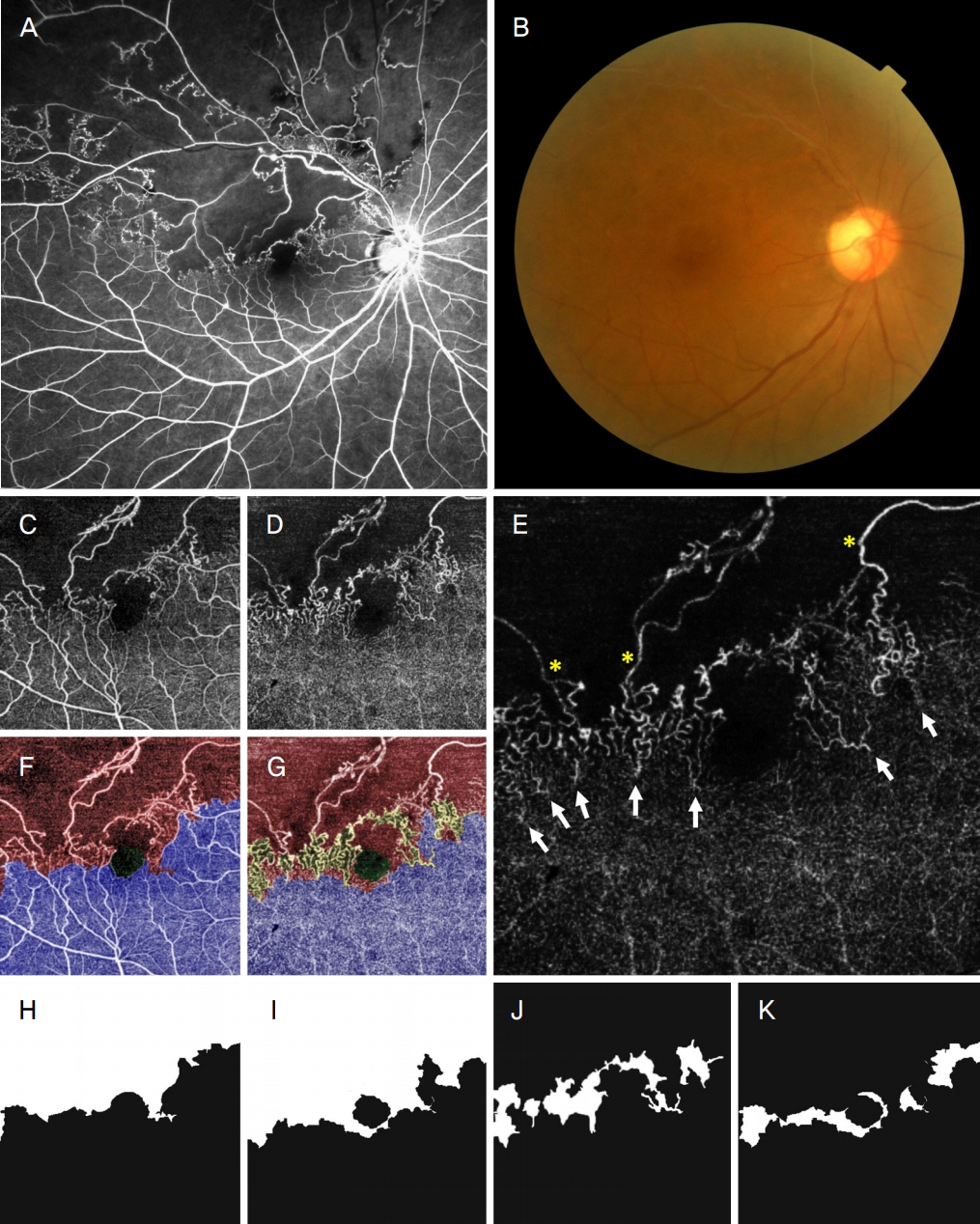
ņāüņÜ® ņśüņāüņ▓śļ”¼ ĒöäļĪ£ĻĘĖļש(Photoshop CC; Adobe Systems, Mountain View, CA, USA)ņØä ņé¼ņÜ®ĒĢśņŚ¼ Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņśüņāüņŚÉņä£ FAZ ĒÖĢņן ņåīĻ▓¼ņØä ņĀ£ņÖĖĒĢśĻ│Ā ļ¬©ņäĖĒśłĻ┤Ćļ╣äĻ┤Ćļźś, ļ¦Øļ¦ē ļé┤ Ļ│Āļ”¼ĒśłĻ┤Ć, ņÜĖĒśłņ▓śļ¤╝ ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØ┤ Ļ┤Ćņ░░ļÉśļŖö ņśüņŚŁņØä ņäĀĒāØĒĢśņśĆļŗż. ņäĀĒāØĒĢ£ ņśüņŚŁņØś ļ░ØĻĖ░ļź╝ 1ļĪ£ ņ¦ĆņĀĢĒĢśĻ│Ā ņĀĢņāü ļ¬©ņäĖĒśłĻ┤ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö ļéśļ©Ėņ¦Ć ņśüņŚŁņØś ļ░ØĻĖ░ļź╝ 0ņ£╝ļĪ£ ņ¦ĆņĀĢĒĢśņŚ¼ SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ(SCP-abnormal vessel)Ļ│╝ DCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ(DCP-abnormal vessel)ņØś ņØ┤ņ¦äĒÖö ņśüņāüņØä ņāØņä▒ĒĢśņśĆļŗż(Fig. 2).
ĒŖ╣Ē׳ DCP ņÜĖĒśłņØĆ ņĀĢņāüĒśłĻ┤ĆņśüņŚŁĻ│╝ ļ╣äĻ┤ĆļźśņśüņŚŁ ņé¼ņØ┤ņŚÉ ļČäĒżĒĢśņśĆĻ│Ā, ļ╣äĻ┤ĆļźśņśüņŚŁ ļ¦Øļ¦ēņäĖļÅÖļ¦źņ£╝ļĪ£ļČĆĒä░ Ēśłļźśļź╝ Ļ│ĄĻĖēļ░øņĢä ņĀĢņāüĒśłĻ┤ĆņśüņŚŁ ļ¦Øļ¦ēņäĖņĀĢļ¦źņ£╝ļĪ£ ļ░░ņČ£ļÉśņŚłļŗż(Fig. 2E). ļ░śļ®┤ SCP ņÜĖĒśłņØĆ ņŚåĻ▒░ļéś Ļ▒░ņØś ļéśĒāĆļéśņ¦Ć ņĢŖņĢä ĻĘĖ Ļ▓ĮĻ│äļź╝ ņĀĢņØśĒĢĀ ņłś ņŚåņŚłļŗż. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ DCP ņÜĖĒśł ņśüņŚŁļ¦ī ņäĀĒāØĒĢśņŚ¼ ļ░ØĻĖ░ļź╝ 1ļĪ£ ņ¦ĆņĀĢĒĢśņŚ¼ DCP ņÜĖĒśłņśüņŚŁ(DCP-vascular congestion) ņØ┤ņ¦äĒÖö ņśüņāüņØä ņāØņä▒ĒĢśņśĆļŗż(Fig. 2J). Ļ░ü ņĖĄņØś FAZ ĒÖĢņןņśüņŚŁļÅä 1ļĪ£ ņ¦ĆņĀĢĒĢśņŚ¼ Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś FAZ ņśüņŚŁ(SCP-FAZ, DCP-FAZ)ļÅä ņČöņČ£ĒĢśņśĆļŗż. ļ¬©ļōĀ ņØ┤ņ¦äĒÖöļŖö ļæÉ ļ¬ģņØś ĒīÉļÅģņ×É(M.S.K, S.M.L)Ļ░Ć ņ░ĖņŚ¼ĒĢśņśĆĻ│Ā ņØ╝ņ╣śĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮĻ│äļŖö ĒĢ£ ļ¬ģņØś Ļ░ÉļÅģņ×É(H.J.K)Ļ░Ć ņĄ£ņóģņĀüņ£╝ļĪ£ ĻĘĖ Ļ▓ĮĻ│äļź╝ Ļ▓░ņĀĢĒĢśņśĆļŗż.
ĒīīņØ┤ņŹ¼ ņåīĒöäĒŖĖņø©ņ¢┤(version 3.7.7; Python Software Foundation, Wilmington, DE, US)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś FAZ ņśüņŚŁņØä ņĀ£ņÖĖĒĢ£ SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ, DCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ ļ░Å ņÜĖĒśłņśüņŚŁņØś ļ®┤ņĀüņØä Ļ│äņé░ĒĢśĻ│Ā Ļ░ü ņśüņŚŁļ│ä ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śņÖĆ ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. DCP ņÜĖĒśłņśüņŚŁņØś ļČäĒżļź╝ ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢ┤ DCP ņśüņŚŁņŚÉņä£ļŖö ņØ┤ņāüĒśłĻ┤ĆņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ćļ¦ī, SCP ņśüņŚŁņŚÉņä£ļŖö ņĀĢņāü ĒśłĻ┤ĆņØ┤ Ļ┤Ćņ░░ļÉśļŖö ņśüņŚŁņØä ņØ┤Ē¢ēņśüņŚŁ(transitional zone)ņ£╝ļĪ£ ņĀĢņØśĒĢśĻ│Ā(Fig. 2K), DCP ņÜĖĒśłņśüņŚŁĻ│╝ Ļ▓╣ņ╣śļŖö ļ®┤ņĀüĻ│╝ ļ╣äņ£©ņØä Ļ│äņé░ĒĢśņśĆļŗż.
ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ ļ░Å ņÜĖĒśłņśüņŚŁĻ│╝ ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀü, Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä, ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļź╝ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ Wilcoxon signed rank test ļ╣äļ¬©ņłś Ļ▓ĆņĀĢņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ĻĖ░ļ│Ė ņØĖņ×ÉņÖĆ Ļ░ü ņśüņŚŁņØś ļ®┤ņĀüĻ│╝ Ļ┤ĆĻ│äļź╝ ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņŚ░ņåŹĒśĢ ļ│ĆņłśļŖö Spearman ņāüĻ┤ĆĻ┤ĆĻ│ä ļČäņäØņØä ņŗ£Ē¢ēĒĢśĻ│Ā ļ▓öņŻ╝ĒśĢļ│ĆņłśļŖö Mann-Whitney ļČäņäØņØä ĒĢśņśĆļŗż. ĒåĄĻ│äļČäņäØņŚÉļŖö SPSS version 20.0 (IBM Corp., Armonk, NY, USA)ņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā pĻ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśļŗżĻ│Ā ņĀĢņØśĒĢśņśĆļŗż.
ļŗ©ņĢł ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä 72ņĢłņØ┤ ĒżĒĢ©ļÉśņŚłĻ│Ā ĒÖ®ļ░śļČĆļź╝ ņ╣©ļ▓öĒĢśņ¦Ć ņĢŖņØĆ 9ņĢł, ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ņČöĻ░ĆļĪ£ ļ░£ņāØĒĢ£ 2ņĢł, ĒśłĻ┤ĆņŚ╝ņØ┤ ļÅÖļ░śļÉ£ 2ņĢł, ļ¦Øļ¦ēļČäņ¦ĆļÅÖļ¦źĒÅÉņćäĻ░Ć ļÅÖļ░śļÉ£ 2ņĢł, Ļ│ĀļÅäĻĘ╝ņŗ£ 1ņĢł, ņĪ░ņé¼ņŗ£Ļ░ä ņ£Āļ”¼ņ▓┤ņČ£ĒśłĻ│╝ ļģ╣ļé┤ņןņ£╝ļĪ£ ņłśņłĀļ░øņØĆ 3ņĢł ļ░Å ņ×ĪņØīņ£╝ļĪ£ ļČäņäØņØ┤ ņ¢┤ļĀżņÜ┤ 5ņĢłņØ┤ ņĀ£ņÖĖļÉśņ¢┤ ņ┤Ø 48ņĢłņØä ļīĆņāüņ£╝ļĪ£ Ļ▓░Ļ│╝ļź╝ ļČäņäØĒĢśņśĆļŗż. ņŚ¼ņä▒ņØĆ 26ļ¬ģ(54.2%), ĒÅēĻĘĀ ļéśņØ┤ļŖö 63.8 ┬▒ 10.5ņäĖ, 27ļ¬ģ(56.3%)ņŚÉņä£ Ļ│ĀĒśłņĢĢņØ┤ ļÅÖļ░śļÉśņŚłļŗż. ņ┤łņ¦ä ĒÅēĻĘĀ LogMAR ņŗ£ļĀźņØĆ 0.354 ┬▒ 0.374, ņżæņŗ¼ĻĄ¼ņŚŁĒÖ®ļ░śļæÉĻ╗śļŖö 357.2 ┬▒ 180.2 ╬╝mņśĆļŗż. ņĄ£ņ┤ł ņ¦äļŗ© ņŗ£ņĀÉļČĆĒä░ ņĪ░ņé¼ ņŗ£ņĀÉĻ╣īņ¦Ć ĻĖ░Ļ░äņØĆ 16.8 ┬▒ 5.9Ļ░£ņøö, ļ¦łņ¦Ćļ¦ē ņ╣śļŻīļČĆĒä░ ņĪ░ņé¼ ņŗ£ņĀÉĻ╣īņ¦Ć ĻĖ░Ļ░äņØĆ 7.7 ┬▒ 1.0Ļ░£ņøöļĪ£ ņĪ░ņé¼ļÉśņŚłļŗż. ņĪ░ņé¼ ņŗ£ņĀÉĻ╣īņ¦Ć ĒÅēĻĘĀ 3.4 ┬▒ 2.9ĒÜīņØś ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ņŻ╝ņé¼ ļ░Å 37ņĢł(77.1%)ņØś Ļ┤æņØæĻ│Āļź╝ ĒĢśņśĆļŗż. ņĪ░ņé¼ ņŗ£ņĀÉņØś ĒÅēĻĘĀ LogMAR ņŗ£ļĀźņØĆ 0.225 ┬▒ 0.240ņ£╝ļĪ£ ĒśĖņĀäļÉśņŚłĻ│Ā ņżæņŗ¼ĻĄ¼ņŚŁĒÖ®ļ░śļæÉĻ╗śļŖö 231.4 ┬▒ 40.8 ╬╝mļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. 34ņĢł(70.8%)ņØĆ ņāüņØ┤ņĖĪ, 14ņĢł(29.2%)ņØĆ ĒĢśņØ┤ņĖĪ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņśĆļŗż(Table 1).
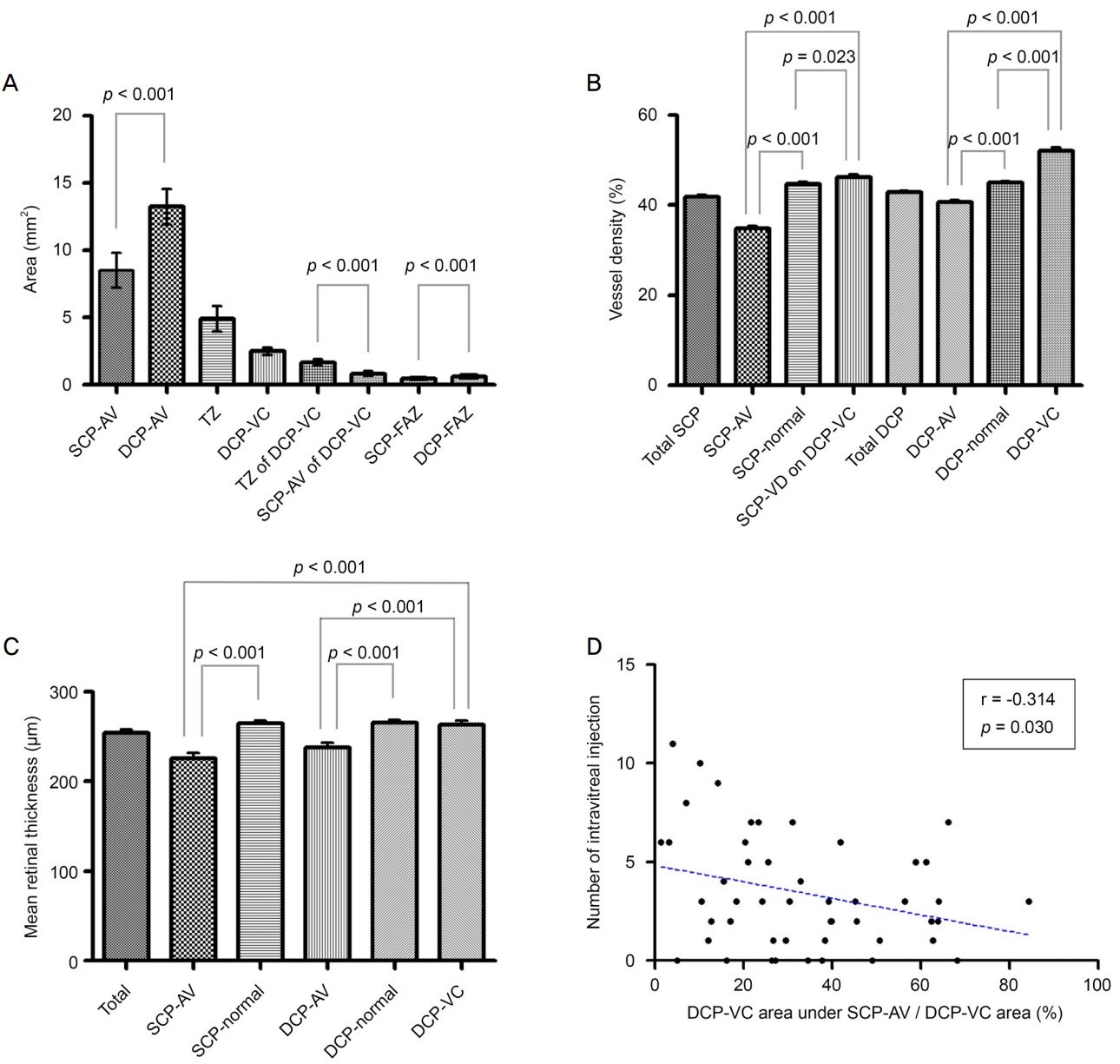
SCP ļ░Å DCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØĆ Ļ░üĻ░ü 8.507 ┬▒ 4.442 mm2 (23.6 ┬▒ 12.3%), 13.238 ┬▒ 4.612 mm2 (36.8 ┬▒ 12.8%)ļĪ£ DCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØ┤ ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ļŹö ļäōĻ▓ī ņĖĪņĀĢļÉśņŚłļŗż(p<0.001) (Fig. 3A). ņØ┤Ē¢ēņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØĆ 4.886 ┬▒ 3.273 mm2 (13.5 ┬▒ 9.1%)ņśĆļŗż. DCP ņÜĖĒśłņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØĆ 2.500 ┬▒ 0.958 mm2 (6.9 ┬▒ 2.7%)ļĪ£, DCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś 20.4 ┬▒ 10.4% ļ░Å ņØ┤Ē¢ēņśüņŚŁņØś 39.6 ┬▒ 16.4%ņŚÉ ļČäĒżĒĢśņśĆļŗż. DCP ņÜĖĒśłņśüņŚŁņØś 66.7 ┬▒ 20.7%ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņśüņŚŁņØĆ ņØ┤Ē¢ēņśüņŚŁņŚÉ ļČäĒżĒĢśņśĆĻ│Ā, ļéśļ©Ėņ¦ĆļŖö SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ ņĢäļלņŚÉ ļČäĒżĒĢśņśĆņ£╝ļ®░, ņØ┤Ē¢ēņśüņŚŁņŚÉ ļČäĒżĒĢ£ DCP ņÜĖĒśłņśüņŚŁņØ┤ ļŹö ļäōņŚłļŗż(p<0.001) (Table 2). SCPļ│┤ļŗż DCP ĒÅēĻĘĀ FAZ ļ®┤ņĀüņØ┤ ļŹö ļäōņŚłļŗż(p<0.001).
SCP ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäļŖö 41.91 ┬▒ 2.39%, SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäļŖö 34.83 ┬▒ 3.91%ļĪ£ SCP ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä 44.80 ┬▒ 2.28%ļ│┤ļŗż ļé«ņĢśļŗż(p<0.001). DCP ņÜĖĒśłņśüņŚŁņØś ņāüņĖĄ SCP ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä(46.17 ┬▒ 4.10%)ļŖö SCP ņĀĢņāüĒśłĻ┤ĆņśüņŚŁ ļ░Å ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p=0.023, p<0.001). ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅäļŖö 42.90 ┬▒ 1.98%ņØ┤ļ®░, DCP ņÜĖĒśłņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä(52.14 ┬▒ 4.74%)ļŖö DCP ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä(44.99 ┬▒ 2.00%)ņÖĆ ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ĒśłĻ┤Ćļ░ĆļÅä(40.70 ┬▒ 3.04%)ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(ļ¬©ļæÉ, p<0.001) (Fig. 3B).
ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļŖö 254.6 ┬▒ 26.6 ╬╝mņØ┤ļ®░, Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļŖö Ļ░ü ņĖĄņØś ņĀĢņāüĒśłĻ┤ĆņśüņŚŁļ│┤ļŗż ļé«ņĢśļŗż(ļ¬©ļæÉ, p<0.001). ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØś ĒÅēĻĘĀļæÉĻ╗śļŖö 263.6 ┬▒ 29.2 ╬╝mļĪ£ Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļ│┤ļŗż ļåÆņĢśņ¦Ćļ¦ī(ļ¬©ļæÉ, p<0.001), Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śņÖĆ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Fig. 3C).
ĻĖ░ļ│Ė ņØĖņ×ÉņÖĆ ļČäĒĢĀņśüņŚŁ ļ®┤ņĀüĻ│╝ņØś ņāüĻ┤Ć ņĪ░ņé¼ Ļ▓░Ļ│╝, ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØ┤ ļäōņØäņłśļĪØ ņĪ░ņé¼ņŗ£ņĀÉņØś ĒÅēĻĘĀ LogMAR ņŗ£ļĀźĻ│╝ ļ╣äļĪĆ(r=0.329, p=0.022)ĒĢśņŚ¼ ņĢłņĀĢĒÖö ņŗ£ņĀÉņØś ņŗ£ļĀźņØ┤ ļé«ņĢśļŗż. ļæÉ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØ┤ ļäōņØäņłśļĪØ ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ņŖżĒģīļĪ£ņØ┤ļō£ ņŻ╝ņé¼ ĒÜīņłśĻ░Ć ļ¦ÄņĢśļŗż(r=0.287, p=0.048; r=0.301, p=0.038). DCP ņÜĖĒśłņśüņŚŁ Ēś╣ņØĆ ņØ┤Ē¢ēņśüņŚŁ ļ®┤ņĀüĻ│╝ Ļ┤ĆļĀ© ņ׳ļŖö ĻĖ░ļ│Ė ņØĖņ×ÉļŖö ņŚåņŚłļŗż. ĒĢśņ¦Ćļ¦ī, DCP ņÜĖĒśłņśüņŚŁ ņżæ ņØ┤Ē¢ēņśüņŚŁņØś ļ®┤ņĀü ļČäņ£©ņØ┤ ņ×æņØäņłśļĪØ, ņ”ē SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ ņĢäļלņØś DCP ņÜĖĒśłņśüņŚŁņØ┤ ļŹö ļ¦ÄņØ┤ ļČäĒżĒĢĀņłśļĪØ ņĢłņĀĢĒÖö ņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢśĻĖ░Ļ╣īņ¦Ć ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ņŻ╝ņé¼ ĒÜīņłśĻ░Ć ņ×æņĢśļŗż(r=-0.314, p=0.030) (Fig. 3D).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉļōżņØś OCTA Ļ▓░Ļ│╝ ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØĆ Ēæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁļ│┤ļŗż ļäōĻ│Ā, ņØ┤ļĪ£ ņØĖĒĢ┤ ņŗ¼ņĖĄņØĆ ņØ┤ņāüĒśłĻ┤ĆņØ┤ ļČäĒżĒĢśņ¦Ćļ¦ī Ēæ£ņĖĄņØĆ ņĀĢņāüņØĖ ņØ┤Ē¢ēņśüņŚŁņØ┤ ņĪ┤ņ×¼ĒĢśņśĆļŗż. ņŗ¼ņĖĄļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś 1/5ņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņŻ╝ļÉ£ ņØ┤ņāüĒśłĻ┤Ć ņåīĻ▓¼ņ£╝ļĪ£ 2/3ļŖö ņØ┤Ē¢ēņśüņŚŁņŚÉ ņĪ┤ņ×¼ĒĢśņśĆļŗż. ļ░śļ®┤ Ēæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ Ļ▒░ņØś Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢäņä£ ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Øņ▓śļ¤╝ ĻĘĖ ļ▓öņ£äļź╝ ĒŖ╣ņĀĢĒĢĀ ņłś ņŚåņŚłļŗż. ĒŖ╣Ē׳ ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņĀĢņāüĒśłĻ┤ĆņśüņŚŁļ│┤ļŗż ļåÆņĢä Ēśłļźśļ¤ēņØ┤ ļ¦ÄņĢśļŗż. ņØ┤ļŖö ĒÅÉņćäļÉ£ ļ¦Øļ¦ēņĀĢļ¦źņØś ņøÉņ£äļČĆ ņĀĢļ¦źņĢĢ ņāüņŖ╣ņ£╝ļĪ£ ĒÖ®ļ░śļČĆņØś ļ¬©ņäĖĒśłĻ┤Ć Ēśłļźś ņĀĢņ▓┤Ļ░Ć ļ░£ņāØĒĢ£ Ēøä, ņĀĢņ▓┤ļÉ£ ĒśłļźśĻ░Ć ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņśüņŚŁņØä ņÜ░ĒÜīļĪ£ļĪ£ ņé¼ņÜ®Ē¢łņØä Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņØ┤ņ▓śļ¤╝ ņĀĢļ¦źņĢĢ ņāüņŖ╣Ļ│╝ ļ╣äĻ┤ĆļźśņŚÉ ņĀüņØæĒĢśļŖö ļæÉ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ņ¢æņāüņØ┤ ļŗżļźĖ ņØ┤ņ£ĀļŖö ļæÉ ņĖĄņØś ņä£ļĪ£ ļŗżļźĖ ĒĢ┤ļČĆĒĢÖņĀü ĒŖ╣ņä▒ņŚÉ ĻĖ░ņØĖĒĢ£ļŗż.
ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä(perifoveal) ļ¦Øļ¦ēļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØĆ Campbell et al [10]ņØ┤ ņĀ£ņŗ£ĒĢ£ Ēæ£ņĖĄ, ņżæņĖĄ, ļ░Å ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒĢ┤ļ©╣(hammock)ĻĄ¼ņĪ░ņŚÉ ļŹöĒĢ┤, ņĄ£ĻĘ╝ ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØĆ ļŗżļźĖ ļæÉ ņāüņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØĻ│╝ ļŗ¼ļ”¼ ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£äņØś ņłśĒÅēņåöĻĖ░(horizontal raphe)ļź╝ Ļ░ĆļĪ£ņ¦Ćļź┤ļŖö Ļ▒░ļ»Ėņżä ĒśĢĒā£ņØś ņåīņÜ®ļÅīņØ┤ ĒśłĻ┤Ć(spider-like vortex capillaries)ņØ┤ Ļ│üņł£ĒÖś(collateral circulation)ņØä ĒśĢņä▒ĒĢ£ļŗżļŖö ņĀÉņØ┤ ļ░ØĒśĆņĪīļŗż[11]. ņØ┤ļ¤░ ņåīņÜ®ļÅīņØ┤ ļ¬©ņäĖĒśłĻ┤ĆņØś ņżæņŗ¼ņŚÉļŖö ļ¦Øļ¦ēņäĖņĀĢļ¦źņ£╝ļĪ£ ņŚ░Ļ▓░ļÉśļŖö ņŻ╝ņÜö ņČ£ĻĄ¼(central vortex connection to venules)Ļ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĪīņ£╝ļ®░, ņØ┤ļŖö ņāØļ”¼ĒĢÖņĀüņ£╝ļĪ£ ļåÆņØĆ ņé░ņåīņÜöĻĄ¼ļ¤ēņØ┤ ĒĢäņÜöĒĢ£ ņÖĖļ¦ØņāüņĖĄ(outer plexiform layer)ņŚÉņä£ ņĄ£ņåīĒĢ£ņØś ņĀĆĒĢŁņ£╝ļĪ£ Ļ▓░ĒĢ® ņé░ņåīĻ░Ć ņĀ£Ļ▒░ļÉ£ ĒŚżļ¬©ĻĖĆļĪ£ļ╣łņØä ļ░░ņČ£ĒĢśĻĖ░ ņ£äĒĢ£ ĻĄ¼ņĪ░ļØ╝Ļ│Ā ņŚ¼Ļ▓©ņ¦äļŗż[11]. ļö░ļØ╝ņä£ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŹś ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ, ĒÖĢņןļÉ£ ņåīņÜ®ļÅīņØ┤ ļ¬©ņäĖĒśłĻ┤ĆĻ│╝ ņŻ╝ņÜö ņäĖņĀĢļ¦ź ņČ£ĻĄ¼ ļ│ĄĒĢ®ņ▓┤ļĪ£ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ņØ┤ĒÖśļÉ£ ņśüņŚŁņŚÉņä£ ņ¦äņ×ģĒĢśļŖö ļ¦Øļ¦ēņäĖļÅÖļ¦źņØś ĒśłļźśĻ░Ć ĒÅÉņćä ņśüņŚŁņØś ņäĖņĀĢļ¦źņ£╝ļĪ£ ņ£ĀņČ£ļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ļ│ĄĒĢ®ņ▓┤ļĪ£ ļ¬░ļĀżļō”ņ£╝ļĪ£ ņØĖĒĢ┤ ņÜĖĒśłļĪ£ Ļ┤Ćņ░░ļÉśļŖö ļ│æļ”¼ņĀüņØĖ ņĀüņØæ(pathologic adaptation)ņØś Ļ▓░Ļ│╝ņ×äņØä ņĢöņŗ£ĒĢ£ļŗż.
ĻĖēņä▒ ļ░Å ļ¦īņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ĒśłĻ┤Ćļ░ĆļÅä ņ░©ņØ┤ļź╝ ņĪ░ņé¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, ņØ┤ĒÖśņśüņŚŁņØś SCP ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ĻĖēņä▒ņŚÉņä£ ļ¦īņä▒ņ£╝ļĪ£ ņ¦äĒ¢ēĒĢĀņłśļĪØ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢ£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[8]. ļ░śļ®┤, ņØ┤ĒÖśņśüņŚŁņØś DCP ĒśłĻ┤Ćļ░ĆļÅäļŖö ĻĖēņä▒Ļ│╝ ļ¦īņä▒ Ļ░ä ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŖöļŹ░, ĻĘĖ ņøÉņØĖņØĆ SCP ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć ĻĖēņä▒ĻĖ░ņŚÉ ļ│┤ņĪ┤ļÉśļŗżĻ░Ć ļé┤ņĖĄ ļ¦Øļ¦ē ņåÉņāüņ£╝ļĪ£ ņé░ņåīņÜöĻĄ¼ļ¤ēņØ┤ ņĀÉņ░© Ļ░ÉņåīĒĢśņŚ¼ ļ¦īņä▒ĻĖ░ņŚÉ ĒśłĻ┤Ćļ░ĆļÅäĻ░Ć Ļ░ÉņåīĒĢ£ļŗżĻ│Ā ĒĢśņśĆļŗż[8]. ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņÜĖĒśłņØĆ ĻĖēņä▒ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ļÅä ņŻ╝ļĪ£ DCPņŚÉ Ļ┤Ćņ░░ļÉśļŖö ņåīĻ▓¼ņØ┤ņ¦Ćļ¦ī SCPņŚÉļŖö ļō£ļ¼╝Ļ▓ī Ļ┤Ćņ░░ļÉśļŖö ņåīĻ▓¼ņØ┤ļŗż. Rispoli et al [7]ņØĆ 10ņĢłņØś ĻĖēņä▒ĻĖ░ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£äļź╝ ņĪ░ņé¼ĒĢ£ Ļ▓░Ļ│╝, ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ DCP ņÜĖĒśłņØ┤ Ļ┤Ćņ░░ļÉ£ ļ░śļ®┤ Ēæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņŚÉņä£ ņÜĖĒśłņØĆ ĒĢ£ ļ¬ģļÅä Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖöļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ Suzuki et al [12]ņØĆ ņŗ¼ļČĆļ¬©ņäĖĒśłĻ┤Ć ĒÖĢņן(deep capillary telangiectasia)ņØ┤ļØ╝ļŖö ņÜ®ņ¢┤ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ļ¬©ļōĀ ņĢłņŚÉņä£ ĒĢ┤ļŗ╣ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉ£ ļ░śļ®┤ Ēæ£ņĖĄļ¬©ņäĖĒśłĻ┤Ć ĒÖĢņןņØĆ ļ░ś ņØ┤ĒĢśņŚÉņä£ļ¦ī Ļ┤Ćņ░░ļÉśņŚłļŗżĻ│Ā ĒĢśņśĆļŗż. ļ░śļ®┤ Coscas et al [13]ņØĆ DCP ņÜĖĒśłņØä Ļ│ĀņØīņśü ņŗĀĒśĖĻ░Ć ļÅÖļ░śļÉ£ ĒÖ®ļ░śļ¬©ņäĖĒśłĻ┤Ć ĒÖĢņן(dilation of deep superior macular capillaries with hyper signal)ņØ┤ļØ╝ļŖö ņÜ®ņ¢┤ļź╝ ņé¼ņÜ®ĒĢśņŚ¼, ĻĖēņä▒ĻĖ░ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś 78.8%ņŚÉņä£ Ļ┤Ćņ░░ļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ņāüĒā£ņØś ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäļÅä DCP ņÜĖĒśłņØ┤ ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļśÉĒĢ£ SCP ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁ ņĢäļלņŚÉ DCP ņÜĖĒśłņśüņŚŁņØ┤ ļŹö ļ¦ÄņØ┤ ļČäĒżĒĢĀņłśļĪØ ļŹö ņ×æņØĆ ņŻ╝ņé¼ ĒÜīņłśļĪ£ ņĢłņĀĢĒÖö ņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢśļŖö ņØ┤ļ▓ł ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļĪ£ ļ»ĖļŻ©ņ¢┤ ļ│╝ ļĢī, DCP ņÜĖĒśłņśüņŚŁņØ┤ ņāüņŖ╣ĒĢ£ ļ¦Øļ¦ē ņĀĢļ¦źņĢĢņ£╝ļĪ£ ņØĖĒĢ£ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ņåÉņāüņśüņŚŁņØś ĒśłĻ┤Ć ņŻ╝ņ£äņŚÉ Ļ│ĀņØ┤ļŖö ļ¦Øļ¦ē ļé┤ņĢĪņØä ļ░░ņĢĪĒĢśļŖö ņŚŁĒĢĀņØ┤ ņ׳ņØīņØä ņĢöņŗ£ĒĢ£ļŗż. ļö░ļØ╝ņä£, DCP ņÜĖĒśłņØĆ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś ĻĖēņä▒ĻĖ░ļČĆĒä░ ļÅÖļ░śļÉśļŖö ņåīĻ▓¼ņ×äĻ│╝ ļÅÖņŗ£ņŚÉ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ņāüĒā£ņŚÉņä£ļÅä Ļ┤Ćņ░░ļÉśļ®░ ĒÖ®ļ░śļČĆņóģ ņŚåņØ┤ ļ╣äĒÖ£ņä▒ ņāüĒā£ļź╝ ņןĻĖ░Ļ░ä ņ£Āņ¦ĆĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀļ¦Øļ¦ēļæÉĻ╗śļŖö ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņŚÉ ļ╣äĒĢ┤ ļ¦ÄņØ┤ ņ¢ćņĢśĻ│Ā ņØ┤ļŖö Oh and Ahn [8]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒ¢łļŗż. ĻĘĖļōżņØĆ ļ¦īņä▒ ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćäņŚÉņä£ ņżæņŗ¼ņśżļ¬®ņŻ╝ņ£ä ņśüņŚŁņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝ ņĀäņ▓┤ ļ¦Øļ¦ēļæÉĻ╗śņÖĆ Ēæ£ņĖĄ ļ¦Øļ¦ēļæÉĻ╗śļŖö ņ¢ćņĢäņ¦ĆļŖö ļŹ░ņŚÉ ļ╣äĒĢ┤ ņÖĖņĖĄ ļ¦Øļ¦ēļæÉĻ╗śļŖö ņ¢ćņĢäņ¦Ćņ¦Ć ņĢŖļŖöļŗżĻ│Ā ĒĢśņśĆļŗż. ņØ┤ļŖö ļ¦īņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ļÅä ĒÖ®ļ░śļČĆņØś ņÖĖņĖĄļ¦Øļ¦ēļæÉĻ╗śļŖö ņ£äņČĢļÉśņ¦Ć ņĢŖĻ│Ā ņ£Āņ¦ĆļÉ©ņØä ņØśļ»ĖĒĢ£ļŗż. ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ ņÜĖĒśłņśüņŚŁņØś ĒÅēĻĘĀ ļ¦Øļ¦ēļæÉĻ╗śļŖö Ļ░ü ņĖĄņØś ņĀĢņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀļæÉĻ╗śņÖĆ ņ░©ņØ┤Ļ░Ć ņŚåņØīņØä ļ»ĖļŻ©ņ¢┤ ļ│╝ ļĢī, DCP ņÜĖĒśł ņśüņŚŁņØĆ ĻĘĖ ņ£äņĖĄņØś Ēæ£ņĖĄļ¦Øļ¦ē ļæÉĻ╗śĻ╣īņ¦Ć ļ│┤ņĪ┤ĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢī ņłś ņ׳ļŗż. ņåÉņāüļÉ£ ļ¬©ņäĖĒśłĻ┤Ćņ┤Øņ£╝ļĪ£ ĒØśļ¤¼ ļōżņ¢┤Ļ░Ćņ¦Ć ņĢŖļŖö ļ¦Øļ¦ēņäĖļÅÖļ¦ź ļé┤ ĒśłļźśļŖö ļåÆņØĆ ņé░ņåīĒżĒÖöļÅäļź╝ ņ£Āņ¦ĆĒĢĀ Ļ▓āņØ┤ļ®░[14,15], ņØ┤ļōżņØĆ DCP ņÜĖĒśłļČĆņ£äļĪ£ ļ¬©ņŚ¼ ņÖĖņĖĄ ļ¦Øļ¦ēļ┐Éļ¦ī ņĢäļŗłļØ╝ Ēæ£ņĖĄ ļ¦Øļ¦ē ņĪ░ņ¦üņŚÉ ņé░ņåīļź╝ ĒÖĢņé░ņŗ£ņ╝£ ņĀĆņé░ņåīņ”ØņØä Ļ░£ņäĀņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ļ¦īņä▒ ņāüĒā£ņŚÉņä£ Ēæ£ņĖĄ ļ¦Øļ¦ēņØä ņĀĆņé░ņåīņ”Øņ£╝ļĪ£ ņØĖĒĢ£ ņ£äņČĢņ£╝ļĪ£ļČĆĒä░ ļ│┤ĒśĖĒĢśļŖö ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ņāüĻ┤ĆĻ┤ĆĻ│ä ņĪ░ņé¼ Ļ▓░Ļ│╝ ņŗ¼ļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØ┤ ļäōņØäņłśļĪØ ņĢłņĀĢĒÖö ņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢśņŚ¼ļÅä ņĪ░ņé¼ ņŗ£ņĀÉņØś ņŗ£ļĀźņØĆ ļé«ņĢśļŗż. ņØ┤ļŖö Wakabayashi et al [16]ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢśļ®░ ņŗ¼ļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņĢäļל ņŗ£ņäĖĒżņÖĆ ņŚ░ņĀæĒĢśļŖö ņłśĒÅēņäĖĒż ļ░Å ņ¢æĻĘ╣ņäĖĒżļĪ£ņØś ņśüņ¢æ Ļ│ĄĻĖē Ļ░ÉņåīņÖĆ ĒŚłĒśłņŚÉ ļö░ļźĖ Ļ▓░Ļ│╝ļĪ£ ņČöņĀĢļÉ£ļŗż. Chung et al [17]ņØĆ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś ņŗ£ļĀź ņāüņŖ╣ ņĀĢļÅäņŚÉ ļö░ļØ╝ ĻĘĖļŻ╣ņØä ļéśļłäĻ│Ā ĒÖ®ļ░śĒŚłĒśł ņ£Āļ¼┤ņÖĆ ļ╣äĻĄÉ ņŚ░ĻĄ¼ņŚÉņä£, ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņŻ╝ņé¼ Ēøä ļŗżņä» ĻĖĆņ×É ņØ┤ņāüņØś ņŗ£ļĀźĒśĖņĀäņØ┤ ņŚåņŚłļŹś ĻĘĖļŻ╣ņØś ĒÖ®ļ░śļČĆ ĒŚłĒśłņØ┤ ĻĘĖļĀćņ¦Ć ņĢŖņØĆ ĻĘĖļŻ╣ļ│┤ļŗż ļŹö ļ¦ÄņØ┤ Ļ┤Ćņ░░ļÉśļ®░ ņØ┤ļŖö ņŗ£ļĀźņāüņŖ╣ņŚÉ ļéśņü£ ņśłĒøä ņØĖņ×ÉļØ╝Ļ│Ā ĒĢśņśĆļŗż. ĒŖ╣Ē׳ ĒĢ┤ļŗ╣ ĻĘĖļŻ╣ņØĆ ņĪ░ņé¼ ņĀä ņŖżĒģīļĪ£ņØ┤ļō£ ņŻ╝ņé¼ ņ╣śļŻī ļ│æļĀźņØ┤ ļŹö ļ¦ÄņØĆ Ļ▓ĮĒ¢źņØ┤ ņ׳ņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüĒśłĻ┤ĆņśüņŚŁņØś ĒÅēĻĘĀ ļ®┤ņĀüņØ┤ ļäōņØäņłśļĪØ ņĢłņĀĢĒÖö ņāüĒā£ņŚÉ ļÅäļŗ¼ĒĢśĻĖ░Ļ╣īņ¦Ć ņŖżĒģīļĪ£ņØ┤ļō£ ņŻ╝ņé¼ ĒÜīņłśĻ░Ć ļ¦ÄņØĆ Ļ▓āņ£╝ļĪ£ ņĪ░ņé¼ļÉśņŚłļŗż. ņØ┤ļ¤░ Ļ▓░Ļ│╝ļōżļĪ£ ļ»ĖļŻ©ņ¢┤ ļ│┤ņĢä Ļ░ü ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒŚłĒśłņśüņŚŁņØ┤ ļäōņØäņłśļĪØ ĒĢŁĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É ņ╣śļŻīļ¦īņ£╝ļĪ£ ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņŚÉ ļÅäļŗ¼ĒĢśĻĖ░ ņ¢┤ļĀżņøĆņØä ņĢī ņłś ņ׳ņŚłļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ ļīĆņāü ĒÖśņ×ÉņØś ņłśĻ░Ć ņĀüĻ│Ā ĻĖēņä▒ĻĖ░ ņŗ£ņĀÉ Ēś╣ņØĆ ļ░śļīĆņĢłĻ│╝ ļ╣äĻĄÉ ņŚ░ĻĄ¼ļź╝ ĒĢśņ¦Ć ņĢŖņØĆ ĒĢ£Ļ│äņĀÉņØ┤ ņ׳ļŗż. ļśÉĒĢ£ ļŗżņ¢æĒĢ£ ņóģļźśņØś ņ£Āļ”¼ņ▓┤Ļ░Ģļé┤ ņŻ╝ņé¼ ļ░Å Ļ┤æņØæĻ│Ā ņ╣śļŻī ļō▒ ļČäņäØ ņŗ£ņĀÉ ņØ┤ņĀäņŚÉ ļŗżņ¢æĒĢ£ ņ╣śļŻī ļ│æļĀźņØ┤ ņ׳ņŚłĻ│Ā, ņØ┤ļ¤¼ĒĢ£ ņ╣śļŻīļōżņØ┤ ĒÖ®ļ░śļČĆ ĒśłļźśņÖĆ ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņ¦Ć ļ¬╗Ē¢łļŗż. ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņÖĆ ņ×¼ļ░£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņØś OCTA ņåīĻ▓¼ņØä ļ╣äĻĄÉĒĢśņ¦Ć ņĢŖņØĆ Ļ▓āļÅä ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņØ┤ļŗż. ņČöĒøä ņ×¼ļ░£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä ĒÖśņ×ÉņŚÉņä£ ĒÖ®ļ░śļČĆņóģ ņśüņŚŁĻ│╝ DCP ņÜĖĒśłņśüņŚŁņØś Ļ┤ĆĻ│äņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ DCP ņÜĖĒśłņØś ņŚŁĒĢĀņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņĪ░ņé¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ĒĢśņ¦Ćļ¦ī ĒĢ┤ļČĆĒĢÖņĀüņ£╝ļĪ£ ņĢłņĀĢļÉ£ ļ¦Øļ¦ēņØĆ ļ¦Øļ¦ēļé┤ņĢĪņØ┤ ņ┤łļלĒĢśļŖö ļČäĒĢĀ ņśżņ░©(segmentation error)ļéś ļ®┤ĒÖöļ░ś ļ░Å ļ¦Øļ¦ēņČ£ĒśłņØ┤ ņ┤łļלĒĢśļŖö ĒøäļČĆ ņØīņśü(posterior shadowing)ņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖņĢä Ēæ£ņĖĄ ļ░Å ņŗ¼ņĖĄ ļ¦Øļ¦ēĒśłĻ┤Ćņ┤ØņØś ņĀĢĒÖĢĒĢ£ ļČäĒĢĀņŚÉ ĻĖ░ļ░śĒĢ£ ņŗĀļó░ņä▒ ņ׳ļŖö Ļ▓░Ļ│╝ļź╝ ņ¢╗ņØä ņłś ņ׳ņŚłļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņØś DCP ņÜĖĒśłņśüņŚŁņØä ņĀĢļ¤ēņĀüņ£╝ļĪ£ ļČäņäØĒĢśņŚ¼ ļČäĒżņÖĆ ĒŖ╣ņ¦ĢņØä ņ▓śņØī ļ│┤Ļ│ĀĒĢśļŖöļŹ░ņŚÉ ņżæņÜöĒĢ£ ņØśņØśĻ░Ć ņ׳ļŗż. DCP ņÜĖĒśłņØĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ņåÉņāüņśüņŚŁņØś ļ¦Øļ¦ē ļé┤ņĢĪņØä ļ░░ņĢĪĒĢśĻ│Ā Ēæ£ņĖĄ ļ¦Øļ¦ē ņĪ░ņ¦üņØä ņ£äņČĢņ£╝ļĪ£ļČĆĒä░ ļ│┤ĒśĖĒĢ©ņ£╝ļĪ£ņŹ© ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäņŚÉņä£ ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņä▒ņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćä DCP ņØ┤ņāüņśüņŚŁņØĆ Ēæ£ņĖĄ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņØ┤ņāüņśüņŚŁļ│┤ļŗż ļäōĻ│Ā ĻĘĖ ņé¼ņØ┤ņŚÉ ņØ┤Ē¢ēņśüņŚŁņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż. ņØ┤Ē¢ēņśüņŚŁņŚÉ ņŻ╝ļĪ£ ļČäĒżĒĢśļŖö DCP ņÜĖĒśłņØĆ ņāüņŖ╣ĒĢ£ ņĀĢļ¦ź ļé┤ ņĢĢļĀźņŚÉ ļīĆĒĢŁĒĢśņŚ¼ Ēśłļźśļź╝ ļ░░ņČ£ĒĢśļŖö DCPņØś ļ│æļ”¼ĒĢÖņĀü ņĀüņØæ Ļ▓░Ļ│╝ļĪ£ ņČöņĀĢļÉ£ļŗż. DCP ņÜĖĒśłņØĆ ļ¦īņä▒ ļ╣äĒÖ£ņä▒ ļ¦Øļ¦ēļČäņ¦ĆņĀĢļ¦źĒÅÉņćäĻ░Ć ĒĢ┤ļČĆĒĢÖņĀü ņĢłņĀĢņä▒ņØä ņ£Āņ¦ĆĒĢśļŖö ļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Figure┬Ā1.
Conversion of color-coded retinal thickness and vessel density map of superficial and deep capillary plexus. (A) Colorcoded retinal thickness map of No. 34 patient obtained from IMAGEnet with the color code suggested by the manufacturer on the bottom left; the retinal thickness corresponding to the color-code is marked in the range of 0-500 ╬╝m. (B, C) Color-coded vessel density map of superficial (B) and deep capillary plexus (C) from the same patient. The vessel density corresponding to the color code varies from 0 to 100%. (D) Each pixel's color information was converted into the retinal thickness for calculating the average retinal thickness of the desired region. All pixels are expressed as a 16-bit grayscale. (E, F) Similarly, the color information of each pixel's vessel density is converted into a 16-bit grayscale. Figure B is transformed into (E) as grayscale. (F) is the converted image of (C).

Figure┬Ā2.
How to acquire manual segmentation images from optical coherence tomography angiographic (OCTA) images in chronic inactive branch retinal vein occlusion. Entire process of extracting the superficial capillary plexus-abnormal vessel (SCP-AV), deep capillary plexus-abnormal vessel (DCP-AV), DCP-vascular congestion (DCP-VC), and transitional zone (TZ) from the OCTA images of No. 34 patient via manual segmentation is illustrated. (A) In fluorescein angiography at 3 months from the first visit, capillary nonperfusion of 5-disc diameter or more was noted. This patient was anatomically stable after two intravitreal anti-vascular endothelial growth factor treatments. (B) Six months after anatomical stabilization, only sclerotic veins and vascular loops were observed in the right fundus photography. (C, D) En face OCTA images of SCP (C) and DCP (D). (E) The brightness was adjusted so that DCP-VC could be seen clearly from the D image. The retinal arterioles (yellow asterisks) from the nonperfusion area supplies flow to DCP-VC, and that flows drain to the central congested vortex venules on the opposite side (white arrows). (F) Except for the fovea avascular zone, the SCP's abnormal vessel region is expressed in red, and the normal vascular region is denoted in blue. (G) Similar to the (F) image, the DCP also expressed the abnormal vessels in red, the DCP-VC in yellow, and the normal vessels in blue. (H) Segmented SCP-AV image (16.22 mm2). (I) Segmented DCP-AV image (18.40 mm2). (J) Segmented DCP-VC image (3.35 mm2). (K) Segmented TZ image (2.33 mm2). TZ is distributed in a similar location to the DCP-VC region. The area where DCP-VC and TZ coincide was measured to be 1.15 mm2. Therefore, DCP-VC was distributed in 34.4% in TZ and 65.6% under SCP-AV. The proportion of DCP-VC in TZ was calculated as 49.4%.
Figure┬Ā3.
Bar graph with standard deviation of area, vascular density, and mean retinal thickness corresponding to segmented region. (A) Mean segmented areas of superficial and deep capillary plexus (SCP and DCP). (B) Mean SCP and DCP vascular densities of corresponding segmented areas. (C) Mean retinal thickness of corresponding segmented regions. (D) Correlation between the number of intravitreal injection and only DCP vascular congestion area under the SCP abnormal vessel area. SCP-AV = superficial capillary plexus-abnormal vessel; DCP-AV = deep capillary plexus-abnormal vessel; DCP-VC = DCP-vascular congestion; TZ = transitional zone; FAZ = fovea avascular zone; VD = vessel density.
Table┬Ā1.
Baseline characteristics of chronic inactive branch retinal vein occlusion
Table┬Ā2.
Area, vascular density, and mean retinal thickness corresponding to segmented region
Values are presented as mean ┬▒ standard deviation unless otherwise indicated.
SCP-AV = superficial capillary plexus-abnormal vessel; DCP-AV = deep capillary plexus-abnormal vessel; TZ = transitional zone; DCP-VC = deep capillary plexus-vascular congestion; FAZ = fovea avascular zone; VD = vascular density; MRT = mean retinal thickness.
REFERENCES
1) Jaulim A, Ahmed B, Khanam T, Chatziralli IP. Branch retinal vein occlusion: epidemiology, pathogenesis, risk factors, clinical features, diagnosis, and complications. An update of the literature. Retina 2013;33:901-10.

2) Rogers SL, McIntosh RL, Lim L, et al. Natural history of branch retinal vein occlusion: an evidence-based systematic review. Ophthalmology 2010 117:1094-101. e5.


3) Hayreh SS. Ocular vascular occlusive disorders: natural history of visual outcome. Prog Retina Eye Res 2014;41:1-25.

4) Hayreh SS, Rojas P, Podhajsky P, et al. Ocular neovascularization with retinal vascular occlusion-III. Incidence of ocular neovascularization with retinal vein occlusion. Ophthalmology 1983;90:488-506.


5) Finkelstein D. Argon laser photocoagulation for macular edema in branch vein occlusion. Ophthalmology 1986;93:975-7.


6) Hayreh SS, Zimmerman MB. Branch retinal vein occlusion: natural history of visual outcome. JAMA Ophthalmol 2014;132:13-22.


7) Rispoli M, Savastano MC, Lumbroso B. Capillary network anomalies in branch retinal vein occlusion on optical coherence tomography angiography. Retina 2015;35:2332-8.



8) Oh J, Ahn J. Comparison of retinal layer thickness and vascular density between acute and chronic branch retinal vein occlusion. Korean J Ophthalmol 2019;33:238-48.



9) Choi KE, Yun C, Cha J, Kim SW. OCT angiography features associated with macular edema recurrence after intravitreal bevacizumab treatment in branch retinal vein occlusion. Sci Rep 2019;9:14153.



10) Campbell JP, Zhang M, Hwang TS, et al. Detailed vascular anatomy of the human retina by projection-resolved optical coherence tomography angiography. Sci Rep 2017;7:42201.



11) Nesper PL, Fawzi AA. Human parafoveal capillary vascular anatomy and connectivity revealed by optical coherence tomography angiography. Invest Ophthalmol Vis Sci 2018;59:3858-67.



12) Suzuki N, Hirano Y, Yoshida M, et al. Microvascular abnormalities on optical coherence tomography angiography in macular edema associated with branch retinal vein occlusion. Am J Ophthalmol 2016 161:126-32. e1.


13) Coscas F, Glacet-Bernard A, Miere A, et al. Optical coherence tomography angiography in retinal vein occlusion: evaluation of superficial and deep capillary plexa. Am J Ophthalmol 2016 161:160-71. e1-2.


14) Hockley DJ, Tripathi RC, Ashton N. Experimental retinal branch vein occlusion in rhesus monkeys. III. Histopathological and electron microscopical studies. Br J Ophthalmol 1979;63:393-411.



15) Frangieh GT, Green WR, Barraquer-Somers E, Finkelstein D. Histopathologic study of nine branch retinal vein occlusions. Arch Ophthalmol 1982;100:1132-40.


-
METRICS

- Related articles
-
Long-term Clinical Course and Prognostic Factor of Branch Retinal Artery Occlusion2023 April;64(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print