1) Mizen TR. Thyroid eye disease. Semin Ophthalmol 2003;18:243-7.


2) Scott IU, Siatkowski MR. Thyroid eye disease. Semin Ophthalmol 1999;14:52-61.


3) Bahn RS, Heufelder AE. Pathogenesis of GravesŌĆÖ ophthalmopathy. N Engl J Med 1993;329:1468-75.


6) Z├Čphel K, Roggenbuck D, Schott M. Clinical review about TRAb assayŌĆÖs history. Autoimmun Rev 2010;9:695-700.


7) Bahn RS, Dutton CM, Joba W, Heufelder AE. Thyrotropin receptor expression in cultured GravesŌĆÖ orbital preadipocyte fibroblasts is stimulated by thyrotropin. Thyroid 1998;8:193-6.


8) Tahara K, Ishikawa N, Yamamoto K, et al. Epitopes for thyroid stimulating and blocking autoantibodies on the extracellular domain of the human thyrotropin receptor. Thyroid 1997;7:867-77.


9) Lytton SD, Kahaly GJ. Bioassays for TSH-receptor autoantibodies: an update. Autoimmun Rev 2010;10:116-22.


10) Michelangeli VP, Munro DS, Poon CW, et al. Measurement of thyroid stimulating immunoglobulins in a new cell line transfected with a functional human TSH receptor (JPO9 cells), compared with an assay using FRTL-5 cells. Clin Endocrinol (Oxf) 1994;40:645-52.


11) Shewring G, Smith BR. An improved radioreceptor assay for TSH receptor antibodies. Clin Endocrinol (Oxf) 1982;17:409-17.


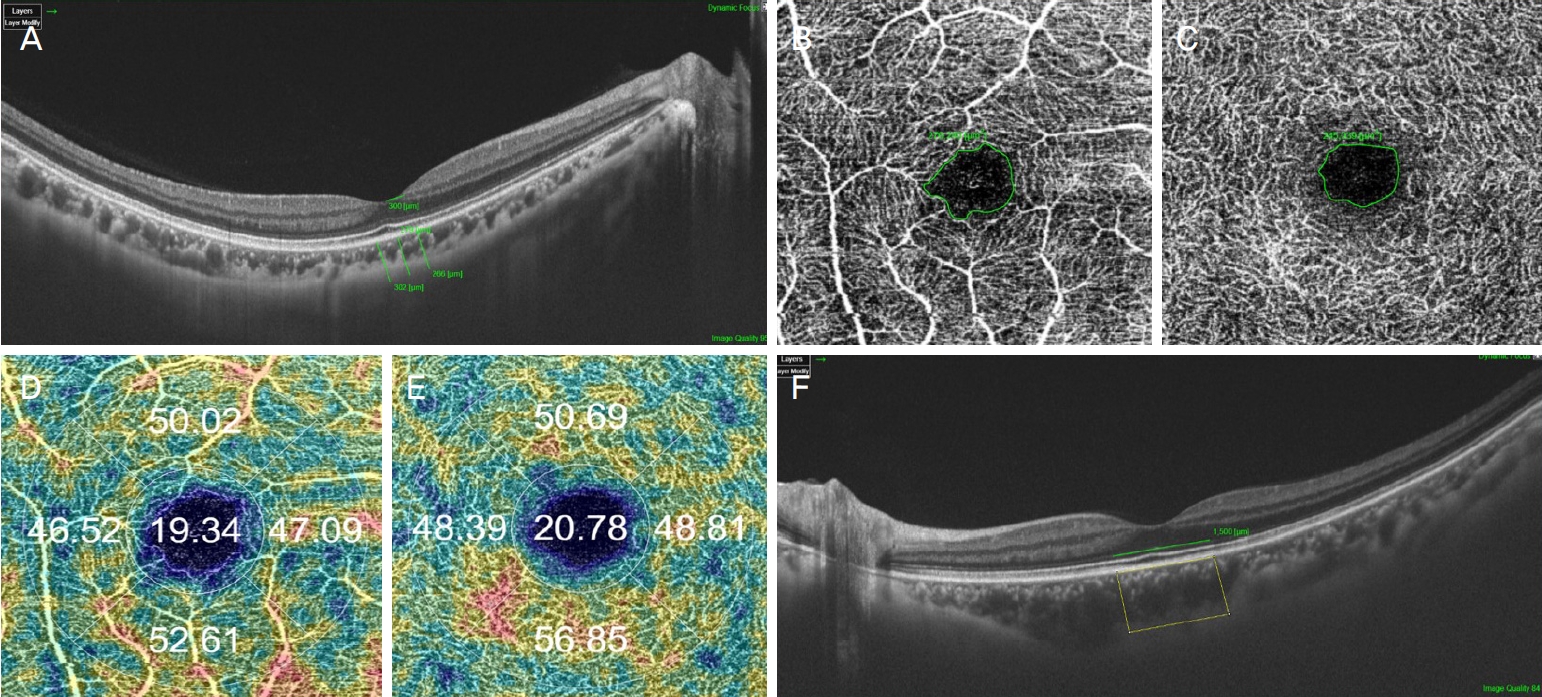
12) Lavia C, Bonnin S, Maule M, et al. Vessel density of superficial, intermediate, and deep capillary plexuses using opical coherence tomography angiography. Retina 2019;39:247-58.

14) Couturier A, Man├® V, Bonnin S, et al. Capillary plexus anomalies in diabetic retinopathy on optical coherence tomography angiography. Retina 2015;35:2384-91.


15) Yu SH, Kang JG, Kim CS, et al. Clinical implications of immunoglobulin G4 to GravesŌĆÖ ophthalmopathy. Thyroid 2017;27:1185-93.


16) Park KA, Oh SY. Choroidal thickness in healthy children. Retina 2013;33:1971-6.


17) Broadhead GK, Hong T, McCluskey P, et al. Choroidal thickness and microperimetry sensitivity in age-related macular degeneration. Ophthalmic Res 2017;58:27-34.


19) Bahn RS, Dutton CM, Natt N, et al. Thyrotropin receptor expression in GravesŌĆÖ orbital adipose/connective tissues: potential autoantigen in GravesŌĆÖ ophthalmopathy. J Clin Endocrinol Metab 1998;83:998-1002.


22) Perri P, Campa C, Costagliola C, et al. Increased retinal blood flow in patients with active GravesŌĆÖ ophthalmopathy. Curr Eye Res 2007;32:985-90.


23) Kim M, Kim H, Kwon HJ, et al. Choroidal thickness in BehcetŌĆÖs uveitis: an enhanced depth imaging-optical coherence tomography and its association with angiographic changes. Invest Ophthalmol Vis Sci 2013;54:6033-9.


24) Maruko I, Iida T, Sugano Y, et al. Subfoveal choroidal thickness after treatment of Vogt-Koyanagi-Harada disease. Retina 2011;31:510-7.


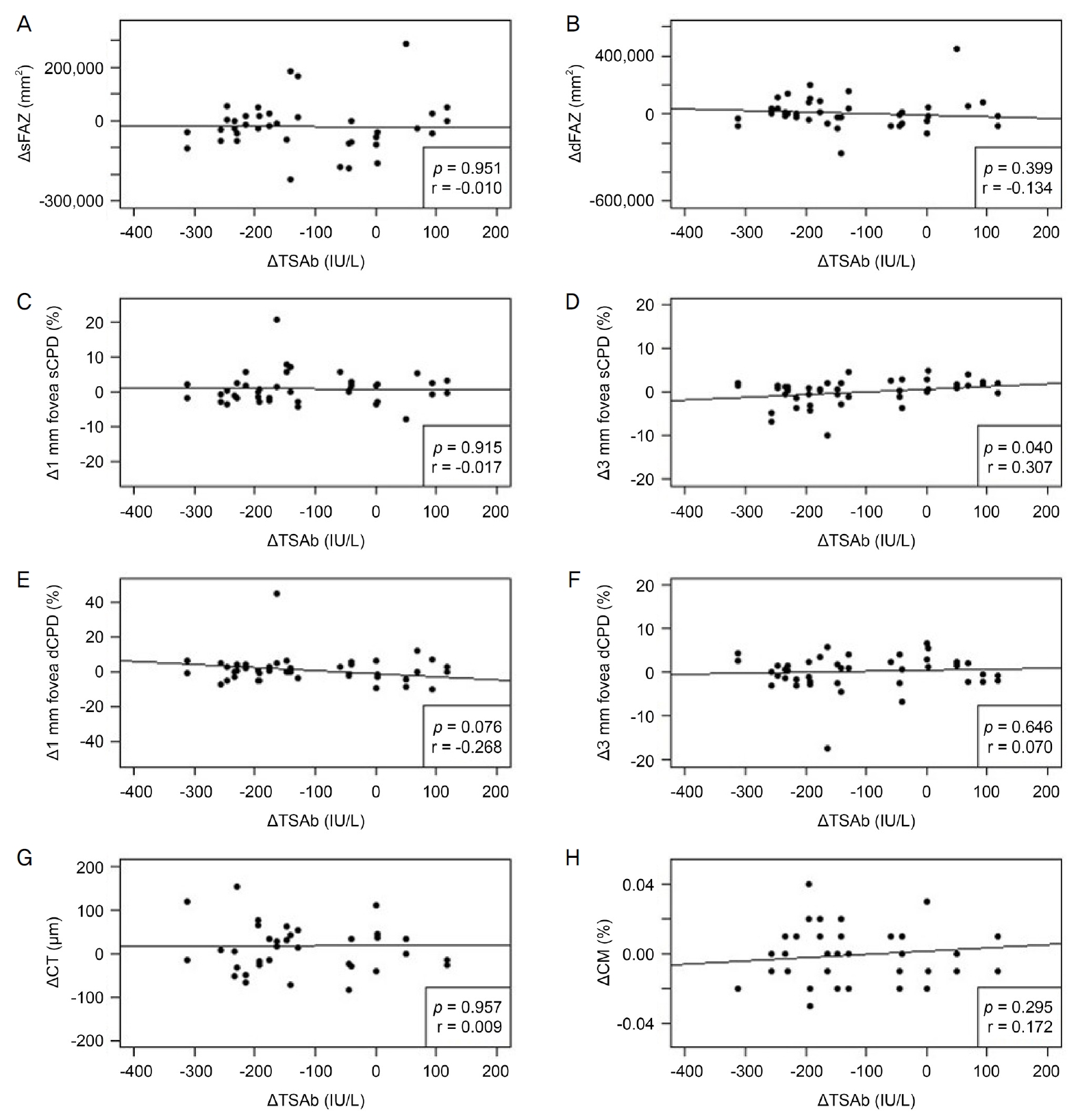
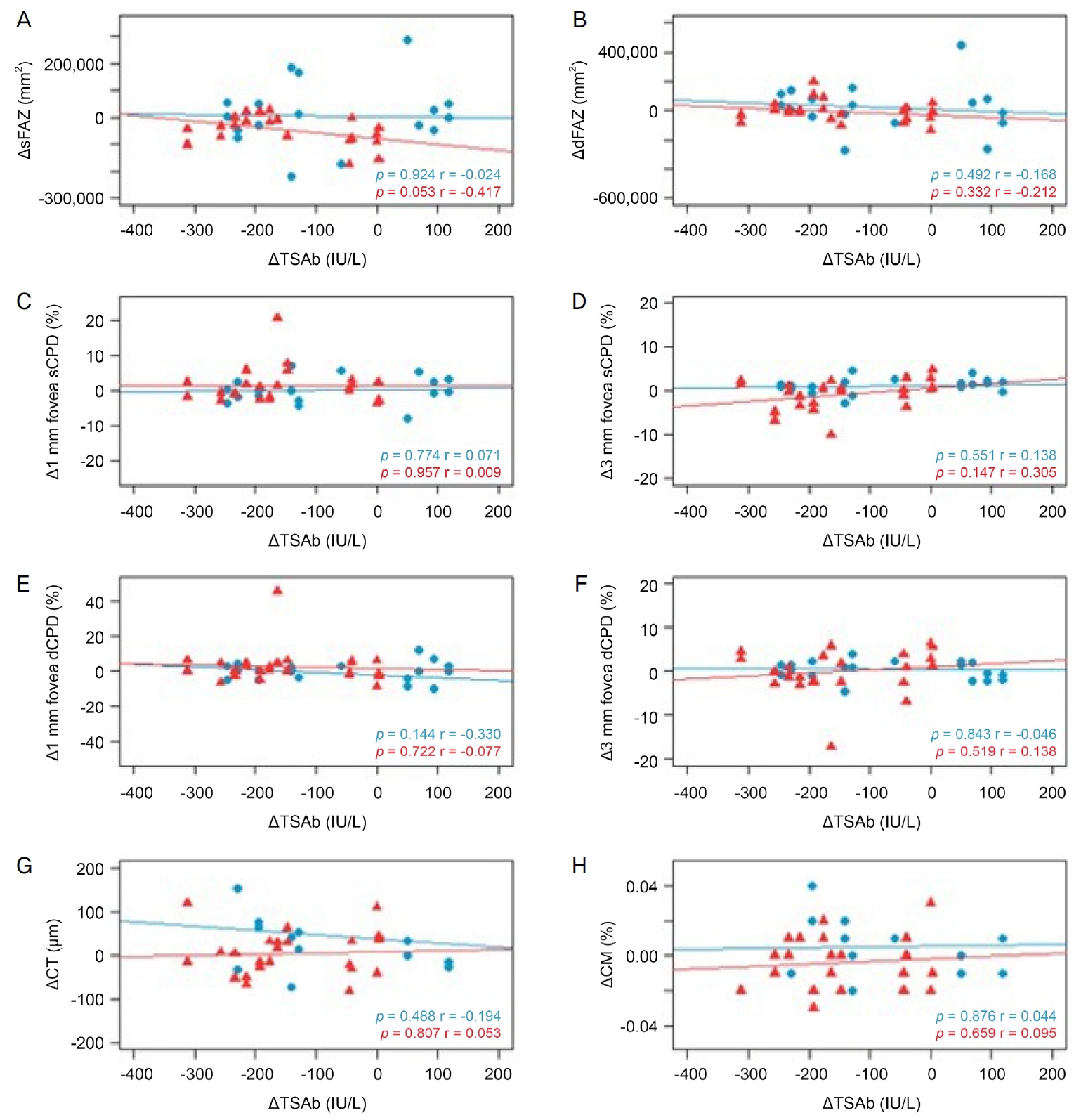
27) Ye L, Zhou SS, Yang WL, et al. Retinal microvasculature alteration in active thyroid-associated ophthalmopathy. Endocr Pract 2018;24:658-67.


28) Wu Y, Tu Y, Bao L, et al. Reduced retinal microvascular density related to activity status and serum antibodies in patients with GravesŌĆÖ ophthalmopathy. Curr Eye Res 2020;45:576-84.


29) Mihailovic N, Lahme L, Rosenberger F, et al. Altered retinal perfusion in patients with inactive Graves ophthalmopathy using optical coherence tomography angiography. Endocr Pract 2020;26:312-7.


30) Arend O, Wolf S, Harris A, Reim M. The relationship of macular microcirculation to visual acuity in diabetic patients. Arch Ophthalmol 1995;113:610-4.


31) Bresnick GH, Condit R, Syrjala S, et al. Abnormalities of the foveal avascular zone in diabetic retinopathy. Arch Ophthalmol 1984;102:1286-93.


32) Parodi MB, Visintin F, Della Rupe P, Ravalico G. Foveal avascular zone in macular branch retinal vein occlusion. Int Ophthalmol 1995;19:25-8.


33) Freiberg FJ, Pfau M, Wons J, et al. Optical coherence tomography angiography of the foveal avascular zone in diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol 2016;254:1051-8.


34) Abbouda A, Dubis AM, Webster AR, Moosajee M. Identifying characteristic features of the retinal and choroidal vasculature in choroideremia using optical coherence tomography angiography. Eye (Lond) 2018;32:563-71.


36) Tan KA, Laude A, Yip V, et al. Choroidal vascularity index-a novel optical coherence tomography parameter for disease monitoring in diabetes mellitus? Acta Ophthalmol 2016;94:e612-6.


37) Steiner M, Esteban-Ortega MDM, Mu├▒oz-Fern├Īndez S. Choroidal and retinal thickness in systemic autoimmune and inflammatory diseases: a review. Surv Ophthalmol 2019;64:757-69.


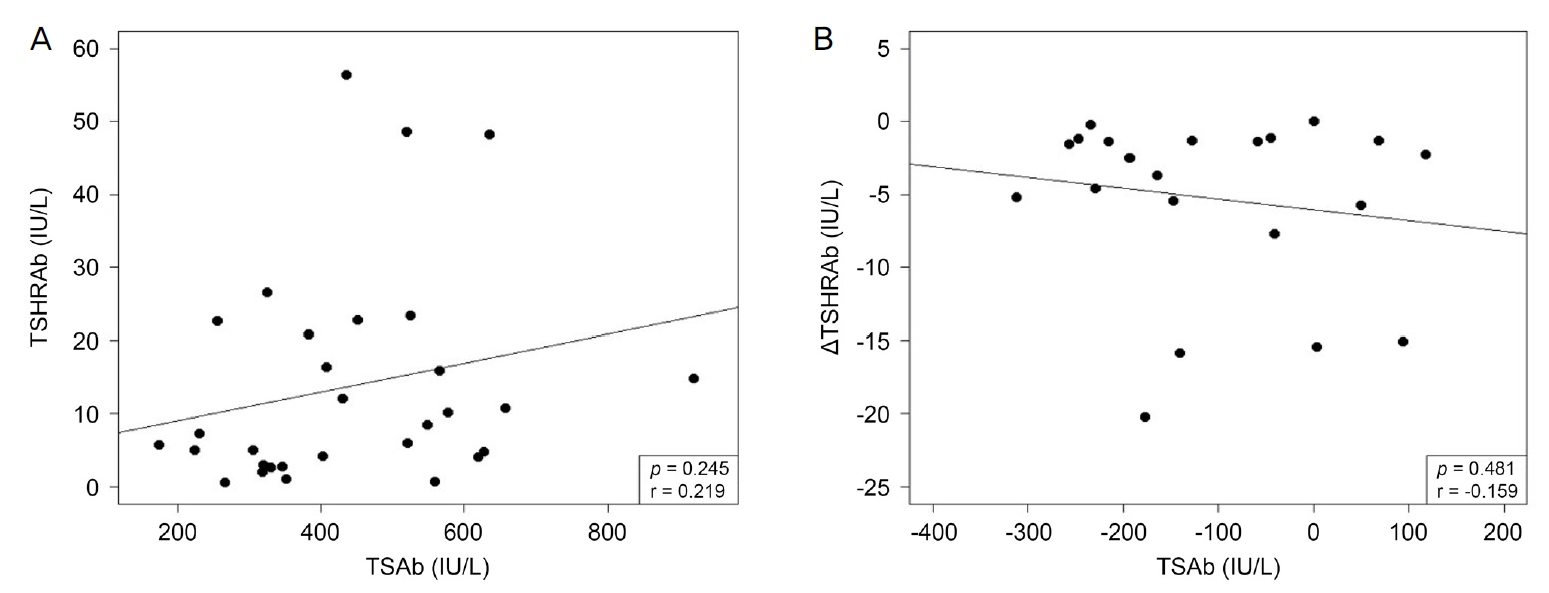
39) Park JW, Kim YC, Lee DC. Effects of thyroid-stimulating hormone receptor autoantibody on retinal and choroidal vessels in thyroid eye disease. J Korean Ophthalmol Soc 2020;61:1121-8.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




