기존 후방 안내렌즈 삽입된 백내장 환자에 대한 펨토초레이저 백내장수술의 임상결과
Clinical Results of Femtosecond Laser-assisted Cataract Surgery in Eyes with Posterior Chamber Phakic Intraocular Lens
Article information
Abstract
목적
기존에 후방 안내렌즈를 삽입했던 백내장 환자에서 펨토초레이저를 이용한 백내장수술 후의 임상결과에 대해 알아보고자 하였다.
대상과 방법
기존에 후방안내렌즈삽입술을 시행 받았던 환자 중 펨토초레이저 백내장수술을 본원에서 받았던 27안을 대상으로 하였고, 펨토초레이저수술 중 전낭절개 및 수정체 분할 성공 여부를 알아보았다. 수술 전과 수술 후 1일, 2개월, 6개월째의 나안시력, 최대교정시력, 각막곡률, 현성굴절값을 측정하여 임상결과를 후향적으로 비교 분석하였다.
결과
후방 안내렌즈 삽입 상태에서 펨토초레이저를 시행한 27안에서 불완전한 전낭절개가 있었던 환자는 없었다. 그러나 수정체 분할을 시행한 18안 중 13안(72%)에서 불완전 수정체 분할이 있었으며, 완전 분할된 환자의 평균 천장높이(vaulting)는 460.40 ± 199.11 μm (0.84 ± 0.35 corneal thickness, [CT]), 불완전 분할된 환자의 평균 천장높이는 225.85 ± 151.2 μm (0.43 ± 0.29 CT)였다. 불완전 분할이 있었던 환자 중 2안은 각각 460 μm, 412 μm의 천장높이를 갖고 있었으나 각막혼탁이 있었다. 불완전 수정체 분할이 있었던 환자 모두 무균 수술 과정에서 추가 합병증 없이 수술을 완료하였고 수술 후 합병증이 있었던 환자도 없었다.
결론
후방 안내렌즈가 삽입된 백내장 환자에서 펨토초레이저수술 시 전낭절개에는 문제가 없으나, 수술 전 안내렌즈의 낮은 천장높이를 갖는 환자에서는 레이저 시행 시 발생한 기포가 안내렌즈 아래 공간에 갇혀 수정체 분할을 방해하는 결과를 보였다.
Trans Abstract
Purpose
To investigate the clinical results of femtosecond laser-assisted cataract surgery (FLACS) in eyes previously implanted with a posterior chamber phakic intraocular lens (PIOLs).
Methods
The medical records of 27 eyes were retrospectively reviewed. Each eye had history of implantation of posterior chamber PIOLs and newly got FLACS. Complications of intraoperative anterior capsulotomy and lens fragmentation were investigated. Uncorrected and corrected visual acuities (UCVA and BCVA), keratometric and manifest refraction (MR) values were compared preoperatively and postoperatively 1 day, 2 months and 6 months.
Results
All eyes completed anterior capsulotomy without any intraoperative complication. However, 13 eyes out of 18 eyes experienced incomplete lens fragmentation. Vaultings of 5 eyes with complete lens fragmentation were 460.40 ± 199.11 μm (0.84 ± 0.35 corneal thickness [CT]) and vaultings of the other 13 eyes with incomplete lens fragmentation were 225.85 ± 151.2 μm (0.43 ± 0.29 CT). 2 eyes with vaultings of 460 μm and 412 μm failed to complete lens fragmentation due to corneal opacity. All eyes could be completed whole surgery without additional complications.
Conclusions
FLACS in eyes with posterior chamber PIOLs is useful to execute anterior capsulotomy. However, there is a limitation in doing lens fragmentation because of bubble accumulated under PIOLs.
후방안내렌즈삽입술은 각막 절삭에 의한 굴절교정수술이 부적합한 환자의 많은 경우에서 선호되어 왔고, 안내렌즈가 삽입된 눈에서 낮은 천장높이(vaulting), 고도 근시 및 고령 등의 원인에 의해 백내장이 발생하고 있다[1-4]. 펨토초레이저수술 플랫폼은 각막과 수정체의 3차원적 이미지를 획득한 후 각 환자 눈에 맞추어진 각막절개, 수정체 전낭절개 및 수정체 분할을 시행함으로써, 고식적인 백내장수술과 비교해 정확한 깊이와 길이 및 위치에 절개를 하여 빠른 창상 치유에 기여하고, 수정체 분할 시 사용되는 유효 초음파 에너지 양을 감소시킴으로써 각막내피세포 손상 및 염증 반응을 줄여 수술의 정확성과 안정성을 높여 줄 수 있다[5-9].
이러한 장점들 때문에 기존 후방안내렌즈삽입술을 시행받았던 고도근시의 백내장 환자들에 대해 펨토초레이저 백내장수술이 이용되고 있으며, 성공적인 수술 사례들도 보고되고 있다[10-12]. 하지만 국내에서 보고된 바는 아직 없고 기존 연구들은 대부분 단일 환자의 사례 보고들이 많아, 본 연구는 본원에서 수술했던 다수 환자들의 임상결과를 분석하고 펨토초레이저 백내장수술 시 발생할 수 있는 문제점에 대해 알아보고자 하였다.
대상과 방법
기존에 후방 안내렌즈가 삽입되어 있고 백내장으로 진단받았던 환자 중 2014년 1월부터 2019년 12월까지 본원에서 펨토초레이저수술을 받았던 27안을 대상으로 후향적으로 연구를 시행하였고 본 연구는 성모안과병원 기준윤리심의위원회의 승인(승인 번호: 202002-BM-02) 후 진행되었다.
수술 전 모든 환자에 대해 병력청취, 세극등검사, 안저검사 및 시신경단층촬영을 하였고, 자동굴절검사와 현성굴절검사 및 각막내피세포검사를 시행하였다. 또한 자동굴절검사기(ARK-1a®; Nidek Co., Gamagori, Japan)를 이용해 각막곡률검사를 시행하였으며, 전안부 optical coherence tomography (CASIA®; Tomey Co., Nagoya, Japan)로 후방안내렌즈의 천장높이를 측정하였다(Fig. 1A). 백내장수술 시 삽입할 인공수정체 도수 및 종류는 Optical biometer OA2000® (Tomey Co.)와 A-scan (Quantel Medical, Rue du Bois Joli, France)의 결과를 비교하여 결정하였다. 빛간섭단층촬영상 망막 질환이 있거나 녹내장이 있어 시력에 영향을 줄 수 있는 환자는 대상에서 제외하였다.
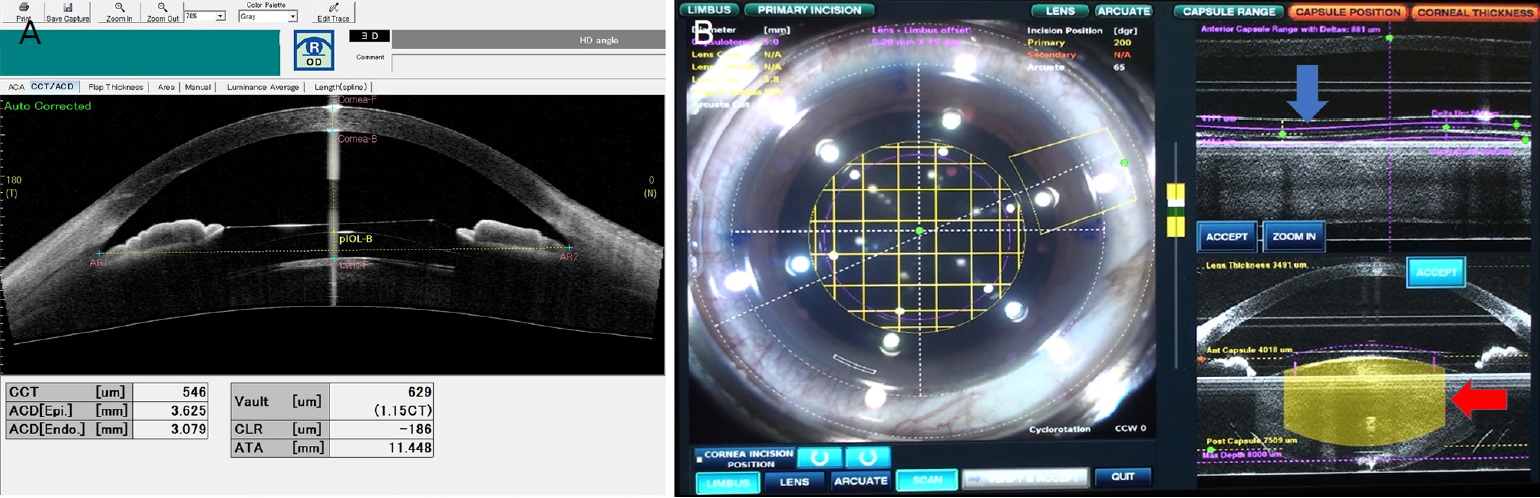
Preoperative image. (A) Measuring vaulting by anterior segment optical coherence tomography. (B) Preoperative manual modification of incision depth (blue arrow) and safety margins (red arrow) by 3D spectral domain optical coherence tomography image.
펨토초레이저수술은 LenSx® (Alcon LenSx, Fort Worth, TX, USA)를 이용하였고 수정체 전낭절개와 수정체 분할을 시행하였다. 수술 전 모든 환자는 0.5% proparacaine hydrochloride 점안 마취를 하고, Soft fitTM 인터페이스를 이용해 각막에 도킹(docking)시킨 후 흡착을 가하여 이미지를 획득하였다. 3차원 spectral domain optical coherence tomography (SD-OCT)로 구현된 전안부 이미지가 모니터에 표시되고(Fig. 1B), 수동 조작을 통해 각 환자의 안내렌즈 천장높이, 수정체낭, 수정체 상태에 맞추어 레이저 영역과 위치 및 깊이를 조절하였다(Fig. 2). 후방에 삽입된 안내렌즈에 의해 발생할 수 있는 합병증을 최소화하기 위해 기존 femtosecond laser-assisted cataract surgery (FLACS)보다 safety margin을 1.5-2배 두껍게 하고, Delta up height를 낮게 조정하였다(Fig. 2).
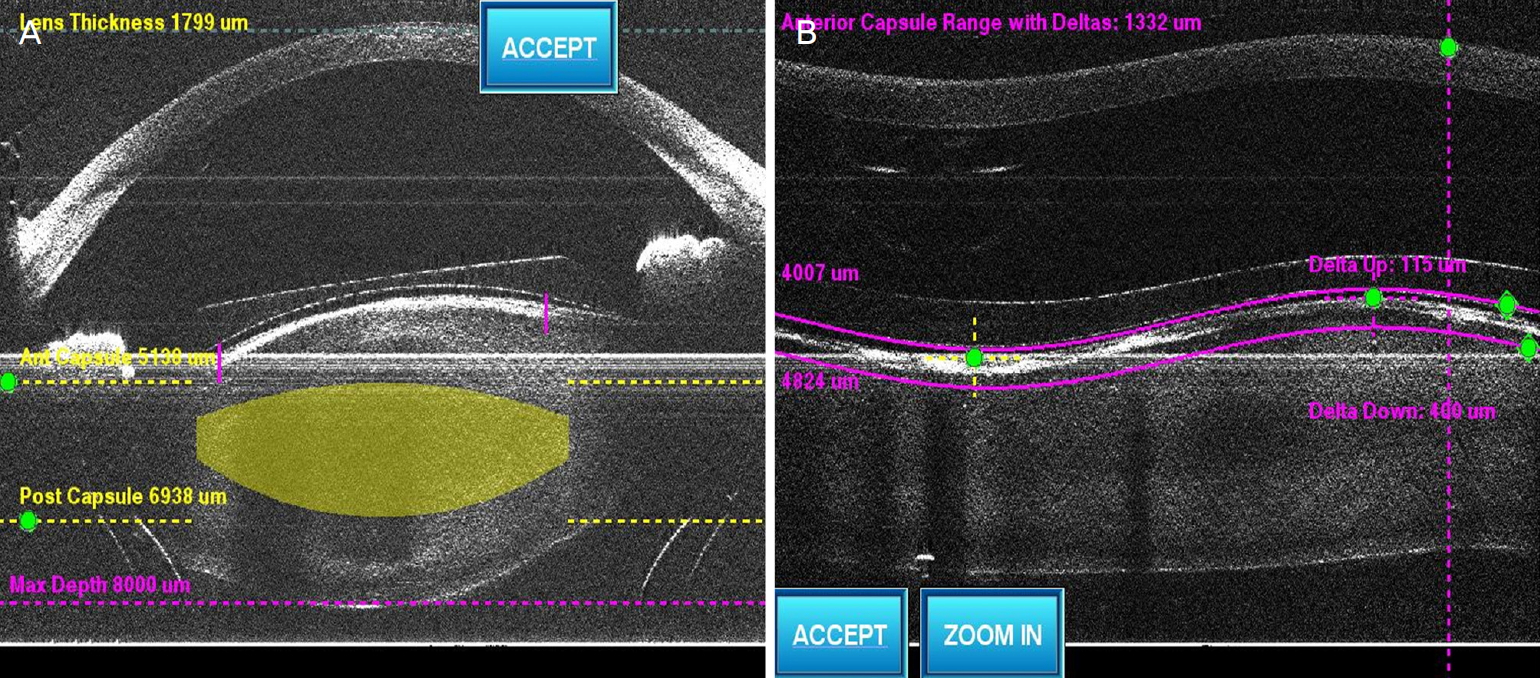
Preoperative modification of setting in low vaulting patient. (A) Increase of safety margin’s thickness to compensate intraoperative complications due to laser focus displacement. (B) Decrease of Delta up height to avoid contact between lens posterior surface and laser energy.
전낭절개는 수정체 중심을 기준으로 직경 5.0 mm 영역에서 이루어졌고, spot separation 5 μm, layer separation 4 μm, 평균 incision depth 184.63 μm 설정값으로 시행되었으며, 수정체 분할은 격자 패턴(grid pattern)으로 직경 5.8 mm, spot separation 2 μm, layer separation 4 μm, 평균 incision depth 2,424.12 μm로 설정 후 진행하였다.
레이저백내장수술이 끝난 후 환자는 무균 수술실로 이동하여 안내렌즈 제거, 수정체유화술 및 인공수정체삽입술을 완료하였고, 수술 시 점탄물질로는 4.0% chondroitin sulfate와 3.0% sodium hyaluronate 혼합물(Viscoat, Alcon Inc., Fort Worth, TX, USA)을 사용하였다. 3 mm 투명각막절개를 시행한 후 점탄물질로 전방을 채우고 후방 안내렌즈를 전방으로 올려, 투명각막절개창을 통해 포셉으로 렌즈를 제거하였고, 수정체유화술 시행 전 마이크로포셉을 이용하여 수정체 전낭절개 완료 여부를 확인하였다. 수술 후 2개월간 항생제, 스테로이드제제, 비스테로이드성 항염증 제제를 점안하였다. 펨토초레이저 백내장수술 중 수정체 전낭절개, 수정체 분할 완료 여부를 확인하였고, 수술 후 1일, 2개월 그리고 6개월의 나안시력과 최대교정시력, 현성굴절검사 및 각막곡률검사 결과를 비교 분석하였다.
IBM SPSS® software version 20 (IBM Corp., Armonk, NY, USA) 프로그램을 사용하여 통계분석을 하였다. 수술 전과 수술 후의 치료 효과를 비교할 때 paired t-test를 사용하였고, 수술 후 반복적으로 측정된 자료 분석은 repeatedmeasures analysis of variance 방법을 사용하였다. p-value가 0.05 미만인 경우를 통계적으로 유의한 것으로 판단하였다.
결 과
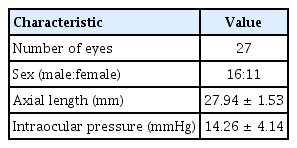
기존에 후방 안내렌즈가 삽입되어 있고 본원에서 백내장 진단하 펨토초레이저 백내장수술을 받은 27안을 대상으로 하였으며 남성 16안, 여성 11안이었다(Table 1). 평균 안축장 길이는 27.94 ± 1.53 mm로 고도근시안의 특징을 보였고, 수술 전 평균 안압은 14.26 ± 4.14 mmHg이었으며, 수술 전 평균 나안시력은 0.56 ± 0.39 (logarithm of the minimal angle of resolution, logMAR), 평균 최대교정시력은 0.40 ± 0.30 (logMAR), 평균 구면렌즈대응치는 -1.06 ± 2.04 diopters (D)로 측정되었다(Table 1, 2).
수술 전 평균 logMAR 나안시력은 0.56 ± 0.39, logMAR 최대교정시력은 0.40 ± 0.30이었고 현성굴절검사상 평균 spherical -0.61 ± 2.12 D, cylinder -0.91 ± 0.72 D로 측정되었으며 구면렌즈대응치(spherical equivalent)는 평균 -1.06 ± 2.04 D의 결과를 보였다(Table 2). 수술 후 1일 혹은 2일째 평균 logMAR 나안시력과 logMAR 최대교정시력은 각각 0.15 ± 0.18, 0.09 ± 0.12로 수술 전과 비교해 유의한 시력호전을 보였고, 현성굴절검사 결과 또한 평균 spherical -0.15 ± 0.66 D, cylinder -0.49 ± 0.37 D 및 평균 구면렌즈 대응치 -0.40 ± 0.60 D의 결과를 보여 수술 전보다 유의하게 정시에 가까워진 변화를 나타냈다(Table 2).
수술 후 2개월, 6개월째에는 각각 평균 logMAR 나안시력 0.14 ± 0.24, 0.08 ± 0.10, logMAR 최대교정시력 0.07 ± 0.09, 0.07 ± 0.08이었고, 현성굴절검사 결과 각각 평균 spherical -0.39 ± 2.77 D, -0.37 ± 0.97 D, 평균 cylinder -0.50 ± 0.43 D, -0.50 ± 0.41 D로 측정되었으며 평균 구면렌즈대응치(spherical equivalent)는 -0.65 ± 0.73 D, -0.62 ± 0.88의 결과를 보였다(Table 2). 수술 후 1일 혹은 2일, 2개월, 6개월의 임상결과에서 나안시력을 제외한 유의한 변화는 관찰되지 않았다(Table 2).
펨토초레이저수술 시 27안 모두 수정체 전낭절개를 시행하였고, 2016년 이후 수술한 18안에서는 수정체 분할까지 같이 시행하였다. 수술 중 불완전한 수정체 전낭절개가 있었던 경우는 없었지만, 수정체 분할을 시행한 18안 중 72%인 13안에서 불완전 수정체 분할이 발생해, 이후 무균 수술 과정에서 chopper를 이용해 재분할 후 진행하였다. 그 외 수술 중 혹은 수술 후 추가 합병증이 있었던 경우는 없었다(Table 3).
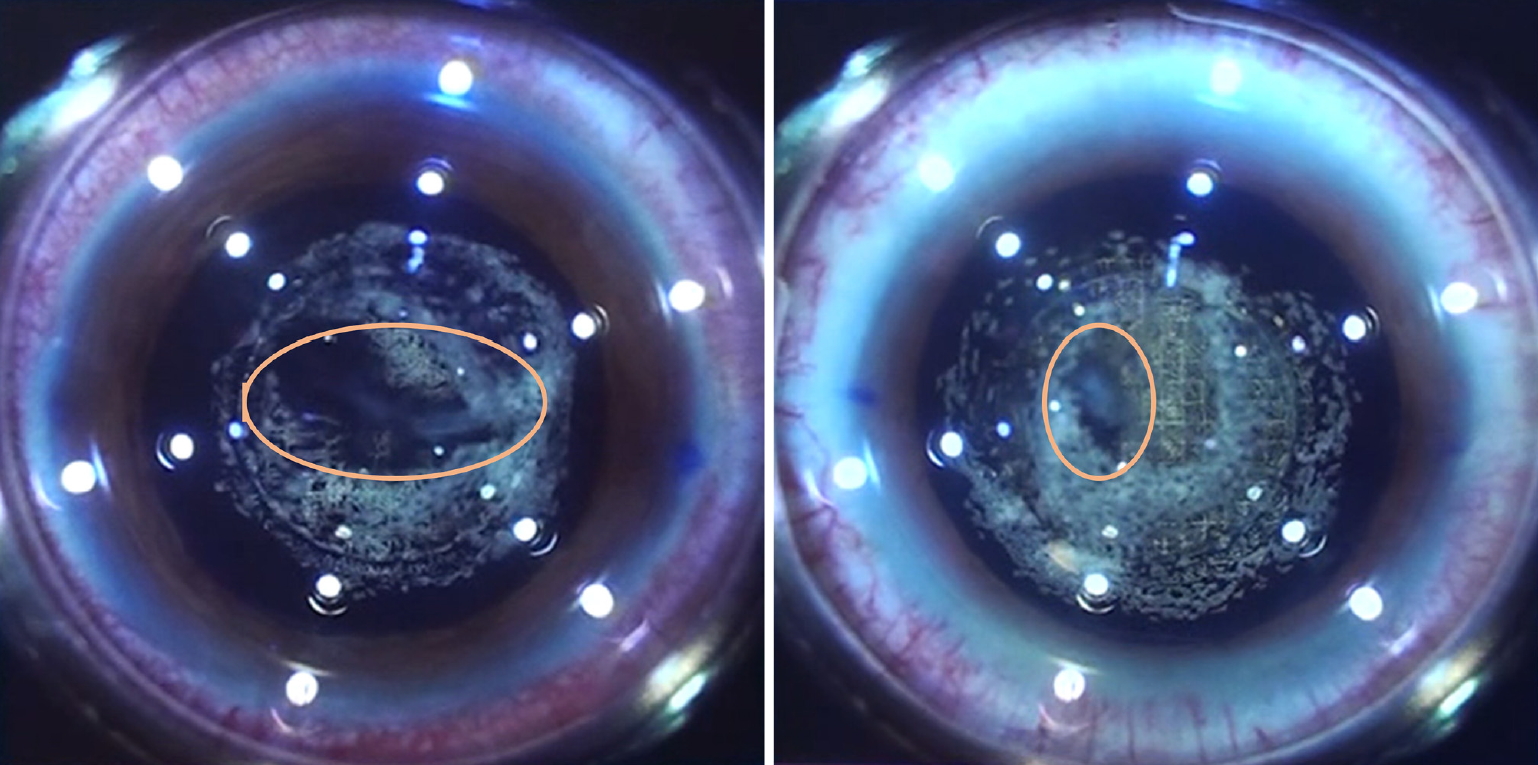
전체 환자의 평균 천장높이는 291.00 ± 192.78 μm (0.54 ± 0.35 corneal thickness [CT])였다. 이 중 완전 수정체 분할이 되었던 5안의 평균 천장높이는 460.40 ± 199.11 μm (0.84 ± 0.35 CT)였고, 불완전한 수정체 분할이 있었던 18안에서는 225.85 ± 151.2 μm (0.43 ± 0.29 CT)로 측정되어 불완전 분할 그룹이 완전 분할 그룹에 비해 유의하게 낮은 평균 천장높이를 보였다(Table 3). 또한 불완전한 수정체 분할이 있었던 그룹 중 460 μm와 412 μm로 가장 큰 천장높이를 보였던 2안에서는 각막혼탁이 동반되어 있어 불완전 수정체 분할의 주요 원인으로 작용하였다(Fig. 3).
고 찰
백내장수술 후 임상결과는 홍채 후 유착, 섬모체소대해리, 녹내장 및 다른 동반 질환 등 여러 요소들에 의해 영향을 받을 수 있고, 안축장이 긴 고도근시안에서는 섬모체소대 및 수정체낭의 불안정성과 관련하여 수술 중 혹은 수술 후 합병증 발생 위험성이 높다[13-15]. 펨토초레이저수술은 레어져를 이용하여 정확한 수정체 전낭절개와 수정체 분할을 미리 시행함으로써, 수정체유화술 시 진행 시간 및 초음파 에너지량을 줄여 고도 근시안에서 발생할 수 있는 수술 합병증을 줄여주는 데 도움을 줄 수 있으며, 특히 팽대백내장, 과숙백내장이 동반된 경우 완벽한 전낭절개를 미리 완성시켜 주는 것은 더욱 큰 도움이 될 수 있다[15].
하지만 이러한 장점들에도 불구하고 안내렌즈를 삽입한 고도근시안에서 펨토초레이저 백내장수술을 시행했을 때 나타나는 한계점들도 기존 사례들에서 보고하고 있다[10-12,15]. 수정체 앞의 전방 혹은 후방에 다른 매질이 존재할 경우 레이저가 목표 조직에 도달하는 것을 방해할 수 있다[15]. 기존에 후방 안내렌즈 삽입 및 유리체절제술을 시행 받고 안구내 오일이 충전된 환자에서 펨토초레이저를 시행한 사례 보고에서는 불완전한 전낭절개의 가장 큰 원인이 전방 내에 존재하는 오일 방울에 의한 레이저 차단이라고 하였고, 이는 레이저수술 시작 전 전방에 점탄물질을 충전하여 기포를 밀어냄으로써 극복해 볼 수 있다고 보고하였다[15].
후방에 삽입되어 있는 안내렌즈 자체도 레이저의 전달을 방해할 수 있다[15]. 안내렌즈의 광학부와 지지부가 만나는 경계 부위에서 레이저 산란이 많이 일어나고, 이로 인해 목표 지점에 도달하는 에너지를 감소시킴으로써 불완전한 절개를 유발할 수 있으며, 산동의 크기가 커질수록 렌즈의 경계 부위 노출이 많아져 더 많은 레이저 산란을 야기할 수 있다[16]. 이러한 점을 예방하기 위해 수술 전 펨토초레이저 기기의 설정을 바꿔, 수정체 전낭절개 영역을 후방 안내렌즈의 광학부보다 크게 조정한 후 시행하는 것이 수술 중 합병증을 줄여줄 수 있는 방법이라는 보고도 있는데[15,16], 이러한 점을 감안하여 본원에서도 레이저수술 전 anterior capsulotomy 직경을 안내렌즈 광학부보다 큰 5 mm로 설정한 후 시행하여 만족스러운 결과를 도출해 낼 수 있었다.
또한 기존 후방 안내렌즈에 의한 굴절력 변화는 펨토초레이저 기기가 이미지를 획득하고 절개 위치에 초점을 맞추는 데 오류를 유발할 수 있는데[10], 이러한 오류에 의한 다른 구조물 손상이나 불완전한 절개를 상쇄하기 위해 본원에서는 수술 전 safety margin thickness를 고식적인 레이저백내장수술과 비교에 약 1.5-2배 두껍게 설정하였다(Fig. 2A).
기존 사례 보고들에서 문제점으로 가장 자주 언급되는 점은 펨토초레이저 중 발생하는 기포에 의한 레이저 전달 방해이다. 펨토초레이저 에너지가 각막, 수정체, 수정체낭 등 안구 조직에 흡수되면 플라즈마 생성을 유발하고, 만들어진 자유 전자 플라즈마와 이온화 입자들은 급격하게 팽창하면서 기포를 형성하게 된다[5]. 이렇게 기포의 팽창력에 의해 조직이 분리되는 것을 광파괴술(photodisruption)이라고 하며, 생성된 기포들은 전방으로 떠올라 빠져나가게 된다[5]. 하지만 후방에 안내렌즈가 존재하는 경우에는 발생한 기포가 전방으로 떠오르지 못하고 렌즈 아래 공간에 축적되어 레이저의 전달을 방해하게 되고 결과적으로 불완전한 수정체 전낭절개 및 수정체 분할을 초래할 수 있다[10-12,15].
본원에서 펨토초레이저 백내장수술을 시행한 27안 중 수정체 전낭절개는 27안 모두에서 시행하였고 수정체 분할은 18안에서 시행하였는데, 기존 보고들과 동일한 안내렌즈 아래 공간에 기포가 축적되는 현상을 관찰할 수 있었다. 하지만 수정체 전낭절개 과정을 관찰한 결과 펨토초레이저가 순차적으로 원형을 그리며 절개를 하게 되는데, 절개가 진행되는 속도에 비해 기포의 생성 및 축적되는 속도가 느려 수정체 전낭절개 과정이 완료되는 데에는 지장이 없었으며, 27안 중 불완전한 전낭절개는 한 건도 관찰되지 않았다. 본원에서는 펨토초레이저수술 전 천장높이가 낮은 경우, 기포 생성을 줄이고 레이저가 안내렌즈의 후면에 접촉되는 것을 방지하고자 수정체 전낭 위쪽의 capsulotomy treatment height를 낮춰 주었고 이러한 수술 전 설정 조정이 완전한 수정체 전낭절개가 가능해지도록 도움을 주었을 것으로 생각된다(Fig. 2B).
하지만 다음 과정인 수정체 분할에서는 이미 축적된 기포들의 영향이 컸고, 총 18안 중 완전한 수정체 분할이 있었던 케이스는 5안에 불과했다. 동일 수술을 시행했던 2안의 한 사례 보고에서는 수술 전 안내렌즈의 천장높이가 수정체 분할의 완성 여부에 영향을 줄 수 있다는 언급을 한 적이 있다[12]. 본원의 임상결과에서도 동일한 양상의 결과를 확인할 수 있었는데, 완전한 수정체 분할이 있었던 그룹의 평균 천장높이가 불완전한 분할을 보였던 그룹에 비해 2배 이상 크게 측정되었고, 실제 수술 과정에서도 천장높이가 낮은 눈에서 기포가 발생한 후 안내렌즈의 아래 공간에 더 과밀하게 축적되어 수술 시야 장애를 더 크게 유발하고 있음을 확연하게 알 수 있었다(Fig. 4). 이러한 한계점을 극복하기 위한 노력으로 수술 전 레이저 기기의 설정을 수정해 vertical spot separation을 늘려서 시행한 결과 기포의 생성을 줄이는 데 도움이 되었다는 사례가 있었고, 레이저의 에너지를 낮춰주는 것이 기포 생성을 줄여 줄 수 있다는 보고도 있었다[10,11,15].

Intraoperative images. Incomplete lens fragmentation due to trapped cavitation bubbles under the posterior chamber phakic intraocular lens.
본원 수술 결과를 보면 수정체 전낭절개는 성공적으로 완료되었으나 그 과정에서 기포 발생이 많아져 다음 단계로의 수술 진행에 문제를 유발하는 경우가 많았다. 이는 기존 보고들에서 언급했던 vertical spot separation 및 레이저 에너지 등에 대한 수술 전 설정 변경을 통해 기포 생성을 줄이려는 시도가 없었던 것이 큰 원인으로 여겨지며, 이 부분에 대한 교정이 추후 더욱 개선된 수술 결과를 가져올 것으로 기대된다.
본원에서 수술 받은 환자 중 최대 천장높이는 630 μm, 최소 천장높이는 76 μm였다. 천장높이가 너무 낮은 경우 조사된 레이저 에너지가 안내렌즈의 후면에 접촉되면서 더 많은 기포를 발생시킬 수 있고, 조사 후 수정체 전낭과 안내렌즈의 후면이 유착되어 추가적인 손상을 유발할 수 있어 천장높이가 0에 가까운 환자에게는 FSACS를 권유하지 않고 있다. 아직 안전하게 수술이 가능한 천장높이의 확실한 기준이 확립되어 있지 않고, 수술이 불가능한 환자에 대해 효과적이고 안전한 대안 연구는 부족한 상황이며, 이에 대한 추가적인 연구와 노력이 필요할 것으로 생각된다.
상기의 한계점들은 있었지만 전체적인 수술 과정을 완료하는 데 문제를 유발할 정도의 합병증들은 아니었으며, 수술 후 임상결과들 또한 고식적인 백내장수술들과 큰 차이 없는 양상을 보였다. 이번 연구를 통해 펨토초레이저 백내장수술은 후방 안내렌즈가 삽입된 눈 수술 시 수정체 전낭절개 시행에는 무리가 없으나, 수술 전 안내렌즈의 천장높이에 따라 수정체 분할에는 한계점이 존재함을 알 수 있었다. 하지만 전체적인 임상결과상 펨토초레이저 백내장수술은 후방 안내렌즈가 삽입된 고도근시안에 대해 좋은 수술적 대안이 되어 줄 수 있을 것으로 생각된다. 아직 이번 연구에 대한 자료 및 보고들이 충분하지 않아 추후 개선과 발전의 여지는 많을 것으로 보이고, 술자들의 노하우와 숙련도가 쌓여 갈수록 더욱 향상된 결과를 도출할 수 있을 것으로 기대된다.
Notes
Conflict of Interest
The authors have no conflicts to disclose.
References
Biography
방찬우 / Chan Woo Bang
성모안과병원
Sungmo Eye Hospital