 |
 |
| J Korean Ophthalmol Soc > Volume 61(4); 2020 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ ļłłļ¼╝ņØś ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæĻ▓Ćņé¼(tear varicella zoster virus polymerase chain reaction, VZV PCR)Ļ░Ć ļ░öņØ┤ļ¤¼ņŖż ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØś ļ░£ņāØĻ│╝ ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
2015ļģä 2ņøöļČĆĒä░ 2018ļģä 6ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ņĢłĻ│╝ņŚÉ ņ▓śņØī ļé┤ņøÉĒĢśņŚ¼ ļłłļīĆņāüĒżņ¦äņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×É 69ļ¬ģņØś ĒøäĒ¢źņĀü ņØśļ¼┤ĻĖ░ļĪØņØä ņĪ░ņé¼ĒĢśņśĆļŗż. ļłłļīĆņāüĒżņ¦äņØĆ ņŗ¼ĒĢ£ ĒåĄņ”ØņØä ļÅÖļ░śĒĢśļ®┤ņä£, ĒÖśņĖĪ ļłł ņŻ╝ļ│Ćņ£╝ļĪ£ ņłśĒżņÖĆ ļö▒ņ¦ĆĻ░Ć ļéśĒāĆļéśļŖö ļīĆņāüĒżņ¦äņØś ĒŖ╣ņ¦ĢņĀüņØĖ ņ×äņāüņ¢æņāüņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ļłłņŻ╝ļ│Ćņ£╝ļĪ£ ĒŚłņ╣£ņŖ©ņ¦ĢĒøä(HutchinsonŌĆÖs sign) ņ£Āļ¼┤, ĒÖśņĖĪ ņ▒äņĘ©ĒĢ£ ļłłļ¼╝ņŚÉņä£ņØś VZV PCR Ļ▓░Ļ│╝Ļ░Ć ņĢłĻĄ¼ņ╣©ļ▓öņØś ļ░£ņāØ ļ░Å ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖöņ¦Ć ņĪ░ņé¼ĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņ┤Ø 69ļ¬ģ ņżæ 51ļ¬ģ(73.9%)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļéśĒāĆļé¼ņ£╝ļ®░ Ļ▓░ļ¦ēņŚ╝ņØ┤ 45ļ¬ģ(65.2%)ņ£╝ļĪ£ Ļ░Ćņן ļ¦ÄņĢśļŗż. ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņÖĆ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØ Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØĆ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆņ£╝ļ®░(p=0.047), VZV PCRĻ│╝ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØ Ļ░äņØś ņŚ░Ļ┤Ćņä▒ļÅä ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆļŗż(p=0.005). ļæÉ ņåīĻ▓¼ņØś ņ¢æņä▒ ņ£Āļ¼┤ņÖĆ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü Ļ░ä Receiver operating characteristics (ROC) Ļ│ĪņäĀļČäņäØņŚÉņä£ VZV PCRņØś Ļ│ĪņäĀĒĢśļ®┤ņĀü(Area under the curve)ņØ┤ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ ļåÆņĢśļŗż(VZV PCR=0.72, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä=0.63). ņ┤łņ¦ä ņŗ£ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ ņåīĻ▓¼ņØ┤ ņ×¼ļ░£ ņ£äĒŚś ņØĖņ×ÉļĪ£ ĒÖĢņØĖļÉśņŚłņ£╝ļéś(OR=30.53, p=0.033), ļłłļ¼╝ VZV PCR ņ¢æņä▒ ņåīĻ▓¼ņØĆ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ ļśÉļŖö ļłłļīĆņāüĒżņ¦äņØś ņ×¼ļ░£Ļ│╝ļŖö Ļ┤ĆļĀ©ņØ┤ ņŚåņŚłļŗż(p>0.05).
ABSTRACT
Purpose
To determine the efficacy of tear varicella zoster virus polymerase chain reaction (VZV PCR) results for the occurrence of ocular symptoms in patients diagnosed with herpes zoster ophthalmicus (HZO), as compared to HutchinsonŌĆÖs sign, and to determine the relationship between recurrence of HZO and VZV PCR results.
Methods
We conducted a retrospective analysis using medical records from 69 patients diagnosed with HZO from February 2015 to June 2018. We investigated whether HutchinsonŌĆÖs sign and VZV PCR results were correlated with the occurrence of ocular symptoms and recurrence of HZO.
Results
Of the 69 patients, 51 patients (73%) had ocular symptoms and 45 patients (65.2%) had conjunctivitis as the most common ocular symptom. There were correlations between HutchinsonŌĆÖs sign and the occurrence of ocular symptoms, and between VZV PCR and the occurrence of ocular symptoms (p = 0.047 and p = 0.005, respectively). The receiver operating characteristic curve of HutchinsonŌĆÖs sign and VZV PCR in ocular involvement of the area under the curve of the tear VZV PCR was larger than HutchinsonŌĆÖs sign (VZV PCR = 0.72; HutchinsonŌĆÖs sign = 0.63). Only keratouveitis was identified as a risk factor for recurrence of HZO (odds ratio = 30.53; p = 0.033). There was no correlation between keratouveitis and recurrence of HZO (p > 0.05).
ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż(varicella zoster virus)ļŖö ņØ╝ņ░©Ļ░ÉņŚ╝ņØĖ ņłśļæÉļź╝ ņØ╝ņ£╝ĒéżĻ│Ā ļé£ Ēøä ņŗĀĻ▓Į ņČĢņéŁļÅīĻĖ░ļź╝ ĒåĄĒĢ┤ Ēö╝ļČĆ ļ│æļ│Ćņ£╝ļĪ£, ĒśłņĢĪņØä ĒåĄĒĢ┤ ļćī, ņ▓Öņłś Ļ░ÉĻ░ü ņŗĀĻ▓ĮņĀłļĪ£ ņØ┤ļÅÖĒĢ£ļŗż. ņØ┤ļĀćĻ▓ī ņØ┤ļÅÖĒĢ£ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖżļŖö ņ×Āļ│ĄĻĖ░ļź╝ Ļ░Ćņ¦Ćļ®░, ņŗĀĻ▓ĮņĀłņŚÉ ņ×Āļ│ĄņāüĒā£ļĪ£ ņ׳ļŹś ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖżĻ░Ć ņ×¼ĒÖ£ņä▒ĒÖöļÉśļ®┤ņä£ 2ņ░©Ļ░ÉņŚ╝ņØĖ ļīĆņāüĒżņ¦äņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉ£ļŗż[1]. ļīĆņāüĒżņ¦ä ļ░£ņāØņØś ņøÉņØĖņ£╝ļĪ£ļŖö ļģĖĒÖö, ļ®┤ņŚŁņĀĆĒĢś, ņÖĖņāü, ņŗ¼ļ”¼ņĀü ņŖżĒŖĖļĀłņŖż ļō▒ņŚÉ ņØśĒĢ£ ņäĖĒżļ¦żĻ░£ ļ®┤ņŚŁņ▓┤Ļ│äņØś ņĢģĒÖöņÖĆ ņØ┤ņĀäņØś ņłśļæÉļīĆņāüĒżņ¦ä ļ░öņØ┤ļ¤¼ņŖż ļģĖņČ£ļĀź ļō▒ņØ┤ ņĢīļĀżņĀĖ ņ׳ļŗż[2]. ņé┤ņĢäĻ░ĆļŖö ļÅÖņĢł ļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż Ļ░ÉņŚ╝ņØ┤ ļ░£ņāØĒĢĀ ĒÖĢļźĀņØĆ 10-20% ņĀĢļÅäļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, ņĀäņ▓┤ ļīĆņāüĒżņ¦ä ĒÖśņ×É ņżæ 7-20%ņŚÉņä£ ļłłļīĆņāüĒżņ¦äņØ┤ ļ░£ņāØĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[2,3].
ļłłļīĆņāüĒżņ¦äņØĆ 1865ļģä Hutchinson [4]ņŚÉ ņØśĒĢ┤ ņ▓śņØī ĻĖ░ņłĀļÉśņŚłņ£╝ļ®░, ļ░£ņāØĒĢśļŖö ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāüņ£╝ļĪ£ļŖö ļłłĻ║╝ĒÆĆļČĆņóģ, Ļ▓░ļ¦ēņŚ╝, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, Ļ░ÉņŚ╝ņä▒ Ļ░üļ¦ēņŚ╝, ņŗĀĻ▓Įņśüņ¢æĻ░üļ¦ēļ│æņ”Ø, Ļ░üļ¦ēņ▓£Ļ│Ą, Ļ│Ąļ¦ēņŚ╝, ļ░▒ļé┤ņן, ļģ╣ļé┤ņן, ļØĀļ¬©ņ¢æ Ļ░üļ¦ēļ│æņ”Ø, ĒøäĒżņ¦äņä▒ ļŗżļ░£ņŗĀĻ▓Įļ│æņ”Ø ļō▒ņØ┤ ņ׳ņ£╝ļ®░ ņØ┤ļ¤¼ĒĢ£ ņ”ØņāüņØĆ Ēö╝ļČĆņ”ØņāüņØ┤ ļ░£ĒśäļÉ£ Ēøä ņłś ņŗ£Ļ░äņŚÉņä£ ņłśņŻ╝ ļé┤ļĪ£ ļéśĒāĆļé£ļŗż[5]. ņØ┤ļ¤¼ĒĢ£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØś ņä▒Ļ│ĄņĀüņØĖ ņ╣śļŻī ĒøäņŚÉļÅä ļłłļīĆņāüĒżņ¦äņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉņØś 4-13%ņŚÉņä£, ļ®┤ņŚŁņ▓┤Ļ│äĻ░Ć ņĢģĒÖöļÉ£ ĒÖśņ×ÉņØś 50% ņØ┤ņāüņŚÉņä£ Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, Ļ░ÉņŚ╝ņä▒ Ļ░üļ¦ēņŚ╝Ļ│╝ Ļ░ÖņØĆ Ļ░üļ¦ēņāüĒö╝ņäĖĒż ņØ┤ņāüņØ┤ ĒĢ£ ļ▓ł ņØ┤ņāü ņ×¼ļ░£ĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[6]. ņĢłņŗĀĻ▓ĮļČäņ¦ĆņØś ņäĖļČĆ ļČäņ¦Ćņżæ ņĮöņä¼ļ¬©ņ▓┤ņŗĀĻ▓ĮņØ┤ ņ╣©ļ▓öļÉĀ Ļ▓ĮņÜ░ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņØä ļ│┤ņØ┤ļ®░, ĒŚłņ╣£ņŖ©ņ¦ĢĒøäļź╝ ļ│┤ņØ╝ Ļ▓ĮņÜ░ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ 2ļ░░ ņØ┤ņāü ĒśĖļ░£ĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņŚ¼, ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØņØś ņżæņÜö ņśłĒøäņØĖņ×ÉļĪ£ņä£ ņĢīļĀżņĀĖ ņ׳ļŗż[4,7].
ņŗżņŗ£Ļ░ä ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæņØĆ ļ¬®Ēæ£ DNA ļČäņ×ÉņØś ņ”ØĒÅŁĻ│╝ ņ¢æņØś ņĖĪņĀĢņØä ļÅÖņŗ£ņŚÉ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņ¢┤, Ļ░ÉņŚ╝ņä▒ ņ¦łĒÖśņØś ņ¦äļŗ©ņŚÉņä£ ĒÅŁļäōĻ▓ī ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[8]. ņĢłĻ│╝ņśüņŚŁņŚÉņä£ļÅä ļłłļ¼╝ ļé┤ ĒŚżļź┤ĒÄśņŖżļ░öņØ┤ļ¤¼ņŖż ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæĻ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ņ¦äļŗ©ņŚÉ ļ¦ÄņØĆ ļÅäņøĆņØä ļ░øĻ│Ā ņ׳ļŗż[9-11]. ĻĘĖļ¤¼ļéś ņĢäņ¦üĻ╣īņ¦Ć ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼ņØś ĒÖ£ņÜ®ņŚÉ ņ׳ņ¢┤ņä£ļŖö ļ│┤Ļ│ĀļÉ£ ļ░öĻ░Ć ņŚåļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ ļłłļ¼╝ņØś VZV PCR Ļ▓Ćņé¼Ļ░Ć ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØ ļ░Å ņ×¼ļ░£Ļ│╝ ņ¢┤ļ¢ĀĒĢ£ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Ā, ĻĖ░ņĪ┤ņŚÉ ņĢīļĀżņ¦ä ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ ņ¢┤ļ¢ĀĒĢ£ ņ£ĀņÜ®ņä▒ņØ┤ ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
2015ļģä 2ņøöļČĆĒä░ 2018ļģä 6ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ņĢłĻ│╝ņŚÉ ņ▓śņØī ļé┤ņøÉĒĢśņŚ¼ ļłłļīĆņāüĒżņ¦äņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×É 69ļ¬ģņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆņ£╝ļ®░, ļ│ĖņøÉņØś ņ×äņāüņŗ£ĒŚśņ£żļ”¼ņ£äņøÉĒÜī(Institutional Review Board, IRB)ņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: GCIRB2019-333). ļłłļīĆņāüĒżņ¦äņØĆ ņé╝ņ░©ņŗĀĻ▓ĮņØś ņ▓½ ļČäņ¦ĆņŗĀĻ▓ĮņØĖ ņĢłļČäņ¦Ć(ophthalmic branch)ļź╝ ņ╣©ļ▓öĒĢśņŚ¼, ņŗ¼ĒĢ£ ĒåĄņ”ØņØä ļÅÖļ░śĒĢśļ®┤ņä£ ĒÖśņĖĪ ļłłņŻ╝ļ│Ćņ£╝ļĪ£ ņłśĒżņÖĆ ļö▒ņ¦ĆĻ░Ć ļéśĒāĆļéśļŖö ļīĆņāüĒżņ¦äņØś ĒŖ╣ņ¦ĢņĀüņØĖ ņ×äņāüņ¢æņāüņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. Ļ│╝Ļ▒░ņŚÉ ļŗżļźĖ ņĢłņ¦łĒÖśņØä ņĢōņĢśĻ▒░ļéś, ņøÉņČöĻ░üļ¦ē, Ļ░üļ¦ēĒś╝Ēāü ļō▒ņØś Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳Ļ▒░ļéś, ļłłļīĆņāüĒżņ¦äņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ļŖö ĒÖśņ×ÉļōżņØĆ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. ņ┤łņ¦ä ņŗ£ ļ®┤ņŚŁņ¢ĄņĀ£ ļ░Å ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®, ļŗ╣ļć© ļō▒Ļ│╝ Ļ░ÖņØĆ ņĀäņŗĀņ¦łĒÖśņŚÉ ļīĆĒĢ£ ļ¼Ėņ¦ä ļ░Å ņŗ£ļĀź, ņĢłņĢĢ, ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼, ņĢłņĀĆĻ▓Ćņé¼, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä ņ£Āļ¼┤ņŚÉ ļīĆĒĢ┤ ņĪ░ņé¼ĒĢśņśĆņ£╝ļ®░, ļ¦ż ļ░®ļ¼Ė ņŗ£ļ¦łļŗż ņŗ£ļĀź, ņĢłņĢĢ, ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņ┤łņ¦ä ļ░Å Ļ▓ĮĻ│╝Ļ┤Ćņ░░ņØĆ ļÅÖņØ╝ĒĢ£ ņØśņé¼(D.H.K)ņŚÉ ņØśĒĢ┤ ņØ┤ļŻ©ņ¢┤ņĪīļŗż.
ļłłļīĆņāüĒżņ¦äņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ļ¬©ļōĀ ĒÖśņ×ÉļōżņŚÉĻ▓ī ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼Ļ░Ć ņŗ£Ē¢ēļÉśņŚłļŗż. ņŗ£Ē¢ē ļ░®ļ▓Ģņ£╝ļĪ£ļŖö ĒÖśņ×ÉĻ░Ć ĒÄĖĒĢśĻ▓ī ņĢēņØĆ ņ×ÉņäĖņŚÉņä£ ĒŖ╣ļ│äĒĢ£ ņĀÉņĢłļ¦łņĘ©ļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖĻ│Ā Ļ▓Ćņé¼ņ×ÉĻ░Ć ļ®┤ļ┤ēņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĢłĻ▓ĆņØä ļ▓īļ”¼Ļ│Ā Ēö╝ĒĽņŚÉ ņāØļ”¼ņŗØņŚ╝ņłśļź╝ ļŗ┤ņØĆ ļŗżņØī, ņĢäļלļłłĻ║╝ĒÆĆ Ļ▓░ļ¦ēĻĄ¼ņäØņŚÉ ņŗØņŚ╝ņłś ņäĖņ▓Ö Ēøä 500 ┬ĄLņØś ņāśĒöīņØä ņ▒äņĘ©ĒĢśņśĆļŗż. ņ▒äņĘ©ĒĢ£ ņŗ£ļŻīļĪ£ļČĆĒä░ ņ×ÉļÅÖĒÖö ĒĢĄņé░ ņČöņČ£ ņןļ╣äņØĖ Magna Pure 96 system (Roche, Mannheim, Germany)ņØś viral modeļź╝ ņĀüņÜ®ĒĢśņŚ¼ 100 ┬ĄLņØś ĒĢĄņé░ņØä ņČöņČ£ĒĢśņśĆņ£╝ļ®░, ĒĢĄņé░ ņ”ØĒÅŁņŚÉ ņé¼ņÜ®ļÉ£ primer ņŚ╝ĻĖ░ņä£ņŚ┤ņØĆ F: 5ŌĆÖ-TGA TTT GGC TTT ACC TTT GAT GCG-3ŌĆÖ, R: 5ŌĆÖ-CGA CGG CAG TTA CAT TTC TGA-3ŌĆÖņØś ņŚ╝ĻĖ░ņä£ņŚ┤ņØä ņ░©ņÜ®ĒĢśņśĆļŗż[12]. PCR ļ░śņØæņØä ņ£äĒĢ┤ HotStarTaq Plus Master Mix (QIagen, Hilden, Germany) 10 ┬ĄL, forwardņÖĆ reverse primerļź╝ Ļ░üĻ░ü 1 ┬ĄL, Coral load 2 ┬ĄL, DNase free water 4 ┬ĄL, ņČöņČ£ĒĢ£ DNA 2 ┬ĄLļź╝ Ēś╝ĒĢ®ĒĢśņŚ¼ ņĄ£ņóģ ņÜ®ļ¤ē 20 ┬ĄLļź╝ ņĀ£ņĪ░ĒĢśņśĆļŗż. ņØ┤Ēøä T3000 thermal cycler (Biometra GmbH, G├Čttingen, Germany)ņŚÉņä£ 95┬░C 5ļČä Ļ░ĆņŚ┤ Ēøä, 94┬░C 30ņ┤ł, 60┬░C 30ņ┤ł, 72┬░C 1ļČäņØä 35 cycle ļ░śļ│ĄĒĢśņśĆĻ│Ā, ļ░śņØæ Ēøä 72┬░C 10ļČäĻ░ä ļ░śņØæņŗ£ņ╝░ļŗż. PCR ņé░ļ¼╝ņØĆ Qiaxcel Advanced System (Qiagen)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀäĻĖ░ ņśüļÅÖĒĢśņśĆņ£╝ļ®░, 650 bpņØś ņ”ØĒÅŁņé░ļ¼╝ņØ┤ Ļ▓ĆņČ£ļÉśļŖö Ļ▓ĮņÜ░, ņ¢æņä▒ņ£╝ļĪ£ ĒīÉļÅģĒĢśņśĆļŗż.
ņĢłĻĄ¼ņ╣©ļ▓öņØĆ ņ×äņāüņ¢æņāüņŚÉ ļö░ļØ╝ Ļ▓░ļ¦ēņŚ╝, ņĀÉņāüĻ░üļ¦ēņŚ╝, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, ĻĖ░ņ¦łĻ░üļ¦ēņŚ╝, Ļ│Ąļ¦ēņŚ╝, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝, ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņśĆļŗż. ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉļĪ£ ņ▓śņØī ņ¦äļŗ©ĒĢ£ ĒÖśņ×ÉņØś ņ╣śļŻīļź╝ ņ£äĒĢ┤ ņ×äņāüņĀü ņåīĻ▓¼ņŚÉ ļö░ļØ╝ ņĀÉņĢłņÜ® ĒĢŁņāØņĀ£ 0.5% ciprofloxacin (Cravit Ophthalmic Solution, Santen Pharmaceutical Co., Ltd., Osaka, Japan)ņØä ĒĢśļŻ© 4ĒÜī, 3% acyclovir ņŚ░Ļ│Ā(Herpecid eye ointment, Samil Pharm, Seoul, Korea) ĒĢśļŻ© 5ĒÜī, Ļ░üļ¦ē ĒżļÅäļ¦ēņŚ╝ņØ┤ļéś ĻĖ░ņ¦łĻ░üļ¦ēņŚ╝ņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ ņ¦łĒÖśņØś Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ 1% prednisolone acetate (Pred forte, Allergan Inc., Irvine, CA, USA) ĒĢśļŻ© 4-8ĒÜī ļśÉļŖö 0.1% fluorometholone (Fluoron-T, Hanmi Pharm, Seoul, Korea)ļź╝ ĒĢśļŻ© 4-8ĒÜīļź╝ ņäĀĒāØņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, ĒÖśņ×ÉņØś Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ Ļ░Éļ¤ēĒĢśņśĆļŗż. ņĀäņŗĀņĀüņØĖ ĒĢŁļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻīļŖö ņÖĖļלĒÖśņ×ÉņŚÉņä£ Valacyclovir (Valtrex, GlaxoSmithKline, London, England) 1,000 mg ĒĢśļŻ© 3ĒÜī ļśÉļŖö famciclovir (Famvir, Novartis, Basel, Switzerland) 750 mg ĒĢśļŻ© 1ĒÜīļĪ£ 1ņŻ╝Ļ░ä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ĻĖēņä▒ ļ│æļ│ĆņØś ĒśĖņĀä ĒøäņŚÉ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖżļĪ£ ņØĖĒĢ£ ņĢłĻĄ¼ ĒĢ®ļ│æņ”Ø ņ×¼ļ░£ņØś ņśłļ░®ņØä ņ£äĒĢ┤ Acyclovir (Vacrovir, Handok Pharm, Seoul, Korea)ļź╝ 400 mg ĒĢśļŻ© 2ĒÜī 2ņŻ╝ņŚÉņä£ 6Ļ░£ņøöĻ╣īņ¦Ć ņé¼ņÜ®ĒĢśņśĆļŗż. ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖżņØś ņĢłĻĄ¼ņ╣©ļ▓ö ņ×¼ļ░£ņØĆ Ļ┤ĆĒĢ┤Ļ░Ć ņØ╝ņ¢┤ļéśĻ│Ā 3ļŗ¼ ņØ┤ņāü Ļ▓ĮĻ│╝ĒĢśņŚ¼ ļŗżņŗ£ ļ░öņØ┤ļ¤¼ņŖż Ļ┤ĆļĀ©ĒĢśņŚ¼ ĒÖśņĖĪ ņĢłņŚÉ ĒÖ£ļÅÖņä▒ ļ│æļ│ĆņØ┤ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[13]. ņĀäņ▓┤ ĒÖśņ×É ņżæ ņĢłĻĄ¼ ņ╣©ļ▓ö ņ×äņāüņ¢æņāüņØś ļ╣äņ£©ņØä ĒāÉņāēņĀüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆĻ│Ā, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä ņ£Āļ¼┤ ļ░Å ļłłļ¼╝ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż PCR Ļ▓░Ļ│╝ņŚÉ ļö░ļźĖ ņŗżņĀ£ ņĢłĻĄ¼ņ╣©ļ▓ö(Ļ▓░ļ¦ēņŚ╝, ņĀÉņāüĻ░üļ¦ēņŚ╝, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, ĻĖ░ņ¦łĻ░üļ¦ēņŚ╝, Ļ│Ąļ¦ēņŚ╝, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝, ļīĆņāüĒżņ¦ä ĒøäņŗĀĻ▓ĮĒåĄ)ņØś ļ╣äņ£©ņØä ĻĄ¼ļČäĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż. ļśÉĒĢ£ ņ┤łņ¦ä ņŗ£ ļéśņØ┤, ņä▒ļ│ä, ļŗ╣ļć©, ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®, Ļ│ĀņĢłņĢĢ, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝, ļłłļ¼╝ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż PCR ņ¢æņä▒ ņ£Āļ¼┤Ļ░Ć ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż Ļ┤ĆļĀ©ļÉ£ ņĢłĻĄ¼ņ╣©ļ▓öņØś ņ×¼ļ░£Ļ│╝ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖöņ¦Ć ņĪ░ņé¼ĒĢśņśĆļŗż.
ĒåĄĻ│äņĀü Ļ▓ĆņĀĢņØĆ SPSS 22.0 Version (IBM Corp., Armonk, NY, USA)ņØä ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, ņ╣┤ņØ┤ņĀ£Ļ│▒Ļ▓ĆņĀĢ(chi-square test), Fisher ņ¦üņĀæĒÖĢļźĀĻ│äņé░ļ▓Ģ(Fisher's exact test), ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØ(logistic regression) ļ░®ļ▓ĢņØä ĒåĄĒĢ┤ Ļ▓░Ļ│╝ ļČäņäØĒĢśņśĆļŗż. ļśÉĒĢ£ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż PCR Ļ▓Ćņé¼ņØś ņ¦äļŗ©ļĀźņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢśņŚ¼, ņłśņŗĀņ×É ĒīÉļŗ© ĒŖ╣ņä▒ Ļ│ĪņäĀ Reveiver Operation Characteristic curve (ROC)ņØä ņČöĻ░ĆĒĢśņśĆļŗż. pĻ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņØśņØśĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
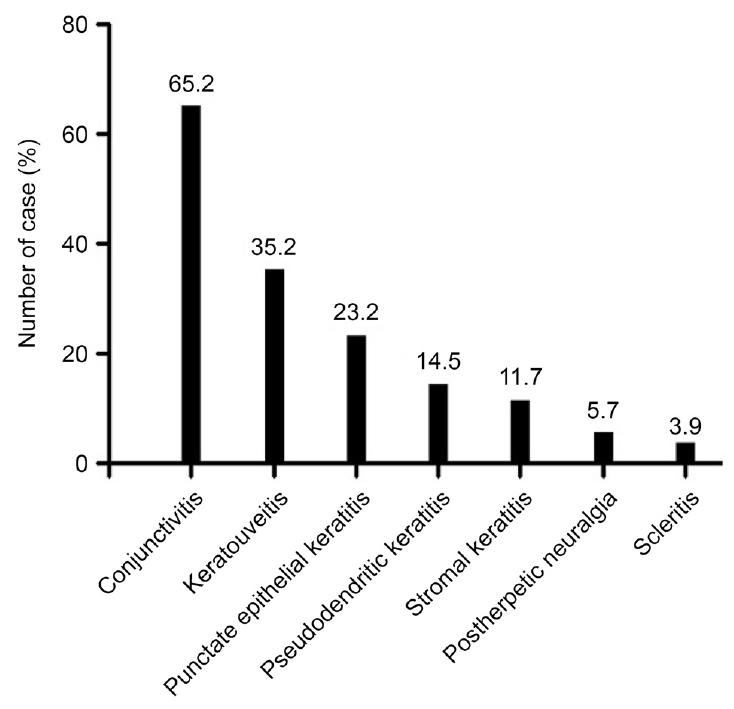
ļīĆņāü ĒÖśņ×ÉļŖö ņ┤Ø 69ļ¬ģ 69ņĢłņ£╝ļĪ£ ļé©ņ×ÉĻ░Ć 28ļ¬ģ(40.5%), ņŚ¼ņ×ÉĻ░Ć 41ļ¬ģ(59.5%)ņØ┤ņŚłļŗż. ĒÅēĻĘĀ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ĻĖ░Ļ░äņØĆ 5.4Ļ░£ņøöņØ┤ņŚłņ£╝ļ®░, ĒÅēĻĘĀņŚ░ļĀ╣ņØĆ 54.5 ┬▒ 19.9ņäĖņśĆļŗż(Table 1). ņ┤Ø 69ļ¬ģ ņżæ 51ļ¬ģ(73.9%)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļéśĒāĆļé¼ņ£╝ļ®░ ļ╣łļÅäļź╝ ļ│┤ņĢśņØä ļĢī Ļ▓░ļ¦ēņŚ╝ņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉĻ░Ć 45ļ¬ģ(65.2%, 45/69)ņ£╝ļĪ£ Ļ░Ćņן ļ¦ÄņĢśļŗż. Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ 18ļ¬ģ(35.2%, 18/51), ņĀÉņāüĻ░üļ¦ēņŚ╝ 16ļ¬ģ(23.2%, 16/69), Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝ 10ļ¬ģ(14.5%, 10/69), ĻĖ░ņ¦łĻ░üļ¦ēņŚ╝ 6ļ¬ģ(11.7%, 6/51), ļīĆņāüĒżņ¦ä ĒøäņŗĀĻ▓ĮĒåĄ 4ļ¬ģ(5.7%, 4/69), Ļ│Ąļ¦ēņŚ╝ 2ļ¬ģ(3.9%, 2/51)ņØś ņł£ņä£ļź╝ ļ│┤ņśĆļŗż(Fig. 1, 2). ĒÖśņ×ÉļōżņØĆ ļłłņŻ╝ļ│ĆņłśĒżĻ░Ć ņ▓śņØī ļ░£ņāØĒĢśļ®┤ņä£, ĒåĄņ”ØņØ┤ ņ׳ņŚłļŹś ņŗ£ņĀÉ ņØ┤ĒøäļĪ£ ĒÅēĻĘĀ 4.7 ┬▒ 3.2ņØ╝ ĒøäņŚÉ ļ│æņøÉņŚÉ ļé┤ņøÉĒĢśņŚ¼ ĒĢŁļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻīļź╝ ļ░øņĢśļŗż.
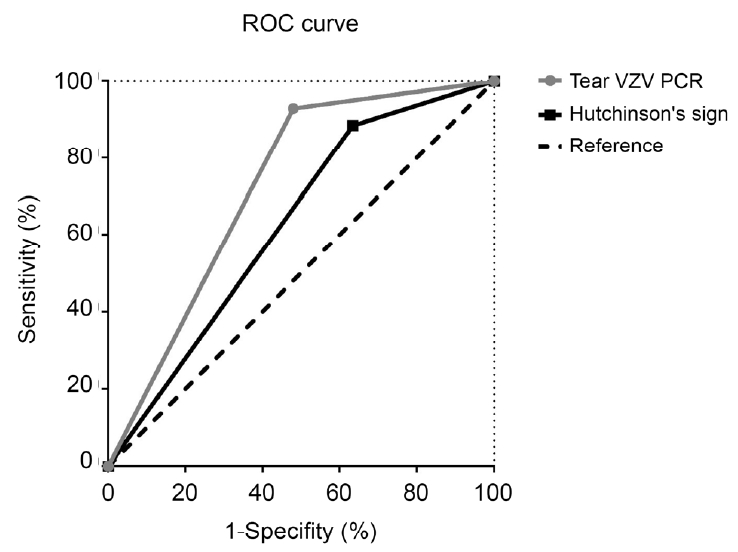
ĒŚłņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ 23ļ¬ģ(88.5%, 23/26)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, ņØīņä▒ņØĖ Ļ▓ĮņÜ░ 26ļ¬ģ(63.4%, 26/41)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆļŗż. ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņÖĆ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØ Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØĆ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆļŗż(p=0.047, Table 2). VZV PCRņØ┤ ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ 13ļ¬ģ(92.9%, 13/14)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, ņØīņä▒ņØĖ Ļ▓ĮņÜ░ 12ļ¬ģ(48%, 12/25)ņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļ®░ ņØ┤ ļśÉĒĢ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż(p=0.005, Table 2). ĒŚłņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ņ¢æņä▒ņØ┤ļ®┤ņä£ ļÅÖņŗ£ņŚÉ VZV PCR ņ¢æņä▒ņØĖ ĒÖśņ×É 9ļ¬ģņØĆ 100% (9/9) ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢ©ņØä ĒÖĢņØĖĒĢśņśĆļŗż(Table 3). ņ┤łņ¦ä ņŗ£ Ļ▓░ļ¦ēņŚ╝ ļ░Å Ļ░üļ¦ēņŚ╝ ņåīĻ▓¼ņØ┤ ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņĢśļŹś 14ļ¬ģņØś ĒÖśņ×É ņżæ 9ļ¬ģņŚÉņä£ VZV PCRņØ┤ ņ¢æņä▒ņ£╝ļĪ£ ĒīÉņĀĢļÉśņŚłĻ│Ā, ņØ┤ ĒÖśņ×ÉļōżņØĆ ņØ┤Ēøä Ļ▓░ļ¦ēņŚ╝ ļśÉļŖö ņĀÉņāüĻ░üļ¦ēņŚ╝ ļō▒ņØś ņĢłĻĄ¼Ēæ£ļ®┤ ņØ┤ņāü ņåīĻ▓¼ņØä ņČöņĀü Ļ┤Ćņ░░ ņżæņŚÉ ņČöĻ░ĆņĀüņ£╝ļĪ£ ļ│┤ņśĆļŗż. ņ£äņØś Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ VZVņØś ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņŚÉ ņ׳ņ¢┤ņä£, ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņÖĆ VZV PCR Ļ▓Ćņé¼ņØś Receiver Operating Characteristi (ROC) curveļź╝ ĻĘĖļĀż ļ│┤ņĢśņØä ļĢī, VZV PCRņØ┤ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ Ļ│ĪņäĀĒĢśļ®┤ņĀü(area under the curve)ņØ┤ ņ╗Ėņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ ņĢłĻĄ¼ņ╣©ļ▓öņØä ņØśņŗ¼ĒĢĀ ņłś ņ׳ļŖö ņ▓ÖļÅäļĪ£ņä£ ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼Ļ░Ć ĒŚłņ╣£ņŖ©ņ¦ĢĒøä ņ£Āļ¼┤ļź╝ ĒÖĢņØĖĒĢśļŖö Ļ▓āņŚÉ ļ╣äĒĢ┤ ņóĆ ļŹö ņ£ĀņÜ®ĒĢ©ņØä ņĢī ņłś ņ׳ņŚłļŗż(Fig. 3).
ņ┤Ø 69ļ¬ģņØś ĒÖśņ×É ņżæ 6Ļ░£ņøö ņØ┤ņāü ņČöņĀü Ļ░ĆļŖźĒĢ£ ĒÖśņ×ÉļŖö 53ļ¬ģņØ┤ņŚłņ£╝ļ®░, 7ļ¬ģ(13.2%, 7/53)ņŚÉņä£ ņ×¼ļ░£ĒĢśņśĆņ£╝ļ®░ ļ¬©ļæÉ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņØś ņ×äņāüņ¢æņāüņØä ļ│┤ņśĆļŗż. ņ┤łņ¦ä ņŗ£ ļéśņØ┤, ņä▒ļ│ä, ļŗ╣ļć©, ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ ņé¼ņÜ®, Ļ│ĀņĢłņĢĢ, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝, VZV PCR ņ¢æņä▒ ņ£Āļ¼┤ņŚÉ ļīĆĒĢ┤ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØ ņŗ£Ē¢ē Ļ▓░Ļ│╝, ņ┤łņ¦ä ņŗ£ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ ņåīĻ▓¼ņØ┤ ņ×¼ļ░£ ņ£äĒŚśņØĖņ×ÉļĪ£ ĒÖĢņØĖļÉśņŚłļŗż(OR=30.53, p=0.033, Table 4). ĒŚłņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ 10ļ¬ģ(38.4%, 10/26)ņŚÉņä£ ņØīņä▒ņØĖ Ļ▓ĮņÜ░ 7ļ¬ģ(16.6%, 7/42)ņŚÉņä£, VZV PCRņØ┤ ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ 4ļ¬ģ(28.5%, 4/14)ņŚÉņä£ ņØīņä▒ņØĖ Ļ▓ĮņÜ░ 6ļ¬ģ(24%, 6/25)ņŚÉņä£ Ļ░üĻ░ü Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļ®░, ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņÖĆ VZV PCR Ļ▓Ćņé¼ ļ¬©ļæÉ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝Ļ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.117, p=0.233) (Table 5).
Szeto et al [14]ņØĆ ļłłļīĆņāüĒżņ¦ä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØļźĀņØ┤ ļåÆņØĆ ņł£ņ£╝ļĪ£ Ļ▓░ļ¦ēņŚ╝(56.8%), ņĀäļ░®ĒżļÅäļ¦ēņŚ╝(17.8%), ĻĖ░ņ¦łĻ░üļ¦ēņŚ╝(6.6%), ņāüĒö╝Ļ░üļ¦ēņŚ╝(5.0%), Ļ│Ąļ¦ēņŚ╝(3.1%)ņØ┤ļØ╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż. Ghaznawi et al [15]ņØĆ 60ņäĖ ņĀäņŚÉļŖö Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝(36.0%), Ļ│ĀņĢłņĢĢ(17.2%), ļ░▒ļé┤ņן(15.5%), ņŗĀĻ▓Įņśüņ¢æņä▒ Ļ░üļ¦ēņŚ╝(8.6%), ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄ(8.0%), Ļ░ÉņŚ╝ņä▒ Ļ░üļ¦ēņŚ╝(3.4%)ņØ┤ ĒśĖļ░£ĒĢśĻ│Ā, 60ņäĖ ņØ┤ĒøäņŚÉļŖö ņŗĀĻ▓Įņśüņ¢æņä▒ Ļ░üļ¦ēņŚ╝(31.5%), ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄ(38.1%), Ļ│ĀņĢłņĢĢ(24.1%), Ļ░ÉņŚ╝ņä▒ Ļ░üļ¦ēņŚ╝(16.7%), Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝, ļ░▒ļé┤ņן(12.7%)ņØ┤ ĒśĖļ░£ĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. 60ņäĖ ņĀäņŚÉļŖö Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝ņØ┤ 60ņäĖ ņØ┤ĒøäļŖö Ļ░ÉņŚ╝ņä▒Ļ░üļ¦ēņŚ╝, ņŗĀĻ▓Įņśüņ¢æņä▒ Ļ░üļ¦ēņŚ╝, ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄņØ┤ ļŗżļźĖĻĄ░ņŚÉ ļ╣äĒĢ┤ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņØśļ»Ėņ׳ļŖö ļåÆņØĆ ļ░£ņāØļźĀņØä ļ│┤ņśĆļŗż. Kim et al [16]ņØĆ 60ņäĖ ņĀä ļ░£ņāØļźĀņØ┤ ļåÆņØĆ ņł£ņ£╝ļĪ£ Ļ▓░ļ¦ēņŚ╝(96.6%), Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝(86.2%), ņĀÉņāüĻ░üļ¦ēņŚ╝(44.8%), ĒżļÅäļ¦ēņŚ╝(20.7%), ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄ(13.8%), Ļ│ĀņĢłņĢĢ(10.3%), Ļ│Ąļ¦ēņŚ╝(6.9%)ņØ┤ļØ╝ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, 60ņäĖ ņØ┤ĒøäļŖö ļ░£ņāØļźĀņØ┤ ļåÆņØĆ ņł£ņ£╝ļĪ£ Ļ▓░ļ¦ēņŚ╝(88.2%), ņĀÉņāüĻ░üļ¦ēņŚ╝(61.8%), Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝(58.5%), ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄ(35.3%), ņŗĀĻ▓Įņśüņ¢æņä▒ Ļ░üļ¦ēņŚ╝(8.8%)ņØ┤ļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. 60ņäĖ ņĀäņŚÉļŖö Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝ņØ┤, 60ņäĖ ņØ┤ĒøäņŚÉļŖö ļīĆņāüĒżņ¦ä Ēøä ņŗĀĻ▓ĮĒåĄņØ┤ ļŗżļźĖĻĄ░ņŚÉ ļ╣äĒĢ┤ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņØśļ»Ėņ׳ļŖö ļåÆņØĆ ļ░£ņāØļźĀņØä ļ│┤ņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņØ┤ņĀä Ļ▓░Ļ│╝ļōżĻ│╝ ļ╣äņŖĘĒĢśĻ▓ī Ļ▓░ļ¦ēņŚ╝(65.2%), Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝(35.2%), ņĀÉņāüĻ░üļ¦ēņŚ╝(23.2%), Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝(14.5%) ņł£ņ£╝ļĪ£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļéś, ņāüļīĆņĀüņ£╝ļĪ£ Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝ņØś ļ╣äņ£©ņØĆ ļé«ņĢśĻ│Ā, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņØś ļ╣äņ£©ņØĆ ļåÆņĢśļŗż.
ĒŚłņ╣£ņŖ©ņ¦ĢĒøäļŖö Ēö╝ļČĆ Ļ░ÉĻ░üņŗĀĻ▓Į ļ¦Éļŗ©Ļ╣īņ¦Ć ļ░öņØ┤ļ¤¼ņŖżĻ░Ć ĒŹ╝ņĀĖņĢ╝ ļ░£ņāØĒĢśļ®░, ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØņØś ņżæņÜö ņśłĒøäņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[5,7]. Zaal et al [17]ņØĆ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░ Ļ░ÉĻ░üņŗĀĻ▓ĮņØś ņ░©ļŗ©ņØ┤ ņ£Āļ░£ļÉśļ®░, ņĢłĻĄ¼ņŚÉ ņŚ╝ņ”ØņØ┤ ļ░£ņāØĒĢśļŖö ļ╣łļÅäĻ░Ć ļåÆņĢäņĀĖ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØņØś ņżæņÜöĒĢ£ ņśłĒøäņØĖņ×ÉļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņÖĆ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØ Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØĆ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆļŗż(p=0.047). ņĀäņŗĀ ĒĢŁļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻīļź╝ ņŗ£Ē¢ēļ░øņØĆ ĒÖśņ×ÉļōżņØĆ Ēö╝ļČĆ Ļ░ÉĻ░üņŗĀĻ▓ĮņØś ļ¦Éļŗ©Ļ╣īņ¦Ć ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖĻ│Ā ņĮöņä¼ļ¬©ņ▓┤ņŗĀĻ▓Įļ¦īņØä ņ╣©ļ▓öĒĢśņŚ¼ ĒŚł ņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ļ│┤ņØ┤ņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ£╝ļ®░, ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ 9-62% ņĀĢļÅäņŚÉņä£ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäĻ░Ć ņ¢æņä▒ņ£╝ļĪ£ ļéśĒāĆļé£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[17-19].
Inata et al [20]ņØĆ ņĢłĻĄ¼Ēæ£ļ®┤Ļ│╝ Ļ░üļ¦ēņŚÉņä£ ņāØļ”¼ņŗØņŚ╝ņłśļĪ£ Ļ░üļ¦ēņØä ņäĖņ▓ÖĒĢ£ ņĢĪņ▓┤ļź╝ ņ▒äņĘ©ĒĢ£ ļÆż, ņĀĢļ¤ēņĀü ņŗżņŗ£Ļ░ä ņżæĒĢ®ĒÜ©ņåīņŚ░ņćä ļ░śņØæĻ▓Ćņé¼ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż Ļ░üļ¦ēņŚ╝ņØä ņ¦äļŗ©ĒĢĀ ņłś ņ׳ļŗżļŖö ļ│┤Ļ│Āļź╝ ĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļłłļ¼╝ VZV PCRņØä ņØ┤ņÜ®ĒĢśņśĆļŖöļŹ░, VZV PCR Ļ▓Ćņé¼ ņ¢æņä▒ ņåīĻ▓¼ņØĆ ļłłļīĆņāüĒżņ¦äņŚÉņä£ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ļ░£ņāØĻ│╝ ņ£ĀņØśĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆļŗż(p=0.005). ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ VZV PCRņØĆ ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ņ׳ņ¢┤ ņóĆ ļŹö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆĻ│Ā, ROC Ļ│ĪņäĀņØś Ļ│ĪņäĀĒĢśļ®┤ņĀü ļśÉĒĢ£ ņ╗ĖļŹś Ļ▓āņ£╝ļĪ£ ļ│╝ ļĢī, Ē¢źĒøä ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼ļŖö ĻĖ░ņĪ┤ ĒŚłņ╣£ņŖ©ņ¦ĢĒøäļĪ£ ņĢłĻĄ¼ņ╣©ļ▓ö ņŚ¼ļČĆļź╝ ņśłņĖĪĒĢśļŖö Ļ▓āļ│┤ļŗż ņóĆ ļŹö ņ£ĀņÜ®ĒĢśĻ▓ī ņ×äņāüņĀüņ£╝ļĪ£ ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
ļłłļīĆņāüĒżņ¦äņØś ņ×¼ļ░£ņŚÉ ļīĆĒĢ┤ ņŚ¼ļ¤¼ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░, Hwang et al [21]ņØĆ ļīĆņāüĒżņ¦ä ļ░▒ņŗĀ ņĀæņóģ Ēøä ņäĖĒżļ¦żĻ░£ ļ®┤ņŚŁ ļ░śņØæņŚÉ ņØśĒĢ┤ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņ£╝ļĪ£ ņ×¼ļ░£ĒĢśļŖö ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļ®░, Hu et al [22]ņØĆ ļłłļīĆņāüĒżņ¦ä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØ┤ ņ׳ņŚłļŹś ĒÖśņ×Éļōż ņżæ ņÖäņĀä ņ╣śļŻī ĒøäņŚÉļÅä ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖż ņłśņ¦ĆņāüĻ░üļ¦ēņŚ╝(late varicella-zoster virus dendriform keratitis)ĒśĢĒā£ļĪ£ ņ×¼ļ░£ĒĢĀ ņłś ņ׳ļŗżļŖö ļ│┤Ļ│Āļź╝ ĒĢśņśĆļŗż. Mun and Jung [5]ņØĆ ļłłļīĆņāüĒżņ¦ä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”ØņāüņØś ņóģļźśļ│ä ļ╣łļÅäņŚÉ ļö░ļØ╝ Ļ▓░ļ¦ēņŚ╝, ņĀÉņāüĻ░üļ¦ēņŚ╝, Ļ░Ćņä▒ņłśņ¦ĆĻ░üļ¦ēņŚ╝ ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö ĒÖśņ×Éļź╝ Ļ▓Įņ”ØĻĄ░, Ļ░üļ¦ēļé┤Ēö╝ņŚ╝, ņŗ¼ņĖĄĻĖ░ņ¦łĻ░üļ¦ēņŚ╝, Ļ│Ąļ¦ēņŚ╝, ļģ╣ļé┤ņן, ņÖĖņĢłĻĘ╝ļ¦łļ╣äļź╝ ļ│┤ņØ┤ļŖö ĻĄ░ņØä ņżæņ”ØĻĄ░ņ£╝ļĪ£ ļČäļźśĒĢśņśĆņ£╝ļ®░, ļæÉ ĻĄ░ Ļ░äņØś ņ×¼ļ░£ļźĀņŚÉ ņ░©ņØ┤Ļ░Ć ņ׳ļŖöņ¦ĆņŚÉ ļīĆĒĢ┤ ņŚ░ĻĄ¼ĒĢśņśĆņ£╝ļ®░, ļæÉ ĻĄ░ Ļ░äņØś ņ×¼ļ░£ļźĀņŚÉļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. Tran et al [13]ņØĆ Ļ│ĀņĢłņĢĢ(hazard ratio [HR], 4.6; 95% confidence interval [CI], 1.3-16.5; odds ratio [OR], 6.7; 95% CI, 1.5-31.2)Ļ│╝ ĒżļÅäļ¦ēņŚ╝(HR, 5.7; 95% CI, 1.7-19.0; OR, 6.7; 95% CI, 1.5-31.2)ņØ┤ ņ×¼ļ░£ņØś ņ£äĒŚśņØĖņ×Éņ×äņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļéśņØ┤, ņä▒ļ│ä, Ļ│ĀņĢłņĢĢ, ĒŚłņ╣£ņŖ©ņ¦ĢĒøä, VZV PCRĻ│╝ ļłłļīĆņāüĒżņ¦ä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ņ×¼ļ░£ Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØĆ ņŚåņŚłņ£╝ļ®░, Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ ņ£Āļ¼┤ļ¦īņØ┤ ļłłļīĆņāüĒżņ¦ä ņĢłĻĄ¼ņ╣©ļ▓ö ņ”Øņāü ņ×¼ļ░£ņŚÉ ņ׳ņ¢┤ņä£ ĒåĄĻ│äĒĢÖņĀü ņ£ĀņØśņä▒ņØ┤ ņ׳ņŚłļŗż(p=0.033; OR, 30.537). ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņØ┤ ļÅÖļ░śļÉśņŚłņØä Ļ▓ĮņÜ░, ņ×¼ļ░£ņŚÉ ņ£ĀņØśĒĢśļ®░ ņ╣śļŻīņŚÉ ņ×äĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ņ£╝ļ®░, Ē¢źĒøä ņ×¼ļ░£ņØä ņżäņØ┤ĻĖ░ ņ£äĒĢ£ ņ╣śļŻīļ▓ĢņŚÉ ļīĆĒĢ┤ņä£ļÅä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśĻ▓Āļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ ĒøäĒ¢źņĀüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ļČäņäØĒĢśņśĆļŗżļŖö ņĀÉ, ņĀüņØĆ ļīĆņāüĻĄ░, ļłłļīĆņāüĒżņ¦äņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×ÉļōżņØś ĻĄŁņåī ļ░Å ņĀäņŗĀ ĒĢŁļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻīņĀ£ņÖĆ ņÜ®ļ▓ĢņØ┤ ĒåĄņØ╝ļÉśņ¦Ć ņĢŖņØĆ ņĀÉņØä ļōż ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ ņłśļæÉļīĆņāüĒżņ¦äļ░öņØ┤ļ¤¼ņŖżņØś ņĢłĻĄ¼ ņ╣©ļ▓öņØä ņśłņĖĪĒĢśļŖö ļŹ░ ņ׳ņ¢┤, ĻĄŁļé┤ņŚÉņä£ ņāłļĪŁĻ▓ī ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼ļź╝ ņĀüņÜ®ĒĢ┤ ļ│┤ņĢśņ£╝ļ®░, ņØ┤Ļ▓āņØ┤ ĻĖ░ņĪ┤ņØś ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ ņóĆļŹö ņĢłĻĄ¼ņ╣©ļ▓ö ņŚ¼ļČĆļź╝ ĒīÉļŗ©ĒĢĀ ļĢī ņĪ░ĻĖł ļŹö ņ£ĀņÜ®ĒĢ£ Ļ▓Ćņé¼ ļÅäĻĄ¼Ļ░Ć ļÉĀ ņłś ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ļłłļīĆņāüĒżņ¦äĒÖśņ×ÉņŚÉņä£ VZV PCR Ļ▓Ćņé¼ļŖö ĒŚłņ╣£ņŖ©ņ¦ĢĒøäņŚÉ ļ╣äĒĢ┤ ņĪ░ĻĖł ļŹö ņ£ĀņÜ®ĒĢśĻ▓ī ņĢłĻĄ¼ņ╣©ļ▓öņØś ņśłņĖĪņØĖņ×ÉļĪ£ņä£ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ĻĘĖļ¤¼ļéś ĒŚłņ╣£ņŖ©ņ¦ĢĒøä ļ░Å ļłłļ¼╝ VZV PCR Ļ▓Ćņé¼ ļ¬©ļæÉ Ļ░üļ¦ēĒżļÅäļ¦ēņŚ╝ņØś ĒśĢĒā£ļĪ£ ļéśĒāĆļéśļŖö ņ×¼ļ░£Ļ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
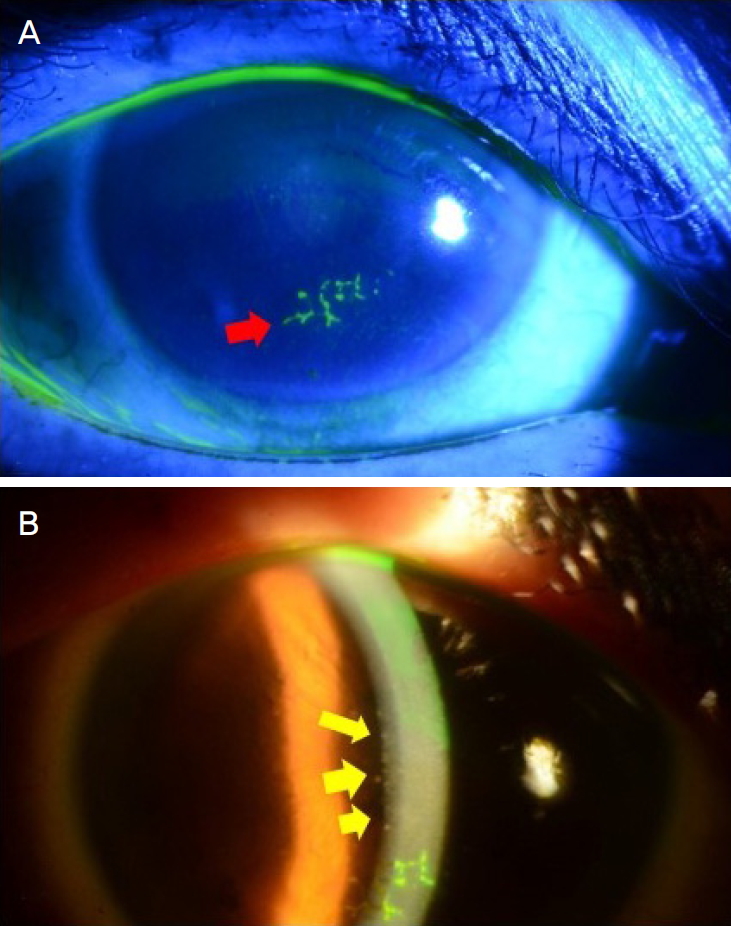
Figure┬Ā1.
Characteristic anterior segment photo of ocular involvement in herpes zoster ophthalmicus. (A) Pseudodendrites (red arrow), (B) granulomatous keratic precipitates in keratouveitis (yellow arrows).
Figure┬Ā2.
Distribution of ocular involvement in patients with herpes zoster ophthalmicus. The incidence of conjunctivitis, keratouveitis and punctate epithelial keratitis was 65.2%, 35.2% and 23.2% respectively. The other diseases was found to be below 20%.
Figure┬Ā3.
Receiver operating characteristic (ROC) curve of HutchinsonŌĆÖs sign and varicella zoster virus polymerase chain reaction (VZV PCR) in ocular involvement. The Area under the curve of tear VZV PCR is larger than HutchinsonŌĆÖs sign. Area under the curve showed tear VZV PCR: 0.72, HutchinsonŌĆÖs sign: 0.63.
Table┬Ā1.
PatientsŌĆÖ basic characteristics
Table┬Ā2.
Ocular involvement according to HutchinsonŌĆÖs sign and VZV PCR
| Factor | Ocular involvement (+) | Ocular involvement (-) | p-value* |
|---|---|---|---|
| HutchinsonŌĆÖs sign (+) | 23 (88.5) | 3 (11.5) | 0.047 |
| HutchinsonŌĆÖs sign (-) | 26 (63.4) | 15 (36.6) | |
| VZV PCR (+) | 13 (92.9) | 1 (7.1) | 0.005 |
| VZV PCR (-) | 12 (48.0) | 13 (52.0) |
Table┬Ā3.
Ocular involvement according to HutchinsonŌĆÖs sign and VZV PCR
Table┬Ā4.
Risk factors affecting recurrence of VZV keratouveitis
| Risk factor | OR (95% CI) | p-value* |
|---|---|---|
| Age (Ōēź60/<60, years) | 2.080 (0.132-32.751) | 0.603 |
| Sex (female/male) | 0.240 (0.025-2.274) | 0.888 |
| DM (+/-) | 0.432 (0.003-60.182) | 0.739 |
| Immunosuppressive drugs (+/-) | 6.235 (0.012-3216.697) | 0.566 |
| IOP (Ōēź21/<21, mmHg) | 0.343 (0.009-12.714) | 0.561 |
| Pseudodendrites (+/-) | 0.332 (0.015-7.439) | 0.487 |
| Keratouveitis (+/-) | 30.537 (1.309-712.417) | 0.033ŌĆĀ |
| HutchinsonŌĆÖs sign (+/-) | 0.161 (0.08-3.207) | 0.231 |
| Tear VZV PCR (+/-) | 0.083 (0.004-1.796) | 0.113 |
Table┬Ā5.
Relationship between HutchinsonŌĆÖs sign, VZV PCR and keratouveitis
| Factor | Keratouveitis (+) | Keratouveitis (-) | p-value* |
|---|---|---|---|
| HutchinsonŌĆÖs sign (+) | 10 (38.4) | 16 (61.6) | 0.177 |
| HutchinsonŌĆÖs sign (-) | 7 (16.6) | 35 (83.4) | |
| VZV PCR (+) | 4 (28.5) | 10 (71.5) | 0.233 |
| VZV PCR (-) | 6 (24.0) | 19 (76.0) |
REFERENCES
1) Johnson RW, Alvarez-Pasquin MJ, Bijl M, et al. Herpes zoster epidemiology, management, and disease and economic burden in Europe: a multidisciplinary perspective. Ther Adv Vaccines 2015;3:109-20.



2) Liesegang TJ. Herpes zoster ophthalmicus natural history, risk factors, clinical presentation, and morbidity. Ophthalmology 2008;115(2 Suppl):S3-12.


3) Vadoothker S, Jeng BH. Management of chronic complications associated with herpes zoster ophthalmicus. Curr Opin Ophthalmol 2018;29:334-9.


4) Hutchinson J. Clinical report on herpes zoster frontalis ophthalmicus (shingles affecting the forehead and nose). Ophthalmic Hospital Reports and Journal of the Royal London Ophthalmic Hospital 1864;5:191.
5) Mun CY, Jung MS. Clinical features and risk factors of herpes zoster ophthalmicus. J Korean Ophthalmol Soc 2017;58:1317-24.

6) Yawn BP, Wollan PC, Kurland MJ, et al. Herpes zoster recurrences more frequent than previously reported. Mayo Clin Proc 2011;86:88-93.



7) Sanjay S, Huang P, Lavanya R. Herpes zoster ophthalmicus. Curr Treat Options Neurol 2011;13:79-91.


8) Inoue T, Ohashi Y. Utility of real-time PCR analysis for appropriate diagnosis for keratitis. Cornea 2013;32 Suppl 1:S71-6.


9) Koizumi N, Nishida K, Adachi W, et al. Detection of herpes simplex virus DNA in atypical epithelial keratitis using polymerase chain reaction. Br J Ophthalmol 1999;83:957-60.



10) Hidalgo F, Mel├│n S, de O├▒a M, et al. Diagnosis of herpetic keratoconjunctivitis by nested polymerase chain reaction in human tear film. Eur J Clin Microbiol Infect Dis 1998;17:120-3.


11) Yamamoto S, Shimomura Y, Kinoshita S, et al. Detection of herpes simplex virus DNA in human tear film by the polymerase chain reaction. Am J Ophthalmol 1994;117:160-3.


12) Tafreshi NK, Sadeghizadeh M, Amini-Bavil-Olyaee S, et al. Development of a multiplex nested consensus PCR for detection and identification of major human herpesviruses in CNS infections. J Clin Virol 2005;32:318-24.


13) Tran KD, Falcone MM, Choi DS, et al. Epidemiology of herpes zoster ophthalmicus: recurrence and chronicity. Ophthalmology 2016;123:1469-75.



14) Szeto SK, Chan TC, Wong RL, et al. Prevalence of ocular manifestations and visual outcomes in patients with herpes zoster ophthalmicus. Cornea 2017;36:338-42.


15) Ghaznawi N, Virdi A, Dayan A, et al. Herpes zoster ophthalmicus: comparison of disease in patients 60 years and older versus younger than 60 years. Ophthalmology 2011;118:2242-50.


16) Kim YR, Cho NC, You IC. Comparison of herpes zoster ophthalmicus in patients 60 years older versus younger than 60 tears. J Korean Ophthalmol Soc 2013;54:568-73.

17) Zaal MJ, V├Člker-Dieben HJ, D'Amaro J. Prognostic value of Hutchinson's sign in acute herpes zoster ophthalmicus. Graefes Arch Clin Exp Ophthalmol 2003;241:187-91.


18) Nithyanandam S, Stephen J, Joseph M, Dabir S. Factors affecting visual outcome in herpes zoster ophthalmicus: a prospective study. Clin Exp Opthalmol 2010;38:845-50.

19) Chung YR, Chang YH, Kim DH, Yang HS. Ocular manifestations of herpes zoster ophthalmicus. J Korean Ophthalmol Soc 2010;51:164-8.

20) Inata K, Miyazaki D, Uotani R, et al. Effectiveness of real-time PCR for diagnosis and prognosis of varicella-zoster virus keratitis. Jpn J Ophthalmol 2018;62:425-31.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




