 |
 |
| J Korean Ophthalmol Soc > Volume 61(8); 2020 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņØś ĒĢŁĒżļÅäņĢīĻĘĀ ĒÜ©Ļ│╝ļź╝ ņØ╝ļ░ś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ļ╣äĻĄÉĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ņØ╝ļ░ś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼, Ļ░üĻ░üņØś ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ļö░ļźĖ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØś ņ”ØņŗØ ņĀĢļÅäņÖĆ 1-3ņäĖļīĆ ņŗżļ”¼ņĮśĒĢśņØ┤ļō£ļĪ£Ļ▓ö ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļīĆĒĢ£ ļČĆņ░® ņĀĢļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ļśÉĒĢ£ 1% ļ░Å 5% ņŚ░ņśźņłśņÖĆ ņāüņÜ® ļŗżļ¬®ņĀü Ļ┤Ćļ”¼ņÜ®ņĢĪņŚÉņä£ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļīĆĒĢ£ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØś ļČĆņ░® ņĀĢļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņØ╝ļ░ś ņĮśĒāØĒŖĖļĀīņ”łļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ļ╣äĒĢ┤ 5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØś ņ”ØņŗØņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉśņŚłņ£╝ļ®░(p=0.004), ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļČĆņ░®ļÉ£ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØś ņłśļÅä ļ¬©ļōĀ ņäĖļīĆņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Ļ░üĻ░ü p=0.026, p=0.043 ļ░Å p=0.001). 1% ļ░Å 5% ņŚ░ņśź ņłśļŖö ļŗżļ¬®ņĀüĻ┤Ćļ”¼ņÜ®ņĢĪĻ│╝ ļ╣äĻĄÉņŗ£ ĒÖ®ņāēĒżļÅäņĢīĻĘĀ ļČĆņ░® ņĀĢļÅäņŚÉņä£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
ABSTRACT
Purpose
To compare the anti-staphylococcal effect of nephrite-containing contact lens (CL) storage cases and conventional CL storage cases.
Method
The degree of proliferation and adhesion of Staphylococcus aureus (S. aureus) on first- to third-generation silicone hydrogel contact lenses (SHCLs) was analyzed through comparison of 5% nephrite-containing CL storage cases and conventional CL storage cases. The degree of adhesion of S. aureus to the CL was also compared between 1% or 5% nephrite solution and multipurpose solution (MPS).
Result
Nephrite-containing CL storage cases showed a significant inhibitory effect on S. aureus proliferation (p = 0.004) and significantly reduced the number of adherent S. aureus on all first- to third generation SHCLs compared with conventional CL storage cases (p = 0.026, p = 0.043, and p = 0.001, respectively). The anti-staphylococcal effect of 1% and 5% nephrite solutions was not significantly better than that of MPS.
ņĄ£ĻĘ╝ ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņĮśĒāØĒŖĖļĀīņ”łļĪ£ ņØĖĒĢ£ Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØś ļ░£ņāØ ļ╣łļÅäļÅä ņĀÉņ░© ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļŗż[1,2]. ĒŖ╣Ē׳, Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØĆ ņŗżļ¬ģĻ│╝ Ļ░ÖņØĆ ņŗ¼Ļ░üĒĢ£ Ļ▓░Ļ│╝ļź╝ ņ┤łļלĒĢĀ ņłś ņ׳ņ¢┤ ņŻ╝ņØśļź╝ ņÜöĒĢśļŖö ņ¦łĒÖśņØĖļŹ░, ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØĆ ņØ┤ļ¤¼ĒĢ£ Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØś ļīĆļČĆļČäņØä ņ░©ņ¦ĆĒĢśļ®░, ņĮśĒāØĒŖĖļĀīņ”łļĪ£ ņØĖĒĢ£ ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņŚÉņä£ļŖö ĻĘĖļ×īņØīņä▒ĻĘĀņØś ļ╣äņ£©ņØ┤ ļåÆĻ│Ā, Ļ░Ćņן ĒØöĒĢ£ ĻĘĖļ×īņØīņä▒ ņøÉņØĖĻĘĀņ£╝ļĪ£ļŖö ļģ╣ļåŹĻĘĀņØ┤ ņל ņĢīļĀżņĀĖ ņ׳ļŗż[3]. ļśÉĒĢ£ ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś ĻĘĖļ×īņ¢æņä▒ ņøÉņØĖĻĘĀņ£╝ļĪ£ļŖö ĒżļÅäņĢīĻĘĀņØś ļ╣äņ£©ņØ┤ ļåÆĻ│Ā[4], ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØĆ ĒżļÅäņĢīĻĘĀ ņżæņŚÉņä£ Ļ░Ćņן ļÅģņä▒ņØ┤ ļåÆļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ¢┤, ņĀüņĀłĒĢ£ ĒĢŁņāØņĀ£ņŚÉ ņØśĒĢ┤ ņ╣śļŻīļÉśņ¦Ć ņĢŖņØä Ļ▓ĮņÜ░ Ļ░üļ¦ēĒś╝ĒāüĻ│╝ ņ▓£Ļ│Ą ļō▒ņØä ņ£Āļ░£ĒĢśņŚ¼ ņŗ¼Ļ░üĒĢ£ ņŗ£ļĀźņĀĆĒĢśļź╝ ņ┤łļלĒĢĀ ņłś ņ׳ļŗż[5,6].
ĻĄŁņÖĖņŚÉņä£ļŖö ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ņāØļ¼╝ļ¦ē(biofilm) ĒśĢņä▒ņØä ņżäņØ┤Ļ│Ā ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļåÆņØ┤ĻĖ░ ņ£äĒĢ£ ļŗżņ¢æĒĢ£ ļ░®ļ▓ĢļōżņØ┤ ņŗ£ļÅäļÉśĻ│Ā ņ׳ļŖöļŹ░, ņØĆņØ┤ņś©, ņģĆļĀłļŖä ĒÖöĒĢ®ļ¼╝, ņĢöļ¬©ļŖä ĒÖöĒĢ®ļ¼╝, Ēö╝ļ”¼ļōÉ ĒÖöĒĢ®ļ¼╝, ņé░ĒÖöņ¦łņåī, Ēō©ļØ╝ļģ╝ ļ░Å ņ¢æņØ┤ņś© ĒÄ®ĒāĆņØ┤ļō£ ļō▒ņØś ņāłļĪ£ņÜ┤ ļ¼╝ņ¦łņØä ņ▓©Ļ░ĆĒĢ£ Ēøä ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[7-10]. ĻĄŁļé┤ ņŚ░ĻĄ¼ļĪ£ļŖö ņŚ░ņśź(nephrite)ņØä ņ▓©Ļ░ĆĒĢ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ ĒĢŁļģ╣ļåŹĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņ”ØļīĆļÉśņŚłĻ│Ā, ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ļŗżļ¬®ņĀüņÜ®ņĢĪ(multipurpose solution, MPS)ņŚÉņä£ ĒĢŁņĢäļ®öļ░ö ĒÜ©Ļ│╝Ļ░Ć ņ”ØļīĆļÉśņŚłņØīņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ¢┤, ņĮśĒāØĒŖĖļĀīņ”ł Ļ┤Ćļ”¼ ņ▓┤Ļ│äņŚÉņä£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ņ”ØļīĆņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņ▓©Ļ░Ćļ¼╝ņ¦łļĪ£ ņŚ░ņśźņØś Ļ░ĆļŖźņä▒ņØä ņĀ£ņŗ£ĒĢ£ ļ░ö ņ׳ļŗż[11,12]. ĻĘĖļ¤¼ļéś, ņäĖĻĘĀĻ░üļ¦ēņŚ╝ ņżæ ĻĄŁļé┤ņŚÉņä£ Ļ░Ćņן ĒØöĒĢ£ ņøÉņØĖĻĘĀņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŖö ĒżļÅäņĢīĻĘĀ[13]ņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņĀäļ¼┤ĒĢ£ ņŗżņĀĢņØ┤ļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒżļÅäņĢīĻĘĀ ņżæ ņ£Āļ│æļźĀņØ┤ ļåÆĻ│Ā ļÅģņä▒ņØ┤ ļåÆļŗżĻ│Ā ņĢīļĀżņ¦ä ĒÖ®ņāēĒżļÅäņĢīĻĘĀņŚÉ ļīĆĒĢ┤ ņŚ░ņśźņØ┤ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ Ļ┤Ćļ”¼ņÜ®ņĢĪņØś ņ▓©Ļ░Ćļ¼╝ņ¦łļĪ£ņä£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ļ│┤Ļ┤ĆņÜ®ĻĖ░ņØś ĒĢŁĒżļÅäņĢīĻĘĀ ĒÜ©Ļ│╝ļź╝ ņĢīņĢäļ│┤ĻĖ░ ņ£äĒĢ┤ ĒÅ┤ļ”¼ņŚÉĒŗĖļĀī ņ×¼ņ¦łņØś ņĀäĒåĄņĀüņØĖ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņØś ņĀäņ▓┤ ļ¼┤Ļ▓ī 5%ņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö ņŚ░ņśźņØä ņÜ®ĻĖ░ņŚÉ ĻĘĀņØ╝ĒĢśĻ▓ī ĒżĒĢ©ļÉśļÅäļĪØ ĒĢśņŚ¼ ņāłļĪ£ņÜ┤ ļ│┤Ļ┤ĆņÜ®ĻĖ░ļź╝ ņĀ£ņ×æĒĢśņśĆļŗż(Fig. 1). ņäĖļīĆļ│ä ņĮśĒāØĒŖĖļĀīņ”łļŖö 1ņäĖļīĆ Air OptixŌōć (Alcon, Fort Worth, TX, USA), 2ņäĖļīĆ Acuvue OasysŌōć (Johnson & Johnson, Limerick, Ireland) ļ░Å 3ņäĖļīĆ BiofinityŌōć (Cooper vision, Southampton, UK)ļĪ£ ņāüņÜ®ĒÖöļÉśņ¢┤ ņ׳ļŖö ņŗżļ”¼ņĮśĒĢśņØ┤ļō£ļĪ£Ļ▓öļĀīņ”łļź╝ ĻĄ¼ļČäĒĢśņŚ¼ ņżĆļ╣äĒĢśņśĆļŗż. ņåīĒöäĒŖĖņĮśĒāØĒŖĖļĀīņ”łņÜ® ļŗżļ¬®ņĀüņÜ®ņĢĪņØĆ Opti-Free ExpressŌōć (Alcon)ļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņŚ░ņśźņłśļŖö ļ»ĖņäĖņ×ģņ×ÉļĪ£ Ļ░ĆĻ│ĄĒĢ£ ņŚ░ņśźļČä(nephrite powder)ņØä phosphate buffer saline (PBS)ņŚÉ 100 mg/mL ļåŹļÅäļĪ£ ņżĆļ╣äĒĢśņŚ¼ pH 7.2ļĪ£ ļ│┤ņĀĢĒĢ£ Ēøä 24ņŗ£Ļ░ä ļÅÖņĢł ļ│┤Ļ┤ĆĒĢśņśĆļŗż. ņØ┤Ēøä 2,500 rpmņŚÉņä£ 5ļČäĻ░ä ņøÉņŗ¼ļČäļ”¼ĒĢśņŚ¼ ņāüņĖĄņĢĪņØä ņĘ©ĒĢ£ Ēøä 1% ļ░Å 5%ļĪ£ Ļ░üĻ░ü ĒؼņäØļÉ£ ņÜ®ņĢĪņØä ļ¦īļōżņŚłļŗż.
ĒÖ®ņāēĒżļÅäņĢīĻĘĀ(Staphylococcus aureus)ņØĆ Ļ▓ĮļČüļīĆĒĢÖĻĄÉļ│æņøÉ ļ│æņøÉņ▓┤ ņ×ÉņøÉņØĆĒ¢ēņŚÉņä£ ņĀ£Ļ│ĄĒĢ£ ļ│æņøÉņ▓┤ ņ×ÉņøÉ(P03415)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņłśĒ¢ēļÉśņŚłņ£╝ļ®░, ĒżļÅäņĢīĻĘĀņØä PBSņŚÉ ĒؼņäØĒĢśņŚ¼ ļ│╝ĒģŹņŖż Ēś╝ĒĢ®ĻĖ░ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņל ņä×ņØĆ Ēøä ĒŖĖļ”ĮĒŗ▒ņåīņØ┤ĒĢ£ņ▓£ļ░░ņ¦Ć(Tryptic soy agar plate)ņŚÉ ļÅäļ¦ÉĒĢśņŚ¼ 37┬░CņŚÉņä£ 24ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æ Ēøä Luria-Bertani (LB) ĒĢ£ņ▓£ļ░░ņ¦ĆņŚÉ 1Ļ░£ņØś ņ¦æļØĮ(colony)ņØä ņĀæņóģĒĢśņŚ¼ 37┬░CņŚÉņä£ 10-18ņŗ£Ļ░ä ļ░░ņ¢æĒĢśņśĆļŗż. ņØ┤Ēøä ļČäĻ┤æĻ┤æļÅäĻ│ä(Spectronic 21DŌōć, Milton Roy Co., Ivyland, PA, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ĒØĪĻ┤æļÅä(optical density, OD) 600ņØś Ļ░ÆņØ┤ 0.1ņØ┤ ļÉśļÅäļĪØ ņżĆļ╣äĒĢśņśĆļŗż.
ņĀäĒåĄņĀüņØĖ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ 5%ņØś ņŚ░ņśźņØ┤ ĒżĒĢ©ļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ņŗżņĀ£ ļ│┤Ļ┤ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ĒżļÅäņĢīĻĘĀņØ┤ ļČĆņ░®ļÉśļŖö ņĀĢļÅäļź╝ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤, PBS ņÜ®ņĢĪ 2 mLĻ░Ć ņ▒äņøīņ¦ä Ļ░ü ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ĒżļÅäņĢīĻĘĀ 0.1 mL (OD=0.1)ļź╝ ņĀæņóģĒĢ£ Ēøä 1, 2 ļ░Å 3ņäĖļīĆ ļĀīņ”łņÖĆ ĒĢ©Ļ╗ś ļ│┤Ļ┤ĆĒĢśņśĆļŗż. ņŗżņś©ņŚÉņä£ 24ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æ Ēøä, ņĮśĒāØĒŖĖļĀīņ”łļź╝ 2 mL PBSļĪ£ 1ļČä ļÅÖņĢł ņČ®ļČäĒ׳ ņäĖņ▓ÖĒĢśņŚ¼ ļĀīņ”łņŚÉ ļČĆņ░®ļÉśņ¦Ć ņĢŖņØĆ ņäĖĻĘĀļōżņØä ņö╗ņ¢┤ļé┤ņŚłļŗż. ņäĖņ▓ÖļÉ£ ņĮśĒāØĒŖĖļĀīņ”łļź╝ ļ¼┤ĻĘĀņĀüņ£╝ļĪ£ ņŗ£ĒŚśĻ┤ĆņŚÉ ļŗ┤ņĢä PBSļź╝ 1 mL ņČöĻ░ĆĒĢśņŚ¼ ļ│╝ĒģŹņŖżļź╝ ņé¼ņÜ®ĒĢśņŚ¼ 3ļČä ļÅÖņĢł ņČ®ļČäĒ׳ ĻĄÉļ░śĒĢśņŚ¼ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļČĆņ░®ļÉ£ ņäĖĻĘĀļōżņØä ļ¢©ņ¢┤ņ¦ĆļÅäļĪØ ĒĢśņśĆļŗż[14-16]. ņØ┤Ēøä Ļ░üĻ░üņØś ĒŖ£ļĖīņŚÉņä£ ņĘ©ĒĢ┤ņ¦ä ņäĖĻĘĀļČĆņ£ĀņĢĪņØä 10-4ļ░░ ļ░Å 10-5ļ░░ ĒؼņäØĒĢśĻ│Ā LB ĒĢ£ņ▓£ļ░░ņ¦ĆņŚÉ ņĀæņóģĒĢśņŚ¼ 37┬░C ņĪ░Ļ▒┤ņŚÉņä£ 18ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æĒĢśņśĆļŗż. ĒؼņäØļÉ£ LB ĒĢ£ņ▓£ļ░░ņ¦ĆņŚÉņä£ ņ×Éļ×Ć ņäĖĻĘĀņ¦æļØĮņØä ņ¦æļØĮĒśĢņä▒ļŗ©ņ£ä(colony forming unit, CFU)ļĪ£ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░ Ļ░üĻ░ü 5ĒÜī ļ░śļ│Ą ņłśĒ¢ēĒĢśņŚ¼ Ļ▓░Ļ│╝ļź╝ ĒÅēĻĘĀĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż.
ĻĖ░ņĪ┤ņØś ļŗżļ¬®ņĀüņÜ®ņĢĪĻ│╝ ņŚ░ņśźņłśņØś ĒÖ®ņāēĒżļÅäņĢīĻĘĀņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ ļŗżļ¬®ņĀüņÜ®ņĢĪ, PBS, ĻĘĖļ”¼Ļ│Ā 1% ļ░Å 5% ņŚ░ņśźņłś Ļ░üĻ░üņØä ņĀäĒåĄņĀüņØĖ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ 2 mL ņ▒äņÜ┤ Ēøä 1, 2 ļ░Å 3ņäĖļīĆ ļĀīņ”łļź╝ ļäŻĻ│Ā ņäĖĻĘĀļČĆņ£ĀņĢĪ 0.1 mL (OD=0.1)ļź╝ ņĀæņóģĒĢśņśĆļŗż. ņŗżņś©ņŚÉņä£ 24ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æĒĢ£ Ēøä, ņĢ×ņä£ ņŗ£Ē¢ēĒĢ£ ļÅÖņØ╝ĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ ļĀīņ”łņŚÉ ļČĆņ░®ļÉ£ ĒżļÅäņĢīĻĘĀņØś ņłśļź╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░ Ļ░üĻ░ü 5ĒÜī ļ░śļ│Ą ņłśĒ¢ēĒĢśņŚ¼ Ļ▓░Ļ│╝ļź╝ ĒÅēĻĘĀĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż.
ĒåĄĻ│äņ▓śļ”¼ļŖö SPSS for Windows 18.0 (SPSS Inc., Chicago, IL, USA) ĒåĄĻ│ä ĒöäļĪ£ĻĘĖļשņØä ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░, ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØś ņ¦æļØĮņłśļź╝ t-Ļ▓ĆņĀĢ ļ░®ļ▓Ģ ļ░Å analysis of variance with the Scheffe testļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż. ņ£ĀņØśļÅä(pĻ░Æ) 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
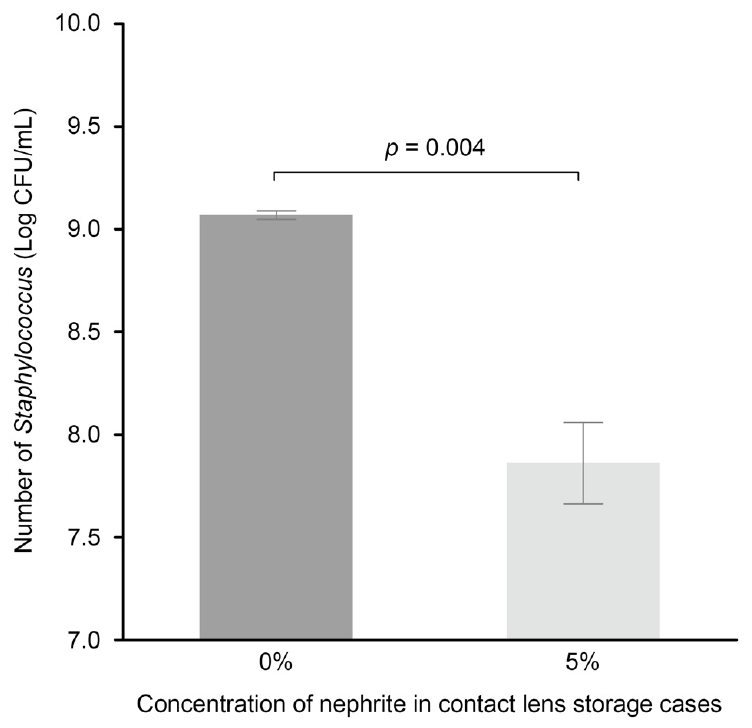
ļ░░ņ¢æļÉ£ ĻĘĀņŻ╝ļź╝ Ļ░üĻ░üņØś ļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ņĀæņóģĒĢśņŚ¼ ņŗżņś©ņŚÉņä£ 24ņŗ£Ļ░äļÅÖņĢł ļ░░ņ¢æĒĢ£ Ļ▓░Ļ│╝, ĻĖ░ņĪ┤ņØś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ļ╣äĒĢ┤(Fig. 2A), 5% ņŚ░ņśźņØ┤ ĒżĒĢ©ļÉ£ ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£(Fig. 2B) ĻĘĀņØś ņ”ØņŗØņØ┤ Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░ Ļ░ü ĻĄ░ņØś Log CFU/mLļŖö 9.07 ┬▒ 0.02 ļ░Å 7.86 ┬▒ 0.20ņ£╝ļĪ£ ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ļ│┤ņśĆļŗż(Fig. 3, p=0.004).
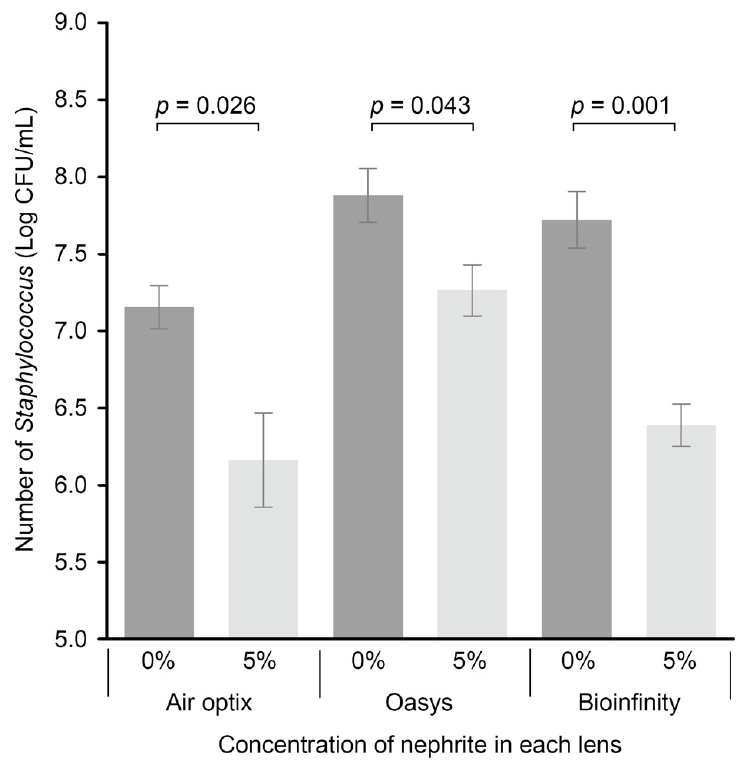
ņØ╝ļ░ś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ 5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ Ļ░ü ņäĖļīĆļ│ä ņĮśĒāØĒŖĖļĀīņ”łļź╝ ļ│┤Ļ┤ĆĒĢ£ Ēøä ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØä ļ░░ņ¢æĒĢ£ Ļ▓░Ļ│╝, ĻĖ░ņĪ┤ņØś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£(Fig. 4A-C)ļ│┤ļŗż 5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£(Fig. 4D-F) ņ¢╗ņ¢┤ņ¦ä CFUĻ░Ć ļ¬©ļōĀ ņäĖļīĆņŚÉņä£ ļé«Ļ▓ī ņĖĪņĀĢļÉśņŚłļŗż. ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ļö░ļźĖ Log CFU/mLļŖö 1ņäĖļīĆ ņĮśĒāØĒŖĖļĀīņ”łņŚÉņä£ļŖö Ļ░üĻ░ü 7.16 ┬▒ 0.14 ļ░Å 6.16 ┬▒ 0.31, 2ņäĖļīĆ ņĮśĒāØĒŖĖļĀīņ”łņŚÉņä£ļŖö Ļ░üĻ░ü 7.88 ┬▒ 0.17 ļ░Å 7.26 ┬▒ 0.17, ĻĘĖļ”¼Ļ│Ā 3ņäĖļīĆ ņĮśĒāØĒŖĖļĀīņ”łņŚÉņä£ļŖö Ļ░üĻ░ü 7.72 ┬▒ 0.18 ļ░Å 6.39 ┬▒ 0.14ļĪ£ ļ¬©ļōĀ ņäĖļīĆņŚÉņä£ ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØä ļ│┤ņśĆļŗż(Fig. 5, Ļ░üĻ░ü p=0.026, p=0.043 ļ░Å p=0.001).
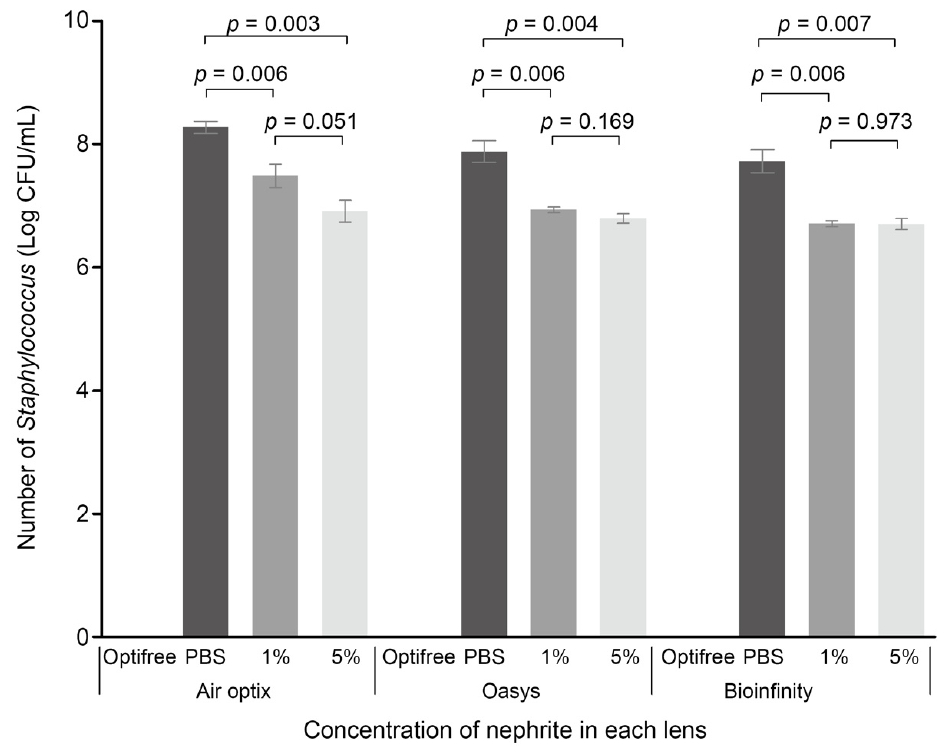
ļŗżļ¬®ņĀüņÜ®ņĢĪ, PBS, ĻĘĖļ”¼Ļ│Ā 1% ļ░Å 5% ņŚ░ņśźņłśņŚÉ 1, 2 ļ░Å 3ņäĖļīĆ ņĮśĒāØĒŖĖļĀīņ”łļź╝ ņ£äņ╣śņŗ£Ēé© ļÆż ĻĘĀņØä ņĀæņóģĒĢ£ Ēøä ļ░░ņ¢æĒĢśņŚ¼ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļČĆņ░®ļÉ£ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņØä Ļ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝, ņŚ░ņśźņłśļŖö PBSņÖĆ ļ╣äĻĄÉņŗ£ ļ¬©ļōĀ ņäĖļīĆņŚÉņä£ ņ£ĀņØśĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆņ¦Ćļ¦ī, ĻĖ░ņĪ┤ņØś ļŗżļ¬®ņĀüņÜ®ņĢĪņŚÉ ļ│┤Ļ┤ĆĒĢśņśĆņØä ļĢīņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī Ļ░£ņäĀļÉ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņŚåņŚłĻ│Ā, 1% ļ░Å 5% ņŚ░ņśźņłśļÅä ņ£ĀņØśĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 6).
ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś ņøÉņØĖ ņżæ Ļ│╝Ļ▒░ņŚÉļŖö ņÖĖņāüņØ┤ Ļ░Ćņן ļ¦ÄņØĆ ņøÉņØĖņØä ņ░©ņ¦ĆĒĢśņśĆņ£╝ļéś, ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņØ┤ ļ│┤ĒÄĖĒÖöļÉśĻ│Ā ņØ┤ņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░ÉņŚ╝ņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ņĮśĒāØĒŖĖļĀīņ”łĻ░Ć ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś ņŻ╝ņÜö ņøÉņØĖņ£╝ļĪ£ ļīĆļæÉļÉśĻ│Ā ņ׳ļŗż[17]. ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ņØśĒĢ£ ņäĖĻĘĀĻ░üļ¦ēņŚ╝Ļ│╝ ņĮśĒāØĒŖĖļĀīņ”łņÖĆ Ļ┤ĆļĀ© ņŚåļŖö ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ļæś ļŗż ĻĘĖļ×īņ¢æņä▒ĻĘĀņŚÉņä£ļŖö ĒÖ®ņāēĒżļÅäņĢīĻĘĀ, ĻĘĖļ×īņØīņä▒ĻĘĀņŚÉņä£ļŖö ļģ╣ļåŹĻĘĀņØ┤ Ļ░Ćņן ļåÆņØĆ ļ╣äņ£©ņØä ņ░©ņ¦ĆĒĢśĻ│Ā ņ׳Ļ│Ā[18], ĻĄŁņÖĖļ┐É ņĢäļŗłļØ╝ ĻĄŁļé┤ņŚÉņä£ļÅä ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś Ļ░Ćņן ĒØöĒĢ£ ņøÉņØĖĻĘĀņØĆ ĒżļÅäņĢīĻĘĀņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[19,20]. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś ņŻ╝ņÜö ņøÉņØĖĻĘĀņØĖ ļģ╣ļåŹĻĘĀņŚÉ Ļ┤ĆĒĢ£ ņØ┤ņĀä ļ│┤Ļ│Ā[11]ņŚÉ ņØ┤ņ¢┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÖ®ņāēĒżļÅäņĢīĻĘĀņŚÉ ļīĆĒĢ£ ņŚ░ņśźņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņŚÉ Ļ┤ĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ņĮśĒāØĒŖĖļĀīņ”łļĪ£ ņØĖĒĢ£ ņäĖĻĘĀĻ░üļ¦ēņŚ╝ņØś ļ░£ņāØ ĻĖ░ņĀäņØä ņé┤ĒÄ┤ļ│┤ļ®┤, ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ņØśĒĢ┤ Ļ░üļ¦ēņØś ņĀĆņé░ņåīņ”ØĻ│╝ Ļ│ĀņØ┤ņé░ĒÖöĒāäņåīņ”ØņØ┤ ļ░£ņāØĒĢśņŚ¼ Ļ░üļ¦ēņāüĒö╝Ļ░Ć ņåÉņāüļÉśļ®┤ Ļ░üļ¦ēņØś ņĀĆĒĢŁļĀźņØ┤ ņĢĮĒÖöļÉśņ¢┤ ļ│æņøÉĻĘĀņØ┤ Ļ░üļ¦ēņØä ņ╣©Ēł¼ĒĢśĻ▓ī ļÉ©ņ£╝ļĪ£ņŹ© Ļ░ÉņŚ╝ņØ┤ ņ£Āļ░£ļÉśļŖö Ļ│╝ņĀĢņØä Ļ▒░ņ╣£ļŗż[21]. ņĮśĒāØĒŖĖļĀīņ”łņØś Ļ▓ĮņÜ░ņŚÉļŖö ņŻ╝ņ£äļĪ£ ņĀÉņĢĪņ¦łĻ│╝ ļŗ©ļ░▒ņ¦łņØ┤ ļæśļ¤¼ņŗĖĻ▓ī ļÉśņ¢┤ ņäĖĻĘĀ ļČĆņ░®ņØ┤ ļŹöņÜ▒ ņ┤ēņ¦äļÉśĻ│Ā, ļČĆņ░®ļÉ£ ņäĖĻĘĀņØĆ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśņŚ¼ Ļ░ÉņŚ╝ņøÉņ£╝ļĪ£ ņ×æņÜ®ĒĢśĻ▓ī ļÉ£ļŗż[22]. ĒĢ£ĒÄĖ, ņØ┤ļź╝ ņ╣śļŻīĒĢśļŖö ĒĢŁņāØņĀ£ņØś ņ×æņÜ®ĻĖ░ņĀäņ£╝ļĪ£ļŖö ņäĖĒżļ▓Į ĒĢ®ņä▒ ņ¢ĄņĀ£, ņäĖĒżļ¦ē Ēł¼Ļ│╝ņØś ļ│ĆĒÖö, ļŗ©ļ░▒ ĒĢ®ņä▒ ņ¢ĄņĀ£, ĒĢĄņé░ ĒĢ®ņä▒ ņ¢ĄņĀ£, ņŚĮņé░ ĒĢ®ņä▒ ņ¢ĄņĀ£ ļō▒ņØ┤ ņĢīļĀżņĀĖ ņ׳ļŖöļŹ░, ņäĖĻĘĀņØ┤ ņāØļ¼╝ļ¦ēņØä ĒśĢņä▒ĒĢśĻ▓ī ļÉśļ®┤ ņØ┤ļ¤¼ĒĢ£ ĒĢŁņāØņĀ£ņØś ņ╣©Ēł¼ļź╝ ļ¦ēĻ│Ā ņĀĆĒĢŁņä▒ņØä ļåÆņŚ¼ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļŹöņÜ▒ Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[23]. ĒŖ╣Ē׳, ņĮśĒāØĒŖĖļĀīņ”łņŚÉņä£ņÖĆ Ļ░ÖņØ┤ ņāØļ¼╝ļ¦ēņ£╝ļĪ£ ļæśļ¤¼ņŗĖņØĖ Ļ░ÉņŚ╝ņøÉņØĆ ņØ╝ļ░śņĀüņØĖ ļČĆņ£Ā ņāüĒā£ņØś Ļ░ÉņŚ╝ņøÉļ│┤ļŗż ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņŚÉ ļŹö ņĀĆĒĢŁņä▒ņØä Ļ░Ćņ¦äļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ¢┤ Ļ░ÉņŚ╝ņŚÉ ļŹöņÜ▒ ņŻ╝ņØśļź╝ ņÜöĒĢ┤ņĢ╝ ĒĢśļŖö ņāüĒÖ®ņØ┤ ļ░£ņāØĒĢśĻ▓ī ļÉśļŖö Ļ▓āņØ┤ļŗż[24,25]. ĻĘĖļ¤¼ļ»ĆļĪ£ ņäĖĻĘĀņØś ļČĆņ░® ļ░Å ņØ┤Ēøä ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØ┤ ņĮśĒāØĒŖĖļĀīņ”łņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░üļ¦ēņŚ╝ņØś ņżæņÜöĒĢ£ ļŗ©Ļ│äĻ░Ć ļÉśļ»ĆļĪ£ ņØ┤ļź╝ ņ░©ļŗ©ĒĢśļŖö Ļ▓āņØ┤ Ļ░ÉņŚ╝ņØä ņżäņØ╝ ņłś ņ׳ļŖö ļ░®ļ▓ĢņØ┤ļØ╝ ĒĢĀ ņłś ņ׳Ļ▓Āļŗż.
Ēśäņ×¼ ņĮśĒāØĒŖĖļĀīņ”łļĪ£ ņØĖĒĢ£ Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØä ļé«ņČöĻĖ░ ņ£äĒĢ┤ ļŗżļ¬®ņĀüņÜ®ņĢĪņØ┤ ļ│┤ĒÄĖņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļŗżļ¬®ņĀüņÜ®ņĢĪņØĆ ļČĆņ£Ā ņāüĒā£ņØś ņäĖĻĘĀĻ│╝ ņ¦äĻĘĀņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņāØļ¼╝ļ¦ēņ£╝ļĪ£ ļæśļ¤¼ņŗĖņØ┤ļ®┤ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņŚÉ ļŹö ņĀĆĒĢŁņä▒ņØä Ļ░Ćņ¦äļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ¦Ćļ¦ī, ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņŚÉ ļīĆĒĢ┤ņä£ļŖö ņĢäņ¦ü ņ”Øļ¬ģļÉ£ ļ░öĻ░Ć ņŚåļŖö ņŗżņĀĢņØ┤ļŗż[26,27]. ĻĄŁņÖĖņŚÉņä£ļŖö ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ ļ░Å ļ│┤ņĪ┤ņĢĪņŚÉ ņäĖĻĘĀņØś ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä ņżäņØ┤Ļ│Ā ņäĖĻĘĀ ņłśļź╝ Ļ░Éņåīņŗ£ĒéżĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŖöļŹ░, ņØĆņØ┤ņś©, ņģĆļĀłļŖä ĒÖöĒĢ®ļ¼╝, ņĢöļ¬©ļŖä ĒÖöĒĢ®ļ¼╝, Ēö╝ļ”¼ļōÉ ĒÖöĒĢ®ļ¼╝, ņé░ĒÖöņ¦łņåī, Ēō©ļØ╝ļģ╝ ļ░Å ņ¢æņØ┤ņś© ĒÄ®ĒāĆņØ┤ļō£ ļō▒ņØś ņāłļĪ£ņÜ┤ ļ¼╝ņ¦łņØä ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ņ▓©Ļ░ĆĒĢ£ Ēøä ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[7-10]. ĒŖ╣Ē׳, ļéśļģĖ ņ×ģņ×É ĒśĢĒā£ņØś ņØĆņØ┤ņś©ņØĆ ĻĘĖļ×īņ¢æņä▒ĻĘĀ, ĻĘĖļ×īņØīņä▒ĻĘĀ, ņ¦äĻĘĀ, ņøÉņāØļÅÖļ¼╝ ļ░Å ņØ╝ļČĆ ļ░öņØ┤ļ¤¼ņŖżņŚÉ ļīĆĒĢ£ Ļ┤æļ▓öņ£äĒĢ£ ĒĢŁĻĘĀ ņ×æņÜ®ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŖöļŹ░[28-31], ņØĆņØ┤ņś©ņØś ņ×æņÜ®ĻĖ░ņĀäņØĆ ņäĖĻĘĀņØś ĒĢĄņé░ ĒĢ®ņä▒ņØä ņ¢ĄņĀ£ĒĢśĻ│Ā, ņäĖĒżļ¦ē ļ░Å ņäĖĒżļ▓ĮņØś ĻĄ¼ņĪ░ņĀü ļ│ĆĒśĢņØä ņ”ØĻ░Ćņŗ£ņ╝£ņä£ ņäĖĻĘĀ ņä▒ņןņØä ņ¢ĄņĀ£ĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[32-37]. ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØĆņØä ņ▓©Ļ░ĆĒĢ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņ”ØļīĆļÉśņŚłņ£╝ļ®░, ĒŖ╣Ē׳ ĻĘĖļ×īņ¢æņä▒ĻĘĀņØĖ ĒÖ®ņāēĒżļÅäņĢīĻĘĀņŚÉ ĒĢŁĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłņØīņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[9]. ņģĆļĀłļŖä ņżæĒĢ®ņ▓┤(selenium polymer)ņØś Ļ▓ĮņÜ░ļŖö ņäĖĻĘĀ ļČĆņ░®ņØä ņ¢ĄņĀ£ņŗ£ĒéżĻ│Ā, ņģĆļĀłļŖäņØ┤ ĒżĒĢ©ļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä Ļ░Éņåīņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŖöļŹ░, ņØĆņØä ņ▓©Ļ░ĆĒĢ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ļ╣äņŖĘĒĢśĻ▒░ļéś ļŹö ņóŗņØĆ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØĖļŗżĻ│Ā ĒĢśņśĆļŗż[10]. ņģĆļĀłļŖäņØś ņ×æņÜ®ĻĖ░ņĀäņØĆ ĒÖ£ņä▒ņé░ņåī ņŚŁĒĢĀņØä ĒĢśļŖö ņ┤łĻ│╝ņé░ĒÖöņłśņåīņØ┤ņś©ņØä ņāØņä▒ĒĢśņŚ¼ ņäĖĒżņØś ņä▒ņןņØä ņ¢ĄņĀ£ĒĢśĻ│Ā ņé¼ļ®ĖņØä ņ£ĀļÅäĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[38].
ĒĢ£ĒÄĖ, ņŚ░ņśźņØĆ ņØĖņ▓┤ņŚÉ ņ£ĀņØĄĒĢ£ 3Ļ░Ćņ¦Ć Ļ┤æļ¼╝ ņ”ē, ņ╣╝ņŖś, ņ▓ĀļČä ļ░Å ļ¦łĻĘĖļäżņŖśņØä ņŻ╝ņä▒ļČäņ£╝ļĪ£ ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņ¦Ćņ¦łļŗżļŗ╣ļźś(lipopolysaccharide)ņŚÉ ņØśĒĢ┤ ņ£ĀļÅäļÉ£ interleukin-1╬▓, tumor necrosis factor-╬▒, cyclooxygenase-2ņÖĆ inducible nitric oxide synthaseņØś ņ£ĀņĀäņ×É ļ░£ĒśäņØä ņĀĆĒĢ┤ĒĢśĻ│Ā, ļ¼╝ļ”¼ņĀüņØĖ ņ×æņÜ®ņ£╝ļĪ£ ņäĖĒżņä▒ņןņØä ņĀĆĒĢ┤ņŗ£Ēéżļ®░, ņåīņŚ╝ ĒÜ©Ļ│╝ļÅä ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[39]. Yeom et al [39]Ļ│╝ Han et al [40]ņØĆ ņŚ░ņśźņØś ņŚ╝ņ”Ø ļ░śņØæ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļź╝ ĒåĄĒĢ┤ ņŚ╝ņ”Øņ¦łĒÖśņØä ņśłļ░®ĒĢśĻ▒░ļéś ņ¢ĄņĀ£ĒĢśļŖö ņ╣śļŻī ļ░®ļ▓ĢņØś Ļ░ĆļŖźņä▒ņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, Lee et al [11]Ļ│╝ Jung et al [12]ņØĆ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ļŗżļ¬®ņĀüņÜ®ņĢĪņŚÉņä£ ņŚ░ņśźņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļģ╣ļåŹĻĘĀĻ│╝ Ļ░Ćņŗ£ņĢäļ®öļ░öņØś Ļ░üļ¦ēņŚ╝ņØś ļ░£ņāØņØä ļé«ņČöļŖö ņ▓©Ļ░Ćļ¼╝ļĪ£ņä£ņØś ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØīņØä ļ│┤Ļ│ĀĒĢśņŚ¼, ņŚ░ņśźņØ┤ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ Ļ┤Ćļ”¼ņÜ®ņĢĪņØś ņ▓©Ļ░Ćļ¼╝ņ¦łļĪ£ņä£ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņØīņØä ņĀ£ņŗ£ĒĢ£ ļ░ö ņ׳ļŗż.
ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļéśņĢäĻ░Ć ĒÖ®ņāēĒżļÅäņĢīĻĘĀņŚÉ ļīĆĒĢ£ ņŚ░ņśźņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ▓░Ļ│╝ ņØ╝ļ░śņĀüņØĖ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ļ│┤ļŗż 5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ ĻĘĀņØś ņ”ØņŗØņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ¢ĄņĀ£ļÉ©ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. ļśÉĒĢ£ ņØ╝ļ░ś ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ļ│┤ļŗż 5% ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ļ│┤Ļ┤Ć ņÜ®ĻĖ░ņŚÉ ļ│┤Ļ┤ĆĒĢśņśĆņØä ļĢī ļ¬©ļōĀ ņäĖļīĆņØś ņĮśĒāØĒŖĖļĀīņ”łņŚÉņä£ ĻĘĀņØś ļČĆņ░®ņØ┤ Ļ░ÉņåīļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņŚ░ņśź ņłś ļśÉĒĢ£ PBSņŚÉ ļ╣äĒĢ┤ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ļČĆņ░®ļÉ£ ĻĘĀņØś ņłśļź╝ ņ£ĀņØśĒĢśĻ▓ī Ļ░Éņåīņŗ£ņ╝░ņ£╝ļéś, ņāüņÜ®ĒÖöļÉ£ ļŗżļ¬®ņĀüņÜ®ņĢĪĻ│╝ ļ╣äĻĄÉņŗ£ņŚÉļŖö 1% ļ░Å 5%ņØś ņŚ░ņśź ņłś ļ¬©ļæÉņŚÉņä£ Ļ░£ņäĀļÉ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢĀ ņłś ņŚåņŚłļŗż. ņ”ē, ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉņä£ļŖö ĒĢŁĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłņ£╝ļéś ļŗżļ¬®ņĀüņÜ®ņĢĪĻ│╝ ļ╣äĻĄÉņŗ£ ņŚ░ņśź ņłśļŖö Ļ░£ņäĀļÉ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝Ļ░Ć ņŚåņŚłļŹś ņĀÉ, ĻĘĖļ”¼Ļ│Ā ņŚ░ņśź ņłśņŚÉņä£ Ļ░Ćņŗ£ņĢäļ®öļ░öņØś ļČĆņ░®ņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉśņŚłļŹś ņØ┤ņĀä ļ│┤Ļ│Ā[12]ļź╝ ĒåĄĒĢ┤ ņŚ░ņśźņØś ņ×æņÜ®ĻĖ░ņĀäņØĆ ņäĖĻĘĀņØś ĒĢĄņé░ ļ░Å ņäĖĒżļ¦ē ļō▒ņØś ĻĄ¼ņĪ░ņĀü ĒīīĻ┤┤ļ│┤ļŗżļŖö ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ņäĖĻĘĀņØś ļČĆņ░® ļŖźļĀźĻ│╝ ĻĘĖņŚÉ ļö░ļźĖ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä Ļ░Éņåīņŗ£ņ╝£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļź╝ ņØ╝ņ£╝Ēé© Ļ▓āņ£╝ļĪ£ ņČöņĖĪĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż.
ļīĆļČĆļČäņØś ļŗżļ¬®ņĀüņÜ®ņĢĪņØĆ polyhexamethylene biguanideņÖĆ ĒÅ┤ļ”¼ņ┐╝Ēä░ļŖä(polyquaternium)ņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ņ¢┤[41], Moon et al [42]ņŚÉ ļö░ļź┤ļ®┤ ĻĄŁļé┤ņŚÉņä£ ņāØņé░ļÉśļŖö ļīĆļČĆļČäņØś ļŗżļ¬®ņĀüņÜ®ņĢĪņØĆ Ļ┤æļ▓öņ£äĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ļŖö ņ׳ņ¦Ćļ¦ī, Ļ░Ćņŗ£ņĢäļ®öļ░öņŚÉ ļīĆĒĢ£ ņé┤ņČ® ĒÜ©Ļ│╝ļŖö ņŚåļŗżĻ│Ā ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ņŚÉ ņØśĒĢśļ®┤ ņĮśĒāØĒŖĖļĀīņ”łļĪ£ ņØĖĒĢ£ Ļ░Ćņŗ£ņĢäļ®öļ░öĻ░üļ¦ēņŚ╝ņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ĻĖ░ņĪ┤ņØś ļŗżļ¬®ņĀüņÜ®ņĢĪņŚÉņä£ ĒĢŁņĢäļ®öļ░ö ĒÜ©Ļ│╝ļź╝ ņ”Øņ¦äņŗ£Ēé©, ļ│┤ļŗż ĒÜ©ņ£©ņĀüņØĖ ļ│┤ņĪ┤ņĢĪņØś Ļ░£ļ░£ņØ┤ ĒĢäņÜöĒĢśļ®░, ņŚ░ņśźņØ┤ ņāłļĪ£ņÜ┤ ļ░®ļ▓ĢņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉ£ļŗż. ņ”ē, ļŗżļ¬®ņĀüņÜ®ņĢĪņŚÉ ņŚ░ņśźņłśļź╝ ņ▓©Ļ░ĆĒĢĀ Ļ▓ĮņÜ░, ĻĖ░ņĪ┤ņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņÖĆ ļŹöļČłņ¢┤ Ļ░Ćņŗ£ņĢäļ®öļ░öņŚÉ ļīĆĒĢ£ ņé┤ņČ® ĒÜ©Ļ│╝ļź╝ ļåÆņŚ¼ Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØä ļé«ņČöļŖö ļŹ░ ļŹöņÜ▒ ņ£ĀņÜ®ĒĢśĻ▓ī ņé¼ņÜ®ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ņŚ░ņśźņØś ĒĢŁĻĘĀ ĒÜ©Ļ│╝ ņżæ ņŚ░ņśźņØ┤ ņĮśĒāØĒŖĖļĀīņ”łņŚÉ ņāØļ¼╝ļ¦ē ĒśĢņä▒ņØä Ļ░Éņåīņŗ£ĒéżļŖö ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ ņĀĢļ¤ēņĀü ļČäņäØņØä ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░, ĒÜ©ņ£©ņĀüņØĖ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ ņŗ£Ļ░äņŚÉ ļīĆĒĢ┤ ļČäņäØĒĢśņ¦Ć ļ¬╗Ē¢łļŗżļŖö ņĀÉņØ┤ļŗż. ņČöĒøä Ēü¼ļ”¼ņŖżĒäĖ ļ░öņØ┤ņś¼ļĀø ņŚ╝ņāē, Ļ│Ąņ┤łņĀÉ ļĀłņØ┤ņĀĆ ņĪ░ņé¼ Ēśäļ»ĖĻ▓Į(confocal laser scanning microscopy) ļō▒ņØś ļŗżņ¢æĒĢ£ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼[43], ņāØļ¼╝ļ¦ēņŚÉ ļīĆĒĢ£ ņĀĢļ¤ēĒÖö ļ░Å ĒÜ©ņ£©ņĀüņØĖ ņĀæņ┤ē ņŗ£Ļ░äņŚÉ ļīĆĒĢ£ ļČäņäØņØ┤ ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ļśÉĒĢ£ ņĮśĒāØĒŖĖļĀīņ”ł Ļ┤Ćļ”¼ņÜ®ĒÆłņØś ņ▓©Ļ░Ćļ¼╝ņ¦łļĪ£ ņŚ░ņśźņØä ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņ×ÉņØś Ļ░üļ¦ē ļ░Å Ļ▓░ļ¦ē ņäĖĒżņŚÉ ļīĆĒĢ£ ņĢłņĀĢņä▒ņØ┤ ņĢäņ¦ü ĒÅēĻ░ĆļÉśņ¦Ć ļ¬╗ĒĢśņśĆļŗżļŖö ņĀÉļÅä ņČöĒøä ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņé¼ĒĢŁņØ┤ ļÉĀ Ļ▓āņØ┤ļ®░, ņØ┤ļ¤¼ĒĢ£ ņĢłņĀĢņä▒ņŚÉ ļīĆĒĢ£ ĒÅēĻ░Ćļź╝ ļ░öĒāĢņ£╝ļĪ£ ņŚ░ņśźņØś ļåŹļÅäļź╝ ļÅģņä▒ņØä ņØ╝ņ£╝Ēéżņ¦Ć ņĢŖļŖö ņłśņżĆĻ╣īņ¦Ć ļŗżņ¢æĒĢśĻ▓ī ļåÆņŚ¼ņä£ ĒÜ©ņ£©ņĀüņØĖ ļåŹļÅäņŚÉ ļīĆĒĢ┤ ļČäņäØļÅä ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņĮśĒāØĒŖĖļĀīņ”ł ņé¼ņÜ®ņ×ÉņŚÉņä£ ļ░£ņāØĒĢśļŖö Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØä Ļ░Éņåīņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņŚÉ ņŚ░ņśźņØä ņ▓©Ļ░ĆĒĢĀ Ļ▓ĮņÜ░ ĻĖ░ņĪ┤ņØś ņĀ£ĒÆłļōżļ│┤ļŗż ĒÖ®ņāēĒżļÅäņĢīĻĘĀ ļ░Å ļģ╣ļåŹĻĘĀņŚÉ ļīĆĒĢ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ ļ░Å Ļ░Ćņŗ£ņĢäļ®öļ░öņŚÉ ļīĆĒĢ£ ņé┤ņČ® ĒÜ©Ļ│╝ļź╝ ņ”ØļīĆņŗ£Ēé¼ļ┐É ņĢäļŗłļØ╝, ļŗżļ¬®ņĀüņÜ®ņĢĪņŚÉ ņŚ░ņśźņØä ņ▓©Ļ░ĆĒĢĀ Ļ▓ĮņÜ░ Ļ░Ćņŗ£ņĢäļ®öļ░öņŚÉ ļīĆĒĢ£ ņé┤ņČ® ĒÜ©Ļ│╝Ļ╣īņ¦Ć ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņŚ░ņśźņØ┤ ņ▓©Ļ░ĆļÉ£ ņĮśĒāØĒŖĖļĀīņ”ł ļ│┤Ļ┤ĆņÜ®ĻĖ░ņÖĆ ļŗżļ¬®ņĀüņÜ®ņĢĪņØ┤ ņé¼ņÜ®ļÉ£ļŗżļ®┤, Ēśäņ×¼ļ│┤ļŗż Ļ░£ņäĀļÉ£ ĒĢŁĻĘĀ ĒÜ©Ļ│╝ņÖĆ ņé┤ņČ® ĒÜ©Ļ│╝ļĪ£ Ļ░ÉņŚ╝Ļ░üļ¦ēņŚ╝ņØś ļ░£ņāØņØä ļé«ņČöļŖö ļŹ░ ļÅäņøĆņØä ņżä ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
NOTES
This article has been supported by the National Research Foundation of Korea (Grant No. NRF-2017R1D1A1B03032153).
Figure┬Ā1.
Representative photographs of contact lens storage cases. (A) Case shows a conventional contact lens storage case and (B) case shows a nephrite-containing contact lens storage case.

Figure┬Ā2.
Representative photographs of bacterial colonies on Luria-Bertani agar plate. The number of Staphylococcus aureus colonies was significantly reduced in contact lens (CL) storage cases containing 5% nephrite (B) compared with conventional CL storage cases (A).

Figure┬Ā3.
Number of Staphylococcus aureus (S. aureus) on contact lens (CL) storage cases. CL storage cases containing 5% nephrite significantly reduced the numbers of S. aureus compared with conventional CL storage cases. Using a unpaired t-test to compare the difference between the two groups.
Figure┬Ā4.
Representative photographs of bacterial colonies on Luria-Bertani agar plate. These pictures (A-F) show the decreased number of Staphylococcus aureus colonies in all generations of silicone hydrogel contact lenses stored at contact lens (CL) storage cases containing 5% nephrite.

Figure┬Ā5.
The number of Staphylococcus aureus (S. aureus) adhering to contact lenses. The number of S. aureus adhering to contact lenses in contact lens storage case containing 5% nephrite was significantly reduced compared with conventional contact lens storage case regardless of the generation of silicone hydrogel contact lenses. Using a unpaired t-test to compare the difference between the two groups.
Figure┬Ā6.
Relationship of the number of Staphylococcus aureus colonies among contact lenses treated with multipurpose solution, phosphate buffer saline (PBS) and 1% and 5% nephrite solutions. Although nephrite solutions showed a lot of colonies compared with optifree solution regardless of the generation of silicone hydrogel contact lenses, they significantly reduced the number of colonies compared with PBS. Using a unpaired t-test to compare the difference between the groups.
REFERENCES
1) Buehler PO, Schein OD, Stamler JF, et al. The increased risk of ulcerative keratitis among disposable soft contact lens users. Arch Ophthalmol 1992;110:1555-8.


2) Poggio EC, Glynn RJ, Schein OD, et al. The incidence of ulcerative keratitis among users of daily-wear and extended wear soft contact lenses. N Engl J Med 1989;321:779-83.


3) Hahn YH, Hahn TW, Choi SH, et al. Epidemiology of infectious keratitis [I] a multi-center study. J Korean Ophthalmol Soc 1998;39:1633-51.
4) Kim MR, Lee SB. Clinical and microbiological analysis of gram-positive bacterial keratitis, a 15-year review. J Korean Ophthalmol Soc 2014;55:1432-44.

5) Hawser SP, Bouchillon SK, Hoban DJ, et al. Rising incidence of Staphylococcus aureus with reduced susceptibility to vancomycin and susceptibility to antibiotics: a global analysis 2004-2009. Int J Antimicrob Agents 2011;37:219-24.


6) Chang VS, Dhaliwal DK, Raju L, Kowalski RP. Antibiotic resistance in the treatment of Staphylococcus aureus keratitis: a 20-year review. Cornea 2015;34:698-703.



7) Weisbarth RE, Gabriel MM, George M, et al. Creating antimicrobial surfaces and materials for contact lenses and lens cases. Eye Contact Lens 2007 33(6 Pt 2):426-9. discussion 434.


8) Dantam J, Zhu H, Stapleton F. Biocidal efficacy of silver-impregnated contact lens storage cases in vitro. Invest Ophthalmol Vis Sci 2011;52:51-7.


9) Datta A, Willcox M, Stapleton F. In vitro antimicrobial efficacy of silver lens cases used with a multipurpose disinfecting solution. Transl Vis Sci Technol 2019;8:52.



10) Tran PL, Huynh E, Pham P, et al. Organoselenium polymer inhibits biofilm formation in polypropylene contact lens case material. Eye Contact Lens 2017;43:110-5.


11) Lee SM, Jung JW, Lee DH, et al. Anti-pseudomonal effect of a nephrite-containing contact lens storage case. J Korean Ophthalmol Soc 2018;59:724-9.

12) Jung JW, Lee JH, Park SH, et al. Amoebicidal effect of nephrite-containing contact lens storage case. J Korean Ophthalmol Soc 2017;58:509-15.

13) Korean External Eye Disease Society. Cornea, 3rd ed. Seoul: Ilchokak, 2013;132-3.
14) Hart DE, Reindel W, Proskin HM, Mowrey-McKee MF. Microbial contamination of hydrophilic contact lenses: quantitation and identification of microorganisms associated with contact lenses while on the eye. Optom Vis Sci 1993;70:185-91.


15) Schultz CL, Pezzutti MR, Silor D, White R. Bacterial adhesion measurements on soft contact lenses using a Modified Vortex Device and a Modified Robbins Device. J Ind Microbiol 1995;15:243-7.



16) Dutta D, Willcox MD. A laboratory assessment of factors that affect bacterial adhesion to contact lenses. Biology (Basel) 2013;2:1268-81.



17) Liesegang TJ. Contact lens-related microbial keratitis: Part I: Epidemiology. Cornea 1997;16:125-31.


18) Bennett L, Hsu HY, Tai S, et al. Contact lens versus non-contact lens-related corneal ulcers at an academic center. Eye Contact Lens 2019;45:301-5.


19) Asbell P, Stenson S. Ulcerative keratitis. Survey of 30 years' laboratory experience. Arch Ophthalmol 1982;100:77-80.


20) Lim SH, Lee SB. Analysis of inpatients with bacterial keratitis over a 12-year period: pathogenic organisms and antibiotic resistance. J Korean Ophthalmol Soc 2012;53:372-84.

21) Bruce AS, Brennan NA. Corneal pathophysiology with contact lens wear. Surv Ophthalmol 1990;35:25-58.


22) Stern GA. Contact lens associated bacterial keratitis: past, present, and future. CLAO J 1998;24:52-6.

23) Davies D. Understanding biofilm resistance to antibacterial agents. Nat Rev Drug Discov 2003;2:114-22.



24) McLaughlin-Borlace L, Stapleton F, Matheson M, Dart JK. Bacterial biofilm on contact lenses and lens storage cases in wearers with microbial keratitis. J Appl Microbiol 1998;84:827-38.


25) Vermeltfoort PBJ, Hooymans JMM, Busscher HJ, van der Mei HC. Bacterial transmission from lens storage cases to contact lenses-effects of lens care solutions and silver impregnation of cases. J Biomed Mater Res B Appl Biomater 2008;87:237-43.


26) Larkin DF, Kilvington S, Easty DL. Contamination of contact lens storage cases by Acanthamoeba and bacteria. Br J Ophthalmol 1990;74:133-5.



27) Szczotka-Flynn LB, Imamura Y, Chandra J, et al. Increased resistance of contact lens related bacterial biofilms to antimicrobial activity of soft contact lens care solutions. Cornea 2014;28:918-26.

28) Balazs DJ, Triandafillu K, Wood P, et al. Inhibition of bacterial adhesion on PVC endotracheal tubes by RF-oxygen glow discharge, sodium hydroxide and silver nitrate treatments. Biomaterials 2004;25:2139-51.


29) Gurunathan S, Han JW, Kwon DN, Kim JH. Enhanced antibacterial and anti-biofilm activities of silver nanoparticles against gram-negative and gram-positive bacteria. Nanoscale Res Lett 2014;9:373.




30) Taheri S, Cavallaro A, Christo SN, et al. Substrate independent silver nanoparticle based antibacterial coatings. Biomaterials 2014;35:4601-9.


31) Stobie N, Duffy B, McCormack DE, et al. Prevention of Staphylococcus epidermidis biofilm formation using a low-temperature processed silver-doped phenyltriethoxysilane sol-gel coating. Biomaterials 2008;29:963-9.


32) Dallas P, Sharma VK, Zboril R. Silver polymeric nanocomposites as advanced antimicrobial agents: classification, synthetic paths, applications, and perspectives. Adv Colloid Interface Sci 2011;166:119-35.


33) Abu-youssef MAM, Soliman SM, Langer V, et al. Synthesis, crystal structure, quantum chemical calculations, DNA interactions, and antimicrobial activity of [Ag(2-amino-3-methylpyridine)(2)] NO(3) and [Ag(pyridine-2-carboxaldoxime)NO(3)]. Inorg Chem 2010;49:9788-97.


34) Dias HVR, Batdorf KH, Fianchini M, et al. Antimicrobial properties of highly fluorinated silver(I) tris(pyrazolyl)borates. J Inorg Biochem 2006;100:158-60.


35) Cavicchioli M, Massabni AC, Heinrich TA, et al. Pt(II) and Ag(I) complexes with acesulfame: crystal structure and a study of their antitumoral, antimicrobial and antiviral activities. J Inorg Biochem 2010;104:533-40.


36) Ramstedt M, Cheng N, Azzaroni O, et al. Synthesis and characterization of poly(3-sulfopropylmethacrylate) brushes for potential antibacterial applications. Langmuir 2007;23:3314-21.


37) Sambhy V, MacBride MM, Peterson BR, Ayusman S. Silver bromide nanoparticle/polymer composites: dual action tunable antimicrobial materials. J Am Chem Soc 2006;128:9798-808.


38) Mathews SM, Spallholz JE, Grimson MJ, et al. Prevention of bacterial colonization of contact lenses with covalently attached selenium and effects on the rabbit cornea. Cornea 2006;25:806-14.


39) Yeom MJ, Choi BH, Han DO, et al. In vitro inhibition of proinflammatory mediator mRNA expression by nephrite in lipopolysaccharide-induced mouse macrophage cells. J Physiol & Pathol Korean Med 2004;18:1622-7.
40) Han DO, Choi BH, Lee HJ, et al. In vivo studies on anti-inflammatory activity of nephrite. J Physiol & Pathol Korean Med 2005;19:977-81.
41) Santodomingo-Rubido J, Mori O, Kawaminami S. Cytotoxicity and antimicrobial activity of six multipurpose soft contact lens disinfecting solutions. Ophthalmic Physiol Opt 2006;26:476-82.


-
METRICS

- Related articles
-
Anti-pseudomonal Effect of a Nephrite-containing Contact Lens Storage Case.2018 August;59(8)
Amoebicidal Effect of Nephrite-containing Contact Lens Storage Case.2017 May;58(5)
The Analysis of Management of Keratoconus Using Contact Lens in Koreans.2004 May;45(5)
Clinical Features of Corneal Erosion in Contact Lens Wearers.2002 August;43(8)
The Effect of Mydriatics and Miotics Using Soft Contact Lenses.1972 September;13(3)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



