미숙아망막병증(retinopathy of prematurity, ROP)은 개발도상국 및 선진국에서 소아 실명의 주된 원인이다.
1 미숙아는 출생 후 산소 분압의 증가로 혈관내피성장인자(vascular endothelial growth factor, VEGF)의 발현이 억제되고 모체로부터 인슐린형성인자-1 (insulin-like growth factor-1, IGF-1)의 전달이 차단되어 망막혈관 성장이 멈추는 혈관폐쇄 단계를 경험할 수 있다.
2 재태연령이 어릴수록 무혈관망막이 더 넓고 이른 IGF-1 농도의 감소로 망막혈관 성장이 조기에 중단된다. 혈관증식 단계로 접어들면, 저산소성 망막이 VEGF의 발현을 자극해 신생혈관이 출현하고 증가하는 IGF-1에 의해 신생혈관이 증식한다.
2 이로 인해 신생혈관의 지속적 증식으로 인한 견인과 망막박리 등의 합병증이 동반될 수 있다. 미숙아망막병증은 냉동요법, 레이저광응고술 및 유리체절제술로 치료하였지만 최근에는 항혈관내피형성인자(anti-VEGF)의 유리체 내 주사도 첫 치료로 시행하고 있다.
3
BEAT-ROP 연구(the Bevacizumab Eliminates the Angiogenic Threat of Retinopathy of Prematurity study)는 유리체 내 베바시주맙(Avastin
®, Genentech, South San Francisco, CA, USA) 주사로 처음 치료 후 재발률이 낮아 미숙아망막병증에서 항혈관내피형성인자 주사 치료의 가능성을 열어주었다.
4 RAINBOW 연구(RAnibizumab Compared with laser therapy for the treatment of INfants BOrn prematurely With retinopathy of prematurity)에서 유리체 내 라니비주맙(Lucentis
®, Novartis Pharmaceuticals Corporation, East Hanover, NJ, USA) 첫 주사 치료는 레이저광응고술과 대등한 치료 성공률과 안정성을 보여주었다.
5 2021년 1월 대한민국 식품의약품안전처는 미숙아망막병증의 항혈관내피형성인자 치료제로 유리체 내 라니비주맙 0.2 mg/0.02 mL 투여 치료를 승인하였다.
6 하지만 미숙아망막병증의 치료로 항혈관내피형성인자를 주사하면 재활성화(reactivation)의 가능성을 염두하며 주사 이후 지속적인 경과 관찰이 필요하였다.
7 RAINBOW 연구에서도 레이저 치료군은 19%만 재치료(retreatment)가 필요하였음에 비해 라니비주맙 주사군은 31%에서 재치료가 필요하였다.
5 식품의약품안전처 또한 라니비주맙 재치료 기준으로 질병 활성의 징후가 나타날 경우 이전 투여 최소 4주 후에 추가 투여할 수 있음을 명시하였다.
6
미숙아망막병증 국제 위원회(International Committee for the Classification of Retinopathy of Prematurity, ICROP) 제3판에서 미숙아망막병증 재활성화는 미숙아망막병증의 치료 이후 급성기 병변(acute phase features)의 재출현(recurrence)으로 망막 병변이나 혈관 변화가 발생하였을 때로 정의한다.
8 재활성화는 자발적 퇴행이나 레이저광응고술 이후보다 항혈관내피형성인자 주사 이후 더 자주 나타난다.
8 주로 월경후연령 37-60주 사이에 재활성화되며 그 시점은 항혈관내피형성인자의 종류, 용량 및 횟수에 영향을 받을 수 있다.
8 국내에서는 39안의 1형 미숙아망막병증을 대상으로 한 라니비주맙 치료 후 13%에서 재활성화가 보고되었다.
9 반면 해외의 다른 연구에서 재활성화 비율은 60%까지 보고되었고, 첫 주사 전 넓은 신생혈관의 분포와 주사 후 지속적인 산소 치료가 재활성화와 관련된 인자였다.
10 하지만 미숙아망막병증이 재활성화되었다고 하더라도 모두 재치료를 하지 않으며, 재치료의 기준에 대한 통일된 논의가 없는 실정이다. 또한 미숙아망막병증의 첫 치료로 유리체 내 라니비주맙을 주사한 후 재치료에 관여하는 주사 전후 인자들에 대해 조사한 보고는 드물다. 이에 저자들은 1형 미숙아망막병증의 환아들의 첫 치료로 유리체 내 라니비주맙을 주사한 환아들의 재치료 비율과 재치료 가능성을 증가시키는 인자들을 조사해 보고하고자 한다.
대상과 방법
2013년 1월부터 2021년 12월까지 본원 산부인과에서 출생 후 신생아 중환자실에 입원한 미숙아들 중 미숙아망막병증 선별 안저검사에서 1형 미숙아망막병증으로 진단된 환아들을 대상으로 하였다. 이들 중 첫 치료로 라니비주맙을 유리체 내 주사 후 6개월 이상 경과 관찰이 가능하였던 환아들의 의무기록을 후향적으로 조사하였다. 라니비주맙 주사 치료는 각막혼탁 및 불량한 산동 상태, 소아과 전문의의 판단에 의한 전신마취 혹은 진정제 투여 후 생체 징후의 악화가 예상되는 경우, 광응고술 후 시야 감소와 고도근시 진행 등의 합병증에 대한 보호자의 우려로 광응고술을 거부한 경우 시행하였다. 첫 주사 치료 이전 레이저광응고술 혹은 유리체 내 베바시주맙 주사로 치료하였거나 유리체 내 주사와 동시에 레이저광응고술로 치료한 환아는 제외하였다. 본 연구는 헬싱키선언을 준수하였고 본원 생명윤리위원회의 승인(IRB No. 05-2022-228) 후 시행하였다.
Phenylephrine hydrochloride 4 mg (5 mg/mL)과 tropicamide 4 mg (5 mg/mL) 복합 제제(Tropherine, Hanmi Pharm., Seoul, Korea)를 10분 간격으로 6회 점안 및 0.5% proparacaine hydrochloride (Paracaine, Hanmi Pharm.) 1회 점안 후 도상검안경으로 시신경유두와 황반을 포함한 후극부 안저검사를 하였다. 공막누르개를 이용하여 망막거상연까지 관찰 후 미숙아망막병증 국제 위원회(ICROP)의 급성기 분류를 참고해 추가 징후(plus sign), 지역(zone) 및 급성기 단계(stages of acute-phase disease)를 각각 기록하였다.
11 Aggressive posterior ROP (AP-ROP)는 2005년도 ICROP 기준에 따라 zone I 혹은 II에서 급속도로 진행하는 미숙아망막병증으로 정의하였다.
11 Early Treatment for ROP (ET-ROP)의 연구 결과에 따라 전문턱(prethreshold) 기준에서 1형 미숙아망막병증으로 분류된 환아들에게 유리체 내 라니비주맙을 주사하였다.
12 유리체 내 주사는 31게이지 8 mm 바늘이 장착된 멸균 주사기(BD Ultra-Fine Short Needle Insulin Syringe, Becton-Dickinson and Company, Franklin Lakes, NJ, USA)를 사용하였다. 소아용 개검기 삽입해 눈꺼풀을 벌리고 5% 포비돈 요오드 용액으로 결막을 두 번 세척하였다. 포셉으로 결막을 붙잡아 안구를 고정 후 하이측 혹은 하비측 윤부로부터 1.5 mm 떨어진 결막에서 후극부를 향해 주사 바늘을 진입한 후 라니비주맙 0.2 mL를 유리체 내로 천천히 주입하였다. 주사 부위를 면봉으로 압박하면서 지혈과 동시에 도상검안경을 통한 안저검사로 중심망막동맥을 관찰하여 관류 이상을 확인하였다. 이후 세극등검사를 통해 각막 및 수정체 손상 유무를 확인하였다.
주사 후 다음 날 안저검사를 통해 추가 징후가 소실될 때까지 이틀 간격으로 검사하고 추가 징후와 급성기 단계의 변화를 기록하였다. 추가 징후가 소실 후 한 달은 일주일 간격으로 검사하였고 미숙아망막병증의 퇴행(involution)이 확인될 때까지 추적하였다. 치료 성공은 RAINBOW 연구의 기준처럼 첫 주사 후 최종 경과 관찰 시점까지 활동성 미숙아망막병증, 망막박리 및 황반편위와 같은 불량한 해부학적 상태 혹은 유리체절제술과 같은 다른 치료를 요하는 상태가 없을 때로 정의하였다.
5
재활성화는 ICROP 제3판의 권고에 따라 치료 이후 전추가(pre-plus) 혹은 추가 징후의 재출현, 망막 외 혈관(extraretinal vessel) 혹은 섬유혈관 능선(fibrovascular ridge)이 재발현하는 경우들에 해당하였다.
8 재치료는 1형 미숙아망막병증의 기준으로 다시 분류되었거나, zone III 영역까지 혈관이 성장한 경우라도 추가 징후를 동반한 stage 3 병변이 관찰된 재활성화 미숙아망막병증의 경우 시행하였다. 재치료 방법으로는 치료자의 임상적 결정에 따라 유리체 내 라니비주맙을 주사하거나 레이저광응고술을 하였다. 전신마취 후 레이저도상검안경(532 nm PUREPOINT
® Laser System of CONSTELLATION
® Vision System, Alcon Laboratories, Inc., Fort Worth, TX, USA)을 사용하고, 응고반의 간격을 0.5 응고반 직경 이내로 하여 재활성화된 망막부터 거상연까지 무혈관망막을 150-250 mW의 세기 및 150-300 milisec의 지속 기간으로 광응고하였다.
유리체 내 라니비주맙 첫 주사 후 재치료 없이 미숙아망막병증이 퇴화된 군을 단일 주사 치료군(single treatment group)으로, 반면 재치료가 필요하였던 눈을 재치료군(retreatment group)으로 정의 후 각 인자들의 차이를 조사하였다. 주사 전 인자로 성별, 주사안, 출생 재태연령, 출생체중, 극소저체중 유무, 다태임신 유무, 분만 방법, 1분 및 5분 Apgar 점수, 전신 질환 여부 및 종류, 첫 주사 전 산소 치료 기간, 주사 직전 미숙아망막병증의 급성기 분류 및 첫 주사를 시행한 월경후연령을 조사하였다. 주사 직후 인자로 첫 주사 후 추가 징후 및 급성기 단계 소실 기간, 퇴행 시점, 주사 후 산소 치료의 여부 및 기간, 재치료 유무 및 종류를 조사하였다. 주사 후 인자로 재치료 방법 및 안내염 발생, 유리체출혈, 황반편위, stage 4 혹은 5 진행, 치료 성공, 경과 관찰 이후 사망 유무를 조사하였다.
재치료군과 단일 주사 치료군의 주사 전 및 주사 직후 인자들의 차이를 비교하기 위해 연속 변수는 Mann-Whitney U 검정으로, 명목 변수는 chi-square 혹은 Fisher's exact 검정으로 분석하였다. 재치료 위험을 증가시키는 인자를 찾기 위해 주사 전 및 직후의 모든 인자들을 하나씩 독립변수로 지정 후 단변량 로지스틱 회귀(logistic regression)분석을 시행하여 유의한 수준의 변수들만 추출하였다. 이후 유의한 수준의 변수들로만 다변량 로지스틱 회귀 모델을 구성하여 재치료의 위험에 미치는 인자들을 재평가하였다. 통계 분석은 SPSS for Windows 23.0 (SPSS Inc, Chicago, IL, USA) 프로그램을 사용하였고 p값이 0.05 미만인 경우 통계적으로 유의하다고 정의하였다.
결 과
본원 신생아중환자실에 입원한 1형 미숙아망막병증 환아들 중 첫 치료로 유리체 내 라니비주맙을 주사한 환아는 총 44명으로 이들의 44안이 조사 대상으로 선정되었다. 환아들의 평균 재태연령과 출생체중은 각각 27.8주 및 1,046.6 g이었다(
Table 1). 극소저체중 환아는 23명(52.3%)이었고, 21명(47.7%)은 다태임신 및 36명(81.8%)은 정상 질식분만으로 출생하였다. 출생 1분 Apgar 평균 점수는 4.1점, 5분 Apgar 평균 점수는 6.4점이었다. 출생 시점 36명(81.8%)에서 전신 질환이 있었고 신생아 호흡곤란증후군 35명, 동맥관개존증 26명, 기관지폐형성이상 15명, 심방중격결손증 8명 및 신생아 괴사성장염 8명순으로 조사되었다. 주사 전 모든 환아에서 산소 치료 병력이 있었고 출생 후 첫 주사까지 평균 61.3일간 산소가 투여되었다. 모든 안에서 추가 징후가 존재하였고 stage 1은 2명(4.5%), stage 2는 25명(56.8%), stage 3는 17명(38.6%)이었다. Zone I 미숙아망막병증은 4명(9.1%)이었고 나머지 40명(90.9%)은 zone II 미숙아망막병증으로 진단되었다. AP-ROP 혹은 zone I 미숙아망막병증은 13안(29.5%)이었다. 첫 주사 시점의 월경후연령은 37.2 ± 2.3주로 첫 주사 후 평균 75.8주 동안 경과 관찰을 하였다. 21안(47.7%)에서 재치료가 필요하였다(
Fig. 1).
재치료군과 단일 주사 치료군의 주사 전 인자들을 비교한 결과, 재치료군은 단일 주사 치료군에 비해 이른 평균재태연령(26.7주 vs. 28.7주,
p=0.036), 더 낮은 평균 1분(3.4 vs. 4.7,
p=0.014) 및 5분(6.0 vs. 6.8,
p=0.029) Apgar 점수, 주사 전 더 넓은 사분면의 추가 징후(2.8 vs. 2.3사분면,
p=0.044)가 관찰되었다(
Table 2). 재치료군은 첫 주사 후 평균 추가 징후의 소실 기간이 6.9일로 단일 주사 치료군의 4.1일에 비해 길었다(
p=0.014) (
Table 3). 재치료군은 첫 주사 이후 퇴행 기간(18.0 vs. 12.5주,
p=0.003) 및 출생 후 퇴행 기간(27.7 vs. 21.6주,
p=0.014) 모두 단일 주사 치료군에 비해 길었다. 첫 주사 이후 재치료군의 산소 투여 기간은 평균 10.2주로 단일 주사 치료군의 3.6주에 비해 오랜 기간의 산소가 투여되었다(
p=0.001).
첫 재치료는 첫 주사 후 평균 8.9주에 시행되었고, 이는 월경후연령 45.4주에 해당하였다. 재치료 방법으로 16안(76.2%)에서 레이저광응고술을 하였고, 3안(14.3%)에서 이차 유리체 내 라니비주맙 주사를 하였으며, 2안(9.5%)은 이차 유리체 내 라니비주맙 주사와 동시에 레이저광응고술 병합 치료를 하였다. 4안(19.0%)에서 다시 재활성화로 인한 재치료가 필요하였으며 첫 주사 후 평균 12.0주에 시행되었고, 이는 월경후연령 49.1주에 해당하였다. 이차 재치료는 모두 레이저광응고술로 치료하였다. 모든 주사 이후 안내염은 합병되지 않았다. 재치료에도 불구하고 1안에서 stage 4a의 망막박리로 진행하여 공막돌륭술을 계획하였지만 환아는 폐동맥고혈압으로 사망하였다. 재치료군 3안에서 유리체출혈이 합병되었지만 모두 첫 주사 후 6개월 내 자연 흡수되었다. 또한 재치료군 1안에서 황반편위가 발생하였다. 첫 주사 이후 경과 관찰 시점이 지나 전신 질환으로 사망한 환아는 재치료군에서 4명(19.0%) 및 단일 주사 치료군에서 1명(4.3%)이었다(
Table 3).
1형 미숙아망막병증의 첫 치료로 유리체 내 라니비주맙 후 재치료 확률을 증가시키는 단일인자들은 이른 재태연령, 낮은 1분 및 낮은 5분 Apgar 점수, 첫 주사 후 늦은 추가 징후 소실일, 첫 주사 후 지속되는 산소 공급으로 조사되었다(
Table 4). 이 다섯 변수들을 독립변수로 정의하고 재치료 유무를 종속변수로 지정한 다변량 로지스틱 회귀 모델 분석 결과, 재치료 위험은 오직 1분 Apgar 점수가 낮을수록(odds ratio [OR]=2.04; 95% confidence interval [CI]=1.19-3.49,
p=0.010) 첫 주사 후 추가 징후 소실이 늦을수록(OR=1.44; 95% CI=1.08-1.92,
p=0.013) 증가하였다.
고 찰
전 세계적으로 조산아는 증가하고 있으며, 조산 합병증을 더 잘 치료할 수 있게 됨에 따라 미숙아망막병증의 위험에 노출되는 환아의 수도 증가하고 있다.
13 미숙아망막병증의 검진과 의료 수준은 각 나라와 지역마다 다르기 때문에 환경적 요인이 미숙아망막병증의 발생률과 치료 후 재발률에 크게 영향을 미칠 수 있다.
14 이번 연구의 조사 대상은 3차 병원의 신생아 중환자실에 입원한 환아들로 극소저체중아 비율이 약 반수로 높았고 평균 출생 교정 주수는 28주로 낮았다. 특히 약 30%의 환아는 나쁜 예후를 나타내고 재발 위험이 높은 zone I 미숙아망막병증 혹은 AP-ROP였다.
8 이러한 환아들을 대상으로 한 이번 조사에서 1형 미숙아망막병증의 첫 치료로 유리체 내 0.2 mg 라니비주맙을 주사한 환아의 약 반수에서 평균 2개월 후 재치료가 필요하였다. 유리체 내 라니비주맙 주사는 높은 재치료율에 불구하고 재치료 후 대부분의 환아(95.5%)에서 치료 성공에 도달해 높은 치료 성공률을 보였다.
미숙아망막병증의 치료에 있어 유리체 내 항혈관내피형성인자 주사는 레이저광응고술에 비해 매체혼탁 및 불충분한 산동으로 안저검사가 어려운 환아들에게도 치료할 수 있는 장점이 있다.
15 점안마취로 시술이 가능하고 주사 후 미숙아망막병증이 퇴행한다면 보다 넓은 시야를 유지할 수 있는 장점도 있다.
16,17 라니비주맙 허가 전 미숙아망막병증의 주사 치료제로 사용된 베바시주맙은 항체 내 불변 영역(constant domain)이 존재하여 전신 노출의 위험성이 높고 전신 순환 중 느리게 제거되어 신경학적 발달 결함의 위험을 증가시킬 것이란 우려가 제기되었다.
18 베바시주맙 주사는 유리체 내 수일 동안 오랜 기간 머무르기 때문에 재활성화 시점이 느리다는 보고가 있어 주사 후 장기간의 경과 관찰이 필요하였다.
19 레이저광응고술 단독에 비해 베바시주맙 주사 동시 치료군이 심각한 정신 운동 결함(psychomotor defects)의 동반이 더 높다는 보고도 있었다.
18 이러한 우려와 함께 베바시주맙은 미숙아망막병증의 치료에 허가된 약물이 아니었기 때문에 그간 미숙아망막병증의 치료는 레이저광응고술이 선호되는 경향이 있었다.
20
베바시주맙과 달리 라니비주맙은 항혈관내피형성인자의 재조합 항체 분절로 작은 분자량과 유리체 내 짧은 반감기의 특징을 보이며,
21 전신 혈관내피형성인자 농도를 변화시키지 않아 전신 노출의 가능성이 낮을 수 있다.
22 미숙아망막병증 환아에서 라니비주맙 주사 후 2년까지 신경학적 발달이 안정적임도 보고되었다.
23 특히 유리체 내 라니비주맙 주사는 zone I 미숙아망막병증과 24주 이하의 환아에서 레이저광응고술 단독 치료에 비해 불량한 해부학적 결과와 재발률이 낮았다.
5 반면 라니비주맙 주사는 베바시주맙에 비해 짧은 반감기로 인해 재활성화율이 높고 주사 6주 시점에 80% 이상에서 재활성화되었다는 보고도 있었다.
22 항혈관내피형성인자 유리체 내 주사 후 미숙아망막병증이 재활성화되어 치료 시기를 놓치면 치료 실패와 실명으로 귀결될 수 있다.
24 이는 평생을 저시력으로 지내야 하는 환아와 가족들에게 큰 상실감을 안겨주고 관련 의사들과 법적 분쟁으로 이어질 수 있다.
43명의 1형 미숙아망막병증을 대상으로 조사한 유리체 내 항혈관내피형성인자 주사 후 재활성화와 연관된 인자는 월경후연령 35주 이하의 주사 치료 및 AP-ROP였다.
25 하지만 약동학 특성이 다른 두 주사제를 사용한 결과를 혼용하였고 재치료가 아닌 재활성화의 위험성을 조사하여 이번 연구와는 다른 결과들이 도출되었다. 또한 이번 연구는 전 추가 징후나 stage 3의 재출현 시 재치료를 시행하지 않아 다른 연구들에 비해 재치료 기준이 다소 엄격하였다.
10,26 연구마다 다른 재치료 기준은 재치료율과 재치료에 영향을 미치는 인자들에 영향을 줄 수 있다. 국내의 다른 3차 병원에서 52안의 미숙아망막병증 환아에 대한 1차 치료로 라니비주맙 주사 후 재치료가 필요하였던 비율은 13.5%로 낮아 이번 연구 결과와 상이한 결과가 보고되었는데, 그들은 평균 출생체중이 1,257.7g으로 본 조사의 환아들보다 무거웠고 약 40%의 증례들이 추가 징후 전단계(pre-plus sign) 시점에 치료가 시작되었다.
26 이는 라니비주맙 1차 주사 후 재치료율이 대상 환아의 인구학적 특성과 치료 기준에 따라 크게 영향을 받을 수 있음을 시사한다. 본 연구 환아들과 유사한 1형 미숙아망막병증 환아 283안을 대상으로 한 라니비주맙 첫 치료에 관한 대규모 후향 연구는 약 반수에 이르는 152안에서 재치료가 필요하여 이번 연구와 유사한 결과가 도출되었다.
27 출생 조건이 양호하지 않은 미숙아망막병증 환아들에서 더 높은 비율로 재치료가 필요한 경향이 있어 첫 라니비주맙 주사 전 보호자에게 재치료 가능성에 대한 설명이 필요하다.
미숙아망막병증의 첫 치료로 라니비주맙을 주사한 다른 연구에서 재치료가 필요한 환아는 64%로 이번 결과보다 다소 높게 조사되었다.
10 그들 중 약 1/3의 환아는 zone I 미숙아망막병증으로 진단되어 본 연구와 유사하였지만, 그들은 재치료 기준을 stage 3가 출현하였을 때로 정의하여 우리 연구보다 완화된 재치료 기준을 적용하였다. 그들의 재치료에 영향을 미치는 인자는 주사 전 망막혈관신생 정도가 심하고 주사 후 산소 치료가 필요하였던 환아였다.
10 한편 그들은 주사 후 추가 징후의 소실 시점이나 미숙아망막병증의 소실 시점에 대해서는 조사하지 않았다. 우리 연구에서도 재치료군에서 더 넓은 사분면의 추가 징후 및 주사 후 더 오랜 산소 투여 기간이 확인되었고, 특히 후자는 단변량 로지스틱 회귀분석 결과 재치료군의 위험인자로 선택되었지만 주사 후 추가 징후의 소실 기간이 재치료를 예측할 수 있는 더 유의미한 인자로 선정되었다. 항혈관내피형성인자 주사 후 미숙아망막병증의 퇴행은 혈관의 정상화로 시작되며 빠르면 주사 후 다음 날부터 사흘 사이에 혈관이 정상화되는데 이는 수주가 소요되는 레이저광응고술 치료 후 퇴행에 비해 빠르다.
14 단일 치료군은 주사 이후 추가 징후의 소실은 평균 약 4일인 반면 재치료군은 추가 징후의 소실이 평균 일주일로 약 3일이 늦었다. 추가 징후의 소실이 하루 늦어질수록 재치료 가능성이 1.4배 증가하였던 통계 결과를 상기하면 주사 후 잦은 안저검사는 재치료 예측에 있어 중요하다.
Apgar 점수는 출생 후 신생아의 피부 색깔, 심박수, 호흡, 근육 긴장도, 자극에 대한 반응을 평가해 그 점수가 높을수록 신생아가 건강함을 의미한다.
28 미숙아망막병증의 발생과 진행에 관련된 위험인자로 5분 Apgar 점수가 6점 이하일 경우 미숙아망막병증의 진행이 많았다.
29 이번 연구에서 재치료군은 1분 Apgar 점수가 3점대로 낮았고 5분 Apgar 점수도 6점이었다. 특히 1분 Apgar 점수가 1점이 낮을수록 재치료 가능성을 약 두 배 증가시켰고, 출생체중, 재태연령, 산소 치료 여부 등 다른 어떠한 주사 전 인자들보다도 유의한 위험인자로 조사되었다. 따라서 1형 미숙아망막병증의 안저검사 전 Apgar 점수를 포함한 소아과 기록을 유심히 살펴야 한다.
이 연구는 소수의 환아를 대상으로 한 후향 연구로 인한 제한점이 존재한다. 특히 전신 상태에 대한 중복 조사로 인한 선택 편향을 막기 위해 더 미숙아망막병증이 심한 눈만 선택하였기 때문에 더 양호한 미숙아망막병증의 주사 치료 후 재치료와 관련된 인자는 본 연구 결과와 다를 수 있다. 장비의 부재로 주사 전후 형광안저촬영을 시행하지 못해 미숙아망막병증의 상태를 더 정확히 판정할 수 없었다. 라니비주맙의 허가 후에도 경제적 사정으로 주사 치료 대신 레이저광응고술 치료가 우선 시행된 미숙아망막병증의 환아들이 탈락되어 이로 인한 편향도 존재한다. 주사 전후 혈장 내 혈관내피성장인자의 농도를 조사하지 못해 주사가 전신 안정성에 미치는 영향을 정량적으로 평가하지 못하였다. 그럼에도 불구하고 3차 병원의 어린이 병원에서 소수의 소아과 전문의들에게 집중 치료를 받은 신생아들만을 대상으로 조사하여 소아과 치료의 교란 변수를 최소화하였다. 또한 주사 이후 안저 상태를 조사 변수에 추가하고 재치료 위험과 관련이 있음을 밝혀냄으로써 첫 주사 후 안저검사의 중요성에 대해 처음으로 보고하였다. 본 연구는 6개월 이상 경과 관찰이 가능한 환아를 대상으로 하였다. 하지만 최근 항혈관내피형성인자 주사 후 3년이 지난 시점에도 재활성화되어 재치료가 필요한 증례가 보고된 만큼,
30 단일 주사 치료한 미숙아망막병증 환아의 경우 충분한 기간 동안 안저검사가 필요하다.
결론적으로 유리체 내 라니비주맙 주사로 처음 치료한 1형 미숙아망막병증의 약 반에서 2개월 후 재치료가 필요할 수 있다. 낮은 1분 Apgar 점수와 첫 라니비주맙 주사 후 추가 징후 소실 지연은 재치료 가능성을 증가시킨다. 따라서 첫 주사 후 안저검사를 통해 추가 징후 소실 시간이 늦어진다면 안과 의료진은 보호자에게 재치료 가능성이 높음을 설명해야 한다. 이후 재치료 시점을 민감하게 파악하여 환아의 최대한의 시기능을 보존할 수 있도록 적절한 재치료가 이루어져야 한다.
Acknowledgments
This work was supported by clinical research grant from Pusan National University Hospital.
Figure 1.
A representative case of type 1 retinopathy of prematurity requiring retreatment after intravitreal ranibizumab injection as the first treatment. At 35+2 weeks of postmenstrual age, a prematurity infant presented more severe type 1 retinopathy of prematurity (ROP) in the right eye. This infant was born at 23+5 weeks of gestational age and weighed 560 g. Extraretinal fibrovascular proliferation (white arrows) corresponding to stage 3 ROP was evident from the zone I anterior region to the zone II posterior region (A). An increase in tortuosity of the retinal arteries and accompanying retinal venous congestion were detected as the plus disease (B, yellow arrows). On the same day, the infant experienced the ranibizumab injection. After 7 days of the first injection, extraretinal fibrovascular proliferation was alleviated to stage 1 (C), and the plus disease finally disappeared, but the infant was classified as a retreatment group. (D). Nine weeks after the first injection, the ridge (E, white asterisks) and pre-plus disease (F, blue arrows) appeared. After 12 weeks of initial treatment, laser photocoagulation was performed because plus disease reappeared.
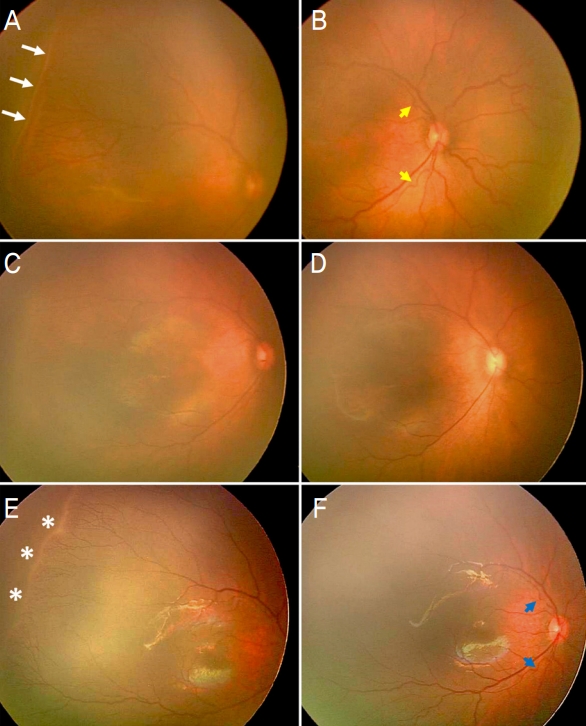
Table 1.
Demographics of type 1 ROP infants who injected intravitreal ranibizumab 0.2 mg as the first treatment
|
Factors |
Values |
|
Treated eyes |
44 |
|
Male/female |
20 (45.5)/24 (54.5) |
|
Right/left |
22 (50.0)/22 (50.0) |
|
Gestational age (weeks) |
27.8 ± 3.0 |
|
Birth weight (g) |
1,046.6 ± 405.2 |
|
ELBWI |
23 (52.3) |
|
Multiple birth/single birth |
21 (47.7)/23 (52.3) |
|
NSVD/C-Sec |
36 (81.8)/8 (18.2) |
|
Apgar score at 1-minute |
4.1 ± 1.6 |
|
Apgar score at 5-minute |
6.4 ± 1.2 |
|
Neonatal complications |
36 (81.8) |
|
Respiratory distress syndrome |
35 (79.5) |
|
Patent ductus arteriosus |
26 (59.1) |
|
Atrial septal defect |
8 (18.2) |
|
Bronchopulmonary dysplasia |
15 (34.1) |
|
Necrotizing enterocolitis |
8 (18.2) |
|
O2 supply before the first injection |
44 (100.0) |
|
Period on O2 supply before the first injection (days) |
61.3 ± 28.9 |
|
Classification of ROP |
|
|
Stage of ROP |
|
|
Stage 1 |
2 (4.5) |
|
Stage 2 |
25 (56.8) |
|
Stage 3 |
17 (38.6) |
|
Zone of ROP |
|
|
Zone I |
4 (9.1) |
|
Zone II |
40 (90.9) |
|
Plus disease |
44 (100.0) |
|
AP-ROP or zone I ROP |
13 (29.5) |
|
PMA of the ranibizumab injection (weeks) |
37.2 ± 2.3 |
|
Follow-up period after the injection (weeks) |
75.8 ± 75.2 |
|
Retreatment/single treatment |
21 (47.7)/23 (52.3) |
Table 2.
Difference between retreatment group and ranibizumab single treatment group before the first ranibizumab injection
|
Factors |
Retreatment group (n = 21) |
Single treatment group (n = 23) |
p-value |
|
Male/female |
11 (52.4)/10 (47.6) |
9 (39.1)/14 (60.9) |
0.131*
|
|
Right/left |
13 (61.9)/8 (38.1) |
9 (39.1)/14 (60.9) |
0.377*
|
|
Gestational age (weeks) |
26.7 ± 2.4 |
28.7 ± 3.2 |
0.036†,§
|
|
Birth weight (g) |
929.0 ± 366.4 |
1,153.9 ± 425.7 |
0.074†
|
|
ELBWI |
14 (66.7) |
9 (39.1) |
0.068*
|
|
Multiple birth/single birth |
7 (33.3)/14 (66.7) |
14 (60.9)/9 (39.1) |
0.068*
|
|
NSVD/C-Sec |
15 (71.4)/6 (28.6) |
21 (91.3)/2 (8.7) |
0.126*
|
|
Apgar score at 1-minute |
3.4 ± 1.6 |
4.7 ± 1.3 |
0.014†,§
|
|
Apgar score at 5-minute |
6.0 ± 1.2 |
6.8 ± 1.1 |
0.029†,§
|
|
Neonatal complications |
19 (90.5) |
17 (73.9) |
0.245‡
|
|
Respiratory distress syndrome |
17 (81.0) |
18 (78.3) |
1.000‡
|
|
Patent ductus arteriosus |
13 (61.9) |
13 (56.5) |
0.718*
|
|
Atrial septal defect |
5 (23.8) |
3 (13.0) |
0.448‡
|
|
Bronchopulmonary dysplasia |
9 (42.9) |
6 (26.1) |
0.342*
|
|
Necrotizing enterocolitis |
6 (28.6) |
2 (8.1) |
0.126‡
|
|
Period on O2 supply before the injection (days) |
66.2 ± 25.3 |
56.8 ± 32.2 |
0.557†
|
|
Classification of ROP |
|
|
|
|
Stage of ROP |
|
|
0.232‡
|
|
Stage 1 |
2 (9.5) |
0 (0.0) |
|
|
Stage 2 |
10 (47.6) |
15 (65.2) |
|
|
Stage 3 |
9 (47.7) |
8 (34.8) |
|
|
Zone of ROP |
|
|
0.335‡
|
|
Zone I |
3 (14.3) |
1 (4.3) |
|
|
Zone II |
18 (85.7) |
22 (95.7) |
|
|
Range of plus disease (quadrants) |
2.8 ± 1.0 |
2.3 ± 0.8 |
0.044†,§
|
|
APROP or zone I ROP |
9 (42.9) |
4 (17.4) |
0.064*
|
|
PMA of the ranibizumab injection (weeks) |
36.5 ± 2.2 |
37.8 ± 2.2 |
0.062†
|
Table 3.
Difference between retreatment group and ranibizumab single treatment group after the first ranibizumab injection
|
Factors |
Retreatment group (n = 21) |
Single treatment group (n = 23) |
p-value |
|
Disappearance of plus sign from the 1st injection (days) |
6.9 ± 3.9 |
4.1 ± 2.4 |
0.014*,†
|
|
Disappearance of acute stage from the 1st injection (days) |
12.5 ± 7.1 |
11.8 ± 10.2 |
0.210*
|
|
ROP regression from the 1st injection (weeks) |
18.0 ± 6.2 |
12.5 ± 4.3 |
0.003*,†
|
|
ROP regression from the birth (weeks) |
27.7 ± 7.3 |
21.6 ± 6.1 |
0.014*,†
|
|
O2 supply after the 1st injection |
18 (85.7) |
13 (56.5) |
0.034†,‡
|
|
Period on O2 supply after the 1st injection (weeks) |
10.2 ± 8.0 |
3.6 ± 9.1 |
0.001*,†
|
|
1st retreatment |
21 (100.0) |
- |
|
|
PMA of the 1st retreatment (weeks) |
45.4 ± 3.7 |
- |
|
|
Period on from the 1st injection to the 1st retreatment (weeks) |
8.9 ± 2.8 |
|
|
|
Photocoagulation |
16 (76.2) |
- |
|
|
2nd intravitreal ranibizumab injection |
3 (14.3) |
- |
|
|
Combined therapy |
2 (9.5) |
|
|
|
2nd Retreatment |
4 (19.0) |
- |
|
|
PMA of the 2nd retreatment (weeks) |
49.1 ± 21.6 |
- |
|
|
Period on from the 1st injection to the 2nd retreatment (weeks) |
12.0 ± 5.4 |
|
|
|
Photocoagulation |
4 (19.0) |
- |
|
|
3rd intravitreal ranibizumab injection |
0 (0.0) |
- |
|
|
Endophthalmitis |
0 (0.0) |
0 (0.0) |
1.000§
|
|
Stage 4 or 5 ROP |
1 (4.8) |
0 (0.0) |
0.477§
|
|
Vitreous hemorrhage |
3 (14.3) |
0 (0.0) |
0.100§
|
|
Macular ectopia |
1 (4.8) |
0 (0.0) |
0.477§
|
|
Treatment success |
19 (90.5) |
23 (100.0) |
0.222§
|
|
Death |
4 (19.0) |
1 (4.3) |
0.176§
|
Table 4.
Factors influencing retreatment of retinopathy of prematurity
|
Factors |
Univariate analysis
|
Multivariate analysis*
|
|
OR |
95% CI |
p-value |
OR |
95% CI |
p-value |
|
Gestational age (weeks) |
0.78 |
0.61-0.98 |
0.032†
|
- |
- |
- |
|
Lower Apgar score at 1-minute |
1.84 |
1.11-3.05 |
0.018†
|
2.04 |
1.19-3.49 |
0.010†
|
|
Lower Apgar score at 5-minute |
1.88 |
1.06-3.33 |
0.031†
|
- |
- |
- |
|
Disappearance of plus sign from the 1st injection (days) |
1.33 |
1.05-1.68 |
0.017†
|
1.44 |
1.08-1.92 |
0.013†
|
|
Period on O2 supply after the 1st injection (weeks) |
1.12 |
1.01-1.24 |
0.030†
|
- |
- |
- |
REFERENCES
3) Gilbert C, Malik ANJ, Nahar N, et al. Epidemiology of ROP update - Africa is the new frontier. Semin Perinatol 2019;43:317-22.


5) Stahl A, Lepore D, Fielder A, et al. Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (RAINBOW): an open-label randomised controlled trial. Lancet 2019;394:1551-9.


7) Chen TA, Shields RA, Bodnar ZH, et al. A spectrum of regression following intravitreal bevacizumab in retinopathy of prematurity. Am J Ophthalmol 2019;198:63-9.


8) Chiang MF, Quinn GE, Fielder AR, et al. International classification of retinopathy of prematurity, third edition. Ophthalmology 2021;128:e51-68.

9) Chung GC, Moon SH. Efficacy of primary intravitreal ranibizumab injection for treatment of type 1 retinopathy of prematurity. J Korean Ophthalmol Soc 2017;58:1080-6.


10) Lyu J, Zhang Q, Chen CL, et al. Recurrence of retinopathy of prematurity after intravitreal ranibizumab monotherapy: timing and risk factors. Invest Ophthalmol Vis Sci 2017;58:1719-25.


11) International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited. Arch Ophthalmol 2005;123:991-9.


12) Early Treatment for Retinopathy of Prematurity Cooperative Group. Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial. Arch Ophthalmol 2003;121:1684-94.


14) Choi JH, Löfqvist C, Hellström A, Heo H. Efficacy of the screening algorithm WINROP in a Korean population of preterm infants. JAMA Ophthalmol 2013;131:62-6.


15) Popovic MM, Nichani P, Muni RH, et al. Intravitreal antivascular endothelial growth factor injection versus laser photocoagulation for retinopathy of prematurity: a meta-analysis of 3,701 eyes. Surv Ophthalmol 2021;66:572-84.


16) Barry GP, Tauber KA, Greenberg S, et al. A comparison of respiratory outcomes after treating retinopathy of prematurity with laser photocoagulation or intravitreal bevacizumab. Ophthalmol Retina 2020;4:1202-8.


17) Tran KD, Cernichiaro-Espinosa LA, Berrocal AM. Management of retinopathy of prematurity-use of anti-VEGF therapy. Asia Pac J Ophthalmol (Phila) 2018;7:56-62.

19) Hu J, Blair MP, Shapiro MJ, et al. Reactivation of retinopathy of prematurity after bevacizumab injection. Arch Ophthalmol 2012;130:1000-6.


22) Wong RK, Hubschman S, Tsui I. Reactivation of retinopathy of prematurity after ranibizumab treatment. Retina 2015;35:675-80.


24) Jang SY, Choi KS, Lee SJ. Delayed-onset retinal detachment after an intravitreal injection of ranibizumab for zone 1 plus retinopathy of prematurity. J AAPOS 2010;14:457-9.


25) Iwahashi C, Utamura S, Kuniyoshi K, et al. Factors associated with reactivation after intravitreal bevacizumab or ranibizumab therapy in infants with retinopathy of prematurity. Retina 2021;41:2261-8.


27) Huang Q, Zhang Q, Fei P, et al. Ranibizumab injection as primary treatment in patients with retinopathy of prematurity: anatomic outcomes and influencing factors. Ophthalmology 2017;124:1156-64.


28) Calmes SH. Dr. Virginia Apgar and the Apgar score: how the Apgar score came to be. Anesth Analg 2015;120:1060-4.

29) Marinov VG, Koleva-Georgieva DN, Sivkova NP, Krasteva MB. The 5-minute Apgar score as a prognostic factor for development and progression of retinopathy of prematurity. Folia Med (Plovdiv) 2017;59:78-83.


30) Hajrasouliha AR, Garcia-Gonzales JM, Shapiro MJ, et al. Reactivation of retinopathy of prematurity three years after treatment with bevacizumab. Ophthalmic Surg Lasers Imaging Retina 2017;48:255-9.


Biography
박수환 / Su Hwan Park
양산부산대학교병원 안과
Department of Ophthalmology, Pusan National University Yangsan Hospital








 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



