 |
 |
| J Korean Ophthalmol Soc > Volume 64(6); 2023 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ļ¦īņä▒ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØä Ļ░Ćņ¦ä ĒÖśņ×ÉļōżņŚÉņä£ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēĒśłĻ┤Ć ļ│ĆĒÖöļź╝ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ©ņØ┤ļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
2020ļģä 12ņøöļČĆĒä░ 2021ļģä 10ņøöĻ╣īņ¦Ć Ļ░ĆĒå©ļ”ŁļīĆĒĢÖĻĄÉ ļČĆņ▓£ņä▒ļ¬©ļ│æņøÉņŚÉ ņ×ģņøÉĒĢ£ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØä Ļ░Ćņ¦ä ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ░ņØĆ Ļ░ÖņØĆ ĻĖ░Ļ░ä ļ│ĖņøÉ ļ¦Øļ¦ēņĀäļ¼Ėņ¦äļŻīļź╝ ļé┤ņøÉĒĢ£ ļ╣äņŖĘĒĢ£ ļéśņØ┤ļīĆņØś ņĀĢņāüņØĖņ£╝ļĪ£ ņäĀņĀĢĒĢśņśĆļŗż. ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēĒśłĻ┤Ćļ░ĆļÅäļŖö ļ¦Øļ¦ē ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüņ£╝ļĪ£ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ņŗ¼ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄĻ│╝ ļ¦źļØĮļ¦ēņĖĄ Ļ░üĻ░üņØś ņØ┤ļ»Ėņ¦Ćļź╝ ņØ┤ņøÉĒÖöĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. ĒśłĻ┤Ćļ░ĆļÅäļŖö ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ Ļ░ä ļ╣äĻĄÉĒĢśņśĆļŗż. Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ ņ×äņāü ļ│ĆņłśļōżĻ│╝ ĒśłĻ┤Ćļ░ĆļÅä Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ņŗ¼ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄĻ│╝ ļ¦źļØĮļ¦ēņĖĄņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ļīĆņĪ░ĻĄ░Ļ│╝ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ Ļ░äņŚÉ ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(p=0.496, 0.988, 0.909, 0.317). ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░ä, ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©Ļ│╝ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäļŖö ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŗż(r=0.393 and 0.393; p=0.015 and 0.015).
Ļ▓░ļĪĀ
ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØś ņĪ┤ņ×¼ ņ×Éņ▓┤ļŖö ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖļŖöļŗż. ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░äĻ│╝ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņØś ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ĒśłĻ┤Ć ĒÖĢņןņŚÉ ņØśĒĢ£ Ļ▓āņØ╝ ņłś ņ׳ņ£╝ļéś ņČöĒøä ņŚ░ĻĄ¼Ļ░Ć ļŹö ĒĢäņÜöĒĢśļŗż.
ABSTRACT
Methods
This study included alcohol-associated liver disease (ALD) patients admitted between December 2020 and October 2021, along with age-matched controls. Retinal and choroidal vessel densities, measured using image binarization at the superficial capillary plexus (SCP), deep capillary plexus (DCP), choriocapillaris, and choroidal layers, were compared between ALD patients and controls. Correlations between clinical parameters and vessel densities in ALD patients were also analyzed.
Results
Vessel densities at SCP, DCP, choriocapillaris, and choroidal layers were not significantly different between controls and ALD patients (p = 0.496, 0.988, 0.909, and 0.317, respectively). Platelet time and international normalized ratio (INR) were positively correlated with SCP density in ALD patients (r = 0.393 and 0.393; p = 0.015 and 0.015, respectively).
ņĢīņĮöņś¼Ļ│╝ ļłłņØś ņāüĻ┤ĆĻ┤ĆĻ│äņŚÉ ļīĆĒĢ┤ņä£ļŖö ļ¦ÄņØ┤ ņĢīļĀżņĀĖ ņ׳ļŗż. ĻĖēņä▒ ņĢīņĮöņś¼ ņżæļÅģņŚÉņä£ļŖö ļ╣äņĀĢņāüņĀüņØĖ ļłł ņøĆņ¦üņ×ä, ņāēĻ░ü ļ│ĆĒÖö, ļīĆļ╣äĻ░ÉļÅä ņĀĆĒĢśĻ░Ć ļéśĒāĆļéĀ ņłś ņ׳Ļ│Ā ĻĖēņä▒ ļ®öĒāäņś¼ ņŗ£ņŗĀĻ▓Įļ│æņ”ØņŚÉņä£ļŖö ņŗ£ņŗĀĻ▓ĮļČĆņóģ, ļ¦Øļ¦ēņŗĀĻ▓ĮņĀłņäĖĒż ņåÉņāü, ņśüĻĄ¼ņĀüņØĖ ņŗ£ļĀźņĀĆĒĢś ļśÉļŖö ņŗ£ņĢ╝Ļ▓░ņåÉ(ņĢöņĀÉ)ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż.1 ļ¦īņä▒ ņĢīņĮöņś¼ ņżæļÅģņŚÉņä£ļŖö ļ░▒ļé┤ņן, Ļ▒┤ņĪ░ņ”Ø, Ļ░üļ¦ēņāüĒö╝ļ│æņ”Ø ļ░Å ņøÉļ░£ņä▒Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן, ņĢīņĮöņś¼ ņ£ĀļÅä ņŗ£ņŗĀĻ▓Įļ│æņ”ØņØ┤ ļ│┤ņØ╝ ņłś ņ׳ņ£╝ļ®░ ļ¦Øļ¦ēņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ļŗ╣ļć©ļ¦Øļ¦ēļ│æņ”Ø, ļ¦Øļ¦ēņĀĢļ¦źĒÅÉņćä, ņżæņŗ¼ņä▒ņןņĢĪļ¦źļØĮļ¦Øļ¦ēļ│æņ”Ø, ņä▒ņāüņ£Āļ”¼ņ▓┤ņ”ØņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż.1
ņĢīņĮöņś¼ ņäŁņĘ©ņÖĆ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ņé¼ņØ┤ņŚÉ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŗżļŖö ņŚ░ĻĄ¼ļŖö ļŗżņłś ņ׳ļŗż.1,2 ĻĘĖņżæ ļīĆĒæ£ņĀüņ£╝ļĪ£ ņ£Āļ¬ģĒĢ£ ņŚ░ĻĄ¼ļĪ£ļŖö ļ╣äļ▓äļīÉ ņŚ░ĻĄ¼3ņÖĆ ļ®£ļ▓äļźĖ Ļ│ĄļÅÖ ņĮöĒśĖĒŖĖ ņŚ░ĻĄ¼4Ļ░Ć ņ׳ļŗż. ļ╣äļ▓äļīÉ ņŚ░ĻĄ¼3ņŚÉņä£ ņÖĆņØĖ ļśÉļŖö ņ¢æņŻ╝ ņäŁņĘ©ļŖö ņ┤łĻĖ░ļéś ĒøäĻĖ░ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒Ļ│╝ Ļ┤ĆĻ│äņŚåņ£╝ļéś ļé©ņä▒ņŚÉņä£ ļ¦źņŻ╝ ņäŁņĘ©ļŖö ļ¦Øļ¦ē ļō£ļŻ©ņĀĀĻ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŗżĻ│Ā ĒĢśņśĆĻ│Ā ļ®£ļ▓äļźĖ Ļ│ĄļÅÖ ņĮöĒśĖĒŖĖ ņŚ░ĻĄ¼4ņŚÉņä£ļŖö ĒĢśļŻ©ņŚÉ 20 g ņ┤łĻ│╝ņØś ņĢīņĮöņś¼ ņäŁņĘ©ļŖö ņ┤łĻĖ░ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ļ░£ņāØņØä 20% Ļ░ĆĻ╣īņØ┤ ņ”ØĻ░Ćņŗ£Ēé©ļŗżĻ│Ā ĒĢśņśĆļŗż. ļ®öĒāĆļČäņäØ5ņŚÉ ļö░ļź┤ļ®┤ ĒĢśļŻ© 30 g ņØ┤ņāüņØś ņĢīņĮöņś¼ ņäŁņĘ©ļŖö ņ┤łĻĖ░ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ņ£äĒŚśņä▒ņØä 47-67%Ļ╣īņ¦Ć ļåÆņØĖļŗżĻ│Ā ĒĢśņśĆļŗż. ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒ ņÖĖņŚÉļÅä ņĢīņĮöņś¼ ņäŁņĘ©ļŖö ļ¦źļØĮļ¦ēĒśłļźś ņĪ░ņĀłņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ĒśłĻ┤Ć Ēł¼Ļ│╝ņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ ņżæņŗ¼ņä▒ņןņĢĪļ¦ēļØĮļ¦źļØĮļ¦ēļ│æņ”ØņØś ņ£äĒŚśņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.6
ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØä Ļ░Ćņ¦ä ĒÖśņ×ÉņŚÉņä£ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäļź╝ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśĻ│Ā ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēĒśłĻ┤ĆņŚÉ ņ¢┤ļ¢ĀĒĢ£ ļ│ĆĒÖöĻ░Ć ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż. ļśÉĒĢ£, ņ×äņāü ļ│ĆņłśļōżĻ│╝ ĒśłĻ┤Ćļ░ĆļÅä Ļ░äņØś ņŚ░Ļ┤Ćņä▒ņØä ļČäņäØĒĢ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ĒŚ¼ņŗ▒ĒéżņäĀņ¢Ė(Declaration of Helsinki)ņØä ņżĆņłśĒĢśņśĆņ£╝ļ®░ ļ│ĖņøÉ ņŚ░ĻĄ¼ņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board, IRB)ņŚÉņä£ ņŗ¼ņØś Ēøä ņŖ╣ņØĖņØä ļ░øņĢśļŗż(Ļ│╝ņĀ£ ļ▓łĒśĖ: HC22RASI0 091).
2020ļģä 12ņøöļČĆĒä░ 2021ļģä 10ņøöĻ╣īņ¦Ć Ļ░ĆĒå©ļ”ŁļīĆĒĢÖĻĄÉ ļČĆņ▓£ņä▒ļ¬©ļ│æņøÉņŚÉ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņ£╝ļĪ£ ņ×ģņøÉĒĢ£ ĒÖśņ×É 40ļ¬ģĻ│╝ Ļ░ÖņØĆ ĻĖ░Ļ░ä ļÅÖņĢł ļ│ĖņøÉ ļ¦Øļ¦ēņĀäļ¼Ėņ¦äļŻīļź╝ ļé┤ņøÉĒĢ£ ļ╣äņŖĘĒĢ£ ļéśņØ┤ļīĆņØś ņĀĢņāüņØĖ ļīĆņĪ░ĻĄ░ 50ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ņŚ░ĻĄ¼ĒĢśņśĆļŗż. ļīĆņĪ░ĻĄ░ņØĆ ĒāĆņøÉņŚÉņä£ ņØ┤ņĀäņŚÉ Ļ░äņ¦łĒÖśņØä ņ¦äļŗ©ļ░øņØĆ Ļ▓ĮņÜ░ ļśÉļŖö ļ░öņØ┤ļ¤¼ņŖżņä▒ Ļ░äņŚ╝ ļō▒ ļŗżļźĖ Ļ░äņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņĀ£ņÖĖĒĢśņśĆņ£╝ļ®░ ļ│ĖņøÉņŚÉņä£ļŖö ņĢłĻ│╝ņĀü Ļ▓Ćņé¼ ņÖĖ ĒśłņĢĪĻ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż. ņ×äņāüņĀü ļ│ĆņłśņØĖ ĒśłņĢĪĻ▓Ćņé¼ņÖĆ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēĒśłĻ┤Ćļ░ĆļÅä ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ļČäņäØņØĆ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ļ¦ī ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØĆ ļ│ĖņøÉ ņåīĒÖöĻĖ░ ļé┤Ļ│╝ ņĀäļ¼ĖņØś 2ņØĖņŚÉ ņØśĒĢśņŚ¼ ņ¦äļŗ©ļÉśņŚłļŗż. Ļ░ä ņ¦łĒÖśņØś ņ¦äļŗ©ņØĆ Ļ░ä Ļ▓Ćņé¼ ļŹ░ņØ┤Ēä░ņÖĆ ļ¼Ėļ¦źņĢĢ ĒĢŁņ¦ä, Ļ░äņäĖĒż ļČĆņĀäņØś ņ¦ĢĒøä, Ļ░äņ┤łņØīĒīī Ļ▓░Ļ│╝(ļ»Ėļ¦īņä▒ ļ╣äĻĘĀņ¦łĒĢ£ ļ¬©ņ¢æ, ļČłĻĘ£ņ╣ÖĒĢ£ Ļ░ä ņØīņśü ņåīĻ▓¼), Ļ░äņāØĻ▓ĆņØä ņŗżņŗ£ĒĢ£ Ļ▓ĮņÜ░ ņĪ░ņ¦üĒĢÖ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļ¼Ėļ¦źņĢĢĒĢŁņ¦äņØĆ ļ│Ąņłś, ņŗØļÅäņĀĢļ¦źļźś, ņĀĢļ¦źĻ│üņł£ĒÖśĻ│╝ ļ╣äļ╣äļīĆĻ░Ć ņ׳ļŖö ļ│ĄĒĢ®ņ”ØĒøäĻĄ░ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā Ļ░äņäĖĒż ļČĆņĀäņØĆ ļ¼┤ļĀźņ”Ø, Ļ░äņä▒ņĢģņĘ©, Ļ░äņä▒Ēś╝ņłś, ĒÖ®ļŗ¼, ņä▒ņāüĒśłĻ┤Ćņóģ, ļ░▒ņāēņåÉļ░£Ēå▒, ņåÉļ░öļŗźĒÖŹļ░ś, ļ│Ąņłś, Ļ│ĀņĀĢņ×ÉņäĖļČłļŖźņ”Ø ļō▒ņØś ņ×äņāüņĀü ņåīĻ▓¼ņØä ļ░öĒāĢņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż.
ņĢīņĮöņś¼ ņé¼ņÜ®ņןņĢĀļŖö ņäĖĻ│äņĀüņ£╝ļĪ£ Ļ░äņ¦łĒÖśņØś ņŻ╝ņÜö ņøÉņØĖņØ┤ļŗż.7 ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×ÉņØś Ļ░ä ļ│æļ│ĆņØś ņ▓ÖļÅäļź╝ ļ│╝ ņłś ņ׳ļŖö ĒśłņĢĪĻ▓Ćņé¼ļĪ£ ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåī(aspartate aminotransferase, AST), ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī(alanine aminotransferase, ALT), ņĢīļČĆļ»╝, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł, ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░ä(prothrombin time, PT), ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©(international normalized ratio, INR)ņØ┤ ņ׳ņ£╝ļ®░ Ļ░äņ¦łĒÖśņŚÉņä£ ņĀĆņĢīļČĆļ»╝ņ”Ø, ņĀĆĒśłļŗ╣, Ļ│Āļ╣īļ”¼ļŻ©ļ╣łĒśłņ”Ø ņåīĻ▓¼ņØä ļ│┤ņØĖļŗż.8
ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņŗ£ļĀź, ĻĄ┤ņĀłĻ▓Ćņé¼, ņĢłņĀĆĻ▓Ćņé¼ ļ░Å ņĢłņĀĆņ┤¼ņśü, ļ¦Øļ¦ē ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņśüņāü(optical coherence tomography angiography; Cirrus 6000, Carl Zeiss Meditec, Jena, Germany) Ļ▓Ćņé¼ ļ░Å ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆļŗż.
Ļ░äņ¦łĒÖś ĒÖśņ×ÉļōżņØś ņØśļ¼┤ĻĖ░ļĪØ ļČäņäØņØä ĒåĄĒĢśņŚ¼ ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåī, ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī, ņĢīļČĆļ»╝, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł, ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░ä, ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©ņØś ņłśņ╣śļź╝ ļČäņäØĒĢśņśĆĻ│Ā ļ¦źļØĮļ¦ēĻ│╝ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļČäņäØĒĢśņśĆļŗż.
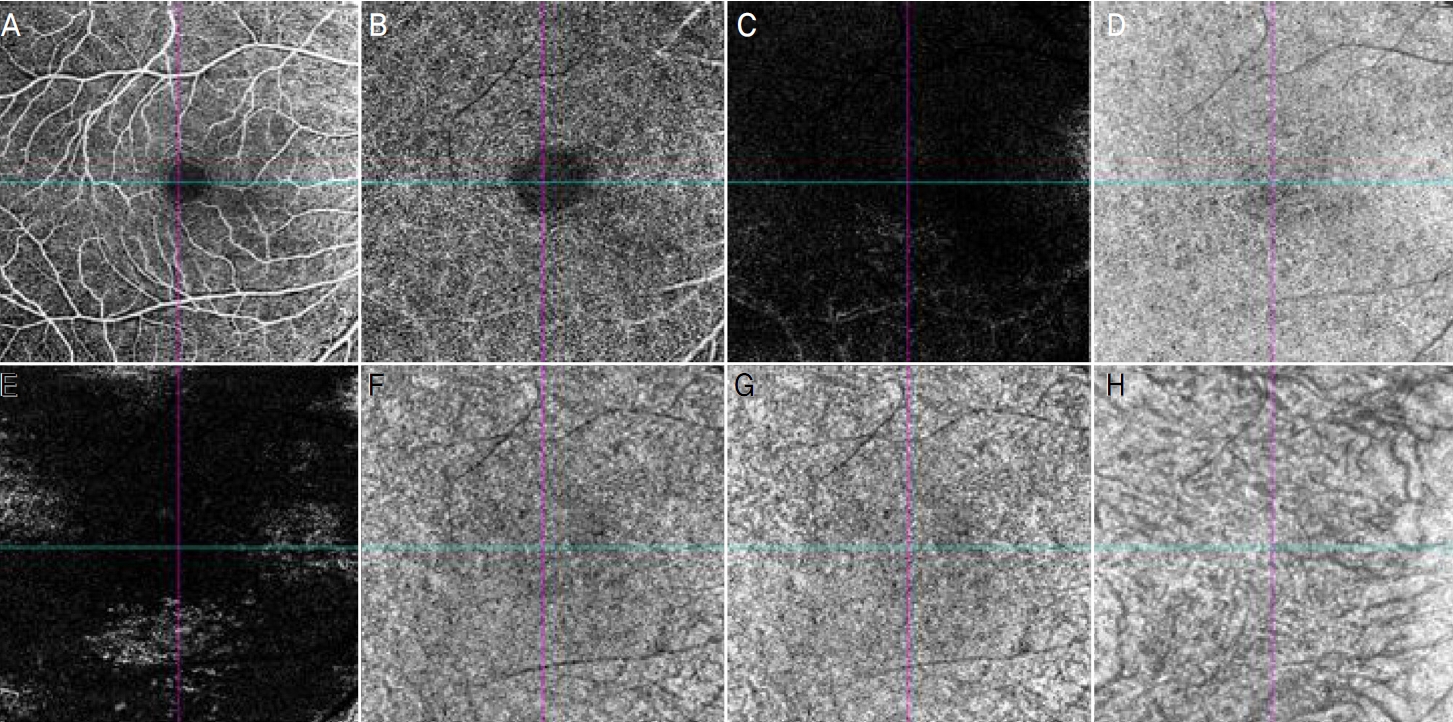
ļ¦Øļ¦ē ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņśüņāü ņżæ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ņŗ¼ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄĻ│╝ ļ¦źļØĮļ¦ēņĖĄ ņé¼ņ¦äņØä ņØ┤ņÜ®ĒĢśņŚ¼ ĒśłĻ┤Ć ļČäņäØņØä ĒĢśņśĆļŗż(Fig. 1). ĒśłĻ┤Ćļ░ĆļÅäļź╝ ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ļ¦Øļ¦ē Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø, ļ¦Øļ¦ē ņŗ¼ņĖĄļČĆļ¬©ņäĖĒśłĻ┤Ćņ┤ØĻ│╝ ļ¦źļØĮļ¦ēņĖĄ ņé¼ņ¦äņØĆ ļĖīļĀłļōżļ”¼ ņØ┤ļ»Ėņ¦Ć ņ×äĻ│äņ▓śļ”¼(Bradley Adaptive Thresholding)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņØ┤ļČäĒÖöĒĢśņśĆļŗż. ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ņé¼ņ¦äņŚÉņä£ļŖö ĒØ░ ņśüņŚŁņØä ĒśłĻ┤Ć ņśüņŚŁņ£╝ļĪ£ Ļ│äņé░ĒĢśņśĆĻ│Ā ļ¦źļØĮļ¦ēņĖĄ ņé¼ ņ¦äņŚÉņä£ļŖö Ļ▓ĆņØĆ ņśüņŚŁņØä ĒśłĻ┤Ć ņśüņŚŁņ£╝ļĪ£ ĒĢśņŚ¼ ņĀäņ▓┤ ņśüņāüļ®┤ņĀüņ£╝ļĪ£ ļéśļłäņ¢┤ Ļ│äņé░ĒĢśņśĆļŗż(Fig. 2). ļ╣łĒśłļźśļČĆņ£ä(flow void)ņØś ļ®┤ņĀüņØä Ļ│äņé░ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄ ņé¼ņ¦äņØĆ ĒīÉņé┤ņ╣┤ ņØ┤ļ»Ėņ¦Ć ņ×äĻ│äņ▓śļ”¼(Phansalkar local thresholding)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņØ┤ļČäĒÖöĒĢśņśĆĻ│Ā ĒØ░ ņśüņŚŁņØä ĒśłĻ┤Ć ņśüņŚŁņ£╝ļĪ£ ĒĢśņŚ¼ ņĀäņ▓┤ ņśüņāüļ®┤ ņĀüņ£╝ļĪ£ ļéśļłäņ¢┤ Ļ│äņé░ĒĢśņśĆļŗż(Fig. 3).
ļīĆņāüņ×ÉņØś ĒåĄĻ│ä ļČäņäØņØĆ MicroSoft Excel (MicroSoft, Redmont, WA, USA)Ļ│╝ SPSS ĒöäļĪ£ĻĘĖļש(SPSS 18.0, IBM Corp., Armonk, NY, USA)ļź╝ ņØ┤ņÜ®ĒĢśņśĆņ£╝ļ®░ ņŚ░ņåŹĒśĢ ņ×ÉļŻīļŖö ņ×ÉļŻī ņłś, ĒÅēĻĘĀ, Ēæ£ņżĆĒÄĖņ░© ļō▒ņØä ĻĄ¼ĒĢśĻ│Ā ļ▓öņŻ╝ĒśĢ ņ×ÉļŻīļŖö ļ╣łļÅäņÖĆ ļ╣äņ£©ņØä ĻĄ¼ĒĢśņśĆĻ│Ā Ļ░ü ņĖĄļ│ä ĒśłĻ┤Ćļ░ĆļÅä ņé¼ņØ┤ņŚÉ, ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņ×äņāüņØĖņ×É ņé¼ņØ┤ņŚÉ ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ļŖöņ¦Ć PearsonĻ│╝ Spearman correlation analysisļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£ ĒśłĻ┤Ćļ░ĆļÅä ņ░©ņØ┤ļź╝ ļ│┤ĻĖ░ ņ£äĒĢ┤ ņĀĢĻĘ£ņä▒ Ļ▓ĆņĀĢ Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ t-testļéś Mann-Whiteney U testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņ┤Ø 40ļ¬ģņØś ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×ÉņÖĆ 50ļ¬ģņØś ļīĆņĪ░ĻĄ░ņØ┤ ĒżĒĢ©ļÉśņŚłļŗż. Ļ░ü ĒÖśņ×ÉņØś ļæÉ ļłł ņżæ ĒĢ£ ļłłļ¦īņØä ļ¼┤ņ×æņ£äļĪ£ ņäĀĒāØĒĢśņŚ¼ ļČäņäØņŚÉ ĒżĒĢ©ņŗ£ņ╝░ļŗż. ļīĆņĪ░ĻĄ░Ļ│╝ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ Ļ░äņŚÉ ņä▒ļ│ä, ļéśņØ┤, ņŗ£ļĀźĻ│╝ ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.065, 0.339, 0.773, 0.939). ļé©ņä▒ ļ╣äņ£©ņØĆ ļīĆņĪ░ĻĄ░ņŚÉņä£ 0.64, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ 0.45ņśĆĻ│Ā ļéśņØ┤ļŖö ļīĆņĪ░ĻĄ░ņØ┤ 57.67 ┬▒ 15.72ņäĖ, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņØ┤ 55.05 ┬▒ 12.13ņäĖņśĆļŗż. ņŖżļä¼ļĀī ņŗ£ļĀźņØĆ ļīĆņĪ░ĻĄ░ņØ┤ 0.9 ┬▒ 0.15, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņØ┤ 0.9 ┬▒ 0.13ņØ┤ņŚłĻ│Ā ĻĄ¼ļ®┤ļĀīņ”łļīĆņØæņ╣śļŖö ļīĆņĪ░ĻĄ░ņØ┤ -0.92 ┬▒ 3.57ļööņśĄĒä░, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņØ┤ -0.88 ┬▒ 2.01ļööņśĄĒä░ņśĆļŗż(Table 1).
ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåī 144 ┬▒ 186.62 IU/L, ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī 105.40 ┬▒ 225.95 IU/L, ņĢīļČĆļ»╝ 2.94 ┬▒ 0.44 g/dL, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł 3.21 ┬▒ 2.35 mg/dL, ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░ä 16.50 ┬▒ 2.63ņ┤ł, ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£© 1.43 ┬▒ 0.23ņØ┤ņŚłļŗż(Table 2).
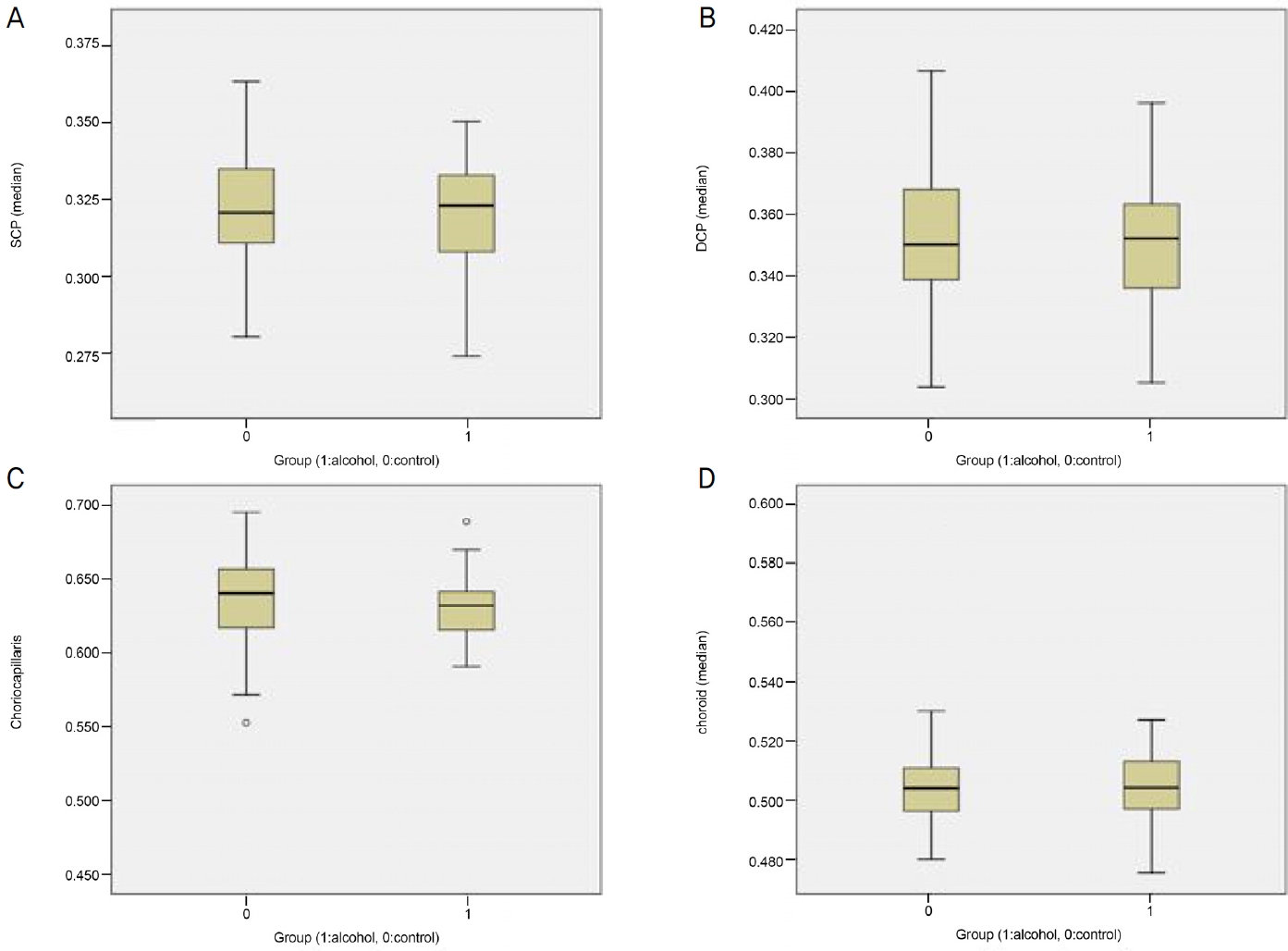
ļ¦Øļ¦ē Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ļīĆņĪ░ĻĄ░ņŚÉņä£ 0.32 ┬▒ 0.02, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ņŚÉņä£ 0.32 ┬▒ 0.02 (p=0.50), ņŗ¼ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤ØņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö Ļ░üĻ░ü 0.35 ┬▒ 0.02, 0.35 ┬▒ 0.02(p=0.99)ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļśÉĒĢ£, ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņĖĄņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö Ļ░üĻ░ü 0.51 ┬▒ 0.02, 0.51 ┬▒ 0.01 (p=0.91)ņØ┤ņŚłņ£╝ļ®░ ļ¦źļØĮļ¦ēņĖĄņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö Ļ░üĻ░ü 0.63 ┬▒ 0.03, 0.63 ┬▒ 0.03(p=0.32)ņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Table 3, Fig. 4).
ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×ÉņØś ņ×äņāüņĀü ļ│Ćņłś ņżæ ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░äĻ│╝ ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©ņØ┤ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŗż(p=0.015, p=0.015). ļ¦Øļ¦ē Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒÖ£Ļ┤ĆņĖĄĻ│╝ ņŗ¼ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤ĆņĖĄņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņä£ļĪ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŗż(p<0.001). ļ¦Øļ¦ē Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤ĆņĖĄĻ│╝ ņŗ¼ņĖĄļČĆļ¬©ņäĖĒśłĻ┤ĆņĖĄ ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ļ¦źļØĮļ¦ēļ¬©ņäĖĒśłĻ┤ĆņØś ļ░ĆļÅäļŖö ņä£ļĪ£ ņØīņØś ņāüĻ┤ĆĻ┤ĆĻ│äĻ░Ć ņ׳ņŚłļŗż(p=0.031) (Table 4).
ļ¦īņä▒ ņĢīņĮöņś¼ ņäŁņĘ©ļŖö ļ░▒ļé┤ņן, ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø, ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן, ņĢīņĮöņś¼ ņ£ĀļÅä ņŗ£ņŗĀĻ▓Įļ│æņ”ØņŚÉ Ļ┤ĆļĀ© ņ׳ņØä ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¢┤ ņŚ░ļĀ╣Ļ┤ĆļĀ©ĒÖ®ļ░śļ│Ćņä▒, ņżæņŗ¼ņä▒ņןņĢĪļ¦źļØĮļ¦Øļ¦ēļ│æņ”Ø, ļ│äļ¬©ņ¢æņ£Āļ”¼ņ▓┤ņ”ØĻ│╝ļÅä Ļ┤ĆļĀ© ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż.1 ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēĒśłĻ┤Ć ĻĄ¼ņĪ░ņÖĆ ļ¦īņä▒ ņĢīņĮöņś¼ ņäŁņĘ©ņŚÉ ļīĆĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤Ļ│Āņ×É ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļ¦Øļ¦ē ļ╣øĻ░äņäŁļŗ©ņĖĄĒśłĻ┤ĆņĪ░ņśü ņśüņāüņØä ņØ┤ņÜ®ĒĢ£ ļČäņäØņØä ņ¦äĒ¢ēĒĢśņśĆļŗż.
ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ņĢīņĮöņś¼ ņé¼ņÜ®ņןņĢĀļĪ£ ņØĖĒĢ┤ ļ░£ņāØĒĢśļŖöļŹ░ ļ¼┤ņ”Øņāü ņ¦Ćļ░®Ļ░äļČĆĒä░ ņĢīņĮöņś¼ Ļ┤ĆļĀ© Ļ░äņŚ╝, Ļ░äĻ▓ĮĒÖö, ļŹö ļéśņĢäĻ░Ć Ļ░äņĢöņ£╝ļĪ£ ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ļŗż. ņĢīņĮöņś¼ Ļ┤ĆļĀ© ņ¦Ćļ░®Ļ░äņØś Ļ▓ĮņÜ░ ļīĆļČĆļČä ĒÖ®ļŗ¼ ļō▒ņØś ņ”Øņāü ņŚåņØ┤ Ļ░äļ╣äļīĆĻ░Ć ļéśĒāĆļéĀ ņłś ņ׳Ļ│Ā ņĢīņĮöņś¼ņä▒ Ļ░äņŚ╝ņØĆ ņ×äņāüņĀüņ£╝ļĪ£ 8ņŻ╝ ņØ┤ļé┤ ĒÖ®ļŗ¼ņØ┤ ļéśĒāĆļéśļ®░ ĒśłņĢĪĻ▓Ćņé¼ņŚÉņä£ ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåī ņłśņ╣śĻ░Ć 50 IU/LņØ┤ ļäśĻ│Ā ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåīņÖĆ ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī ņłśņ╣śņØś ļ╣äĻ░Ć 1.5ļź╝ ļäśņ£╝ļ®░ ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäļŗ¼ĒÜ©ņåīņÖĆ ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī ņłśņ╣ś Ļ░üĻ░üņØĆ 400 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░, ņ┤Øļ╣īļ”¼ļŻ©ļ╣ł ņłśņ╣śĻ░Ć 3.0 mg/dLņØ┤ ļäśņØä Ļ▓ĮņÜ░ ņ¦äļŗ©ĒĢ£ļŗż. ņĢīņĮöņś¼ Ļ┤ĆļĀ© Ļ░äĻ▓ĮĒÖöņØś Ļ▓ĮņÜ░ ļ│ĄļČĆ ņśüņāüĻ▓Ćņé¼ņŚÉņä£ Ļ░äĻ▓░ņĀłņØ┤ Ļ┤Ćņ░░ļÉśĻ▒░ļéś ļ¼Ėļ¦źņĢĢĒĢŁņ¦ä ņåīĻ▓¼ņØ┤ ļéśĒāĆļéśļ®░ Ļ░äņä¼ņ£ĀĒÖöĻ▓Ćņé¼ņŚÉņä£ Ļ░äņä¼ņ£ĀĒÖö ņåīĻ▓¼ņØä ļ│┤ņØĖļŗż. Ļ░äĻ▓ĮĒÖöĻ░Ć ņ¦äĒ¢ēĒĢśņŚ¼ Ļ░äņäĖĒżņä▒ ņĢöņóģĻ╣īņ¦Ć ļéśĒāĆļéĀ ņłś ņ׳ļŗż.9 ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ 40ļ¬ģņØś ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×É ņżæ 30ļ¬ģņØĆ ņĢīņĮöņś¼ ņäŁņĘ©ļĪ£ ņØĖĒĢ£ Ļ░äĻ▓ĮĒÖöņśĆņ£╝ļ®░, ļéśļ©Ėņ¦Ć 10ļ¬ģ ņżæ 4ļ¬ģņØĆ ņ¦Ćļ░®Ļ░ä, 4ļ¬ģņØĆ ņĢīņĮöņś¼ņä▒ Ļ░äņŚ╝, 2ļ¬ģņØĆ Ļ░äņäĖĒżņä▒ ņĢöņóģņØ┤ņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ Ļ░äņ¦łĒÖś ĒÖśņ×ÉĻĄ░ņØś ļīĆļČĆļČä(75%)ņØ┤ Ļ░äĻ▓ĮĒÖöņśĆĻ│Ā Ļ░äĻ▓ĮĒÖö ņÖĖ ļŗżļźĖ Ļ░äņ¦łĒÖś ļČäļźśĻĄ░ņØś ņłśĻ░Ć ņĀ£ĒĢ£ņĀüņØ┤ņ¢┤ņä£ Ļ░äņ¦łĒÖś ņżæņ”ØļÅäņŚÉ ļö░ļźĖ ļČäņäØņØĆ ņ¢┤ļĀżņøĀļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉ Ļ░Ćņן ļ¦ÄņØ┤ ĒżĒĢ©ļÉ£ Ļ░äĻ▓ĮĒÖöņ”ØņØĆ ņĀäņŗĀņĀüņØĖ ļ»ĖņäĖĒśłļźś ņןņĢĀ ļ░Å ĒśłņŚŁĒĢÖņĀü ņןņĢĀņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗż. Gifford et al10ņŚÉ ļö░ļź┤ļ®┤ Ļ░äĻ▓ĮĒÖöņ”ØņŚÉņä£ ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēņØś ļæÉĻ╗ś, ļ¦Øļ¦ē ļČĆĒö╝Ļ░Ć ņ£ĀņØśļ»ĖĒĢśĻ▓ī Ļ░ÉņåīĒĢśĻ│Ā Ļ░äņØ┤ņŗØ ĒøäņŚÉļŖö 6ņŻ╝ņŚÉ Ļ▒Ėņ│É ĒÜīļ│ĄļÉ£ļŗż. Ļ░äĻ▓ĮĒÖöņ”Ø ĒÖśņ×ÉļōżņŚÉņä£ ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēņØś ņØ┤ņāüņØ┤ ņ┤łļלļÉśļŖö Ļ▓āņØä ņĢī ņłś ņ׳ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö Ļ░äņ¦łĒÖśņØ┤ ņ׳ļŖö ĻĄ░ņŚÉņä£ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ć ļ░ĆļÅäĻ░Ć ņżäņ¢┤ļōż Ļ▓āņØ┤ļØ╝ļŖö ņśłņāüĻ│╝ļŖö ļŗżļź┤Ļ▓ī ĒśłĻ┤Ćļ░ĆļÅäļŖö ļīĆņĪ░ĻĄ░Ļ│╝ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśĻĄ░ Ļ░ä ņ£ĀņØśļ»ĖĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļŗżļźĖ ņØ┤ļČäĒÖö ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ļÅä Ļ░ÖņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØś ņĪ┤ņ×¼ ņ×Éņ▓┤ļŖö ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖļŖö Ļ▓āņØä ĒÖĢņØĖ ĒĢĀ ņłś ņ׳ņŚłļŗż. Gifford et al10Ļ│╝ ļ│Ė ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ļ│ĆĒÖöĻ░Ć ļéśĒāĆļéśņ¦Ćļ¦ī ĒśłĻ┤Ćļ░ĆļÅäļŖö ļ│ĆĒÖöņŚåņØ┤ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ļČĆĒö╝ ļ░Å ļæÉĻ╗śļ¦ī ņżäņ¢┤ļōĀļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż. ņØ┤ļŖö ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ļČĆĒö╝ņÖĆ ļæÉĻ╗śĻ░Ć ņżäņ¦Ćļ¦ī ĒśłĻ┤ĆņØś ļČĆĒö╝ ļśÉĒĢ£ ĒĢ©Ļ╗ś ņżäņ¢┤ļōżņ¢┤ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäņŚÉļŖö ļ│ĆĒÖöĻ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢĀ ņłś ņ׳Ļ▓Āļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņāüĻ┤ĆļČäņäØņŚÉ ļö░ļź┤ļ®┤ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ĒÖśņ×ÉņØś ņ×äņāüņĀü ļ│Ćņłś ņżæ ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░äĻ│╝ ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©ņØ┤ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņśĆļŗż. ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░ä ņāüņŖ╣ņØĆ ļŹö ņżæņ”Ø Ļ░äņ¦łĒÖśņ×äņØä ņØśļ»ĖĒĢśļ®░ Ļ▒░ļ»ĖņāüĒśłĻ┤ĆĒÖĢņןņ”ØĻ│╝ Ļ░ÖņØĆ ļ¬©ņäĖĒśłĻ┤Ć ĒÖĢņן ļśÉĒĢ£ ņżæņ”Ø Ļ░äņ¦łĒÖśņŚÉņä£ ļéśĒāĆļéĀ ņłś ņ׳ļŗż.11 Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤ĆņĖĄ ĒśłĻ┤Ćļ░ĆļÅä ņ”ØĻ░ĆļŖö Ēæ£ņĖĄļČĆ ļ¦Øļ¦ēĒśłĻ┤ĆņØś ĒÖĢņןņ£╝ļĪ£ ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢĀ ņłś ņ׳Ļ▓Āļŗż. ņØ┤ļź╝ ĒåĄĒĢ┤ ņĪ░ĻĖł ļŹö ņżæņ”ØļÅäĻ░Ć ļåÆņØĆ Ļ░äņ¦łĒÖś ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēĒśłĻ┤Ćļ░ĆļÅäņŚÉ ļīĆĒĢ£ Ļ▓░Ļ│╝Ļ░Ć ļŗżļź┤Ļ▓ī ļéśņś¼ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņČöņĖĪļÉśņ¢┤ ņČöĒøä ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ĒĢśņ¦Ćļ¦ī ņØ┤ļŖö ļŗżļźĖ ņ£ĀņØśļ»ĖĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ»ĆļĪ£ ĒĢ┤ņäØņŚÉ ņŻ╝ņØśļź╝ ņÜöĒĢśĻ▓Āļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö ļŗ©ņØ╝ĻĖ░Ļ┤ĆņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ņØ┤ļ®░ ĒøäĒ¢źņä▒ ņŚ░ĻĄ¼ļØ╝ļŖö ņĀÉ, ĒÖśņ×ÉĻĄ░ņØś Ēü¼ĻĖ░Ļ░Ć ņ×æņĢśļŗżļŖö ņĀÉ, ļīĆņāüņ×É ņłś ņĀ£ĒĢ£ņ£╝ļĪ£ ņØĖĒĢ┤ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØś ņżæņ”ØļÅäņŚÉ ļö░ļźĖ ļČäņäØņØ┤ ņ¢┤ļĀżņøĀļŗżļŖö ņĀÉņŚÉņä£ ĒĢ£Ļ│äņĀÉņØ┤ ņ׳ļŗż. ļśÉĒĢ£ ņĢīņĮöņś¼ ņäŁņĘ©ļ¤ēĻ│╝ Ļ░äņ¦łĒÖśņØś ņżæņ”ØļÅäņŚÉ ļö░ļźĖ ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäļŖö ņĢīņ¦Ć ļ¬╗ĒĢśļ®░ ĒÖśņ×ÉļōżņØś ļŗżļźĖ ņé¼ĒÜīĻ▓ĮņĀ£ņĀü ņāüĒā£, ņĢīņĮöņś¼ ņäŁņĘ© ņÖĖ ĒØĪņŚ░, ņÜ┤ļÅÖ ņŚ¼ļČĆ ļō▒ņØś ņāØĒÖ£ ņŖĄĻ┤ĆņØĆ ļ░śņśüļÉśņ¦Ć ņĢŖņĢśļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░ļĪĀņØĆ ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖś ņ£Āļ¼┤ļŖö ļ¦Øļ¦ēĻ│╝ ļ¦źļØĮļ¦ēĒśłĻ┤Ćļ░ĆļÅäņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖļŖöļŗżļŖö Ļ▓āņØ┤ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£, ņĢīņĮöņś¼ņä▒ Ļ░äņ¦łĒÖśņØś ņĪ┤ņ×¼ ņ×Éņ▓┤ļŖö ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēņØś ĒśłĻ┤Ćļ░ĆļÅäņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņ£╝ļéś, ĒöäļĪ£ĒŖĖļĪ¼ļ╣łņŗ£Ļ░äĻ│╝ ĻĄŁņĀ£Ēæ£ņżĆĒÖöļ╣äņ£©ņØ┤ Ēæ£ņĖĄļČĆ ļ¬©ņäĖĒśłĻ┤Ćņ┤Ø ĒśłĻ┤Ćļ░ĆļÅäņÖĆ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņŚ¼ Ļ░äņ¦łĒÖśņØś ņżæņ”ØļÅäņŚÉ ļö░ļØ╝ ļŗżļź╝ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢśļ®░, ņČöĒøä ļŹö ļ¦ÄņØĆ ņłśņØś Ļ░äņ¦łĒÖś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņżæņ”ØļÅäļ│ä ļ¦Øļ¦ē ļ░Å ļ¦źļØĮļ¦ēņØś ļæÉĻ╗ś ļ░Å ļČĆĒö╝ļź╝ ĒżĒĢ©ĒĢ£ ĒśłĻ┤Ćļ░ĆļÅäņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņØ┤ļŗż.
Figure┬Ā1.
Optical coherence tomography angiography (Zeiss HD 6000) images (8 conventional angiographic slabs) of superficial capillary plexus (A), deep capillary plexus (B), avascular (C), outer retinal to choriocapillaris (D), retinal pigment epithelium (RPE)-RPE fit (E), sub-RPE (F), choriocapillaris (G), and choroid slabs (H).
Figure┬Ā2.
Images of superficial capillary plexus and choroid binarized using Bradley Adaptive Thresholding. Image binarization was performed using Bradley Adaptive Thresholding on capillary plexuses slabs (A, B) and calculated white area as vessel area (C). Same procedure done to choroid slabs (D, E) and black area was calculated as vessel area (F).
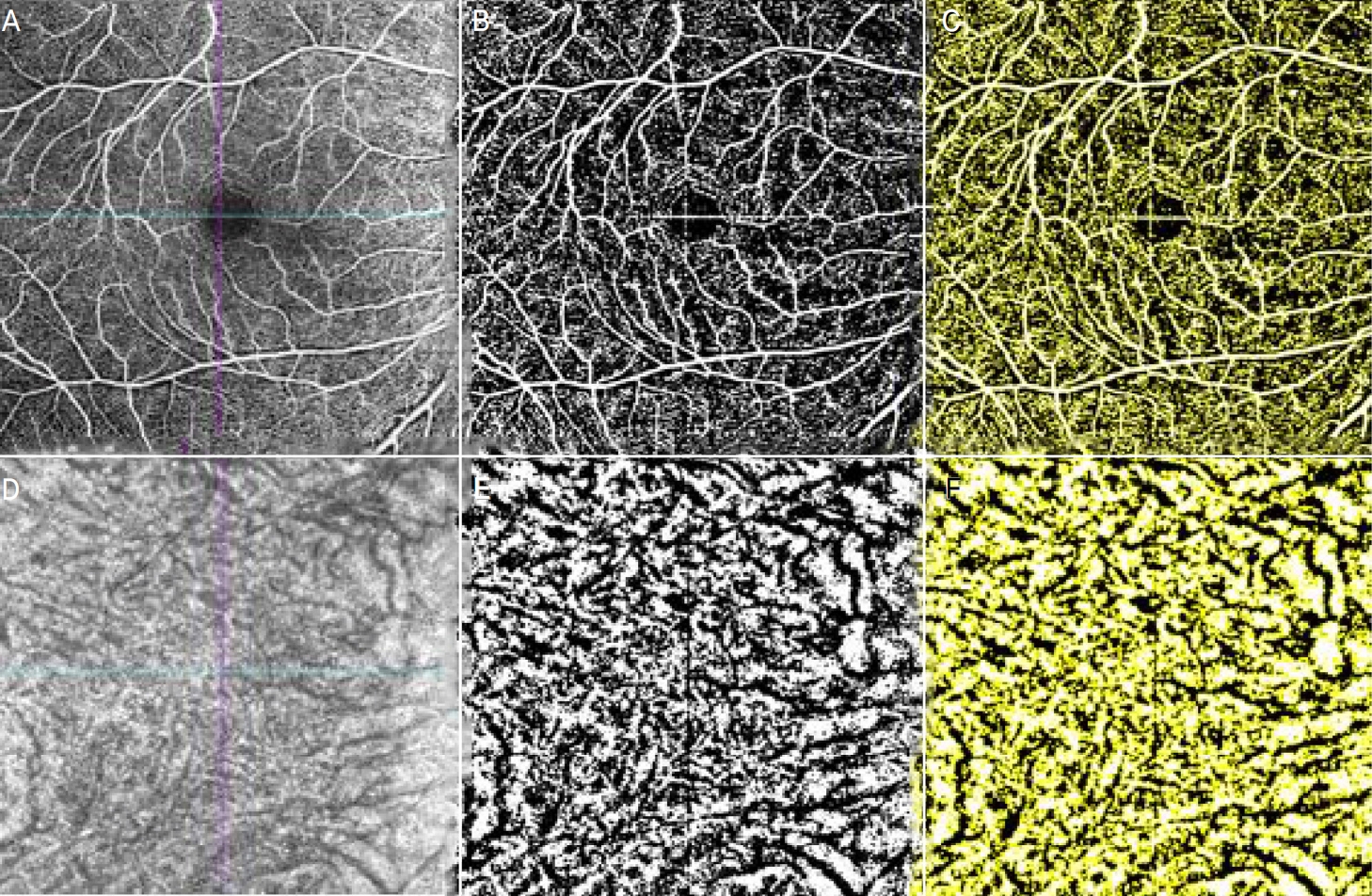
Figure┬Ā3.
Images of choriocapillaris binarized using Phansalkar local thresholding. Image binarization was performed using Phansalkar local thresholding on choriocapillaris slabs (A, B) and calculated white area as vessel area (C).

Figure┬Ā4.
Comparison of vessel density between controls and alcohol-associated liver disease (ALD) group. No significant differences in vessel density were shown between controls and ALD in all parameters ; superficial capillary plexus (SCP) (A), deep capillary plexus (DCP) (B), choriocapillaris (C), and choroid (D).
Table┬Ā1.
Demographics and clinical features of study subjects
| Controls | ALD | p-value* | |
|---|---|---|---|
| Numbers of patients | 50 | 40 | |
| Sex (male proportion) | 0.64 | 0.45 | 0.065 |
| Age (years) | 57.67 ┬▒ 15.72 | 55.05 ┬▒ 12.13 | 0.339 |
| VA (Snellen) | 0.9 ┬▒ 0.15 | 0.9 ┬▒ 0.13 | 0.773 |
| SE (diopter) | -0.92 ┬▒ 3.57 | -0.88 ┬▒ 2.01 | 0.939 |
Table┬Ā2.
Laboratory parameters related with liver disease status in ALD patients
| Lab variables | Values |
|---|---|
| ALT (IU/L) | 144 ┬▒ 186.62 |
| AST (IU/L) | 105.40 ┬▒ 225.95 |
| Albumin (g/dL) | 2.94 ┬▒ 0.44 |
| Total bilirubin (mg/dL) | 3.21 ┬▒ 2.35 |
| Prothrombin time (seconds) | 16.50 ┬▒ 2.63 |
| INR | 1.43 ┬▒ 0.23 |
Table┬Ā3.
Comparison of vessel density between controls and ALD
| Vessel layers | Controls | ALD | p-value* |
|---|---|---|---|
| SCP (median) | 0.32 ┬▒ 0.02 | 0.32 ┬▒ 0.02 | 0.496 |
| DCP (median) | 0.35 ┬▒ 0.02 | 0.35 ┬▒ 0.02 | 0.988 |
| Choroid (median) | 0.51 ┬▒ 0.02 | 0.51 ┬▒ 0.01 | 0.909 |
| Choriocapillaris | 0.63 ┬▒ 0.03 | 0.63 ┬▒ 0.03 | 0.317 |
Table┬Ā4.
Correlation between clinical parameters and vessel densities in ALD patients
REFERENCES
3) Moss SE, Klein R, Klein BE. Asteroid hyalosis in a population: the Beaver Dam eye study. Am J Ophthalmol 2001;132:70-5.


4) Adams MK, Chong EW, Williamson E, et al. 20/20-alcohol and age-related macular degeneration: the Melbourne collaborative cohort study. Am J Epidemiol 2012;176:289-98.


5) Chong EW, Kreis AJ, Wong TY, et al. Alcohol consumption and the risk of age-related macular degeneration: a systematic review and meta-analysis. Am J Ophthalmol 2008;145:707-15.


6) Liu B, Deng T, Zhang J. Risk factors for central serous chorioretinopathy: a systematic review and meta-analysis. Retina 2016;36:9-19.

7) Asrani SK, Devarbhavi H, Eaton J, Kamath PS. Burden of liver diseases in the world. J Hepatol 2019;70:151-71.


8) Di├®dhiou D, Sow D, Thioye EMM, et al. Hepatic cirrhosis: diagnostic and prognosis in internal medicine. Open J Internal Med 2020;10:171-80.


9) Crabb DW, Im GY, Szabo G, et al. Diagnosis and treatment of alcohol-associated liver diseases: 2019 practice guidance from the American association for the study of liver diseases. Hepatology 2020;71:306-33.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 991 View
- 46 Download
- Related articles
-
Two Cases of Retinal Hemorrhage in Alcoholic Cirrhosis.2015 August;56(8)
Age and Spherical Equivalent Related Changes in Wavefront Aberrations.2004 February;45(2)
The Variants of Macular Choroidal Veins in ICG Angiography.1996 November;37(11)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



