국내 아이스텐트 인젝트와 젠의 단독 시행 및 백내장 병합술 성공률 비교와 예후인자 분석
Short-term Outcomes and Prognostic Factor of Cataract Combined Surgery with iStent Inject versus XEN
Article information
Abstract
목적
국내에서 시행한 아이스텐트 인젝트(iStent inject®)와 젠(XEN®)의 단독 및 백내장 병합술의 안압하강 효과, 성공률, 예후인자, 수술 후 합병증에 대해 비교하고자 한다.
대상과 방법
국내에서 개방각녹내장으로 진단받은 환자를 대상으로 아이스텐트 인젝트 삽입술과 젠 삽입술을 단독 혹은 백내장수술과 병합하여, 수술 후 6개월 이상 추적 관찰이 가능했던 총 83안을 대상으로 의무기록을 통하여 후향적 분석하였다. 수술 성공 여부는 수술 후 안압이 21 mmHg 미만이며, 수술 전 안압에 비해 20% 이상 감소하였을 경우로 하였다.
결과
수술 후 6개월째 평균 안압하강률은 아이스텐트 인젝트 단독 삽입술(A군, 24안)이 33.80%, 젠 단독 삽입술(B군, 15안)이 24.91%, 아이스텐트 인젝트 삽입술과 백내장수술 병합(A-1군, 32안)이 20.47%, 젠 삽입술과 백내장수술 병합(B-1군, 12안)이 30.39%로 모두 통계적으로 유의한 안압하강을 보였다. 수술 후 6개월째 안압이 수술 전 안압에 비해 20% 이상 감소한 비율은 A군이 45.5% ± 11.2%, B군이 52.8% ± 15.4%, A-1군이 51.9% ± 9.0%, B-1군이 83.3% ± 10.8%였다. A군과 B군의 성공률 차이는 유의하지 않았으며(p=0.574), A-1군과 B-1군 또한 성공률 차이는 통계적으로 유의하지 않았다(p=0.079).
결론
아이스텐트 인젝트 삽일술과 젠 삽입술 모두 안압 하강에 유의미한 효과가 있으며, 단독 삽입술과 백내장 병합술 모두 통계적으로 유의미한 안압하강 결과를 얻을 수 있었다. 젠 삽입술은 통계적으로 유의하게 사용 안압약의 감소를 이끌어 냈다.
Trans Abstract
Purpose
To analyze the intraocular pressure (IOP) lowering effect, prognostic factors, and complications that occurred after iStent inject® or XEN® implantation in South Korea.
Methods
We retrospectively analyzed 83 eyes with glaucoma who were followed-up for more than 6 months after iStent inject® or XEN® implantation alone or combination with cataract surgery. The success of surgery was defined as an IOP ≤21 mmHg and IOP reduction ≥20% from preoperative IOP.
Results
The average IOP drop rate for 6 months after surgery was 33.80% for iStent inject® (group A, 24 eyes), 24.91% for XEN® (group B, 15 eyes), 20.47% for combined iStent inject® and cataract surgery (group A-1, 32 eyes), and 30.39% for combined XEN® and cataract surgery. The cumulative success rate of 6 months after surgery was 45.5% ± 11.2% for group A, 52.8% ± 15.4% for group B, 51.9% ± 9.0% for group A-1, and 83.3% ± 10.8% for group B-1. The difference in success rates between groups A and B was not statistically significant (p = 0.574), and also between groups A-1 and B-1 (p = 0.079).
Conclusions
iStent inject® and XEN® both have a significant effect on lowering IOP, regardless of combining cataract surgery. XEN® implantation led to a statistically significant reduction in IOP lowering medications.
녹내장은 안압상승 등 다양한 원인으로 시신경이 점차 손상되어 비가역적 실명을 일으키는 질환이다[1]. 녹내장의 치료 목표는 안압 조절을 통하여 시신경 손상의 진행을 억제하는 것이며, 그 종류는 약물, 레이저 치료, 수술적 치료가 있다. 초기에는 약물 치료가 우선적으로 고려되나, 약물에 대한 부작용 및 안압 조절 실패, 지속적 사용에 대한 단점이 존재하며, 다음 순서로 레이저와 수술적 치료가 고려된다[2]. 레이저 치료는 녹내장 치료로 간단하고 효과적이나 시간이 지날수록 효과가 떨어지며, 안압 조절 실패 가능성이 있다[3]. 다음으로 기존의 수술적 치료인 침습적 녹내장수술을 고려해 볼 수 있다[4]. 기존 녹내장수술법은 안압하강 효과는 뛰어나나 수술 부위 감염을 통한 안내염, 저안압증, 맥락막박리 등의 치명적인 부작용을 야기할 수 있는 합병증이 있어 이에 따른 대안적 수술법에 대한 연구가 진행되고 있다[5-7].
최근에는 미세침습 녹내장수술(minimally-invasive glaucoma surgeries)이라 불리는 수술법을 통하여 수술 후 합병증 발생율을 낮추며, 회복에 필요한 시간이 비교적 짧아져 기존의 침습적 녹내장수술의 대안으로 연구되고 있다[8,9]. 미세침습 녹내장수술은 섬유주, 맥락막 위, 결막하 등으로 장치를 삽입하여 방수를 배출하게 되며, 백내장수술과 병합 시행될 경우에는 추가 절개 없이 가능하다[10]. 현재 섬유주 미세우회 스텐트의 2세대 격인 아이스텐트 인젝트(iStent inject®, Glaukos, Laguna Hills, CA, USA)와 젠(XEN® Gel stent, Allergan Inc., Irvine, CA, USA)은 최근 한국에서 녹내장 환자에게 안압 조절을 위해서 주로 적용되고 있다.
섬유주 미세우회 스텐트 중 1세대 아이스텐트에 대하여 Park et al [11]이 단기간 치료 성적 및 수술 성공률 분석을 진행하였으며, 본 연구를 진행하기 앞서 Gong et al [12]에서 아이스텐트와 아이스텐트 인젝트의 백내장 병합술 성공률 비교를 통하여 한국인에서 아이스텐트와 백내장수술 병합 시 아이스텐트 인젝트가 아이스텐트보다 안압하강 효과가 좋다는 결과를 얻었다. 하지만 국외에서는 젠 삽입술과 아이스텐트 인젝트 두 수술법에 대한 비교와 효과에 관한 연구가 있으나 국내에서는 이에 대한 비교와 합병증에 대한 연구가 없는 상태이다[13-15]. 이에 따라 본 연구는 국내 개방각녹내장 환자들에게서 아이스텐트 인젝트 삽입술과 젠 삽입술을 단독 및 백내장수술 병합 시행한 후 6개월간의 치료 성적의 비교, 예후 인자와 합병증에 대해 분석하고자 한다.
대상과 방법
본 연구는 2020년 3월부터 2021년 12월까지 가톨릭대학교 인천성모병원에서 개방각녹내장을 진단받고, 아이스텐트 인젝트 혹은 젠 단독 삽입술, 혹은 백내장수술과 병합하여 시행한 83안을 대상으로 하였으며, 후향적으로 분석하였다. 2020년 3월부터 수술 후 6개월 이상 추적 관찰이 가능한 환자를 대상으로 하였으며, 모든 수술은 1명의 수술자에 의해 시행되었다. 한 개 이상의 녹내장 안약을 사용하거나 안압이 21 mmHg 이상인 개방각녹내장의 경우, 전방각경검사에서 섬유주가 3사분면 이상 관찰이 가능한 경우를 포함하였으며, 백내장수술이 필요한 경우에는 백내장수술을 병합하여 시행하였다. 6개월 이상 추적 관찰이 불가능한 경우, 6개월 이내에 다른 안과적 수술을 받거나 안질환 병력이 있는 경우, 급성폐쇄각녹내장 발작의 경우, 시야 이상을 유발할 만한 다른 신경학적 질환이 있는 경우는 연구 대상에서 제외하였다. 본 연구는 헬싱키 선언에 입각한 인천성모병원의 의학연구윤리 심의위원회(Institutional Review Board)로부터 승인 번호 OC21RASI0011로 심의 승인을 받았다.
백내장수술을 병합하여 시행할 경우, 수술 전 교정시력이 0.6 이하이고 환자의 의사를 고려하여 적응증으로 결정하였다. 수술은 0.5% proparacaine hydrochloride (Alcaine, Alcon, Fort Worth, TX, USA)를 이용하여 점안마취 하에 진행되었으며, 5% potadine 용액으로 결막을 소독한 후에 시행되었다. 다이아몬드 칼로 이측에 2.75 mm의 각막윤부 절개선을 긋고, 각막을 절개한 후 점탄물질(Hyalu inj. 1.5%, Hanmi, Seoul, Korea)을 전방에 주입한 후 수정체낭 원형절개술을 시행하였다. 수력분리술을 시행 후 수정체 초음파 유화술로 핵과 피질의 일부를 제거하고 관류 및 흡입 장치로 잔류 피질을 제거한 후 낭 내에 점탄물질을 채워 팽창시켜 인공수정체를 인젝터(injector)로 삽입하였다. 아이스텐트 인젝트와 병합술의 경우, 백내장수술에 이어 전방각경으로 섬유주와 쉴렘관 상태 확인을 진행하고, 각막 절개 부위로 삽입기를 넣은 후 전방각경으로 스텐트의 위치를 확인하며, 쉴렘관에 수직으로 스텐트를 2개 삽입하였다(Fig. 1). 전방각경으로 스텐트의 위치를 확인 후 점탄물질을 제거 후, 각막절개부는 기질수화(stromal hydration)를 하여 마무리하였다. 젠과 백내장수술 병합술의 경우에는 백내장수술에 이어 전방각경으로 섬유주와 쉴렘관의 상태 확인하고, 각막 절개 부위로 삽입기를 넣은 후 비상측(supero-nasal) 방면으로 젠 삽입물을 삽입시켜 위치시켰으며, 이후 0.02% 농도의 mitomycin C 0.1 mL를 결막하 주사를 시행하였다(Fig. 2). 이후, 점탄물질을 제거한 후, 기질수화를 시행하여 각막절개를 마무리하였다.

iStent inject® in the trabecular meshwork (blue arrows). Two iStent injects are placed in trabecular meshwork and these can be observed through gonioscopy.
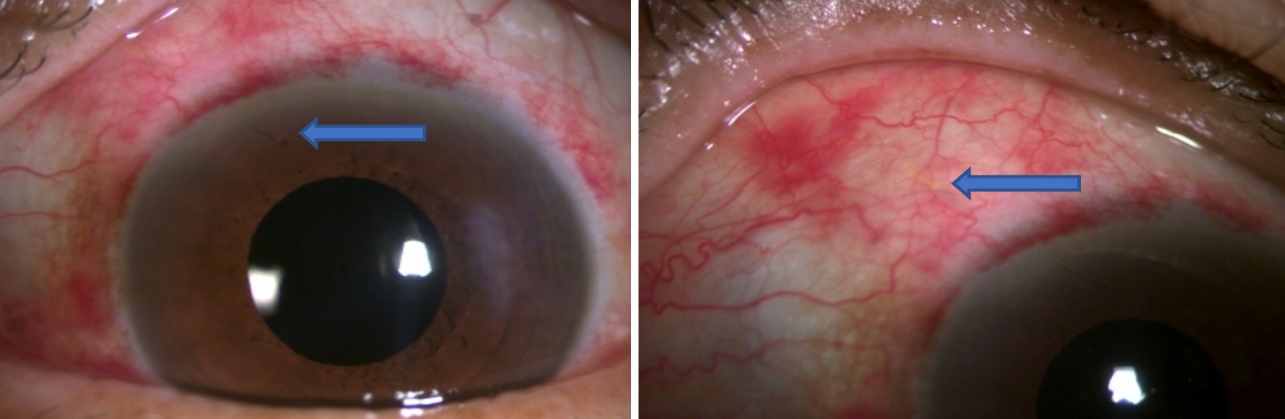
Xen® positioned at anterior chamber and subconjunctiva. Well positioned Xen® after surgery (blue arrow).
안압 및 수술 상태는 수술 후 1, 2, 3, 6개월 째에 확인하였다. 안압은 비접촉안압계(non-contact tonometer)와 골드만압평안압계(Goldmann applanation tonometer)로 측정하였으며, 골드만압평안압계는 모두 한 사람에 의해 측정되었다. 수술 성공의 기준은 안약 사용 유무와 상관없이 안압 기준으로 정의하여 분석하였다. 수술 전의 안압에 비해 20% 이상 감소한 경우를 성공으로 정의하였다. 또한, 각 군에 대해서 약물을 사용하지 않고 목표 안압에 도달했으며, 수술 전의 안압에 비해 20% 이상 감소한 경우 완전 성공(complete success), 약물 사용을 동반하면서 목표 안압에 도달한 제한적 성공(qualified success)을 나누어 분석을 진행하였다.
통계처리는 SPSS 통계프로그램(version 27.0; SPSS Inc., Chicago, IL, USA)을 사용하였으며, 수술 전 각 그룹의 연속형 변수 비교는 Mann-Whitney U test를 사용하였으며, 범주형 자료 chi-square test with Fisher’s exact test를 사용하였다. 수술 전과 후의 비교는 Wilcoxon signed rank test를 통해 비모수 분석하였다. 유의도(p-value) 0.05 미만인 경우에 통계적 유의성을 가지는 것으로 간주하였다. 수술 성공률(cumulative probabilities of success)은 Kaplan-Meier 생존 분석을 사용하였으며, log-rank test를 통해 각 군 간의 수술 성공률을 비교하였다. 수술 후 6개월의 수술 성공 결과에 영향을 주는 예후인자 콕스 회귀분석을 통하여 각 변수들의 위험비(hazard ratio, HR)와 5% 신뢰구간(confidence interval, CI)을 계산하였다.
결 과
아이스텐트 인젝트 단독 삽입술을 시행한 경우는 24안(A군), 아이스텐트 인젝트와 백내장수술 병합은 32안(A-1군), 젠 단독 삽입술을 시행한 경우는 15안(B군), 젠과 백내장수술 병합은 12안(B-1군)이었다. 아이스텐트 인젝트 단독 삽입술 중 유수정체안에서 시행한 경우가 7안, 젠 단독 삽입술 중 유수정체안에서 시행한 경우가 6안을 차지했다. A군과 B군, A-1군과 B-1군에서 나이, 성별, 당뇨 유무, 고혈압 유무, 수술 전 안압, 수술 전 사용한 안약의 개수, 안축장의 길이, 전방의 깊이, 각막내피세포수, 중심 각막 두께는 각각 유의한 차이가 없었다(Table 1).
A군에서는 수술 전 안압 22.42 ± 7.11 mmHg에 비하여, 수술 후 1달째 16.33 ± 3.41 mmHg (p<0.001), 수술 후 2달째 16.00 ± 3.04 mmHg (p<0.001), 수술 후 3달째 16.75 ± 4.10 mmHg (p<0.001), 수술 후 6달째 16.50 ± 3.44 mmHg (p<0.001)로 모두 유의한 안압 감소를 보였다. B군에서는 수술 전 안압 21.67 ± 4.80 mmHg에 비하여, 수술 후 1달째 15.93 ± 4.78 mmHg (p<0.001), 수술 후 2달째 16.53 ± 5.19 mmHg (p<0.001), 수술 후 3달째 16.07 ± 4.02 mmHg (p<0.001), 수술 후 6달째 16.27 ± 3.28 mmHg (p<0.001)로 모두 유의한 안압 감소를 보였다(Table 2, Fig. 3).
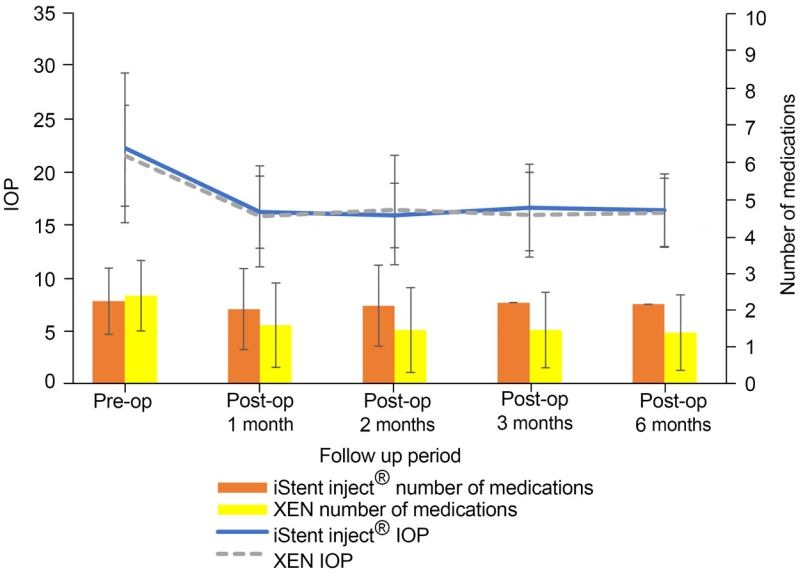
The change of IOP and glaucoma eyedrops during 6 months follow up. IOP decreased both iStent inject® (group A) and XEN® (group B). The number of glaucoma eyedrops decreased at XEN® (group B). IOP = intraocular pressure; Pre-op = preoperative; Post-op = postoperative.
A-1군에서는 수술 전 안압 18.66 ± 3.60 mmHg에 비하여, 수술 후 1달째 14.28 ± 2.55 mmHg (p<0.001), 수술 후 2달째 14.63 ± 2.66 mmHg (p<0.001), 수술 후 3달째 14.63 ± 2.71 mmHg (p<0.001), 수술 후 6달째 14.84 ± 2.75 mmHg (p<0.001)로 모두 안압이 유의하게 감소하였다. B-1군에서는 수술 전 안압 18.92 ± 3.68 mmHg에 비하여, 수술 후 1달째 13.00 ± 3.39 mmHg (p=0.003), 수술 후 2달째 12.58 ± 3.28 mmHg (p=0.002), 수술 후 3달째 12.75 ± 2.45 mmHg (p=0.002), 수술 후 6달째 13.17 ± 2.67 mmHg (p=0.002)로 모두 안압이 유의하게 감소하였다(Table 3, Fig. 4).
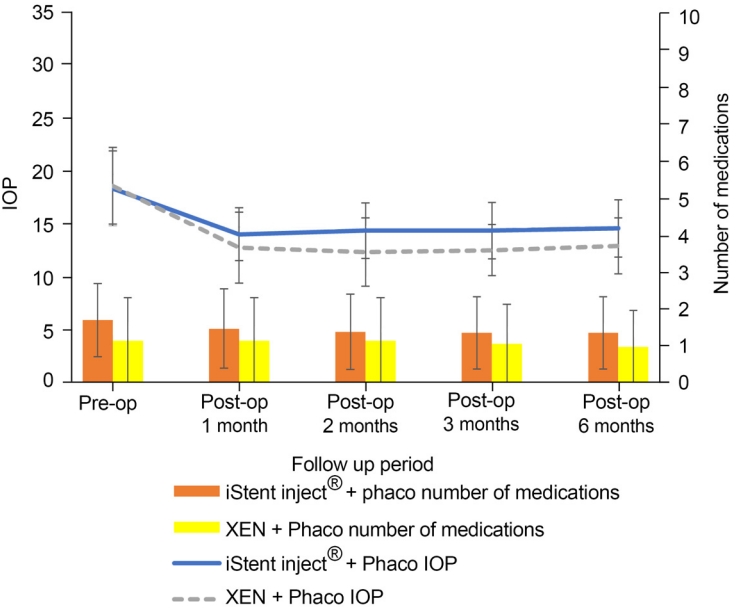
The change of IOP and glaucoma eyedrops during 6 months follow up. IOP decreased both iStent inject® + Phaco (group A-1) and XEN® + Phaco (group B-1). The number of glaucoma eyedrops decreased at iStent inject® + Phaco (group A-1). IOP = intraocular pressure; Pre-op = preoperative; Post-op = postoperative; Phaco = phacoemulsification.
A군에서 사용한 안압약의 개수는 수술 전 2.25 ± 0.88개에 비하여, 수술 후 1달째 2.04 ± 1.06개(p=0.129), 수술 후 2달째 2.13 ± 1.05개(p=0.257), 수술 후 3달째 2.21 ± 0.91개(p=0.655), 수술 후 6달째 2.17 ± 0.90개(p=0.414)로 유의미한 차이는 없었다. B군에서 사용한 안압약의 개수는 수술 전 2.40 ± 0.95개에 비하여, 수술 후 1달째 1.60 ± 1.14개(p=0.010), 수술 후 2달째 1.47 ± 1.15개(p=0.006), 수술 후 3달째 1.47 ± 1.02개(p=0.006)로 수술 후 6달째 1.40 ± 1.02개(p=0.011)로 감소하는 경향을 보였다. 통계적으로 유의하지 않았지만, A군에 비해서 B군의 안압약 사용 개수가 더 많이 감소하였다(Table 4, Fig. 2).

Comparison of preoperative and postoperative number of preoperative IOP-lowering medications in group A & group B
A-1군에서 사용한 안압약의 개수는 수술 전 1.73 ± 1.00개에 비하여, 수술 후 1달째 1.50 ± 1.09개(p=0.046), 수술 후 2달째 1.41 ± 1.03개(p=0.008), 수술 후 3달째 1.38 ± 0.99개(p=0.005), 수술 후 6달째 1.38 ± 0.99개(p=0.005)로 유의미한 감소를 보였으며, B-1군에서 사용한 안압약의 개수는 수술 전 1.17 ± 1.21개에 비하여, 수술 후 1달째 1.17 ± 1.21개(p=1.000), 수술 후 2달째 1.17 ± 1.21개(p=1.000), 수술 후 3달째 1.08 ± 1.11개(p=0.317)로 수술 후 6달째 1.00 ± 1.08개(p=0.317)로 유의미한 차이는 없었다. A군에 비해 B군의 안압약 사용이 통계적으로 더 적었다(Table 5, Fig. 3).

Comparison of preoperative and postoperative number of preoperative IOP-lowering medications in group A-1 & group B-1
수술 성공률은 수술 전후 안압 비교 수치를 기준으로 하였으며, Kaplan-Meier 생존 분석 결과에 따른 누적 성공률은 A군은 수술 1개월 후 66.7% ± 9.6%, 2개월 후 57.8% ± 10.2%, 3개월 후 52.0% ± 10.7%, 6개월 후 45.5% ± 11.2%였으며, B군은 수술 1개월 후 73.3% ± 11.4%, 2개월 후 66.0% ± 12.4%, 3개월 후 66.0% ± 12.4%, 6개월 후 52.8% ± 15.4%였으며, A군과 B군의 수술 성공률의 차이는 통계적으로 유의하지는 않았다(p=0.574) (Fig. 5A). A-1군은 수술 1개월 후 71.9% ± 7.9%, 2개월 후 58.8% ± 8.8%, 3개월 후 51.9% ± 9.0%, 6개월 후 51.9% ± 9.0%였으며, B-1군은 수술 1개월 후 83.3% ± 10.8%, 2개월, 3개월, 6개월 후 동일한 83.3% ± 10.8%였으며, B-1군의 수술 성공률이 A-1군에 비하여 높은 경향이 있으나 통계적으로 유의한 차이는 없었다(p=0.079) (Fig. 5B).
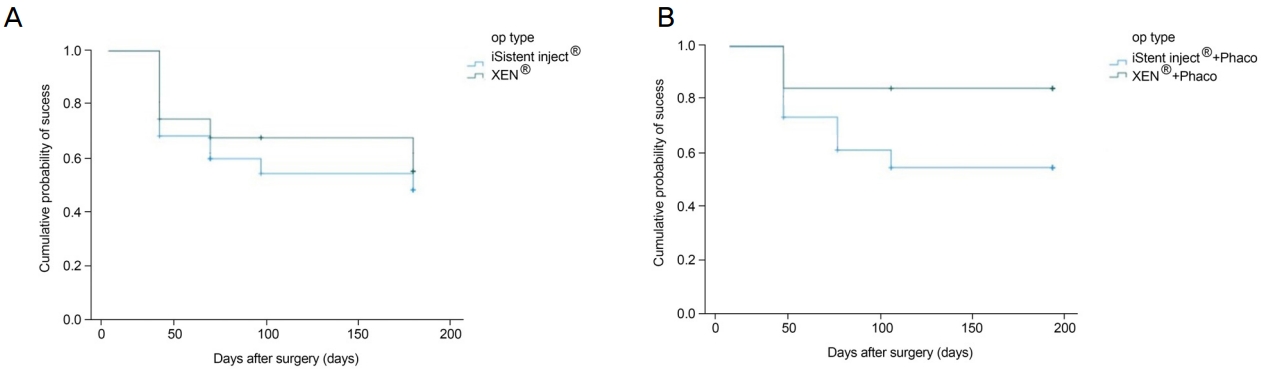
Kaplan-Meier curves used for successful intraocular pressure using the definition of success. (A) Success rate at 6 months was 45.5% in group A (iStent inject®) and 52.8% in group B (XEN®) (p = 0.574). (B) Success rate at 6 months was 51.9% in group A-1 (iStent inject® + Phaco) and 83.3% in group B-1 (XEN® + Phaco) (p = 0.007). OP = operation; Phaco = phacoemulsification.
수술 12개월 후 A군의 완전 성공(complete success)은 0% (n=0), 제한적 성공(qualified success)은 45.8% (n=11)였으며, B군의 완전 성공은 13.3% (n=2), 제한적 성공은 40.0% (n=6)였다. A-1군의 경우 완전 성공은 6.3% (n=2), 제한적 성공은 40.6% (n=13)였으며, B-1군의 완전 성공은 33.3% (n=4), 제한적 성공은 41.7% (n=5)였다.
수술 전 나이, 성별, 당뇨 유무, 고혈압 유무, 수술 전 안압, 수술 전 사용한 안압약의 개수, 안축장의 길이, 전방의 깊이, 각막내피세포수, 중심 각막 두께를 대상으로 수술 성공 여부와 관계에 대해 분석하고자 하였다. 연구는 콕스 회귀분석을 시행하였으며, 수술 전 안압이 수술 성공 여부에 유의하게 영향을 주는 인자로 나타났다. 단변량 콕스 회귀분석에서 수술 전 안압이 유의하게 영향을 주며(HR, 0.775; 95% CI, 0.67-0.90; p=0.001), 나이, 성별 및 수술 전 안압 등을 공변량으로 한 다변량 콕스 회귀분석에서도 수술 전 안압이 1 mmHg 높을수록 수술 실패율이 18% 낮아진다는 결론이 나왔다(HR, 0.827; 95% CI, 0.74-0.93; p=0.001) (Table 6).
수술 후 합병증은 총 8건 발생하였으며, 전방출혈(gross hyphema)이 발생한 경우 4건이었으며, 수술 6개월 후 모두 회복되었고 그중 수술 후 안압이 40 mmHg로 고안압이 동반된 경우도 호전이 확인되었다. 수술 후 1일째 수술안 안압이 25 mmHg 이상인 고안압 경우는 전방출혈 동반 경우를 포함하여 4건이었으며, 2건은 수술 후 6개월째 21 mmHg 미만으로 호전되었으나, 2건은 안압이 조절되지 않아 아메드삽입술을 시행하였다(Table 7).
고 찰
본 수술 결과 연구를 통해 한국인에서 아이스텐트 인젝트 삽입술과 젠 삽입술의 수술 결과를 비교하고자 하였다. 수술 후 6개월째 평균 안압하강률은 아이스텐트 인젝트 단독 삽입술(A군, 24안)이 33.80%, 젠 단독 삽입술(B군, 15안)이 24.91%, 아이스텐트 인젝트 삽입술과 백내장수술 병합(A-1군, 32안)이 20.47%, 젠 삽입술과 백내장수술 병합(B-1군, 12안)이 30.39%로 모두 수술 후 통계적으로 유의한 안압하강을 보였다. 수술 후 6개월 누적 성공률은 아이스텐트 인젝트 단독 삽입술(A군)이 45.5% ± 11.2%, 젠 단독 삽입술(B군)이 52.8% ± 15.4%, 아이스텐트 인젝트와 백내장수술 병합(A-1군) 51.9% ± 9.0%, 젠과 백내장수술 병합(B-1군) 83.3% ± 10.8%로 B-1군이 A-1군에 비해 성공률이 높은 경향성은 보였으나, 유의미하지 않은 성공률(p=0.079)을 보였으며, A군과 B군의 성공률 차이는 유의하지 않았다(p=0.574). 또한, 수술 전 안압이 수술 성공률과 연관성이 있으며, 수술 전 안압이 1.0 mmHg 높을수록 수술 성공 확률이 17.3% 높아진다는 결론이 나왔다(HR, 0.827; p=0.001).
섬유주 미세우회 스텐트삽입술의 단기 및 장기간 수술 결과 보고에 대해서 국외에서는 많은 연구가 진행되어 있다[16-18]. Le and Saheb [16]은 미세우회 스텐트삽입술 결과를 요약하였으며, 술 후 안압하강은 16-33%, 녹내장 약물 감소는 0.5-2개를 보인다는 논문을 발표하였다. 또한 백내장수술과 병합을 하여 진행하여 비교한 논문인 Samuelson et al [19]에서는 백내장수술만 진행한 123건에서 5.4%의 안압하강, 백내장수술과 1개의 아이스텐트를 삽입한 117건에서 8.2%의 안압하강을 확인하여, 이를 통해 백내장수술과 병합하였을 때 효과가 더 좋다는 결론을 얻었다. 젠 삽입술은 고식적인 수술법과 비교를 했을 때, 안전성 및 효과에 큰 차이가 없다는 것에 대해서는 연구가 진행되고 있는 상태이다[20,21]. 2021년 Nicolaou et al [22]에 보고된 바에 따르면 대조군인 젠 단독 삽입술 시행한 76건과 실험군인 젠과 백내장수술 병합 107건에 대하여 수술 후 24개월 동안 후향적 분석을 하였을 때, 대조군에서는 30%의 안압하강, 실험군에서는 31%의 안압하강이 나타나 유의한 차이는 없으나 두 수술법 모두 효과적이라는 결과를 얻었다.
이번 연구는 아이스텐트 인젝트 삽입술과 젠 삽입술 모두 안압하강에 유의미한 효과가 있으며, 단독 삽입술과 백내장 병합술 모두 통계적으로 유의미한 안압하강 결과를 얻을 수 있어 국외의 비교 연구들과 상응한 결과를 확인할 수 있었다. 본원에서 단순 백내장수술만 시행한 대조군 20명 정도를 대조군으로 설정하여 비교한 결과, 수술 전 안압 17.55 ± 2.27 mmHg에 비하여 수술 6개월 후 15.20 ± 1.83 mmHg의 안압하강이 있었다. 13.39%의 안압하강을 보였으나, 본 연구에서 보인 안압하강에 비해 하강률이 적었다. 추가적으로 젠 삽입술이 아이스텐트 인젝트에 비하여 누적 성공률이 높은 경향을 보였으나 통계적 유의한 결과는 보이지 않아 장기적인 비교 분석의 전향적인 연구가 필요할 것으로 사료된다.
아이스텐트 인젝트 및 젠 삽입술의 성공률만을 단순 비교했을 때, 일부에서 본 연구보다 더 높은 경우가 보고된 바 있다. 이러한 결과는 연구 간 수술의 적응증과 술기의 차이로 인해서 유발되었을 것이라고 추측한다. 본 연구 대상자의 수술 전 평균 안압이 상대적으로 낮은 20대 초반이었기 때문에, 유의한 안압하강 효과를 보였어도 일률적인 20%의 성공 확률을 가까스로 도달하지 못할 수 있다. 마찬가지로 수술 대상자의 수술 전 안압이 상대적으로 낮았기 때문에, 술 후 안압을 낮추기 위한 술기들을 시행할 필요가 없었다. 여러 연구에서 언급되고 있는 술 후 안구 압박 마사지나 술 후 결막의 조작 및 정리 수술을 병합한다면 수술 성공률이 상승할 수 있다. 마지막으로 일부 보고에서처럼 수술 성공을 목표 안압의 달성으로 정의하게 된다면, 본 연구의 수술 성공률은 크게 높아지게 된다. 그러나 본 연구의 목적은 수술 성공률의 일률적인 비교보다는 안압하강의 지속성과 안압약의 감소, 합병증의 조사였기 때문에 수치 자체에 중점을 두지 않았다.
본 연구에서 보고된 8건의 수술 후 합병증에서 가장 흔하게 나타난 합병증은 각 4건 보고된 전방출혈과 고안압이었고, 그중 2건의 단순 고안압에서 아메드밸브삽입술을 시행하였다. 이를 통해 수술 후 전방출혈보다 고안압의 경우가 수술 성공률에 유의미하게 영향을 주는 것으로 사료된다. 또한 수술 전 안압이 1 mmHg 높을수록 수술 실패율이 18% 낮아지는 결론이 나왔으며(HR, 0.775; 95% CI, 0.67-0.90; p=0.001), 이 결과는 Ferguson et al [23]이 이전에 발표한 수술 전 안압이 높을수록 수술 후 안압하강 정도가 크다는 논문의 결과와 상응한다.
본 연구는 모든 수술이 1명의 수술자에 의해 시행되어 수술자 요소의 영향을 주지 않았으나, 전체 대상이 83건으로 수가 작고 12개월이라는 단기간의 예후를 후향적으로 분석하여 제한점이 존재한다. 하지만 결론적으로 한국인에서 아이스텐트 인젝트와 젠 삽입술 모두 안압하강에 유의미한 효과가 있으며, 젠 삽입술의 경우 통계적으로 유의하진 않으나 아이스텐트 인젝트에 비해서 수술 성공률이 더 높은 것을 확인할 수 있었다. 지속적인 미세침습 녹내장수술에 대한 임상적 적용과 연구를 한다면, 성공적 녹내장 치료의 한 단계 도약을 할 수 있을 것으로 사료된다.
Notes
Conflicts of Interest
The authors have no conflicts to disclose.
References
Biography
마건정 / Gun Jung Ma
가톨릭대학교 의과대학 인천성모병원 안과학교실
Department of Ophthalmology, Incheon St. Mary’s Hospital, College of Medicine, The Catholic University of Korea





