 |
 |
| J Korean Ophthalmol Soc > Volume 62(2); 2021 > Article |
|
ĻĄŁļ¼Ėņ┤łļĪØ
ļ¬®ņĀü
ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖņéĮņ×ģņłĀņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś 1ļģä ņ×äņāü ņä▒ņĀüņØä ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļīĆņāüĻ│╝ ļ░®ļ▓Ģ
ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖņéĮņ×ģņłĀņØ┤ ņŗżĒī©ĒĢśņŚ¼ ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀCļź╝ ņØ┤ņÜ®ĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ņĄ£ņåī 12Ļ░£ņøö ņØ┤ņāüņØĖ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ Kaplan-Meier ņāØņĪ┤ļČäņäØņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖņéĮņ×ģņłĀņØ┤ ņłśņłĀ ņä▒ņĀüņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż. ņÖäņĀä ņłśņłĀ ņä▒Ļ│ĄņØĆ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ņĢłņĢĢņØ┤ 18 mmHg ņØ┤ĒĢśņØ┤Ļ│Ā, 20% ņØ┤ņāü ĒĢśĻ░ĢĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
Ļ▓░Ļ│╝
ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņØĆ 9ļ¬ģ 10ņĢł, ļīĆņĪ░ĻĄ░ņØĆ 10ļ¬ģ 10ņĢłņØ┤ņŚłļŗż. ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņØś ņłśņłĀ Ēøä 12Ļ░£ņøöņØś ņÖäņĀä ņä▒Ļ│ĄļźĀņØĆ Ļ░üĻ░ü 80%, 90%ņśĆļŗż(p=0.584). ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņŚÉņä£ ĒÅēĻĘĀ ņĢłņĢĢņØĆ ņłśņłĀ ņĀä 29.0 ┬▒ 7.4 mmHg, ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ėņŗ£ 12.4 ┬▒ 3.1 mmHgņśĆļŗż(p<0.001). ļīĆņĪ░ĻĄ░ņŚÉņä£ ĒÅēĻĘĀ ņĢłņĢĢņØĆ ņłśņłĀ ņĀä 29.2 ┬▒ 7.5 mmHg, ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ėņŗ£ 12.1 ┬▒ 4.1 mmHgņśĆĻ│Ā(p<0.001), ņłśņłĀ ņĀä, ĻĘĖļ”¼Ļ│Ā ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ėņŗ£ ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(Ļ░üĻ░ü p=0.828, p=0.387).
ABSTRACT
Purpose
To evaluate the efficacy of trabeculectomy with mitomycin C (MMC) for primary open angle glaucoma (POAG) in eyes refractory to a trabecular micro-bypass stent.
Methods
We reviewed the medical records of patients with POAG who underwent trabeculectomy with MMC after failed trabecular micro-bypass stent implantation. All patients had a Ōēź12 months follow-up. We compared surgical outcomes according to trabecular micro-bypass stent implantation using a Kaplan-Meier survival analysis. Complete surgical success was defined as intraocular pressure (IOP) Ōēż18 mmHg and IOP reduction Ōēź20% without medication.
Results
A total of 19 patients (20 eyes) were included; 10 eyes of nine patients in the trabecular micro-bypass stent group and 10 eyes of 10 patients in the control group. The cumulative probabilities of complete success after trabeculectomy with MMC were 80% and 90% after 1 year in the trabecular micro-bypass stent and control groups, respectively (p = 0.584). Mean IOP decreased from 29.0 ┬▒ 7.4 mmHg preoperatively to 12.4 ┬▒ 3.1 mmHg at the final visit in the trabecular micro-bypass stent group (p < 0.001). Mean IOP decreased from 29.2 ┬▒ 7.5 mmHg preoperatively to 12.1 ┬▒ 4.1 mmHg at the final visit in the control group (p < 0.001). The preoperative and final IOP were not significantly different between the two groups (p = 0.828, p = 0.387, respectively).
ļģ╣ļé┤ņןņØĆ ņĢłņĢĢņāüņŖ╣ ļśÉļŖö ĻĘĖ ņÖĖņØś ņŚ¼ļ¤¼ ņøÉņØĖņ£╝ļĪ£ ņŗ£ņŗĀĻ▓ĮņØ┤ ņåÉņāüļÉśņ¢┤ ņ¦äĒ¢ēĒĢśļŖö ņŗ£ņĢ╝Ļ▓░ņåÉņ£╝ļĪ£ ļéśĒāĆļéśļŖö ņ¦łĒÖśņØ┤ļŗż[1]. ĻĘĖņżæ Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØĆ ļģ╣ļé┤ņן ņżæņŚÉņä£ Ļ░Ćņן ļ¦ÄņØĆ ĒśĢĒā£ņØś ļģ╣ļé┤ņןņØ┤ļŗż[2]. Ēśäņ×¼ ļģ╣ļé┤ņןņØś ņłśņłĀņĀü ņ╣śļŻī ļ░®ļ▓Ģ ņżæ Ļ░Ćņן ļäÉļ”¼ ņō░ņØ┤Ļ│Ā ņ׳ļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒Ļ│ĄļźĀņØĆ 67-94%ļĪ£ ļåÆņ¦Ćļ¦ī, ņłĀ Ēøä ĒĢ®ļ│æņ”ØļÅä ļ¦ÄņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ļŖö ņ┤łĻĖ░ņØś Ļ▓░ļ¦ēļłäņČ£, ĒøäĻĖ░ņŚÉļŖö ļ¼┤ĒśłĻ┤Ć ļéŁĒżņä▒ ņŚ¼Ļ│╝Ēż ĒśĢņä▒, ļśÉļŖö ņŚ¼Ļ│╝Ēż ļłäņČ£, ņĀäļ░®ņČ£Ēśł, ļ¦źļØĮļ¦ēņāüĻ░ĢņČ£Ēśł, ņĀĆņĢłņĢĢ, ļ¦źļØĮļ¦ēņé╝ņČ£, ņĀĆņĢłņĢĢ ĒÖ®ļ░śļ│æņ”Ø, ņŚ¼Ļ│╝Ēż Ļ┤ĆļĀ© Ļ░ÉņŚ╝ ļō▒ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[3-7].
ņĄ£ĻĘ╝ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ļ░£ņāØĒĢśļŖö ĒĢ®ļ│æņ”ØņØä ņśłļ░®ĒĢśĻ│Ā ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĢłņĢĢņØä Ļ░ÉņåīĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ»ĖņäĖņ╣©ņŖĄ ļģ╣ļé┤ņןņłśņłĀ(minimally-invasive glaucoma surgery)ņØ┤ Ļ░£ļ░£ļÉśņ¢┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ļīĆņĢłņ£╝ļĪ£ ņĀ£ņŗ£ļÉśĻ│Ā ņ׳ļŗż. ĻĘĖņżæ ĻĄŁļé┤ņŚÉ Ļ░Ćņן ļ©╝ņĀĆ ļÅäņ×ģļÉ£ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖņéĮņ×ģņłĀ(trabecular micro-bypass stents, iStent; Glaukos Corporation, Laguna Hills, CA, USA)ņØĆ ņłśņłĀ Ēøä ņĢłņĢĢĒĢśĻ░ĢņØ┤ 16-33%, ņłśņłĀ Ēøä ļģ╣ļé┤ņן ņĢĮļ¼╝ Ļ░ÉņåīļŖö 0.5-2Ļ░£ņśĆļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[8]. iStentņØś ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ ņéĮņ×ģļÉśļŖö iStentņØś Ļ░£ņłśņŚÉ ņśüĒ¢źņØä ļ░øĻ│Ā, 1Ļ░£ņØś iStent ņéĮņ×ģņŗ£ 20% ņØ┤ņāüņØś ņĢłņĢĢĒĢśĻ░ĢņØä ļ│┤ņØ┤ļŖö ļ╣äņ£©ņØĆ ņłśņłĀ Ēøä 12Ļ░£ņøöņŚÉ 89%, ņłśņłĀ Ēøä 42Ļ░£ņøöņŚÉ 61%ļĪ£ ņןĻĖ░Ļ░ä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņŗ£ Ļ░ÉņåīĒĢśņśĆļŗż[9]. ļ│Ė ņŚ░ĻĄ¼ ĻĘĖļŻ╣ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ļŖö iStentļź╝ 1Ļ░£ ņéĮņ×ģĒĢśņśĆņØä Ļ▓ĮņÜ░ ņłśņłĀ Ēøä 6Ļ░£ņøöņŚÉ ņĢłņĢĢ 20 mmHg ļ»Ėļ¦ī ļ░Å 20% ņØ┤ņāüņØś ņĢłņĢĢĒĢśĻ░ĢņØä ļ│┤ņØ┤ļŖö ļ╣äņ£©ņØĆ 33.7%ļĪ£ ĻĄŁņÖĖ Ļ▓░Ļ│╝ļōżņŚÉ ļ╣äĒĢśņŚ¼ ĒĢ£ĻĄŁņØĖņŚÉņä£ņØś ņłśņłĀ ņä▒Ļ│ĄļźĀņØ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[10]. ļśÉĒĢ£, iStent Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ļŖö ņłĀ Ēøä ņĢłņĢĢņāüņŖ╣, ņŖżĒģÉĒŖĖ ļ¦ēĒל ļśÉļŖö ņŖżĒģÉĒŖĖņØś ņ£äņ╣śņØ┤ņāü, ņĀäļ░®ņČ£Ēśł ļō▒ņØ┤ ļéśĒāĆļéĀ ņłś ņ׳ļŗż[11]. ņØ┤ņÖĆ Ļ░ÖņØ┤ iStent ņéĮņ×ģņłĀ Ēøä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ļō▒ņØś 2ņ░©ņĀüņØĖ ņłśņłĀņØ┤ ĒĢäņÜöļĪ£ ĒĢĀ ņłś ņ׳ļŗż.
Ļ▓░ļ¦ēņĀłĻ░£ ņŚåņØ┤ ņ×æņØĆ Ēł¼ļ¬ģ Ļ░üļ¦ēņĀłĻ░£ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ ļ░▒ļé┤ņןņłśņłĀ Ēøä 12Ļ░£ņøöņŚÉņä£ 35Ļ░£ņøö ņé¼ņØ┤ņŚÉ ĒÖśņ×ÉņØś ļ░®ņłśļź╝ ņ▒äņĘ©ĒĢśņŚ¼ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ ņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ļ░®ņłś ĒØÉļ”╝ ņłśņ╣śĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņŚ¼ ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņØ┤ ļ░£Ļ▓¼ļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[12]. ņØ┤ļ¤¼ĒĢ£ ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņ£╝ļĪ£ ņØĖĒĢ£ ļ░®ņłś ņä▒ņāüņØś ļ│ĆĒÖöļŖö Ļ▓░ļ¦ēĒĢś ņä¼ņ£ĀĒÖöļź╝ ņ┤ēņ¦äĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņŗżĒī©ņŚÉ ĻĖ░ņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[13-15]. ļö░ļØ╝ņä£, ņØ┤ļ¤¼ĒĢ£ ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ļōżņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ Ēł¼ļ¬ģ Ļ░üļ¦ēņĀłĻ░£ļź╝ ņØ┤ņÜ®ĒĢśļŖö ņĢłĻĄ¼ļé┤ ņłśņłĀļĪ£ņä£ iStent ņéĮņ×ģņłĀ ņŗ£Ē¢ē ĒøäņŚÉ iStent ņéĮņ×ģņłĀ ņ×Éņ▓┤ļĪ£ ņØĖĒĢ£ ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņØ┤ ļ░£ņāØĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ Ļ░ĆņĀĢĒĢśņśĆļŗż. ļśÉĒĢ£, Ēśäņ×¼Ļ╣īņ¦Ć ĻĄŁļé┤ ļ░Å ĻĄŁņÖĖņŚÉņä£ iStent ņéĮņ×ģņłĀ Ēøä ņŗ£Ē¢ēĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņŚÉ ļīĆĒĢ£ ņ×äņāü ņä▒ņĀüņØä ļ│┤Ļ│ĀĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņŚåĻĖ░ņŚÉ 1ļģä ņ×äņāü ņä▒ņĀüņØä ļ│┤Ļ│ĀĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö 1Ļ░£ņØś iStent ņéĮņ×ģņłĀ ņØ┤ĒøäņŚÉļÅä ņĢłņĢĢņØ┤ ņĪ░ņĀłļÉśņ¦Ć ņĢŖņĢä ļ¦łņØ┤ĒåĀļ¦łņØ┤ņŗĀC (mitomycin C, MMC)ļź╝ ņØ┤ņÜ®ĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ē ļ░øĻ│Ā ņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ņĄ£ņåī 12Ļ░£ņøö ņØ┤ņāüņØĖ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņä▒ļ│ä, ļéśņØ┤, ņŗ£ņĢ╝ Ļ▓Ćņé¼ņØś mean deviation (MD)ņ£╝ļĪ£ ĒīÉļŗ©ĒĢ£ ļģ╣ļé┤ņן ņåÉņāü ņĀĢļÅäļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀļ¦ī ļŗ©ļÅģņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļīĆņĪ░ĻĄ░ņØä ņäżņĀĢĒĢśņŚ¼ ņłśņłĀ ņä▒ņĀüņØä ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż. ņØ┤ ņŚ░ĻĄ¼ļŖö ņØĖĻ░ä ļīĆņāü ņŚ░ĻĄ¼ļź╝ ņ£äĒĢ£ ĒŚ¼ņŗ▒ĒéżņäĀņ¢ĖņØä ņżĆņłśĒĢśņŚ¼ ņŗ£Ē¢ēļÉśņŚłĻ│Ā, ļČĆņé░ļīĆĒĢÖļ│æņøÉ ņāØļ¬ģņ£żļ”¼ņŗ¼ņØśņ£äņøÉĒÜī(Institutional Review Board)ļĪ£ļČĆĒä░ ņŖ╣ņØĖņØä ļ░øņĢśļŗż(ņŖ╣ņØĖ ļ▓łĒśĖ: 2005-003-090).
ņłśņłĀņØä ņŗ£Ē¢ēĒĢ£ ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņłśņłĀ ņĀä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀź(best corrected visual acuity), ņäĖĻĘ╣ļō▒Ēśäļ»ĖĻ▓ĮĻ▓Ćņé¼, Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļź╝ ņØ┤ņÜ®ĒĢ£ ņĢłņĢĢ ņĖĪņĀĢ, ņĀäļ░®Ļ░üĻ▓ĮĻ▓Ćņé¼, ņé░ļÅÖņĢłņĀĆĻ▓Ćņé¼, ņŗ£ņŗĀĻ▓ĮĻ│╝ ļ¦Øļ¦ēņŗĀĻ▓Įņä¼ņ£ĀņĖĄņ┤¼ņśü(AFC-210; Nidek, Gamagori, Japan), ņ×ÉļÅÖņŗ£ņĢ╝Ļ▓Ćņé¼(Humphrey Field Analyzer, Swedish interactive threshold algorithm standard C24-2; Carl Zeiss Meditec, Inc. Dublin, CA, USA), ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼(Cirrus HD-OCT, Carl Zeiss Meditec, Inc. Dublin, CA, USA)ļź╝ ĒżĒĢ©ĒĢ£ ņ▓ĀņĀĆĒĢ£ ņĢłĻ│╝ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņןņØĆ ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāüĻ│╝ ņØ┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņĀäļ░®Ļ░üņØĆ Ļ░£ļ░®ļÉśņ¢┤ņ׳Ļ│Ā, ņ╣śļŻī ņĀäņĢłņĢĢ >21 mmHgņØĖ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāüņØĆ ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒĢ©ļ¬░ļ╣ä Ōēź0.7, ņ¢æņĢłņØś ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒĢ©ļ¬░ļ╣ä ņ░©ņØ┤ Ōēź0.2, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉĒģīņØś Ēī©ņ×äņØ┤ļéś ņ¢ćņĢäņ¦É, ņŗ£ņŗĀĻ▓Įņ£ĀļæÉņČ£Ēśł, ņŗ£ņŗĀĻ▓Įņä¼ņ£ĀĻ▓░ņåÉ ņżæ ĒĢ£ Ļ░Ćņ¦Ć ņØ┤ņāüņØ┤ ĒÖĢņØĖļÉ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, ļģ╣ļé┤ņןņä▒ ņŗ£ņĢ╝Ļ▓░ņåÉņØĆ ņŗĀļó░ĒĢĀ ņłś ņ׳ļŖö ļæÉ ļ▓łņØś ņŚ░ņåŹņĀüņØĖ ņŗ£ņĢ╝Ļ▓Ćņé¼ņŚÉņä£ glaucoma hemifield testĻ░Ć ŌĆ£outside normal limitŌĆØņØ┤ ļéśĒāĆļéĀ ļĢī, ļśÉļŖö pattern deviation plotņŚÉņä£ ĒÖ£ļ¬©ņ¢æ ņśüņŚŁņŚÉ ņ׳ļŖö 3Ļ░£ ņØ┤ņāü ņĀÉņØś ņŚŁņ╣śĻ░Ć ņĀĢņāüņØś 5% ļ»Ėļ¦īņŚÉņä£ ļéśĒāĆļéśĻ│Ā ĻĘĖņżæ ĒĢ£ ņĀÉņØ┤ 1% ļ»Ėļ¦īņØ╝ ļĢīņØ┤Ļ▒░ļéś, pattern standard deviation (PSD) <5% Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[16]. ņŗ£ņŗĀĻ▓Į, ĒÖ®ļ░ś ļśÉļŖö ņŗ£ņĢ╝ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŖö ņĢłĻ│╝ņĀü Ēś╣ņØĆ ņŗĀĻ▓ĮĻ│╝ņĀü ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ņŚ░ĻĄ¼ņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż. iStent ņéĮņ×ģņłĀ Ēøä ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØĆ iStent ņéĮņ×ģņłĀ ņØ┤Ēøä ņĄ£ļīĆņĢĮļ¼╝ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĄ£ņåī 2ļ▓łņØś ņŚ░ņåŹņĀüņØĖ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņŚÉņä£ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśļĪ£ ņĪ░ņĀłļÉśņ¦Ć ņĢŖĻ▒░ļéś, 20% ņØ┤ņāü ņĢłņĢĢņØ┤ Ļ░ÉņåīĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░, ļģ╣ļé┤ņןņä▒ ņŗ£ņŗĀĻ▓ĮņåÉņāü Ēś╣ņØĆ ņŗ£ņĢ╝Ļ▓░ņåÉņØ┤ ņ¦äĒ¢ēĒĢśļŖö Ļ▓ĮņÜ░ņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż[17].
iStentļŖö ļåÆņØ┤ 0.33 mm, ĻĖĖņØ┤ 1.00 mmņØś L ļ¬©ņ¢æņØś ĒŚżĒīīļ”░ņ£╝ļĪ£ ņĮöĒīģļÉ£ Ēŗ░ĒāĆļŖä ņŖżĒģÉĒŖĖņØ┤ļ®░, 1ĒÜīņÜ® ņØĖņä£Ēä░ņŚÉ ņäżņ╣śļÉśņ¢┤ ņ׳ļŗż. ņØ┤ņĖĪļČĆņŚÉ Ēł¼ļ¬ģĻ░üļ¦ēņĀłĻ░£ļź╝ ĒĢśĻ│Ā ņĀÉĒāäļ¼╝ņ¦ł 1.0% sodium hyaluronate (Hyal 2000; LG Life Sciences, Seoul, Korea)ņØä ņĀäļ░®ņŚÉ ņ▒äņøī ņĀäļ░®Ļ░üņØä Ļ╣ŖĻ▓ī ĒĢśĻ│Ā ņĀäļ░®ņØä ņ£Āņ¦ĆĒĢśņśĆļŗż. ņĀäļ░®Ļ░üĻ▓ĮņØä ĒåĄĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņÖĆ ņē┤ļĀśĻ┤ĆņØś ņ£äņ╣śļź╝ ĒÖĢņØĖĒĢśĻ│Ā Ļ░üļ¦ēņĀłĻ░£ ļČĆņ£äļź╝ ĒåĄĒĢśņŚ¼ ņØĖņä£Ēä░ļź╝ ļäŻņØĆ Ēøä ņŖżĒģÉĒŖĖļź╝ ņāüļ╣äņĖĪ Ēś╣ņØĆ ĒĢśļ╣äņĖĪ ņē┤ļĀśĻ┤ĆņŚÉ ņłśņ¦üņ£╝ļĪ£ ņéĮņ×ģĒĢśņśĆļŗż. ņŖżĒģÉĒŖĖĻ░Ć ņĀüņĀłĒĢ£ ņ£äņ╣śņŚÉ ņéĮņ×ģļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢ£ Ēøä ņĀÉĒāäļ¼╝ņ¦łņØä ņĀ£Ļ▒░ĒĢśņśĆĻ│Ā, Ēł¼ļ¬ģ Ļ░üļ¦ēņĀłĻ░£ļŖö ĻĖ░ņ¦łņłśĒÖöļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. iStent ņéĮņ×ģņłĀ Ēøä ņĢłņĢĮņØĆ Levofloxacin (CravitŌōć; Santen Pharm, Co., Osaka, Japan), Prednisolone acetate (PredbellŌōć; CKD Pharm, Co., Seoul, Korea) ņĀÉņĢłņĢĪņØä ĒĢśļŻ© 4ĒÜī 1ņŻ╝ņØ╝ ļÅÖņĢł ņé¼ņÜ®ĒĢśņśĆĻ│Ā, 8ņŻ╝ņŚÉ Ļ▒Ėņ│É ņé¼ņÜ® Ēܤņłśļź╝ Ļ░Éņåīņŗ£ņ╝░ļŗż.
ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØĆ ĻĄŁņåīļ¦łņĘ©ĒĢśņŚÉ ņøÉĻ░£ĻĖ░ņĀĆĻ▓░ļ¦ēĒÄĖ ĒśĢņä▒ņØä ņ£äĒĢśņŚ¼ Ļ░üļ¦ēņ£żļČĆ Ļ▓░ļ¦ēņØä 5-6 mmļĪ£ ņĀłĻ░£ĒĢśņŚ¼ Ļ▓░ļ¦ēĻ│╝ Ēģīļģ╝ļéŁņØä Ļ▓░ļ¦ēļéŁ ņ¬Įņ£╝ļĪ£ ļ░Ģļ”¼ļź╝ ĒĢśĻ│Ā 3 ├Ś 3 mm Ēü¼ĻĖ░, 2/3 Ļ│Ąļ¦ē ļæÉĻ╗śņØś ņĀĢņé¼Ļ░üĒśĢ Ļ│Ąļ¦ēĒÄĖņØä ļ¦īļōżņŚłļŗż. 0.4 mg/mLņØś ĒؼņäØļÉ£ MMCļź╝ ņĀüņŗĀ Weck-cell ņŖżĒÄĆņ¦Ćļź╝ Ēģīļģ╝ļéŁĻ│╝ Ļ│Ąļ¦ē ņé¼ņØ┤ņŚÉ 2-3ļČä ļÅÖņĢł ņĀæņ┤ēņŗ£Ēé© ļŗżņØī ņŖżĒÄĆņ¦Ćļź╝ ņĀ£Ļ▒░ĒĢśĻ│Ā ņĢĮ 20 mLņØś ĒÅēĒśĢņŚ╝ĻĖ░ņÜ®ņĢĪņ£╝ļĪ£ ņäĖņ▓ÖņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļé┤ņĖĪĻ│Ąļ¦ēņĀłĻ░£ņłĀņØä ņŗ£Ē¢ēĒĢśĻ│Ā ņØ┤ļź╝ ĒåĄĒĢśņŚ¼ ņŻ╝ļ│Ć ĒÖŹņ▒äļź╝ ņĀłņĀ£ĒĢ£ Ēøä ļ»Ėļ”¼ Ļ│Ąļ¦ēĒÄĖņØś ļÆżņ¬Į ļ¬©ņä£ļ”¼ņŚÉ ņäżņ╣śĒĢ┤ļæö 9-0 ļéśņØ╝ļĪĀ ļ┤ēĒĢ®ņé¼(Ethicon Inc., Johnson & Johnson, Somerville, NJ, USA)ļĪ£ ļæÉ ĻĄ░ļŹ░ Ļ░£ļ┤ē ļ┤ēĒĢ®ņØä ņŗ£Ē¢ēĒĢśņŚ¼ Ļ│Ąļ¦ēĒÄĖņØä ņøÉņ£äņ╣śņŚÉ ļ┤ēĒĢ®ĒĢśņśĆļŗż.
ņØ┤Ēøä Ļ▓░ļ¦ēņØĆ ņ¢æņ¬ĮņŚÉņä£ 10-0 ļéśņØ╝ļĪĀ ļ┤ēĒĢ®ņé¼(Ethicon Inc., Johnson & Johnson, Somerville, NJ, USA)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ēģīļģ╝ļéŁĻ│╝ ĒĢ©Ļ╗ś Ļ│Ąļ¦ēņŚÉ Ļ│ĀņĀĢļ┤ēĒĢ®ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĀäļ░®ņ▓£ņ×É ļČĆņ£äļź╝ ĒåĄĒĢśņŚ¼ ĒÅēĒśĢņŚ╝ĻĖ░ņÜ®ņĢĪņØä ņŻ╝ņ×ģĒĢśņŚ¼ ņĀäļ░®ņØä ĒśĢņä▒ņŗ£ĒéżĻ│Ā Ļ│Ąļ¦ēĒÄĖņØä ĒåĄĒĢ£ ļ░®ņłśņØś ņ£ĀņČ£ ņĀĢļÅäņÖĆ Ļ▓░ļ¦ē ļ┤ēĒĢ® ļČĆļČäņØä ĒåĄĒĢ£ ļ░®ņłś ļłäņČ£ņØ┤ ņ׳ļŖöņ¦Ć ĒÖĢņØĖĒĢśņśĆļŗż. ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ņĢłņĢĮņØĆ Levofloxacin (CravitŌōć; Santen Pharm, Co.), Prednisolone acetate (PredbellŌōć; CKD Pharm, Co.) ņĀÉņĢłņĢĪņØä ĒĢśļŻ© 4ĒÜī ņØ╝ņŻ╝ņØ╝ ļÅÖņĢł ņé¼ņÜ®ĒĢśņśĆĻ│Ā, 8ņŻ╝ņŚÉ Ļ▒Ėņ│É ņé¼ņÜ® Ēܤņłśļź╝ Ļ░Éņåīņŗ£ņ╝░ļŗż. ņĢłņĢĢĻ│╝ ņŚ¼Ļ│╝ĒżņØś ņāüĒā£ņŚÉ ļö░ļØ╝ ņĢłĻĄ¼ ņ¦ĆņĢĢĻ│╝ Ļ░£ļ┤ēļ┤ēĒĢ®ņé¼ ņĀ£Ļ▒░ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. iStent ņéĮņ×ģņłĀ ņŗ£Ē¢ēņŗ£ņŚÉ ņÜ░ņĢłņØĆ 2-4ņŗ£ ņé¼ņØ┤, ņóīņĢłņØĆ 8-10ņŗ£ ņé¼ņØ┤ņŚÉ ņ£äņ╣śĒĢ£ ņē┤ļĀśĻ┤ĆņŚÉ iStentļź╝ ņéĮņ×ģĒĢśņśĆĻ│Ā, ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņŗ£Ē¢ēņŗ£ ļé┤ņĖĪ Ļ│Ąļ¦ē ņĀłņĀ£ņłĀĻ│╝ ĒÖŹņ▒äņĀłņĀ£ņłĀņØĆ ņÜ░ņĢłņØĆ 12-1ņŗ£ ņé¼ņØ┤, ņóīņĢłņØĆ 11-12ņŗ£ ņé¼ņØ┤ņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŗż.
ņłśņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØĆ ņłśņłĀ Ēøä 1ņØ╝, 1ņŻ╝, 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøö, 9Ļ░£ņøö, 12Ļ░£ņøöņŚÉ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņŗ£ļ¦łļŗż Ļ│©ļō£ļ¦ī ņĢĢĒÅēņĢłņĢĢĻ│╝ ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØä ņĖĪņĀĢĒĢśĻ│Ā ņé¼ņÜ®ĒĢśļŖö ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņłśņÖĆ ĒĢ®ļ│æņ”Ø ļ░£ņāØ ņŚ¼ļČĆļź╝ ĻĖ░ļĪØĒĢśņśĆņ£╝ļ®░, ņŚ¼Ļ│╝Ēż ņāüĒā£ņŚÉ ļīĆĒĢ£ ņĀäņĢłļČĆ ņé¼ņ¦äņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢśņŚ¼ Indiana Bleb Appearance Grading Scale (IBAGS)ņŚÉ ļö░ļØ╝ ņŚ¼Ļ│╝ĒżņØś ļåÆņØ┤(bleb height, H)ņÖĆ ļ▓öņ£ä(horizontal extent, E), ĒśłĻ┤ĆļČäĒż ņĀĢļÅä(vascularity, V), ņŚ¼Ļ│╝Ēż ļłäņČ£ ņĀĢļÅä(seidel test, S)ļź╝ ĒÅēĻ░ĆĒĢśņŚ¼ ņŚ¼Ļ│╝ĒżņØś ĒśĢĒā£ņŚÉ ļīĆĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż[18]. ņŚ¼Ļ│╝ĒżņØś ļåÆņØ┤ H0ļŖö ņŚ¼Ļ│╝ĒżņØś ņāüņŖ╣ņØ┤ ņŚåņØ┤ ĒÅēĒÅēĒĢ£ Ļ▓ĮņÜ░, H1ņØĆ ļé«ņØĆ ņŚ¼Ļ│╝Ēż ņāüņŖ╣, H2ļŖö ņżæļō▒ļÅäņØś ņŚ¼Ļ│╝Ēż ņāüņŖ╣, H3ļŖö ļåÆņØĆ ņŚ¼Ļ│╝Ēż ņāüņŖ╣ņ£╝ļĪ£ ļČäļźśļÉśņŚłļŗż[18]. ņŚ¼Ļ│╝ĒżņØś ļ▓öņ£äļŖö ņŚ¼Ļ│╝ĒżņØś ņłśĒÅē ļäłļ╣äļź╝ ļéśĒāĆļé┤Ļ│Ā E0ļŖö 1ņŗ£Ļ░ü ļ»Ėļ¦ī, E1ņØĆ 1ņŗ£Ļ░ü ņØ┤ņāü 2ņŗ£Ļ░ü ļ»Ėļ¦ī, E2ļŖö 2ņŗ£Ļ░ü ņØ┤ņāü 4ņŗ£Ļ░ü ļ»Ėļ¦ī, E3ļŖö 4ņŗ£Ļ░ü ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ļĪ£ ļČäļźśĒĢśņśĆļŗż[18]. ĒśłĻ┤ĆļČäĒż ņĀĢļÅä V0ļŖö ļ»ĖņäĖļéŁĒżĻ░Ć ļ│┤ņØ┤ņ¦Ć ņĢŖļŖö ļ¼┤ĒśłĻ┤Ć ĒØ░ņāē(avascular white) ņŚ¼Ļ│╝Ēż, V1ņØĆ ļ»ĖņäĖļéŁĒżĻ░Ć ļ│┤ņØ┤ļŖö ļ¼┤ĒśłĻ┤Ć ļéŁĒżņä▒(avascular cystic) ņŚ¼Ļ│╝Ēż, V2ļŖö Ļ▓ĮļÅä ĒśłĻ┤ĆļČäĒż, V3ļŖö ņżæļō▒ļÅä ĒśłĻ┤ĆļČäĒż, V4ļŖö ņÜĖĒśłļÉ£ ĒśłĻ┤ĆņØä Ļ░Ćņ¦ä Ļ│╝ļÅäĒĢ£ ĒśłĻ┤ĆļČäĒżļĪ£ ļČäļźśĒĢśņśĆļŗż[18]. ņŚ¼Ļ│╝ĒżņØś ļłäņČ£ ņĀĢļÅäļŖö Seidel Ļ▓Ćņé¼ņŚÉņä£ ņŚ¼Ļ│╝Ēż Ēæ£ļ®┤ņŚÉņä£ ļ░®ņłśņØś ļłäņČ£ņØ┤ ļéśĒāĆļéśļŖö ņĀĢļÅäņŚÉ ļö░ļØ╝ 3Ļ░Ćņ¦ĆļĪ£ ļČäļźśĒĢśņŚ¼ S0ļŖö ņŚ¼Ļ│╝Ēż ļłäņČ£ņØ┤ ņŚåļŖö Ļ▓ĮņÜ░, S1ņØĆ ĒśĢĻ┤æļ¼╝ņ¦łļÅäĒż Ēøä 5ņ┤ł ņØ┤ļé┤ņŚÉ ĒØśļ¤¼ļéśņśżļŖö ļ░®ņłśņØś ļłäņČ£ņŚåņØ┤ ņŚ¼Ļ│╝Ēż Ēæ£ļ®┤ņØś ņŚ¼ļ¤¼ ņ×æņØĆ ņ¦ĆņĀÉņŚÉņä£ Ļ▓░ļ¦ēņØä ĒåĄĒĢ£ ļłäņČ£ņØ┤ ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░(multiple pinpoint leak), S2ļŖö ĒśĢĻ┤æļ¼╝ņ¦ł ļÅäĒż Ēøä 5ņ┤ł ņØ┤ļé┤ņŚÉ ļ░®ņłśņØś ĒØÉļ”äņØ┤ ļ│┤ņØ┤ļŖö ļłäņČ£(streaming aqueous leak)ļĪ£ ļČäļźśĒĢśņśĆļŗż[18].
ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņÖäņĀäĒĢ£ ņä▒Ļ│ĄņØĆ ņłśņłĀ Ēøä ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖĻ│Ā ņĢłņĢĢņØ┤ 18 mmHg ņØ┤ĒĢśņØ┤Ļ│Ā ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņĢłņĢĢņØ┤ 20% ņØ┤ņāü ĒĢśĻ░ĢĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, ņĀ£ĒĢ£ņĀüņØĖ ņä▒Ļ│ĄņØĆ ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ ņĢłņĢĢņØ┤ 18 mmHg ņØ┤ĒĢśņØ┤Ļ│Ā ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņĢłņĢĢņØ┤ 20% ņØ┤ņāü ĒĢśĻ░ĢĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[15]. ņŻ╝ņé¼ņ╣©ņØä ņØ┤ņÜ®ĒĢ£ ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀ(Bleb needling)ņØĆ ņłśņłĀ ņŗżĒī©ļĪ£ Ļ░äņŻ╝ĒĢśņ¦Ć ņĢŖņĢśļŗż[19]. ņĀĆņĢłņĢĢņØĆ ņłśņłĀ Ēøä 6ņŻ╝ ņØ┤ņāü Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ Ēøä 2ļ▓łņØś ņŚ░ņåŹļÉ£ Ļ▓Ćņé¼ņŚÉņä£ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢņØ┤ 5 mmHg ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆņ£╝ļ®░, ņ¦ĆņåŹļÉśļŖö ņĀĆņĢłņĢĢņØĆ ņłśņłĀ Ēøä 3Ļ░£ņøö ņØ┤ņāü Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ Ēøä 3ļ▓ł ņØ┤ņāüņØś ņŚ░ņåŹņĀüņØĖ Ļ▓Ćņé¼ņŚÉņä£ Ļ│©ļō£ļ¦īņĢĢĒÅēņĢłņĢĢĻ│äļĪ£ ņĖĪņĀĢĒĢ£ ņĢłņĢĢņØ┤ 5 mmHg ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[19].
ĒåĄĻ│äņĀü ļ░®ļ▓Ģņ£╝ļĪ£ ļŹ░ņØ┤Ēä░ņØś ņĀĢĻĘ£ņä▒ņØä Ļ▓ĆņĀĢĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Kolmogorov-Smirnov testļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņØś ņŚ░ņåŹĒśĢ ļ│Ćņłś ļ╣äĻĄÉļź╝ ņ£äĒĢśņŚ¼ studentŌĆÖs t-test Ēś╣ņØĆ Mann-Whitney U-testļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā, ņłśņłĀ ņĀäĒøä ļ│Ćņłśļź╝ ļ╣äĻĄÉļź╝ ņ£äĒĢśņŚ¼ paired t-test Ēś╣ņØĆ Wilcoxon signed rank testļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ▓öņŻ╝ĒśĢ ņ×ÉļŻīņØś ļČäņäØņØĆ chi-squared test Ēś╣ņØĆ FisherŌĆÖs exact testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ Kaplan-Meier ņāØņĪ┤ ļČäņäØņØä ņé¼ņÜ®ĒĢśņśĆĻ│Ā, Log-rank testļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņØś ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉĒĢśņśĆļŗż. ĒåĄĻ│äĒĢÖņĀüņØĖ ļČäņäØņØĆ ņ£łļÅäņÜ░ņÜ® SPSS 25.0 (IBM Corp., Armonk, NY, USA)ņØä ņØ┤ņÜ®ĒĢśņśĆĻ│Ā, p-valueĻ░Ć 0.05 ļ»Ėļ¦īņØ╝ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśņśĆļŗż.
ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņØĆ 9ļ¬ģ 10ņĢł, ļīĆņĪ░ĻĄ░ņØĆ 10ļ¬ģ 10ņĢłņØ┤ņŚłļŗż. ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ĒÅēĻĘĀ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØĆ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņØ┤ 13.1 ┬▒ 1.4Ļ░£ņøö, ļīĆņĪ░ĻĄ░ņØ┤ 13.9 ┬▒ 2.1Ļ░£ņøöņØ┤ņŚłļŗż(p=0.393). ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņŚÉņä£ iStent ņéĮņ×ģņłĀ ņĀä ĒÅēĻĘĀ ņĢłņĢĢņØĆ 31.8 ┬▒ 14.7 mmHgņśĆĻ│Ā iStent ņéĮņ×ģņłĀ Ēøä ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņŗ£Ē¢ē ņé¼ņØ┤ņØś ĒÅēĻĘĀ ĻĖ░Ļ░äņØĆ 5.0 ┬▒ 2.1Ļ░£ņøöņØ┤ņŚłļŗż. ļéśņØ┤, ņä▒ļ│ä, ņłĀ ņĀä ņłśņĀĢņ▓┤ ņāüĒā£, ņżæņŗ¼Ļ░üļ¦ēļæÉĻ╗ś, ņĢłņČĢņן ĻĖĖņØ┤, ņłśņłĀ ņĀä ĒÅēĻĘĀ ņĢłņĢĢ, ņłśņłĀ ņĀä ņé¼ņÜ®ĒĢ£ ĒÅēĻĘĀ ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņłśņÖĆ ņŗ£ņĢ╝Ļ▓Ćņé¼ņØś Visual Field Index (VFI), MD, PSDļŖö ļæÉ ĻĄ░ Ļ░äņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłĻ│Ā(pŌēź0.063), ņłśņłĀ ņĀä ļŗżļźĖ ļģ╣ļé┤ņןņłśņłĀ ļśÉļŖö ļĀłņØ┤ņĀĆ ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉļŖö ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņŚåņŚłļŗż(Table 1).
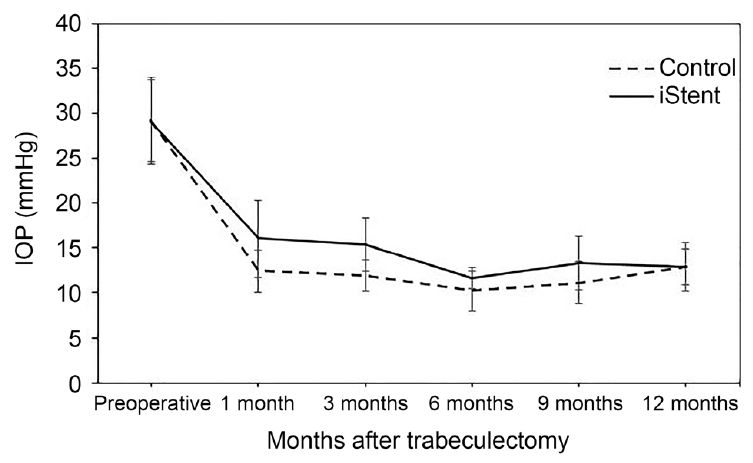
ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņĀä ĒÅēĻĘĀ ņĢłņĢĢņØĆ Ļ░üĻ░ü 29.0 ┬▒ 7.4 mmHg, 29.2 ┬▒ 7.5 mmHgņśĆĻ│Ā, ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.828). ņłśņłĀ Ēøä ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ė ņŗ£ ņĢłņĢĢņØĆ Ļ░üĻ░ü 12.4 ┬▒ 3.1 mmHg, 12.1 ┬▒ 4.1 mmHgļĪ£ ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.387). ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņłśņłĀ Ēøä ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ė ņŗ£ņØś ņĢłņĢĢņØĆ ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(ļ¬©ļæÉ p<0.001) (Fig. 1). ņłśņłĀ ņĀä ņé¼ņÜ®ĒĢ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ĒÅēĻĘĀ Ļ░£ņłśļŖö Ļ░üĻ░ü 3.8 ┬▒ 0.4Ļ░£, 4Ļ░£ņśĆĻ│Ā ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.481). ņłśņłĀ Ēøä ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ė ņŗ£ ņé¼ņÜ®ĒĢ£ ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ĒÅēĻĘĀ Ļ░£ņłśļŖö 0.5 ┬▒ 1.3Ļ░£ņÖĆ 0.4 ┬▒ 1.3Ļ░£ļĪ£ ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(p=0.739). ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņłśņłĀ Ēøä ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ė ņŗ£ņØś ņĢłņĢĢĒĢśĻ░ĢņĀ£ņØś ĒÅēĻĘĀ Ļ░£ņłśļŖö ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(p=0.006, p=0.003). ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ļæÉ ĻĄ░ņŚÉņä£ ņłśņłĀ ņĀä Ļ░üĻ░ü 0.57 ┬▒ 0.69, 0.47 ┬▒ 0.90ņØ┤ņŚłĻ│Ā, ņłśņłĀ Ēøä Ļ░üĻ░ü 0.60 ┬▒ 0.71, 0.45 ┬▒ 0.74ļĪ£ ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż(Ļ░üĻ░ü p=0.280, p=0.353). ņłśņłĀ ņĀä Ēøä ņĄ£ļīĆĻĄÉņĀĢņŗ£ļĀźņØĆ ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņ£ĀņØśĒĢ£ ļ│ĆĒÖöļŖö ņŚåņŚłļŗż(p=0.334, p=1.000) (Table 2).
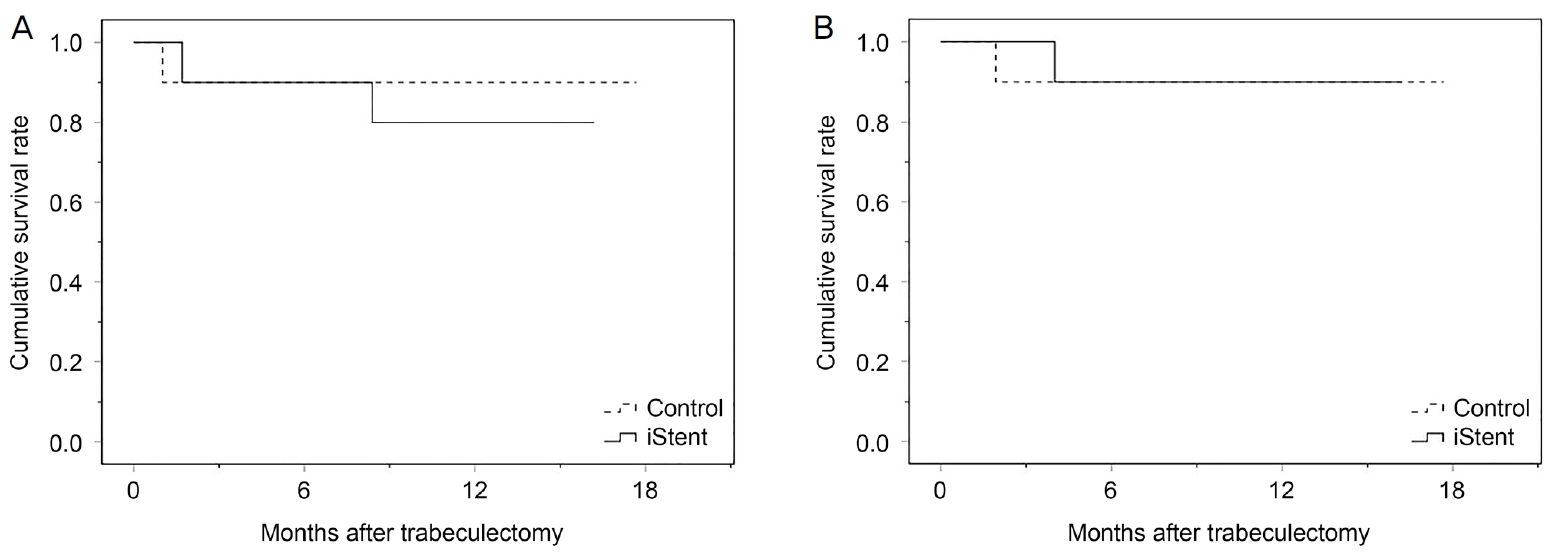
Kaplan-Meier ņāØņĪ┤ ļČäņäØ Ļ▓░Ļ│╝, ņłśņłĀ 12Ļ░£ņøö Ēøä ņÖäņĀä ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉņä£ Ļ░üĻ░ü 80%, 90%ņśĆĻ│Ā, ļæÉ ĻĄ░ Ļ░ä ņä▒Ļ│ĄļźĀņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.584) (Fig. 2A). ņĀ£ĒĢ£ņĀüņØĖ ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉņä£ Ļ░üĻ░ü 90%, 90%ņśĆĻ│Ā, ļæÉ ĻĄ░ Ļ░ä ņä▒Ļ│ĄļźĀņØś ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(p=0.970) (Fig. 2B).
ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░Ļ│╝ ļīĆņĪ░ĻĄ░ņŚÉņä£ ņóüņØĆ ņĀäļ░®ņØ┤ Ļ░üĻ░ü 1ņĢł(10.0%)ņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, ļ¦źļØĮļ¦ēļ░Ģļ”¼Ļ░Ć Ļ░üĻ░ü 1ņĢł(10.0%)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(ļ¬©ļæÉ p=1.000). ņłśņłĀ Ēøä ņŻ╝ņé¼ņ╣©ņØä ņØ┤ņÜ®ĒĢ£ ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀņØä ĒĢ£ Ļ▓ĮņÜ░ļŖö Ļ░üĻ░ü 4ņĢł(40.0%)ņØ┤ņŚłĻ│Ā(p=1.000), ņłśņłĀ Ēøä ņĀĆņĢłņĢĢņ£╝ļĪ£ Ļ▓ĮĻ▓░ļ¦ē Ļ│Ąļ¦ēĒīÉļ┤ēĒĢ®ņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ļŖö ļīĆņĪ░ĻĄ░ņŚÉņä£ 1ņĢł(10.0%)ņØ┤ņŚłļŗż(p=1.000) (Table 3). ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņŚ¼Ļ│╝Ēż Ļ┤ĆļĀ© Ļ░ÉņŚ╝ņØĆ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśļŗż.
ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ņŚ¼Ļ│╝ĒżņØś ĒśĢĒā£ļź╝ IBAGSņŚÉ ļö░ļØ╝ ļČäļźśĒĢśņŚ¼ ļæÉ ĻĄ░ņØä ļ╣äĻĄÉ ļČäņäØĒĢśņśĆļŗż. ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņŚÉņä£ ņŚ¼Ļ│╝ĒżņØś ļåÆņØ┤ļŖö 20.0%Ļ░Ć H1, 80.0%Ļ░Ć H2ņśĆĻ│Ā, ļīĆņĪ░ĻĄ░ņŚÉņä£ ņŚ¼Ļ│╝ĒżņØś ļåÆņØ┤ļŖö 30.0%Ļ░Ć H1, 70.0%Ļ░Ć H2ņśĆļŗż(p=1.000). ņŚ¼Ļ│╝ĒżņØś ļ▓öņ£äļŖö ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņØĆ 20.0%Ļ░Ć E1, 50.0%Ļ░Ć E2, 30.0%Ļ░Ć E3ņśĆĻ│Ā, ļīĆņĪ░ĻĄ░ņØĆ 10.0%Ļ░Ć E1, 60.0%Ļ░Ć E2, 30.0%Ļ░Ć E3ņśĆļŗż(p=1.000). ĒśłĻ┤Ć ļČäĒżņĀĢļÅäļŖö ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖĻĄ░ņØĆ 70.0%Ļ░Ć V2, 30.0%Ļ░Ć V3ņśĆĻ│Ā, ļīĆņĪ░ĻĄ░ņØĆ 90.0%Ļ░Ć V2, 10.0%Ļ░Ć V3ņśĆļŗż(p=0.582) (Table 4).
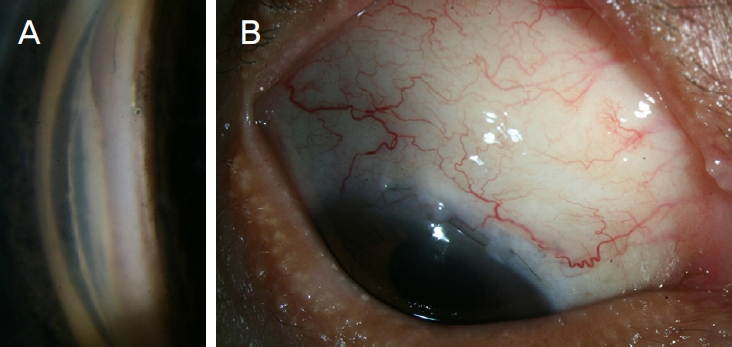
ļīĆĒæ£ ņ”ØļĪĆņØĖ 60ņäĖ ļé©ņä▒ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉļŖö iStent ņéĮņ×ģņłĀ ņĀä ņĄ£ļīĆņĢĮļ¼╝ņ╣śļŻīņŚÉ ļČłĻĄ¼ĒĢśĻ│Ā ņÜ░ņĢł ņĢłņĢĢņØ┤ 31 mmHgļĪ£ ņĖĪņĀĢļÉśņ¢┤ iStent ņéĮņ×ģņłĀņØä ņŗ£Ē¢ē ļ░øņĢśņ£╝ļéś, 5Ļ░£ņøö Ēøä ņĢłņĢĢņØ┤ 40 mmHgļĪ£ ņāüņŖ╣ĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ē ļ░øņĢśļŗż. ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä 1ļģä ļÅÖņĢłņØś Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł ņĢłņĢĢņØ┤ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņĪ░ņĀłļÉśņŚłĻ│Ā, ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ 1ļģä Ēøä ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņé¼ņÜ® ņŚåņØ┤ ņĢłņĢĢņØĆ 7 mmHgļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. iStentļŖö ņÜ░ņĢł 2ņŗ£ ļ░®Ē¢źņØś ņē┤ļĀśĻ┤ĆņŚÉ ņéĮņ×ģļÉśņŚłĻ│Ā, ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł IBAGSņŚÉ ļö░ļźĖ ņŚ¼Ļ│╝Ēż ļåÆņØ┤ļŖö ņżæļō▒ļÅäņØś ņŚ¼Ļ│╝Ēż ņāüņŖ╣, ņŚ¼Ļ│╝ĒżņØś ļ▓öņ£äļŖö 4ņŗ£Ļ░ü ņØ┤ņāü, Ļ▓ĮļÅäņØś ĒśłĻ┤ĆļČäĒżļĪ£ ņ£Āņ¦ĆļÉśņŚłĻ│Ā, ņŚ¼Ļ│╝Ēż ļłäņČ£, ļ¼┤ĒśłĻ┤Ć ļéŁĒżņä▒ ņŚ¼Ļ│╝Ēż, ņŚ¼Ļ│╝Ēż Ļ┤ĆļĀ© Ļ░ÉņŚ╝Ļ│╝ Ļ░ÖņØĆ ņØ┤ņāü ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 3).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ┤ņĀäņŚÉ ņŗ£Ē¢ēĒĢ£ iStent ņŚ¼ļČĆĻ░Ć ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒Ļ│ĄļźĀņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ļČäņäØĒĢśĻĖ░ ņ£äĒĢśņŚ¼ 1Ļ░£ņØś iStentļź╝ ņéĮņ×ģĒĢ£ ĒÖśņ×Éļōż ņżæņŚÉņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśĻ│Ā Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ņĄ£ņåī 12Ļ░£ņøö ņØ┤ņāüņØĖ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņ×äņāü ņä▒ņĀüņØä ļČäņäØĒĢśņśĆļŗż. ņłśņłĀ Ēøä ļ¦łņ¦Ćļ¦ē ļ░®ļ¼Ė ņŗ£ņØś ņĢłņĢĢņØĆ ņłśņłĀ ņĀäņŚÉ ļ╣äĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆĻ│Ā, Kaplan-Meier ņāØņĪ┤ ļČäņäØ Ļ▓░Ļ│╝, ņłśņłĀ 12Ļ░£ņøö Ēøä ņÖäņĀä ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ 80%, ņĀ£ĒĢ£ņĀüņØĖ ņłśņłĀ ņä▒Ļ│ĄļźĀņØĆ 90%ļĪ£ ņØ┤ņĀä ņŚ░ĻĄ¼ļōżņŚÉņä£ ļ│┤Ļ│ĀļÉ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņä▒Ļ│ĄļźĀņØĖ 67-94%ņÖĆ ņ£Āņé¼ĒĢśĻ│Ā, ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖņéĮņ×ģņłĀ ņŗ£Ē¢ē ļ│æļĀź ņŚåņØ┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ē ļ░øņØĆ ĒÖśņ×ÉļōżĻ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ņŗ£ņŚÉļÅä ņä▒Ļ│ĄļźĀ ņĖĪļ®┤ņŚÉņä£ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļśÉĒĢ£ ņŚ¼Ļ│╝ĒżņØś ĻĖ░ļŖźĻ│╝ ļ░ĆņĀæĒĢ£ Ļ┤ĆļĀ©ņä▒ņØ┤ ņ׳ļŖö ņŚ¼Ļ│╝ĒżņØś ņ£ĪņĢłņĀü ĒŖ╣ņä▒ņØä IBAGSņŚÉ ļö░ļØ╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢīļĪ£ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłĻ│Ā, ĒĢ®ļ│æņ”Ø ļ░£ņāØ ļ╣łļÅä ņĖĪļ®┤ņŚÉņä£ļÅä ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż.
Popovic et al [11]ņØĆ iStent Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņłĀ Ēøä ņĢłņĢĢņāüņŖ╣, ņŖżĒģÉĒŖĖ ļ¦ēĒל ļśÉļŖö ņŖżĒģÉĒŖĖņØś ņ£äņ╣ś ņØ┤ņāü, ņĀäļ░®ņČ£Ēśł ļō▒ņØ┤ ļéśĒāĆļéĀ ņłś ņ׳Ļ│Ā, ņØ┤ļ¤¼ĒĢ£ ĒĢ®ļ│æņ”ØņØĆ ņłĀņĢłņØś 25%ļź╝ ļäśņ¦Ć ņĢŖņĢśĻ│Ā ļīĆļČĆļČä ņ╣śļ¬ģņĀüņØ┤ņ¦Ć ņĢŖņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£, ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņŚÉ ļ╣äĒĢśņŚ¼ ņŖżĒģÉĒŖĖņéĮņ×ģņłĀņØ┤ ņłśņłĀ Ēøä ņ┤łĻĖ░ ĒĢ®ļ│æņ”Ø ļ╣äņ£©ņØ┤ ņĀüļŗżļŖö ņןņĀÉņØ┤ ņ׳ņ¢┤ iStentļź╝ 1ņ░©ņĀüņØĖ ņłśņłĀļĪ£ ņŗ£Ē¢ēĒĢśĻĖ░ņŚÉ ļČĆļŗ┤ņØ┤ ņĀüļŗżĻ│Ā ļ│╝ ņłś ņ׳ļŗż[19].
ĒĢ£ĻĄŁņØĖņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉ ņØśĒĢśļ®┤[10], ĒĢ£ĻĄŁņØĖņŚÉņä£ iStent ņéĮņ×ģņłĀ Ēøä 6Ļ░£ņøöĻ░äņØś ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł ĒÅēĻĘĀ 27.7%ņØś ņĢłņĢĢĒĢśĻ░ĢĻ│╝ 33.7%ņØś ņä▒Ļ│ĄļźĀņØä ļ│┤ņśĆļŗż. 60ņäĖ ĻĖ░ņżĆņ£╝ļĪ£ ļłäņĀü ņłśņłĀ ņä▒Ļ│ĄļźĀņØä ļ╣äĻĄÉ ļČäņäØĒĢśņśĆņØä ļĢī, ņä¼ņ£ĀņŻ╝ ļ»ĖņäĖņÜ░ĒÜī ņŖżĒģÉĒŖĖ ļŗ©ļÅģĻĄ░ņØś 60ņäĖ ļ»Ėļ¦īņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 85.9 ┬▒ 5.0%, 59.2 ┬▒ 7.6%, 36.2 ┬▒ 8.1%ņØ┤Ļ│Ā, 60ņäĖ ņØ┤ņāüņŚÉņä£ ņłĀ Ēøä 1Ļ░£ņøö, 3Ļ░£ņøö, 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 70.2 ┬▒ 7.2%, 38.7 ┬▒ 7.9%, 23.3 ┬▒ 7.0%ļĪ£ 60ņäĖ ļ»Ėļ¦īņŚÉņä£ ļłäņĀü ņłśņłĀ ņä▒Ļ│ĄļźĀņØ┤ 60ņäĖ ņØ┤ņāüņŚÉ ļ╣äĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(p=0.023). ļśÉĒĢ£, iStent ņéĮņ×ģ Ēøä ĒĢ®ļ│æņ”ØļÅä ļ│┤Ļ│ĀļÉśņ¦Ć ņĢŖņĢśļŗż. 60ņäĖ ļ»Ėļ¦īņØś ņĀŖņØĆ ĒÖśņ×ÉņŚÉņä£ ļŹö ņÜ░ņłśĒĢ£ ņä▒Ļ│ĄļźĀņØä ļ│┤ņśĆĻ│Ā ĒĢ®ļ│æņ”ØļÅä ļ░£ņāØĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ»ĆļĪ£, ļģ╣ļé┤ņןņØś ņżæļō▒ļÅäļź╝ Ļ│ĀļĀżĒĢśņŚ¼ 60ņäĖ ļ»Ėļ¦īņØś ņĀŖņØĆ ļģ╣ļé┤ņן ņ┤łĻĖ░ ĒÖśņ×ÉņŚÉņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņØ┤ņĀäņŚÉ iStent ņéĮņ×ģņłĀņØĆ ņä▒Ļ│ĄļźĀĻ│╝ ņłśņłĀ Ēøä ĒĢ®ļ│æņ”Ø ņĖĪļ®┤Ļ│╝ ļ╣ĀļźĖ ņŗ£ļĀźĒÜīļ│ĄņØä ĒåĄĒĢ£ ņøÉĒÖ£ĒĢ£ ņé¼ĒÜī ņāØĒÖ£ņØä Ļ░ĆļŖźĒĢśĻ▓ī ĒĢśļ»ĆļĪ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀļ│┤ļŗż ļ©╝ņĀĆ ņŗ£Ē¢ēĒĢ┤ ļ│╝ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[10].
ĻĘĖļ¤¼ļéś, Katz et al [9]ņØĆ iStent ņéĮņ×ģ Ļ░£ņłśņŚÉ ļö░ļźĖ ņĢłņĢĢĒĢśĻ░Ģ ņĀĢļÅäļź╝ ļ╣äĻĄÉĒĢśņśĆĻ│Ā, 20% ņØ┤ņāüņØś ņĢłņĢĢĒĢśĻ░ĢņØä ļ│┤ņØ┤ļŖö ļ╣äņ£©ņØ┤ ņŖżĒģÉĒŖĖ 1Ļ░£, 2Ļ░£, 3Ļ░£ ņéĮņ×ģĻĄ░ņŚÉņä£ ņłśņłĀ Ēøä 12Ļ░£ņøöņ¦ĖņŚÉ Ļ░üĻ░ü 89%, 90%, 92%ņśĆĻ│Ā, ņłśņłĀ Ēøä 42Ļ░£ņøöņ¦ĖņŚÉ Ļ░üĻ░ü 61%, 91%, 91%ļĪ£ ņןĻĖ░ņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ĒĢĀņłśļĪØ 1Ļ░£ ņŖżĒģÉĒŖĖ ļŗ©ļÅģ ņéĮņ×ģņØ┤ ņĢłņĢĢĒĢśĻ░Ģ ĒÜ©Ļ│╝Ļ░Ć Ļ░ÉņåīĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. Esfandiari et al [20]ņØĆ iStentļź╝ ņŗ£Ē¢ē ļ░øņØĆ 110ņĢłņŚÉņä£ ņéĮņ×ģņłĀ Ēøä 24Ļ░£ņøöņŚÉ ļŗ©ņ¦Ć 16.6%ļ¦īņØ┤ ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņé¼ņÜ® ņŚåņØ┤ ņĢłņĢĢņØ┤ 21 mmHg ņØ┤ĒĢśņśĆĻ│Ā, ņĢłņĢĢĒĢśĻ░ĢņĀ£ ņé¼ņÜ® ņŚåņØ┤ 20% ņØ┤ņāü ņĢłņĢĢņØ┤ ĒĢśĻ░ĢļÉ£ ĒÖśņ×ÉļŖö ņŚåņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļśÉĒĢ£ ĒĢ£ĻĄŁņØĖņØä ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļ│Ė ņŚ░ĻĄ¼ ĻĘĖļŻ╣ņØś ņØ┤ņĀä ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ļÅä 1Ļ░£ņØś iStent ņéĮņ×ģĒĢśņśĆņØä Ļ▓ĮņÜ░, ņłĀ Ēøä 1Ļ░£ņøö, 3Ļ░£ņøö ļ░Å 6Ļ░£ņøöņŚÉ Ļ░üĻ░ü 71.3%, 58.9%, 33.7%ņØś ņä▒Ļ│ĄļźĀņØä ļ│┤ņŚ¼ ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢ©ņŚÉ ļö░ļØ╝ ņä▒Ļ│ĄļźĀņØ┤ Ļ░ÉņåīļÉśļŖö Ļ▓ĮĒ¢źņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż[10]. ļö░ļØ╝ņä£ ņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ĻĖĖņ¢┤ņ¦łņłśļĪØ iStentņØś ņłśņłĀ ņä▒Ļ│ĄļźĀņØ┤ Ļ░ÉņåīĒĢ©ņØ┤ ĒÖĢņØĖļÉśņŚłĻ│Ā, ņØ┤ļ¤¼ĒĢ£ Ļ▓ĮņÜ░ ņĢłņĢĢĒĢśĻ░ĢņØä ņ£äĒĢśņŚ¼ ņØ┤ņ░©ņĀüņØĖ ņłśņłĀļĪ£ņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØ┤ ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż.
iStent Ēøä ļ░®ņłśņØś ņ£ĀņČ£ņØ┤ ņē┤ļĀśĻ┤ĆņŚÉņä£ ņ¦æĻ▓░ļĪ£ļź╝ ĒåĄĒĢśņŚ¼ ņāüĻ│Ąļ¦ēņĀĢļ¦źĻ│╝ Ļ▓░ļ¦ēņĀĢļ¦źņ£╝ļĪ£ ņŚ░Ļ▓░ļÉ£ ļ░®ņłśņĀĢļ¦ź ļśÉļŖö Ļ│Ąļ¦ēļé┤ņĀĢļ¦źņ┤Øņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā[10], ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ļ░®ņłśņØś ļ░░ņČ£ņØĆ Ļ│Ąļ¦ēĒÄĖņØś Ļ░Ćņןņ×Éļ”¼ ņŻ╝ņ£äļĪ£ļČĆĒä░ ļ░®ņłśĻ░Ć ļéśņÖĆ Ļ▓░ļ¦ēĒĢś Ļ│ĄĻ░äņØä ļōżņ¢┤Ļ░Ćņä£ Ļ▓░ļ¦ēņØä Ļ┤ĆĒåĄĒĢśļŖö ņŚ¼Ļ│╝ņŚÉ ņØśĒĢ£ ļ░®ņłśņ£ĀņČ£, ļ”╝ĒöäĻ│ä ņåŹņ£╝ļĪ£ņØś ĒØĪņłś, ĻĘĖļ”¼Ļ│Ā Ļ▓░ļ¦ēĒĢś ņĪ░ņ¦üņØś ĒśłĻ┤ĆļōżņŚÉ ņØśĒĢ£ ĒØĪņłśļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ÉņØä Ļ│ĀļĀżĒĢĀ ļĢī[3,15], iStentņÖĆ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņĢłņĢĢĒĢśĻ░Ģ ĻĖ░ņĀäņØĆ ņä£ļĪ£ ļŗżļź┤ļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ļĪĀņĀüņ£╝ļĪ£ļŖö iStentļź╝ ņ£Āņ¦ĆĒĢśĻ│Ā, ļŗżļźĖ ņé¼ļČäļ®┤ņŚÉ ņä¼ņ£ĀņŻ╝ ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢĀ Ļ▓ĮņÜ░ņČöĻ░ĆņĀüņØĖ ņĢłņĢĢĒĢśĻ░Ģ ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā ņØ┤ņŚÉ ļīĆĒĢ£ ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Huang et al [21]ņØĆ ņØĖņ▓┤ņŚÉņä£ ņĀüņČ£ĒĢ£ 14ņĢłņŚÉņä£ iStent ņéĮņ×ģņłĀ ņĀäĻ│╝ ĒøäņŚÉ ļ░®ņłś ĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ļ░®ņłśņ£ĀņČ£ņØś ļ│ĆĒÖö ņ¢æņāüņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝, iStent ņéĮņ×ģņłĀ ņĀä ņŗ£Ē¢ēĒĢ£ ļ░®ņłś ĒśłĻ┤ĆņĪ░ņśüņłĀņŚÉņä£ ĒØÉļ”äņØ┤ļéś ņŗĀĒśĖĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņØĆ ļČĆņ£äņŚÉņä£ iStent ņéĮņ×ģņłĀ ņØ┤Ēøä ĒØÉļ”äņØ┤ļéś ņŗĀĒśĖĻ░Ć ņ”ØĻ░ĆĒĢ©ņØä ļ│┤Ļ│ĀĒĢśņŚ¼ iStent ņéĮņ×ģņłĀ ņØ┤Ēøä ļ░®ņłśņ£ĀņČ£ņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ņŻ╝ņןĒĢśņśĆļŗż. ņĄ£ĻĘ╝ Huang et al [22]ņØĆ ļģ╣ļé┤ņן ĒÖśņ×É 14ņĢłņŚÉņä£ ļ░▒ļé┤ņןņłśņłĀĻ│╝ ļÅÖņŗ£ņŚÉ iStentļź╝ ļ╣äņĖĪņŚÉ ņéĮņ×ģĒĢśĻ│Ā ņłśņłĀ ņĀäĻ│╝ ĒøäņŚÉ ļ░®ņłś ĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ļ░®ņłśņ£ĀņČ£ņØś ļ│ĆĒÖö ņ¢æņāüņØä ļČäņäØĒĢ£ Ļ▓░Ļ│╝, ņłśņłĀ ņĀä ļé«ņØĆ ņØĖļÅäņŗ£ņĢäļŗī ņŗĀĒśĖ Ļ░ĢļÅäļź╝ ļ│┤ņØĖ ņśüņŚŁņŚÉņä£ iStent ņéĮņ×ģņłĀ Ēøä ņØ╝ņŗ£ņĀü Ēś╣ņØĆ ņ¦ĆņåŹļÉ£ ĒöīļŻ©ņśżļĀłņäĖņØĖ ņŗĀĒśĖ Ļ░ĢļÅäņØś ņ”ØĻ░ĆĻ░Ć Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ņłśņłĀ ņĀä ļåÆņØĆ ņØĖļÅäņŗ£ņĢäļŗī ņŗĀĒśĖ Ļ░ĢļÅäļź╝ ļ│┤ņØĖ ņśüņŚŁņŚÉ iStent ņéĮņ×ģņłĀ Ēøä ĒöīļŻ©ņśżļĀłņäĖņØĖ ņŗĀĒśĖĻ░Ć ļŹö ļ╣©ļ”¼ ļéśĒāĆļé©ņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ļ░®ņłśņ£ĀņČ£ņØś ĒśĖņĀäļÉśņŚłņØīņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ļö░ļØ╝ņä£ iStent ņéĮņ×ģņłĀ ņĀäĒøäņŚÉ ļ░®ņłś ĒśłĻ┤ĆņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņéĮņ×ģļÉ£ iStent ļČĆņ£äņØś ļ░®ņłśņ£ĀņČ£ņØ┤ ĒśĖņĀäļÉśņŚłļŖöņ¦Ćļź╝ ĒÖĢņØĖĒĢ£ļŗżļ®┤, ļŗżļźĖ ņé¼ļČäļ®┤ņŚÉ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ĒżĒĢ©ĒĢ£ ļģ╣ļé┤ņןņłśņłĀ ņŗ£Ē¢ēņ£╝ļĪ£ ĻĖ░ļīĆļÉśļŖö ņČöĻ░ĆņĀüņØĖ ņĢłņĢĢĒĢśĻ░Ģ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢśņŚ¼ ņÖäļ▓ĮĒĢśņ¦ĆļŖö ņĢŖņ£╝ļéś ņśłņĖĪņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņØ┤ņĀäņØś ļ░▒ļé┤ņןņĀüņČ£ņłĀ, ņ£Āļ”¼ņ▓┤ņĀłņĀ£ņłĀ ļō▒ņØś ņĢłĻ│╝ņĀü ņłśņłĀļĪ£ ņØĖĒĢśņŚ¼ ļ░£ņāØĒĢ£ Ļ▓░ļ¦ēņØś ņ£äņČĢĻ│╝ ļ░śĒØöņØĆ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņŗżĒī©ņØś ņŻ╝ņÜö ņøÉņØĖņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[23]. Broadway and Chang [24]ņØĆ ņØ┤ņĀäņŚÉ Ļ▓░ļ¦ēņĀłĻ░£ļź╝ ĒżĒĢ©ĒĢ£ ņłśņłĀ ņŚ¼ļČĆĻ░Ć ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņŗżĒī©ņØś ņ£äĒŚśņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, ĻĘĖ ņøÉņØĖņ£╝ļĪ£ ņØ┤ņĀäņŚÉ Ļ▓░ļ¦ēņØä ņĀłĻ░£ĒĢ£ ņłśņłĀņØä ņŗ£Ē¢ē ļ░øņØĆ ņĢłņŚÉņä£ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņ”ØĻ░ĆļÉ£ ņä¼ņ£ĀņĢäņäĖĒżņÖĆ ņŚ╝ņ”ØņäĖĒżĻ░Ć ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņØ┤ĒøäņØś ņāüņ▓ś ņ╣śņ£Ā Ļ│╝ņĀĢņØä Ļ░ĢĒÖöņŗ£ĒéżĻĖ░ ļĢīļ¼ĖņØĖ Ļ▓āņ£╝ļĪ£ ņČöņĀĢĒĢśņśĆļŗż. ļśÉĒĢ£, ņ×æņØĆ ņĀłĻ░£ļź╝ ņŗ£Ē¢ēĒĢ£ ļ░▒ļé┤ņןņłśņłĀņŚÉņä£ļÅä ņןĻĖ░Ļ░ä ļ│┤ņĢśņØä ļĢī ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņØ┤ ļ░£Ļ▓¼ļÉ£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłĻ│Ā[12], ņØ┤ļ¤¼ĒĢ£ ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņ£╝ļĪ£ ņØĖĒĢ£ ļ░®ņłś ņä▒ņāüņØś ļ│ĆĒÖöļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņŗ£ ņłśņłĀ ļČĆņ£äņØś ņä¼ņ£ĀĒÖöļź╝ ņĢ╝ĻĖ░ņŗ£Ēé¼ ņłś ņ׳ņ¢┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[13].
ĻĘĖļ¤¼ļéś Ēł¼ļ¬ģ Ļ░üļ¦ēņĀłĻ░£ļź╝ ņØ┤ņÜ®ĒĢ£ iStent ņéĮņ×ģņłĀņØś Ļ▓ĮņÜ░ ņĢłĻĄ¼ļé┤ ņłśņłĀņ×äņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņāüņĖĪ Ļ▓░ļ¦ēņØä ļ│┤ņĪ┤ĒĢ£ļŗżļŖö ņĖĪļ®┤ņŚÉņä£ļŖö ņØ┤ĒøäņŚÉ ņŗ£Ē¢ēĒĢśļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒Ļ│ĄļźĀņŚÉ ļČĆņĀĢņĀüņØĖ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśĻ│Ā, ņłśņłĀ Ēøä ĒśłņĢĪ ļ░®ņłś ņןļ▓ĮņØś ņØ┤ņāüņ£╝ļĪ£ ņØĖĒĢ£ ļ░®ņłś ņä▒ņāüņØś ļ│ĆĒÖö ņĖĪļ®┤ņŚÉņä£ļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļéś ļ│Ė ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļæÉ ĻĄ░ņØś ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒Ļ│ĄļźĀĻ│╝ ņŚ¼Ļ│╝Ēż ĒśĢĒā£ņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļ»ĆļĪ£ iStent ņéĮņ×ģņłĀļĪ£ ņØĖĒĢ£ ļ░®ņłś ņä▒ņāüņØś ļ│ĆĒÖö ļśÉĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Āļ¦īĒü╝ Ēü¼ņ¦Ć ņĢŖņĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļŖö ļ»ĖņäĖņ╣©ņŖĄ ļģ╣ļé┤ņןņłśņłĀņŚÉ ĒĢ┤ļŗ╣ļÉśļŖö ļé┤ņĖĪ ņĀæĻĘ╝ ņä¼ņ£ĀņŻ╝ņĀłĻ░£ņłĀ ņŗżĒī© Ēøä ņŗ£Ē¢ēĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņØä ļ│┤Ļ│ĀĒĢ£ ņØ┤ņĀä ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ņÖĆ ņØ╝ņ╣śĒĢ£ļŗż[25]. Jea et al [25]ņØĆ TrabectomeŌōć (NeoMedix Corp., Tustin, CA, USA)ņØä ņØ┤ņÜ®ĒĢ£ ņłśņłĀ ņØ┤Ēøä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ņŗżĒī©ĒĢśņŚ¼ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ ĻĄ░(ņŗżĒŚśĻĄ░)Ļ│╝ TrabectomeņØä ņØ┤ņÜ®ĒĢ£ ņłśņłĀ ĻĖ░ņÖĢļĀź ņŚåņØ┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀļ¦ī ļŗ©ļÅģņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļīĆņĪ░ĻĄ░ņØä ļīĆņāüņ£╝ļĪ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņØä ļ╣äĻĄÉ ļČäņäØĒĢ£ Ļ▓░Ļ│╝, 2ļģä ņä▒Ļ│ĄļźĀņØ┤ ņŗżĒŚśĻĄ░ 60.2%, ļīĆņĪ░ĻĄ░ 55.5% (p=0.895)ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłĻ│Ā, Trabectome ņŗ£Ē¢ēņŗ£ Ļ▓░ļ¦ēņØ┤ ļ│┤ņĪ┤ļÉśļ»ĆļĪ£ TrabectomeņØś ĻĖ░ņÖĢļĀźņØ┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņŗżĒī©ņŚÉ ĻĖ░ņŚ¼ĒĢśņ¦Ć ņĢŖļŖöļŗżĻ│Ā ņŻ╝ņןĒĢśņśĆļŗż.
Gizzi et al [26]ņØĆ 8ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ ļ»ĖņäĖņ╣©ņŖĄ ļģ╣ļé┤ņןņłśņłĀņØĖ XEN-45 (Allergan, Dublin, CA, USA) ņéĮņ×ģņłĀ ņØ┤Ēøä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ļÉśņ¦Ć ņĢŖņĢä ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ ņ┤łĻĖ░ ņŚ¼Ļ│╝Ēż ņ£ĀņČ£(37.5%), ļ¼┤ĒśłĻ┤Ć ļéŁĒżņä▒ ņŚ¼Ļ│╝Ēż(37.5%), ņĀĆņĢłņĢĢ Ļ┤ĆļĀ© ĒĢ®ļ│æņ”Ø(25%)ņØ┤ ļ░£ņāØĒĢ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĻĘĖ ņøÉņØĖņ£╝ļĪ£ XEN-45 ņłśņłĀņŗ£ Ļ▓░ļ¦ēĒĢśļĪ£ ņŻ╝ņ×ģļÉ£ MMCņØś ņ¦ĆņåŹļÉ£ ĒÜ©Ļ│╝ņÖĆ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņŗ£ ņé¼ņÜ®ĒĢśļŖö MMCļĪ£ ņØĖĒĢśņŚ¼ Ļ▓░ļ¦ēņØ┤ MMCņŚÉ ļ░śļ│ĄļÉśņ¢┤ ļģĖņČ£ļÉśļ®┤ņä£ ņåÉņāüļÉśĻ│Ā ļ¬©ņ¢æņ▓┤ ĻĖ░ļŖźņØ┤ ņĀĆĒĢśļÉśņŚłĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöņĀĢĒĢśņśĆļŗż[26]. ĻĘĖļ¤¼ļéś iStent ņéĮņ×ģņłĀ ņŗ£ņŚÉļŖö Ļ▓░ļ¦ēņØ┤ ļ│┤ņĪ┤ļÉśņ¢┤ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØś ņä▒ņĀüņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņØä ļ┐Éļ¦ī ņĢäļŗłļØ╝, MMCļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņ£╝ļ»ĆļĪ£ MMCļź╝ ņé¼ņÜ®ĒĢ£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ņŚ¼Ļ│╝Ēż ļłäņČ£, ļ¼┤ĒśłĻ┤Ćņä▒ ņŚ¼Ļ│╝Ēż ļ░£ņāØņØś ļ╣łļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[25,26].
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņØ┤ĒøäņŚÉļÅä ņĢłņĢĢĒĢśĻ░ĢņĀ£ļź╝ ņČöĻ░ĆļĪ£ ņé¼ņÜ®ĒĢśĻ│ĀļÅä ņĢłņĢĢ ņĪ░ņĀłņØ┤ ļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░Ļ░Ć ļæÉ ĻĄ░ņŚÉņä£ Ļ░üĻ░ü 1ņĢł(10%)ņö® ņ׳ņŚłĻ│Ā, ņØ┤ ĒÖśņ×ÉļōżņØĆ ņĢłņĢĢ ņĪ░ņĀłņØä ņ£äĒĢśņŚ¼ ņĢäļ®öļō£ļ░ĖļĖīņéĮņ×ģņłĀņØä ņŗ£Ē¢ē ļ░øņĢśļŗż. ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ Ēøä ĒĢ®ļ│æņ”Øņ£╝ļĪ£ļŖö ņĀäļ░®ņØś ņ¢ĢņĢäņ¦ÉĻ│╝ ļ¦źļØĮļ¦ēļ░Ģļ”¼Ļ░Ć ļæÉ ĻĄ░ņŚÉņä£ Ļ░üĻ░ü 1ņĢł(10%)ņö® ļ░£ņāØĒĢśņśĆĻ│Ā, ļæÉ ĻĄ░ņŚÉņä£ ņŻ╝ņé¼ņ╣©ņØä ņØ┤ņÜ®ĒĢ£ ņŚ¼Ļ│╝Ēżļ│ĄņøÉņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░Ļ░Ć Ļ░üĻ░ü 4ņĢł(40%)ņö® ņ׳ņŚłĻ│Ā, ņĀĆņĢłņĢĢ ĻĄÉņĀĢņØä ņ£äĒĢ£ Ļ▓ĮĻ▓░ļ¦ē Ļ│Ąļ¦ēĒÄĖļ┤ēĒĢ®ņłĀņØĆ ļīĆņĪ░ĻĄ░ 1ņĢł(10%)ņŚÉņä£ ņŗ£Ē¢ēĒĢśņśĆļŗż. ĒĢ®ļ│æņ”Ø ņóģļźśņÖĆ ļ░£ņāØ ņĖĪļ®┤ņŚÉņä£ ļæÉ ĻĄ░ ņé¼ņØ┤ņŚÉ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż.
ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀ ņłśņłĀ ņżæ ļśÉļŖö ņłśņłĀ Ēøä ņØ┤ņĀäņŚÉ ņŗ£Ē¢ēĒĢśņśĆļŹś iStentĻ░Ć ņĀäļ░® ļé┤ļĪ£ ņåīņŗżļÉśĻ▒░ļéś ņ£äņ╣ś ļ│ĆļÅÖņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņØ┤ļŖö iStent ņéĮņ×ģņłĀņŗ£ ņŖżĒģÉĒŖĖļź╝ ņÜ░ņĢł ņłśņłĀņŗ£ 2-4ņŗ£ ļ░®Ē¢ź, ņóīņĢł ņłśņłĀņŗ£ 8-10ņŗ£ ļ░®Ē¢źņØś ņē┤ļĀśĻ┤ĆņŚÉ ņéĮņ×ģĒĢśņśĆĻ│Ā ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņŗ£ ļé┤ņĖĪ Ļ│Ąļ¦ēņĀłņĀ£ņłĀĻ│╝ ĒÖŹņ▒äņĀłņĀ£ņłĀņØĆ ņÜ░ņĢł ņłśņłĀņŗ£ 12-1ņŗ£ ļ░®Ē¢ź, ņóīņĢł ņłśņłĀņŗ£ 11-12ņŗ£ ņé¼ņØ┤ņŚÉ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ»ĆļĪ£ ļé┤ņĖĪ Ļ│Ąļ¦ēņĀłņĀ£ņłĀ ņŗ£Ē¢ēņŗ£ ņéĮņ×ģļÉ£ iStentņØś ņ£äņ╣śņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņĢśļŹś Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ņØ┤ļ▓ł ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņØĆ iStentļź╝ ņŗ£Ē¢ē ļ░øĻ│Ā ņØ┤ĒøäņŚÉ ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×É ņłśĻ░Ć 9ļ¬ģ 10ņĢł, ļīĆņĪ░ĻĄ░ ļśÉĒĢ£ 10ļ¬ģ 10ņĢłņ£╝ļĪ£ Ļ░ü ĻĄ░ņØś Ēü¼ĻĖ░Ļ░Ć ņ×æņĢäņä£ Ļ▓░Ļ│╝ņØś ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņŚÉ ļīĆĒĢ£ ņŗĀļó░ļÅäĻ░Ć ļ¢©ņ¢┤ņ¦ł ņłś ņ׳Ļ│Ā, ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ Ļ▓░Ļ│╝ņØ┤ļ®░, ņłśņłĀ Ēøä Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ 12Ļ░£ņøöļĪ£ ļ╣äĻĄÉņĀü ņ¦¦ņØĆ ņĀÉņØä ļōż ņłś ņ׳ļŗż. ļö░ļØ╝ņä£, ņČöĒøä ļŹö ļ¦ÄņØĆ ņłśņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņןĻĖ░ņĀüņØĖ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ņØä ĒĢśļŖö ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöļĪ£ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļśÉĒĢ£ 1Ļ░£ņØś 1ņäĖļīĆ iStentļ¦ī ņéĮņ×ģĒĢ£ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ»ĆļĪ£ 2Ļ░£ ņØ┤ņāüņØś ņŖżĒģÉĒŖĖņÖĆ 2ņäĖļīĆ iStentļź╝ ņéĮņ×ģĒĢ£ ĒÖśņ×ÉļōżņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼ļÅä ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś ļśÉ ļŗżļźĖ ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ņŚ¼Ļ│╝Ēż ļé┤ļČĆĻĄ¼ņĪ░ ļČäņäØņØä ņ£äĒĢ£ ņĀäņĢłļČĆ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņ¦Ć ļ¬╗ĒĢ£ ņĀÉņØä ļōż ņłś ņ׳ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ņäĖĻĘ╣ļō▒Ļ▓Ćņé¼ņŚÉ ņØśĒĢ£ ņŚ¼Ļ│╝ĒżņØś ņ£ĪņĢłņĀü ĒŖ╣ņä▒ ļČäņäØņØĆ ņŚ¼Ļ│╝ĒżņØś ĻĖ░ļŖźĻ│╝ ļ░ĆņĀæĒĢ£ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņ£╝ļéś, ņłśņłĀ Ēøä ņןĻĖ░ņĀüņØĖ ņłśņłĀ ņä▒Ļ│Ą Ēś╣ņØĆ ņŗżĒī©ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņŚ¼Ļ│╝ĒżņØś ļé┤ļČĆ ĻĄ¼ņĪ░ļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåļŗżļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż[27-33]. ņŚ¼Ļ│╝ĒżņŚÉ ļīĆĒĢ£ ļ╣øĻ░äņäŁļŗ©ņĖĄņ┤¼ņśüĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ļŗżļ®┤ ļæÉ ĻĄ░ Ļ░ä ņłśņłĀ ņä▒Ļ│ĄņŚÉ ļ»Ėņ╣śļŖö ņŚ¼Ļ│╝Ēż ĒśĢĒā£ļź╝ ņØ┤ĒĢ┤ĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ iStent ņéĮņ×ģņłĀņØ┤ ņŗżĒī©ĒĢ£ ņøÉļ░£Ļ░£ļ░®Ļ░üļģ╣ļé┤ņן ĒÖśņ×ÉņŚÉņä£ ņŗ£Ē¢ēĒĢśļŖö ņä¼ņ£ĀņŻ╝ņĀłņĀ£ņłĀņØĆ ņĢłņĢĢņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒĢśĻ░Ģņŗ£ĒéżļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉ©ņØä ņĢī ņłś ņ׳ņŚłļŗż.
Figure┬Ā1.
Changes in mean intraocular pressure (IOP) after trabeculectomy in iStent and control groups. Intraocular pressure at each time point was not significantly different between the two groups during entire study period. The errors bars are 95% confidence intervals (mean ┬▒ standard error ├Ś 1.96).
Figure┬Ā2.
Cumulative probabilities of complete and qualified surgical success after trabeculectomy in iStent group and control group. (A) Cumulative probabilities of complete surgical success after trabeculectomy in iStent group and control group. Success rate was not different between the two groups (Mantel-Cox log rank test). The mean (standard error, SE) complete success rates at the first year of follow-up was 80.0% (12.6) for iStent group and 90.0% (9.5) for control group (p = 0.584). (B) Cumulative probabilities of qualified surgical success after trabeculectomy in iStent group and control group. Success rate was not different between the two groups (Mantel-Cox log rank test). The mean (SE) qualified success rates at the first year of follow-up was 90.0% (9.5) for iStent group and 90.0% (9.5) for control group (p = 0.970).
Figure┬Ā3.
Gonioscopic images showing an iStent inserted at SchlemmŌĆÖs canal at 2.5 oŌĆÖclock position (A) and bleb photograph (B) of representative case of iStent group at 1 year after trabeculectomy. A 60-year-old man with primary open-angle glaucoma received iStent implantation in right eye 5 months before trabeculectomy. Intraocular pressure in the right eye was 31 mmHg with maximal tolerated medical therapy before iStent implantation. However, Intraocular pressure increased again to 40 mmHg with maximal tolerated medical therapy at 5 months after iStent implantation and trabeculectomy with mitomycin-C was performed. Bleb photograph in the right eye shows bleb with medium height (H2), 4-clock hours extent (E3) and mild vascularity (V2). Intraocular pressure was 7 mmHg without glaucoma medication at 1 year after trabeculectomy with mitomycin-C.
Table┬Ā1.
Clinical and demographic characteristics of iStent and control groups
| Characteristic | iStent group | Control group | p-value |
|---|---|---|---|
| Eyes (patients) | 10 (9) | 10 (10) | - |
| Sex (male/female) | 8/1 | 9/1 | 1.000* |
| Age (years) | 60.9 ┬▒ 22.1 | 64.4 ┬▒ 12.0 | 0.796ŌĆĀ |
| Follow up (months) | 13.1 ┬▒ 1.4 | 13.9 ┬▒ 2.1 | 0.393ŌĆĀ |
| Interval between iStent and trabeculectomy (months) | 5.0 ┬▒ 2.1 | - | - |
| Baseline IOP (before iStent, mmHg) | 31.8 ┬▒ 14.7 | - | - |
| Preoperative IOP (before trabeculectomy, mmHg) | 29.0 ┬▒ 7.4 | 29.2 ┬▒ 7.5 | 0.828ŌĆĪ |
| Number of preoperative medication | 3.8 ┬▒ 0.4 | 4 | 0.481ŌĆĀ |
| Central corneal thickness (╬╝m) | 547.3 ┬▒ 46.3 | 508.4 ┬▒ 39.2 | 0.063ŌĆĀ |
| Axial length (mm) | 25.9 ┬▒ 2.7 | 24.8 ┬▒ 1.8 | 0.436ŌĆĀ |
| Spherical equivalent (diopter) | -3.2 ┬▒ 4.1 | -2.28 ┬▒ 3.0 | 0.481ŌĆĀ |
| Lens status (phakia/pseudophakia) | 5/5 | 6/4 | 1.000* |
| Visual field test | |||
| ŌĆāVisual Field Index (%) | 42.8 ┬▒ 35.9 | 52.4 ┬▒ 33.5 | 0.544ŌĆĪ |
| ŌĆāMean deviation (dB) | -19.4 ┬▒ 10.1 | -17.2 ┬▒ 10.1 | 0.625ŌĆĪ |
| ŌĆāPattern standard deviation (dB) | 7.1 ┬▒ 3.6 | 8.2 ┬▒ 5.0 | 0.573ŌĆĪ |
| Cirrus optical coherence tomography | |||
| ŌĆāAverage macular GC/IPL thickness (╬╝m) | 59.5 ┬▒ 10.3 | 58.0 ┬▒ 10.6 | 0.751ŌĆĪ |
| ŌĆāAverage RNFL thickness (╬╝m) | 70.9 ┬▒ 8.4 | 64.4 ┬▒ 10.9 | 0.153ŌĆĪ |
Table┬Ā2.
Preoperative and postoperative intraocular pressure, number of glaucoma medication, visual acuity in iStent and control groups
| iStent group | Control group | p-value between two groups | |
|---|---|---|---|
| IOP (mmHg) | |||
| ŌĆāPreoperative | 29.0 ┬▒ 7.4 | 29.2 ┬▒ 7.5 | 0.828* |
| ŌĆāPostoperative | 12.4 ┬▒ 3.1 | 12.1 ┬▒ 4.1 | 0.387* |
| ŌĆāp-value between preoperative and postoperative value | <0.001ŌĆĀ | <0.001ŌĆĀ | - |
| Number of medications | |||
| ŌĆāPreoperative | 3.8 ┬▒ 0.4 | 4 | 0.481ŌĆĪ |
| ŌĆāPostoperative | 0.5 ┬▒ 1.3 | 0.4 ┬▒ 1.3 | 0.739ŌĆĪ |
| ŌĆāp-value between preoperative and postoperative value | 0.006┬¦ | 0.003┬¦ | - |
| BCVA (LogMAR) | |||
| ŌĆāPreoperative | 0.57 ┬▒ 0.69 | 0.47 ┬▒ 0.90 | 0.280ŌĆĪ |
| ŌĆāPostoperative | 0.60 ┬▒ 0.71 | 0.45 ┬▒ 0.74 | 0.353ŌĆĪ |
| ŌĆāp-value between preoperative and postoperative value | 0.334┬¦ | 1.000┬¦ | - |
Table┬Ā3.
Complications after trabeculectomy in iStent and control groups
| Postoperative complication | iStent group | Control group | p-value* |
|---|---|---|---|
| Shallow anterior chamber | 1 (10.0) | 1 (10.0) | 1.000 |
| Choroidal effusion | 1 (10.0) | 1 (10.0) | 1.000 |
| Hypotony | 1 (10.0) | 0 | 1.000 |
| Transconjunctival scleral flap suture | 0 | 1 (10.0) | 1.000 |
| Bleb needling | 4 (40.0) | 4 (40.0) | 1.000 |
Table┬Ā4.
Comparison of bleb morphology based on IBAGS after trabeculectomy in iStent and control groups
| iStent group | Control group | p-value* | ||
|---|---|---|---|---|
| Height (H0-H3) | 1 | 2 (20.0) | 3 (30.0) | 1.000 |
| 2 | 8 (80.0) | 7 (70.0) | - | |
| Horizontal extent (E0-E3) | 1 | 2 (20.0) | 1 (10.0) | 1.000 |
| 2 | 5 (50.0) | 6 (60.0) | - | |
| 3 | 3 (30.0) | 3 (30.0) | - | |
| Vascularity (V0-V4) | 2 | 7 (70.0) | 9 (90.0) | 0.582 |
| 3 | 3 (30.0) | 1 (10.0) | - |
REFERENCES
3) Akafo SK, Goulstine DB, Rosenthal AR. Long-term post trabeculectomy intraocular pressures. Acta Ophthalmol (Copenh) 1992;70:312-6.


4) WuDunn D, Cantor LB, Palanca-Capistrano AM, et al. A prospective randomized trial comparing intraoperative 5-fluorouracil vs mitomycin C in primary trabeculectomy. Am J Ophthalmol 2002;134:521-8.


5) Kim DH, Lee YG, Hong YJ. The effect of mitomycin C on primary trabeculectomy: comparative study in the same person. J Korean Ophthalmol Soc 1998;39:2129-35.
6) Palanca-Capistrano AM, Hall J, Cantor LB, et al. Long-term outcomes of intraoperative 5-fluorouracil versus intraoperative mitomycin C in primary trabeculectomy surgery. Ophthalmology 2009;116:185-90.


7) Anand N, Arora S, Clowes M. Mitomycin C augmented glaucoma surgery: evolution of filtering bleb avascularity, transconjunctival oozing, and leaks. Br J Ophthalmol 2006;90:175-80.



8) Le K, Saheb H. iStent trabecular micro-bypass stent for open-angle glaucoma. Clin Ophthalmol 2014;8:1937-45.


9) Katz LJ, Erb C, Guillamet AC, et al. Long-term titrated IOP control with one, two, or three trabecular micro-bypass stents in open-angle glaucoma subjects on topical hypotensive medication: 42-month outcomes. Clin Ophthalmol 2018;12:255-62.



10) Park SH, Park KH, Lee JW, Shin J. Short-term outcomes and prognostic factors of iStent in the Republic of Korea. J Korean Ophthalmol Soc 2020;61:385-93.

11) Popovic M, Campos-Moller X, Saheb H, Ahmed IIK. Efficacy and adverse event profile of the iStent and iStent inject trabecular micro-bypass for open-angle glaucoma: a meta-analysis. J Curr Glaucoma Pract 2018;12:67-84.



12) Schauersberger J, Kruger A, M├╝llner-Eidenb├Čck A, et al. Long-term disorders of the blood-aqueous barrier after small-incision cataract surgery. Eye (Lond) 2000;14(Pt 1):61-3.


13) Joseph JP, Grierson I, Hitchings RA. Chemotactic activity of aqueous humor. A cause of failure of trabeculectomies? Arch Ophthalmol 1989;107:69-74.


14) Reichel MB, Cordeiro MF, Alexander RA, et al. New model of conjunctival scarring in the mouse eye. Br J Ophthalmol 1998;82:1072-7.



15) Fontana H, Nouri-Mahdavi K, Lumba J, et al. Trabeculectomy with mitomycin C: outcomes and risk factors for failure in phakic open-angle glaucoma. Ophthalmology 2006;113:930-6.


16) Foster PJ, Buhrmann R, Quigley HA, Johnson GJ. The definition and classification of glaucoma in prevalence surveys. Br J Ophthalmol 2002;86:238-42.



17) Jongsareejit B, Tomidokoro A, Mimura T, et al. Efficacy and complications after trabeculectomy with mitomycin C in normal-tension glaucoma. Jpn J Ophthalmol 2005;49:223-7.


18) Cantor LB, Mantravadi A, WuDunn D, et al. Morphologic classification of filtering blebs after glaucoma filtration surgery: the Indiana Bleb Appearance Grading Scale. J Glaucoma 2003;12:266-71.


19) Gedde SJ, Schiffman JC, Feuer WJ, et al. Treatment outcomes in the tube versus trabeculectomy (TVT) study after five years of follow-up. Am J Ophthalmol 2012 153:789-803. e2.



20) Esfandiari H, Taubenslag K, Shah P, et al. Two-year data comparison of ab interno trabeculectomy and trabecular bypass stenting using exact matching. J Cataract Refract Surg 2019;45:608-14.


21) Huang AS, Saraswathy S, Dastiridou A, et al. Aqueous angiography-mediated guidance of trabecular bypass improves angiographic outflow in human enucleated eyes. Invest Ophthalmol Vis Sci 2016;57:4558-65.



22) Huang AS, Penteado RC, Papoyan V, et al. Aqueous angiographic outflow improvement after trabecular microbypass in glaucoma patients. Ophthalmol Glaucoma 2019;2:11-21.


23) Skuta GL, Parrish RK 2nd. Wound healing in glaucoma filtering surgery. Surv Ophthalmol 1987;32:149-70.


24) Broadway DC, Chang LP. Trabeculectomy, risk factors for failure and the preoperative state of the conjunctiva. J Glaucoma 2001;10:237-49.


25) Jea SY, Mosaed S, Vold SD, Rhee DJ. Effect of a failed trabectome on subsequent trabeculectomy. J Glaucoma 2012;21:71-5.


26) Gizzi C, Mohamed-Noriega J, Elkarmouty A, Scott A. Trabeculectomy following failed ab interno gelatin microstent: case series. J Glaucoma 2018;27:e168-73.


27) Singh D, Singh M. Pretrabecular filtration in aphakic glaucoma. Indian J Ophthalmol 1978;26:17-21.
28) Jung KI, Lim SA, Park HYL, Park CK. Visualization of blebs using anterior-segment optical coherence tomography after glaucoma drainage implant surgery. Ophthalmology 2013;120:978-83.


29) Jung KI, Park H, Jung Y, Park CK. Serial changes in the bleb wall after glaucoma drainage implant surgery: characteristics during the hypertensive phase. Acta Ophthalmol 2015;93:e248-53.


30) Kokubun T, Kunikata H, Tsuda S, et al. Quantification of the filtering blebŌĆÖs structure with anterior segment optical coherence tomography. Clin Exp Ophthalmol 2016;44:446-54.


31) Kokubun T, Tsuda S, Kunikata H, et al. Anterior-segment optical coherence tomography for predicting postoperative outcomes after trabeculectomy. Curr Eye Res 2018;43:762-70.


-
METRICS

-
- 1 Crossref
- 0 Scopus
- 2,491 View
- 70 Download
- Related articles
-
Long-term Results of Primary Trabeculectomy in Glaucoma.2003 March;44(3)
Results of Trabeculectomy on the Glaucoma Associated with Keratoplasty.1997 December;38(12)
Clinical Results of Trabeculectomy: 23 Cases.1976 December;17(4)




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



