 |
 |
| J Korean Ophthalmol Soc > Volume 61(12); 2020 > Article |
|
ęľëŹ¸ě´ëĄ
몊ě
í¨í ě´ë ě´ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě ěííěŹ ěě결곟뼟 매ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěęłź ëšęľíěŹ ëł´ęł íęł ě íë¤.
ëěęłź ë°Šë˛
매ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěě ë°ě 21ě, í¨í ě´ë ě´ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě ë°ě 29ěě ëí´ ěľëęľě ěë Ľ, ęľ´ě ëě, ę°ë§ëě, ę°ë§ë´íźě¸íŹě, ě´ě ęą°ëś, 기ëĽëśě ëąě ě í ěě결곟뼟 ëšęľíěë¤.
결곟
ěě í 1, 3, 6, 12, 18ę°ěě 츥ě í ěľëęľě ěë Ľě 매ë´ěźęľ°ě logMAR 1.21, 1.28, 1.25, 1.14, 1.43, í¨í ě´ë ě´ě ęľ°ě logMAR 0.82, 0.71, 0.78, 0.49, 0.56ěźëĄ 모ë 기ę°ěě í¨í ě´ë ě´ě ęľ°ě´ ë§¤ë´ěźęľ°ě ëší´ ëě ěë Ľě ě ě§íěë¤. ęľ´ě ëěë 매ë´ěźęľ°ě 5.13, 6.35, 5.28, 5.18, 6.36 diopters (D), í¨í ě´ë ě´ě ęľ°ě 6.09, 6.33, 5.14, 5.23, 4.89 D, ę°ë§ëěë 매ë´ěźęľ°ě 5.40, 6.45, 6.30, 5.64, 5.78 D, í¨í ě´ë ě´ě ęľ°ě 6.17, 6.24, 5.72, 5.02, 4.83 Dě´ëŠ° ęľ´ě ëěë ěě í 18ę°ě째, ę°ë§ëěë ěě í 12, 18ę°ě째ě í¨í ě´ë ě´ě ęľ°ěě ě ěíę˛ ëě ëěę° ëŽěë¤. ę°ë§ë´íźě¸íŹě, ě´ě ęą°ëś ë° ę¸°ëĽëśě ě ë ęľ°ěě ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤.
결ëĄ
í¨í ě´ë ě´ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě 매ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěęłź ëšęľíěŹ ěë Ľíëłľě´ ě˘ęł ęľ´ě ëěě ę°ë§ëěę° ě ěźëŠ°, ě°˝ěëśě ěě ěąě´ ë ě˘ě ěĽě ě´ ěěźëŻëĄ ě 츾ę°ë§ě´ě ěě ęł ë ¤í ě ěë íëě ěě ë°Šë˛ě´ë¤.
ABSTRACT
Purpose
We compare the clinical outcomes of femtosecond-laser penetrating keratoplasty and penetrating keratoplasty performed using a manual trephine.
Methods
The clinical outcomes of 21 eyes that underwent penetrating keratoplasty using a manual trephine and 29 eyes that underwent femtosecond-laser penetrating keratoplasty were compared in terms of best-corrected visual acuity, refractive and corneal astigmatisms, endothelial cell counts, and graft rejection and failure.
Results
The best-corrected visual acuities measured 1, 3, 6, 12, and 18 months after surgery were logMAR 1.21, 1.28, 1.25, 1.14, and 1.43 for the manual trephine group and logMAR 0.82, 0.71, 0.78, 0.49, and 0.56 for the femtosecond-laser group; the latter group thus exhibited better visual acuity at all times. The refractive astigmatism values were 5.13, 6.35, 5.28, 5.18, and 6.36 diopters (D) for the manual trephine group and 6.09, 6.33, 5.14, 5.23, and 4.89 D for the femtosecond-laser group. The corneal astigmatism values were 5.40, 6.45, 6.30, 5.64, and 5.78 D for the manual trephine group and 6.17, 6.24, 5.72, 5.02, and 4.83 D for the femtosecond-laser group. The refractive astigmatism was significantly lower at 18 months after surgery and the corneal astigmatism was significantly lower at both 12 and 18 months after surgery in the femtosecond-laser group. None of endothelial cell count, graft rejection or failure rate, differed significantly between the two groups.
ę°ë§ě´ěě ę°ë§ ě¤ěŹëśëĽź íŹëŞ
íę˛ íęł ę°ë§ęľ´ě ě´ěě ęľě í늰 ę°ë§ě 꾏쥰ě ěźëĄ ě§ě§íęł íľěŚě 경ę°ěí¤ëŠ° ę°ěźě 쥰ě íë ěí ě íë¤. ë°ě¤ëŠë§ë°ëŚŹ ěëë´íźę°ë§ě´ě, ë°ě¤ëŠë§ ë´íźę°ë§ě´ě, ěŹëśě츾íę°ë§ě´ě, ě 츾ę°ë§ě´ě ëą ë¤ěí ěě ë°Šë˛ě´ ěěźëŠ° ě 츾ę°ë§ě´ěě ěěŠę°ë§ě ě 츾ě 기ěŚę°ë§ěźëĄ ëěšíěŹ ě´ěíë ě ę¸°ëĄ ę°ë§ě´ěěě ę°ěĽ ë§ě´ ěŹěŠëë ě 기ě´ë¤[1]. ę°ë§ě´ě ěě í ë°ěíë ëě, ě°˝ěëśë´íŠě ě ě§ ë° ę°ěź, ě´ěí¸ě ęą°ëś ë°ě ëąě ěě í ë°ěí ě ěë 돸ě ë¤ě´ë¤. ꡸ ě¤ ëěë ěë Ľ íëłľě 죟ěí 깸댟ë ě¤ íëě´ë¤. ěě í ëěě ë°ě ěě¸ěźëĄ ë´íŠěŹě ëě¨í¨ íšě 긴ěĽë Ľ, ě°˝ěëśěšě ě ě§ě°ęłź ëśęˇěší¨, 기ěŚę°ë§ęłź ěěŠę°ë§ ę°ě ě¤ě ë Ź, ë´íŠ ëśě ë˛ě´ě§, ěě ě ěěŹěě ę°ë§ëě ěí ëąě´ ěě¸ěźëĄ ěë ¤ě ¸ ěë¤[2]. ěěŹ ëě뼟 ę°ěěí¤ę¸° ěíěŹ ě íě ë´íŠěŹ ě ęą°, ě경 ë° RGP ě˝íí¸ë ěŚ ě°ŠěŠ, ěě ě ě¤ěŹ ë°Šë˛ë¤ě´ ěíëě´ ěë¤. ꡸ ě¸ ěěŹ ëě뼟 ěľěíí기 ěíěŹ ěëĄě´ 기ě ë¤ě´ ě°ęľŹëěěźëŠ° ꡸ ě¤ íëëĄ í¨í ě´ë ě´ě ę° ę°ë°ëě´ ě´ëĽź ě´ěŠíěŹ ě 츾ę°ë§ě´ěě ěííę˛ ëěë¤[3]. í¨í ě´ë ě´ě ë ě´ë¨íě ě§ë 죟기뼟 ę°ě§ęł ěě´ ë ěě 윊겊íě 기íŹëĽź ë°ěíěŹ ěíë 모ěěźëĄ ę°ë§ 쥰ě§ě ě ííę˛ ě뼟 ě ěë¤. ě´ë, ěŁźëł ěĄ°ě§ě ěľěíě ěíĽě 죟늰 ę°ë§ëśě˘
ëą ë§¤ě§ě´ íźííěŹë íŹęłźí ě ěě´ ę°ë§ ë´ ě´ë ęłłěë ěëě§ëĽź ě ëŹí ě ěë¤. í¨í ě´ë ě´ě 뼟 íľí´ ę¸°ěŚ ę°ë§í¸ě ëˇëŠ´ě ě§ëŚě´ ěëŠ´ëł´ë¤ í° ě¤ě 모ě 모ě(top-hat), ę¸°ěŚ ę°ë§í¸ě ě늴ě ě§ëŚě´ ëˇëŠ´ëł´ë¤ í° ë˛ěŻ 모ě(mushroom), ěŹě 모ě(oblique), ěě§ ëŞ¨ě(vertical) ëą ë¤ěí ě°˝ě 모ěě ę°ë§ě ë§ë¤ ě ěę˛ ëěë¤. ě´ëŹí ę°ë§ ě°˝ě 모ěě ě íí ě ě , ěěŠ-기ěŚę°ë§ě ě ě´ëŠ´ě ëë ¤ 쥰기 ë´íŠěŹ ě ęą°, ë´íŠ ëśěě 긴ěĽě ę°ěěěź ëěě ę°ěëĄ ěë Ľě ëš ëĽ´ę˛ íëłľěíŹ ę˛ěźëĄ ěę°ëěë¤[4-7].
í¨í ě´ë ě´ě ę° ę°ë°ëě´ ę°ë§ě´ěě ě´ěŠë늴ě í¨í ě´ë ě´ě ě 매ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěě ěě결곟뼟 ëšęľíë ë§ě ě°ęľŹë¤ě´ ě§íëěë¤. í ě°ęľŹěěë í¨í ě´ë ě´ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě´ ë§¤ë´ěź í¸ë íě¸ě ě´ěŠí ęľ°ëł´ë¤ ěë Ľě íëłľě´ ëš ëĽ´ęł ëě ë°ěě´ ě ë¤ęł 죟ěĽíěěźëŠ° ë¤ëĽ¸ ě°ęľŹěěë ë ęľ° ę°ě ě ěí ě°¨ě´ë ěěë¤ęł ë§íë¤[8,9]. ě´ëŹí ě°ęľŹë¤ě ě´ę¸° ěě ěąě ě ëšęľí ę˛ë¤ě´ ë§ě기ě ě´ě ě ěë¤ě 본 ě°ęľŹěě í¨í ě´ë ě´ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě ěííěŹ ěľëęľě ěë Ľ, ę°ë§ëě, ęľ´ě ëě, ę°ë§ë´íźě¸íŹě, ě´ě ęą°ëś, 기ëĽëśě ëąě ě í ěĽę¸° ěě결곟뼟 ěě기ëĄě ííĽě ęł ě°°ě íľíěŹ ë§¤ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěęłź ëšęľíěŹ ëł´ęł íęł ě íë¤.
2015ë
1ěëśí° 2018ë
12ěęšě§ 본ěěě ě 츾ę°ë§ě´ěě ë°ě 50ě(50ëŞ
) ě¤ ë§¤ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěě ë°ě 21ě(21ëŞ
; ę°ë§íźí 7ě, ěíŹę°ë§ëłěŚ 8ě, ę°ë§ě´ěěŚ 2ě, ě´ě ęą°ëś ëą 4ě)ęłź í¨í ě´ë ě´ě (IntraLase FS laser, IntraLase, Irvine, CA, USA)뼟 ě´ěŠí ě 츾ę°ë§ě´ěě ë°ě 29ě(29ëŞ
; ěěśę°ë§ 11ě, ę°ë§íźí 12ě, ěíŹę°ë§ëłěŚ 2ě, ę°ë§ě´ěěŚ 3ě, ě´ě ęą°ëś 1ě)ě ëěěźëĄ íěë¤. ě´ě¸ ę°ë§ě´ě í ěŹěě ě¸ ę˛˝ě°, íľěŚěĄ°ě ě ěí´ ě 츾ę°ë§ě´ěě ěíí 경ě°, íëěąě ěźěŚě´ ę´ě°°ëë 경ě°, ěě ě´í ěśě ę´ě°°ě´ ëě§ ěěë 경ě°ë 본 ě°ęľŹěě ě ě¸íěë¤. ěě í í¨ęłź ë° ěě경곟뼟 ëšęľí기 ěí´ ě돴기ëĄě ííĽě ěźëĄ 쥰ěŹíěë¤. 본 ě°ęľŹë íŹěąí¤ě ě¸ě ě
ę°í ě°ęľŹě¤ëŚŹěŹěěěí(IRB)ě ěšě¸ě ë°ě(ěŹěŹ ë˛í¸: KC20RISI0286) ě§íëěë¤.
모ë ěě ě ě ě ë§ěˇ¨íě ěíëěë¤. 매ë´ěźęľ°ě ę˛˝ě° ěěŠę°ë§ ěěśě ě¤ěŹě íěíęł ę°ęłľë§ěíě ě 기(Barron Trephine, Katena Products Inc., Parsippany, NJ, USA)뼟 ě´ěŠíěŹ ěěŠę°ë§ě ěěëë ě ě ëśěě íě뼟 íěë¤. ꡸ í ę°ęłľë§ěíě ě 기뼟 ě´ěŠíěŹ ę¸°ěŚę°ë§ě ěí ě ě íěęł ě§ęłľę°ë§ěíě ě 기(Barron Vacuum Trephine, Katena Products Inc.)뼟 ě´ěŠíěŹ ěěŠę°ë§ě ë°ě¤ëŠë§ ꡟě˛ęšě§ ęšę˛ ě ě íěë¤. 9ě ëë 3ě ë°ŠíĽě ěíě ę°í ě댏뼟 ě댏í ěšźëĄ ě˛ěíęł ě°˝ěě ě˝ę° ëí í ě ë°Šě ě í돟ě§ě 죟ě
íěŹ ě ë°Šě ęšę˛ íęł Katzin Corneal Transplant Scissors (Katena Products, Inc.)ě ě´ěŠíěŹ ë¨ěěë ę°ë§ěĄ°ě§ě ëë ¤ëë¤. ě´í ě í돟ě§ě 죟ě
íěŹ ěěě ě ě§íęł ěěŠę°ë§ ěě 기ěŚę°ë§ě ěŹë ¤ëęł 10-0 ëěźëĄ ë´íŠěŹëĽź ě´ěŠíěŹ 16ę° ë¨ě ë´íŠě ěííěë¤. í¨í ě´ë ě´ě ęľ°ě ę˛˝ě° ę¸°ěŚę°ë§ęłź ěěŠę°ë§ 모ë 60-kHz í¨í ě´ë ě´ě 뼟 ě´ěŠíěŹ ę°ë§ě ě ę°íěë¤. 3ěěěë ë˛ěŻ 모ě, 6ěěěë ěŹě 모ě, ꡸ ě¸ 20ěěěë ěě§ ëŞ¨ěěźëĄ ě ę°ëĽź ěííěë¤(Fig. 1). 먟ě ě¸ëęľ´ě ě¤ěě ěěŠę°ë§ě í¨í ě´ë ě´ě 뼟 ě´ěŠíěŹ ëěě íěë¤. ě´í 기ěŚę°ë§ě ě¸ęłľě ë°Š(artificial anterior chamber; Moria, Antony, France)ě ěŹë ¤ëęł ííěźěĄ(balanced salt solution)ě ě ë°Šě 죟ě
íěŹ ěë°Šě ě§ěĽěš(anterior chamber maintainer, Moria)ëĄ ěë Ľ 50 mmHgëĄ ě ě§ěí¨ë¤. 미댏 기ęłëĽź ě¤ě íěŹ ë˛ěŻ, ěŹě , ěě§ ëŞ¨ěěźëĄ ěëě§ í(pulse)ę° ě ëŹëëëĄ íěë¤. ěě§ ëŞ¨ěěěë ę°ë§ í늴곟 90°ę°ëëĄ ě ę°ëĽź ěííěęł ë˛ěŻ 모ěěěë ę°ë§ ëˇëŠ´ě ěě§ě ę°ëĽź ěí í ę°ë§ ě쪽 늴ěźëĄëśí° 330 Îźm ęšě´ěě í 0.6 mmě 츾íěíě ę°(lamellar cut)ě ěííěë¤. ěŹě 모ěěěë ě 체 길ě´ëĽź ę°ë§ ě늴ě ëší´ ëˇëŠ´ě 0.2 mm ě§§ę˛ íěŹ ě ę°íěë¤. ě´ ë ę°ë§ě 츾ě ě ę°íęł ěěŠę°ë§ęłź ë´íŠí ëśě뼟 í¨í ě´ë ě´ě ëĄ íěíěë¤(Fig. 2A). ě ę°ë ę°ë§ě ěľí°ěĄ¸(Optisol GS; Bausch & Lomb Surgical, Irvine, CA, USA)ě ë´ěëěë¤. ěěŠę°ë§ě ę˛˝ě° ë¨źě ëěí´ ëě ëśě뼟 í¨í ě´ë ě´ě 뼟 ě´ěŠíěŹ ě ę°íëë° ę°ë§ě˛ęłľě ë§ę¸° ěí´ ę¸°ě ëś 150 Îźm뼟 ë¨ę˛¨ëěë¤. 기ěŚę°ë§ęłź ë§ě°Źę°ě§ëĄ ë´íŠí ëśě뼟 í¨í ě´ë ě´ě ëĄ íěíěë¤(Fig. 2B). ě´í ěě ë°ŠěźëĄ ě´ëíěŹ Katzin Corneal Transplant Scissors(Katena Products, Inc.)ě ě´ěŠíěŹ ěěŠę°ë§ě ëˇëŠ´ě ě ę°ëĽź ěśę°ëĄ ěííěŹ ę°ë§ě ę°ëĽź ěěąěěź°ë¤. ě´íě ęłźě ě 매ë´ěźęľ°ęłź ëěźíę˛ ěííěěźëŠ° 기ěŚę°ë§, ěěŠę°ë§ě í¨í ě´ë ě´ě ëĄ ë´íŠí ëśě뼟 íěí ëśëśëźëŚŹ ë´íŠě ěííěë¤. ěě í 0.5% moxifloxacin (VigamoxÂŽ, Alcon, Inc., Fort Worth, TX, USA), 1% prednisolone acetate(PredforteÂŽ; Allergan, Inc., Irvine, CA, USA)ě í루 4í 2ę°ěę° ě ěíěęł ě´í 0.1% fluorometholone (FumelonÂŽ, Hanmi Pharm. Co., Ltd., Seoul, Korea)ěźëĄ ëłę˛˝íěŹ í루 4í ě ěíëëĄ íěěźëŠ° ę°ë§ěíź ěíě ë°ëź ěě˝ě 쥰ě íěë¤. ë´íŠěŹ ě ęą°ë ěě í 6ę°ě í ě¸ë 밊돸í ë ë§ë¤ ę°ë§ ě§íëěě ëě ë°ŠíĽě ë°ëź ě íě ěźëĄ ë´íŠěŹ ěźëśëĽź ě ęą°íěěźëŠ° ë´íŠěŹę° ëě´ě§ęą°ë ëě¨í 경ě°ë í´ëšëë ë´íŠěŹëĽź ě ęą°íěë¤.
ěě ě 모ë íěěě ěľëęľě ěë Ľ, ě¸ęˇšëąí미경ę˛ěŹ, ěëęľ´ě ęłëĽź íľí ęľ´ě ę˛ěŹ, ę°ë§ë´íźě¸íŹę˛ěŹ, ę°ë§ëęť ě¸Ąě ęłëĄ ę°ë§ëęť, ěëę°ë§ęłĄëĽ ęłëĄ ěě§ ë°ŠíĽęłź ěíë°ŠíĽě ęľ´ě ę°ě 츥ě íęł ëšę°ěë¨ě¸ľě´Źě(Visante anterior segment Optical coherence tomography, Carl Zeiss Meditec AG, Jena, Germany)ě ě´ěŠíěŹ ěěŹę°ë§ě ě ę° ë°Šë˛ęłź ëěě 결ě íë ë°ě ě´ěŠíěë¤. ě í 1ę°ě, 3ę°ě, 6ę°ě, 12ę°ě, 18ę°ě째 ěľëęľě ěë Ľ, ëě뼟 íę°í기 ěíěŹ ěëęľ´ě ęłëĽź ě´ěŠíěŹ ęľ´ě ëě, ę°ë§ëě, ę°ë§ë´íźě¸íŹě뼟 츥ě íęł ě ěëś ěŹě§ě ě´Źěíěë¤. ęą°ëś ë°ěě ěě ě겏곟 í¨ęť ě´ěí ę°ë§ëęť ě¸Ąě ë˛ě ě´ěŠí ę°ë§ě ëęť, ë´íźě¸íŹ ě 츥ě ěźëĄ ě§ë¨ ë´ë ¸ěźëŠ° ě¤í
ëĄě´ë, 늴ěěľě ě ëąěë íëłľëě§ ěë 경ě°ëĽź ę°ë§ě´ě ě¤í¨ëź ě ěíěë¤.
íľęłíě ě˛ëŚŹë SPSS software (version 22.0, IBM Corp., Armonk, NY, USA)뼟 ě´ěŠíěěźëŠ° ě°ěëłěěě ë ęľ° ę°ě ě°¨ě´ëĽź ëšęľí기 ěí´ Mann-Whitney U test뼟 ě´ěŠíěęł ęľ° ë´ěě ěě í 1ę°ěęłź 18ę°ěëě ě°¨ě´ëĽź ëšęľí기 ěí´ ëěí본 t ę˛ě ě ě´ěŠíěë¤. pę°ě´ 0.05 미ë§ěź ę˛˝ě° íľęłě ěźëĄ ě ěíë¤ęł íę°íěë¤.
매ë´ěź í¸ë íě¸(매ë´ěźęľ°)ęłź í¨í ě´ë ě´ě (í¨í ě´ë ě´ě ęľ°)뼟 ě´ěŠí ě 츾ę°ë§ě´ěě ë°ě 21ě(21ëŞ
) ë° 29ě(29ëŞ
)ě 기본ě ě¸ íšěąë¤ě ě 댏íěë¤(Table 1). ěě ě íęˇ ě°ë šě 매ë´ěźęľ°ě 63.9 Âą 15.5ě¸, í¨í ě´ë ě´ě ęľ°ě 45.6 Âą 17.4ě¸ëĄ ë ęľ° ę°ě ě ěí ě°¨ě´ę° ěěë¤(p=0.00). ë ęľ° 모ëěě ë¨ěě ëšě¨ě´ ëěěźëŠ°(76.2%, 82.8%), ę°ë§ě´ěě íę˛ ë ě ěěŚě ěěśę°ë§, ę°ë§íźí, ěíŹę°ë§ëłěŚ, ę°ë§ě´ěěŚ ëąěźëĄ 매ë´ěźęľ°ěěë ěíŹę°ë§ëłěŚ, í¨í ě´ë ě´ě ęľ°ěěë ę°ë§íźíě´ ę°ěĽ ëě ëšě¨ě ě°¨ě§íęł ěěë¤. ěě ě 츥ě í ěľëęľě ěë Ľě 매ë´ěźęľ°ěěë logMAR 1.86 Âą 0.74, í¨í ě´ë ě´ě ęľ°ěěë logMAR 1.48 Âą 0.67ëĄ ë ęľ° ę°ě ě ěí ě°¨ě´ë ěěë¤(p=0.057). 매ë´ěźęľ°ěěë 기ěŚę°ë§ě íŹę¸°ë 8.51 Âą 0.19 mmëĄ ěěŠę°ë§ëł´ë¤ 0.27 Âą 0.06 mm íŹę˛ íěěźëŠ° í¨í ě´ë ě´ě ęľ°ěěë 기ěŚę°ë§ě íŹę¸°ë 8.60 Âą 0.19 mmëĄ ěěŠę°ë§ëł´ë¤ 0.24 Âą 0.06 mm íŹę˛ íěë¤. 기ěŚę°ë§ě íŹę¸°ě 기ěŚę°ë§-ěěŠę°ë§ íŹę¸° ě°¨ě´ë ë ęľ°ěě ě ěí ě°¨ě´ë ěěë¤(p=0.105, p=0.057). ëí ę¸°ěŚ ę°ë§ë´íźě¸íŹěë 매ë´ěźęľ°ěěë 2,843.8 Âą 219.6 cells/mm2, í¨í ě´ë ě´ě ęľ°ěěë 2,796.8 Âą 247.2 cells/mm2ëĄ ë ęľ° ę°ě ě ěí ě°¨ë ěěë¤(p=0.640). ěě í 경곟 ę´ě°°íë ëě ě ěëś ěŹě§ě ě´ŹěíěěźëŠ° ěě í 1ę°ě째 í¨í ě´ë ě´ě ęľ°ęłź 매ë´ěźęľ° ě ěëś ě겏ěě 기ěŚę°ë§, ěěŠę°ë§ ę°ě ě íŠě´ ě ě ě§ëęł ę˛˝ëŻ¸í ę°ë§ëśě˘
ěę˛Źě´ ę´ě°°ëěë¤(Fig. 3).
ë ęľ°ěě ěě í ěľëęľě ěë Ľě ëłí뼟 ě í 1ę°ě, 3ę°ě, 6ę°ě, 12ę°ě, 18ę°ěëĄ ëëě´ ě´í´ëł´ěë¤. í¨í ě´ë ě´ě ęľ°ě ěě í ěľëęľě ěë Ľě logMAR 0.82 Âą 0.51, logMAR 0.71 Âą 0.44, logMAR 0.78 Âą 0.75, logMAR 0.49 Âą 0.29, logMAR 0.56 Âą 0.39, 매ë´ěźęľ°ě logMAR 1.21 Âą 0.59, logMAR 1.28 Âą 1.03, logMAR 1.25 Âą 0.64, logMAR 1.14 Âą 0.62, logMAR 1.43 Âą 1.10ěźëĄ 모ë 기ę°ěě ě§ěě ěźëĄ í¨í ě´ë ě´ě ęľ°ě´ ë§¤ë´ěźęľ°ě ëší´ ëě ěë Ľě ě ě§íěë¤(모ë pę° <0.5, Mann-Whitney U test)(Fig. 4).
ë ęľ°ěě ěě í ěëęľ´ě ę˛ěŹëĄ 츥ě í ęľ´ě ëě, ę°ë§ëě ëłí뼟 ě í 1ę°ě, 3ę°ě, 6ę°ě, 12ę°ě, 18ę°ěëĄ ëëě´ ě´í´ëł´ěë¤. í¨í ě´ë ě´ě ęľ°ě ęľ´ě ëěë 6.09 Âą 2.79 diopters (D), 6.33 Âą 1.99 D, 5.14 Âą 2.69 D, 5.23 Âą 2.58 D, 4.89 Âą 2.92 D, 매ë´ěźęľ°ě ęľ´ě ëěë 5.13 Âą 2.55 D, 6.35 Âą 2.59 D, 5.28 Âą 2.51 D, 5.18 Âą 2.70 D, 6.36 Âą 3.26 DëĄ ěě í 1ę°ě, 3ę°ě, 6ę°ě, 12ę°ě째 경곟 ę´ě°°íë ëě ě ěí ě°¨ě´ë ëł´ě´ě§ ěěěźë ěě í 18ę°ě째ěë ęľ´ě ëě ëěę° í¨í ě´ë ě´ě ęľ°ěě ě ěíę˛ ëŽěë¤(p=0.057, p=0.098, p=0.307, p=0.066, p=0.00, Mann-Whitney U test). í¨í ě´ë ě´ě ęľ°ě ę°ë§ëěë 6.17 Âą 2.67 D, 6.24 Âą 2.21 D, 5.72 Âą 2.66 D, 5.02 Âą 2.71 D, 4.83 Âą 3.03 D, 매ë´ěźęľ°ě ę°ë§ëěë 5.40 Âą 2.11 D, 6.45 Âą 2.32 D, 6.30 Âą 3.02 D, 5.64 Âą 2.72 D, 5.78 Âą 3.36 DëĄ ěě í 1ę°ě째 매ë´ěźęľ°ě´ í¨í ě´ë ě´ě ęľ°ě ëší´ ę°ë§ëěę° ě ěíę˛ ëŽěěźë ě´í í¨í ě´ë ě´ě ęľ°ě ę°ë§ëěę° ë§¤ë´ěźęľ°ě ëší´ ë ëŽěěźëŠ° ěě í 12ę°ě, 18ę°ě째 ëěëěë íľęłě ěźëĄ ě ěí ě°¨ě´ëĽź ëł´ěë¤(p=0.008, p=0.086, p=0.123, p=0.006, p=0.000, Mann-Whitney U test)(Fig. 5).
ë ęľ°ěě ěě í ę°ë§ë´íźě¸íŹ ëłí뼟 ě í 1ę°ě, 3ę°ě, 6ę°ě, 12ę°ě, 18ę°ěëĄ ëëě´ ě´í´ëł´ěë¤. í¨í ě´ë ě´ě ęľ°ě ę°ë§ë´íźě¸íŹěë 2,154.17 Âą 752.33 cells/mm2, 1,989.41 Âą 729.52 cells/mm2, 2,376.00 Âą 672.18 cells/mm2, 2,083.24 Âą 560.74 cells/mm2, 2,108.03 Âą 728.85 cells/mm2, 매ë´ěźęľ°ě ę°ë§ë´íźě¸íŹěë 2,191.24 Âą 394.34 cells/mm2, 1,833.14 Âą 748.61 cells/mm2, 2,276.14 Âą 534.67 cells/mm2, 1,712.19 Âą 763.10 cells/mm2, 1,984.14 Âą 766.24 cells/mm2ëĄ ěě í 3ę°ě째ëśí° í¨í ě´ë ě´ě ęľ°ěě ëę˛ ě¸Ąě ëěěźë íľęłě ěźëĄ ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤(p=0.602, p=0.569, p=0.560, p=0.118, p=0.573, Mann-Whitney U test) (Fig. 6).
ěě í ę° ęľ°ěě ë°ěí íŠëłěŚěźëĄ ęą°ëś ë°ě, ě´ěě¤í¨ë 매ë´ěźęľ°ěěë 6ě(28.6%), 5ě(23.8%), í¨í ě´ë ě´ě ęľ°ěě 7ě(24%), 2ě(6.9%)ěźëĄ ěě í ë°ěí íŠëłěŚ ě¤ ę°ěĽ ëě ëšě¨ě ě°¨ě§íěë¤. ꡸ëŹë ë ęľ°ěě ęą°ëś ë°ě ë° ě´ě ě¤í¨ë íľęłě ěźëĄ ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤(p=0.937, p=0.237). ꡸ ě¸ ë§¤ë´ěźęľ°ěě ë
šë´ěĽ 4ě(19%), ę°ěźěą ę°ë§ěźě´ 2ě(9.5%), í¨í ě´ë ě´ě ęľ°ěěë ë
šë´ěĽ 2ě(6.9%), ę°ěźěą ę°ë§ěźě´ 1ě(3.4%) ë°ěíěë¤.
ě 츾ę°ë§ě´ěě ě°˝ěëśë´íŠ ëśěę° ě˝í´ ë¨ë¨í ë´íŠěŹě ě§ę° íěíęł ë¤ëĽ¸ ę°ë§ě´ěě ě ëší´ ë´íŠ ëśě ěšě ę° ë ě¤ë ěę° ěěëë¤. ë´íŠěŹëĄ ě¸í ëěë ěě í ěë Ľíëłľě í° ęą¸ëŚźëëĄ ěěŠíë¤[10]. ě´ëĽź í´ę˛°í기 ěí ë°Šë˛ěźëĄ í¨í ě´ë ě´ě 뼟 ě´ěŠí ę°ë§ě´ěě´ ěëëěęł ë§ě ě°ęľŹë¤ě í¨í ě´ë ě´ě ě 매ë´ěź í¸ë íě¸ě ě´ěŠí ě 츾ę°ë§ě´ěě ëšęľíěŹ ę˛°ęłźëĽź ëł´ęł íěë¤[11-15]. í¨í ě´ë ě´ě 뼟 ě´ěŠíę˛ ë늴 ěě§ ëŞ¨ě ě¸ ë˛ěŻ 모ě, ě¤ě 모ě 모ě, ěŹě 모ě ëą ë¤ěí ě°˝ě 모ěě ę°ë§ě ë§ë¤ ě ěë¤. ë˛ěŻ 모ěě ę˛˝ě° ę¸°ěŚę°ë§ě ęą´ę°í ę¸°ě§ ě 츾ě ë ë§ě´ ěěŹ, ěěŠę°ë§ě ë´íźę° ë¨ěěě´ ę°ë§ë´íŠ í ě°˝ěëś ěě ěą, ëěě ë°ěě ě ę˛ ě ë°í늰[16] ě´ě¸ěë ë¤ěí ę°ë§ ě°˝ě 모ěěźëĄ ě ě´ëŠ´ě ëë ¤ ě°˝ěëśě ěě ěą, ë´íŠěŹě 쥰기 ě ęą°, ě´ëĄ ě¸í ëě뼟 ě ę˛ ě ë°íęł ëš ëĽ¸ ěë Ľíëłľě 기ěŹí ę˛ě´ëźë ě°ęľŹ ę˛°ęłźę° ěěë¤[17-19]. 본 ě°ęľŹěěë ěěśę°ë§, ę°ë§íźí, ě벨댏ë
¸ ę°ë§ě´ěěŚ ěěě ëšęľě ë´íźě¸íŹę° ęą´ę°í 3ěěěë ë˛ěŻ 모ě, ěěśę°ë§ě, ę°ë§íźíě´ ëšęľě ę°ë§ ě¤ěŹëśě ěěźëŠ° ë´íźě¸íŹę° ě˘ě§ 몝í 6ěěěë ěŹě 모ě, ꡸ ě¸ 20ěěěë ěě§ëިěěźëĄ ě ę°ëĽź ěííěë¤.
ë ęľ° 모ë ěě ě ě ëší´ ěě í ě ěíę˛ ěë Ľě´ í¸ě ëěěźëŠ° ěě í 12ę°ěęšě§ ěě í 1ę°ěě 츥ě í ěë Ľě ëší´ ě ě í¸ě ëë ěěě ëł´ěë¤. ëí 경곟 ę´ě°°í 모ë ę¸°ę° ë´ě í¨í ě´ë ě´ě ęľ°ě ěľëęľě ěë Ľě´ ë§¤ë´ěźęľ°ě ëší´ ě ěíę˛ ě°ěí 결곟뼟 ëł´ěŹěŁźěë¤. ěëęľ´ě ęłëĄ 츥ě í ęľ´ě ëěě ę˛˝ě° ěě í 12ę°ěęšě§ ë ęľ°ěě ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěěźë ěě í 18ę°ě째 í¨í ě´ë ě´ě ęľ°ě ęľ´ě ëěę° ě ěíę˛ ëŽěë¤. ęľ° ë´ě ěě í 1ę°ěęłź 18ę°ě ëě ęľ´ě ëě뼟 ëšęľí´ ëł´ěě ë 매ë´ěźęľ°ě ę˛˝ě° ě ěí ě°¨ě´ë ěěěźë(p=0.073), í¨í ě´ë ě´ě ęľ°ě ę˛˝ě° ěě í 1ę°ě째 6.09 Âą 2.79 Děě 18ę°ě째 4.89 Âą 2.92 DëĄ ě ěíę˛ ę°ěí ě겏ě ëł´ěë¤(p=0.035). ę°ë§ëěě ę˛˝ě° ěě í 3ę°ě ě´íëśí°ë 매ë´ěźęľ°ě ëší´ í¨í ě´ë ě´ě ęľ° ę°ë§ëě ëěę° ëŽěěźëŠ° ěě í 12ę°ě, 18ę°ě째ěë ě ěí ě°¨ě´ëĽź ëł´ěë¤. ë ęľ° 모ë ěě í 3ę°ě째ëśí° 경곟 ę´ě°°íë ëě ëěę° ě ě í¸ě ëë ěěě ëł´ěęł ęľ° ë´ě ěě í 1ę°ěęłź 18ę°ě ëě ę°ë§ëě뼟 ëšęľí´ ëł´ěě ë 매ë´ěźęľ°ě ę˛˝ě° ě ěí ě°¨ě´ë ěěěźë(p=0.498), í¨í ě´ë ě´ě ęľ°ě ę˛˝ě° ěě í 1ę°ě째 6.17 Âą 2.67 Děě 18ę°ě째 4.83 Âą 3.03 DëĄ ě ěíę˛ ę°ěí ě겏ě ëł´ěë¤(p=0.017). 본 ě°ęľŹ 결곟뼟 í ëëĄ í¨í ě´ë ě´ě ęľ°ě ę˛˝ě° ěę°ě´ ě§ë ěëĄ ęľ´ě ëě, ę°ë§ëě뼟 ě ę˛ ě ë°íęł ěě í 12ę°ě ě´íëśí°ë 매ë´ěźęľ°ě ëší´ ě ěí ëě ëě ě°¨ě´ëĽź ëł´ěŹ ë§¤ë´ěźęľ°ě ëší´ ěë Ľě´ ě˘ěźëŠ° ëš ëĽ¸ ěë Ľíëłľě ëł´ěë¤ęł í ě ěë¤. ꡸ëŹë ëě ě¸ěë í¨í ě´ë ě´ě ęľ°ě´ ëěěě ě°ë šě´ ě ęł ěě ěíę° ě˘ě ěěś ę°ë§ ě§ë¨ě´ ë§ě ę˛ë ëš ëĽ¸ ěë Ľíëłľě ëł´ě¸ ě´ě ě¤ íëěź ę˛ě´ëŠ° ë ęľ°ě ě§ë¨ě´ ëšěˇíě§ ěě ě íí ëšęľëĽź íě§ ëŞťí ę˛ě´ 본 ě°ęľŹě ě íě ěź ę˛ě´ë¤.
매ë´ěźęľ°ęłź í¨í ě´ë ě´ě ęľ° 모ë 10-0 ëěźëĄ ë´íŠěŹëĽź ě´ěŠí 16ę° ë¨ě ë´íŠě ěííěë¤. í¨í ě´ë ě´ě ęľ°ě ę˛˝ě° ěě ě ě¸ë ęľ´ě ě¤ěě ěěŠę°ë§, 기ěŚę°ë§ě í¨í ě´ë ě´ě 뼟 ě´ěŠíěŹ ë´íŠí ëśěě íěíęł íěí ëśëśëźëŚŹ ë´íŠě ěííěë¤. ě´ëĄě ě íŠ ëśěę° ěě ě ě´ęł ě íí ëśě°Šě íëëĄ íěë¤. ěě í 6ę°ě íëśí° ě íě ěźëĄ ë´íŠěŹ ěźëśëĽź ě ęą°íěěźëŠ° ěě í 18ę°ěę° ę˛˝ęłź ę´ě°°í늴ě ë´íŠěŹëĽź 모ë ě ęą°í 경ě°ë ěěë¤. ěě í 18ę°ě ë 매ë´ěźęľ°ě 14.33 Âą 2.95ę°ě ë´íŠěŹę° ë¨ěęł í¨í ě´ë ě´ě ęľ°ěěë 10.76 Âą 3.83ę°ě ë´íŠěŹę° ë¨ěë¤. ë ęľ° 모ëěě 기ěŚę°ë§ęłź ěěŠę°ë§ě ě íŠ ě ě§ëĽź ěí´ ę˛˝ęłź ę´ě°°íë ëě ě´ë ě ëě ë´íŠěŹë ě§ěě ěźëĄ íěíěěźë ě ě§ě íěí ë´íŠěŹě ěë í¨í ě´ë ě´ě ęľ°ěě 매ë´ěźęľ°ëł´ë¤ ě ěë¤. ě´ë í¨í ě´ë ě´ě 뼟 ě´ěŠíę˛ ëě´ ę°ë§ë´íŠ í ě°˝ěëś ěě ěąě´ 매ë´ěźęľ°ëł´ë¤ ě˘ě ë´íŠěŹëĽź 매ë´ěźęľ°ě ëší´ 쥰기ě ě ęą°í ě ěěë ę˛ěźëĄ ěę°ëë¤. ꡸ëŹë 매ë´ěźęľ°ęłź í¨í ě´ë ě´ě ęľ° 모ëěě ë´íŠěŹëĽź 모ë ě ęą°í íě ëě뼟 ëšęľíě§ ëŞťíë¤. ëí ë ęľ°ěě ę°ę° 매ë´ěź í¸ë íě¸ęłź í¨í ě´ë ě´ě ěí í ě꾏 íí뼟 ě ě§í기 ěí´ ë¨ę˛¨ë ę°ë§ 쥰ě§ě ěśę°ëĄ ěě ë꾏뼟 ě´ěŠíěŹ ě ě í ę˛ě´ ěě í ëě 결곟ě ěźë§íź ěíĽě ëźěš ě§ě ëí´ěë ě°ęľŹíě§ ëŞťíěěźëŠ° ě´ę˛ë¤ě ě´ ë
źëŹ¸ě ě íě ě´ëŠ° ěěźëĄ ě´ě ëí ëśě ë° ë°ëłľě ě¸ ě°ęľŹę° íěí ę˛ě´ë¤. í¨í ě´ë ě´ě ě ę˛˝ě° ę°ë§ëśě˘
ëą ë§¤ě§ě´ íźííěŹë ë ě´ě ę° íŹęłźí ě ěě´ ę°ë§ě´ěě ě ěěŚě´ ëë íěë¤ěę˛ ë댏 ě´ěŠë ě ěě ęą°ëź ěę°ě´ ëë¤. ꡸ëŹë 본ěěěë ę°ë§ëśě˘
ě´ ěŹí 경ě°ë 매ë´ěź í¸ë íě¸ě ěŁźëĄ ě´ěŠíěë¤. ę°ë§ëśě˘
ě´ ěë íěë¤ěę˛ í¨í ě´ë ě´ě 뼟 ěííęł ë¨ę˛¨ë ę°ë§ 쥰ě§ě ěśę°ëĄ ě ě 뼟 ěííěŹ ę°ë§ě ę°ëĽź ěíë 모ěěźëĄ ěěąíëë° ě´ë ¤ěě´ ěëě§, ę°ë§ëśě˘
ě´ ěŹí íěë¤ě ę˛˝ě° ë§¤ë´ěźęłź í¨í ě´ë ě´ě 뼟 ě´ěŠí 결곟 ě°¨ě´ę° ěëě§ě ëí ěśę° ě°ęľŹë íěí ę˛ě´ë¤.
í¨í ě´ë ě´ě 뼟 ě´ěŠí ę˛˝ě° ę°í´ě§ ěëě§ ëë ꡸ě ë°ëĽ¸ 윊겊íëĄ ě¸í ę°ë§ë´íź ě¸íŹě ěěě ë°°ě í ě ěë¤. ě´ë í¨í ě´ë ě´ě 뼟 ě´ěŠí ěě ě ęł ë ¤í´ěź í ěŹíěźëĄ 본 ě°ęľŹ 결곟 매ë´ěźęľ°ęłź í¨í ě´ë ě´ě ęľ°ěě ěě í ę°ë§ë´íźě¸íŹěě íľęłě ěźëĄ ě ěí ě°¨ě´ë ěěë¤. ě´ëĽź íľí´ í¨í ě´ë ě´ě ëĄ ě¸í ě ěí ę°ë§ë´íźě¸íŹě ěě¤ě ěěë ę˛ěźëĄ ěę°ëë¤.
매ë´ěźęľ°ęłź í¨í ě´ë ě´ě ęľ°ěě ęą°ëś ë°ě, ě´ě ě¤í¨ë ě ěí ě°¨ě´ë ëł´ě´ě§ ěěë¤. ěąëł, ëě´, ěě ě ěęłźě ěě ë Ľ ëą ëłěë¤ě´ ęą°ëś ë°ě, ě´ě ě¤í¨ě ěíěąě ëě´ě§ ěěěźëŠ° ëí í¨í ě´ë ě´ě ęľ°ě ěě ěíę° ě˘ě ěěśę°ë§ ě§ë¨ě´ ë§ěěěë ë ęľ°ěě ęą°ëś ë°ě, ě´ě ě¤í¨ë ě ěí ě°¨ě´ëĽź ëł´ě´ě§ ěěë¤.
매ë´ěź í¸ë íě¸ ě ěíě ě 기뼟 ě´ěŠíěŹ ě ě í ë ě¤ěŹěśě ě ëëĄ ë§ěśě§ 몝í ę˛˝ě° ěíě´ ěë íěí ě ě ę° ë ě ěęł , ę°ë§ ě¤ěŹěě ěšě°ěłě§ęą°ë íë 돸ě ę° ë°ěí ě ěë¤[20]. í¨í ě´ë ě´ě ě ę˛˝ě° ěěŠę°ë§ě í¨í ě´ë ě´ě 뼟 ě´ěŠíěŹ ë¨źě ëěě í í ě ě 늴ě ë§ë¤ ě ěě´ ě¤ěŹěśě ë˛ě´ëęą°ë ě¤ěŹěśě ě ëëĄ ë§ěśě§ 몝íë 돸ě ë ě ě ę˛ě´ë¤. ꡸ëŹë ěëĄě´ 기ě ě ě ěŠí ë ëšěŠ-í¨ęłź 돸ě , ěě ěą ëąě ęł ë ¤í´ěź í늰 í¨í ě´ë ě´ě 뼟 ě¸ë ěě ě¤ěě ěííęł ěě ë°Šěě ě´ě´ě ě 츾ę°ë§ě´ěě í기ęšě§ě ěę° ę°ę˛Šě ěľěëĄ ě§íí´ěź í늰 ë ě´ě ęłźě ěźëĄ ěśę°ě ě¸ ěě ěę°ě´ ë ë¤ë ëśě ě ě¸ ě¸ĄëŠ´ë ěě ę˛ě´ë¤.
ę˛°ëĄ ě ěźëĄ, 본 ě°ęľŹěě í¨í ě´ë ě´ě ęľ°ě´ ë§¤ë´ěźęľ°ě ëší´ ěĽę¸°ę° 경곟 ę´ě°°í ëě ěě í ěë Ľě´ ě˘ęł íëłľęłźě ě´ ëš ëĽ´ęł ę°ë§ëě, ęľ´ě ëěë ěę°ě´ ě§ë¨ě ë°ëź ě ěí í¸ě ě겏ě ëł´ěěźëŠ° ěě í 12ę°ě ě´íëśí°ë 매ë´ěźęľ°ě ëší´ ě ěí ě°¨ě´ëĽź ëł´ěë¤. 본 ě°ęľŹë ěľęˇźęšě§ě ëł´ęł ě¤ ě 츾ę°ë§ě´ě í ě´ę¸° ěěěąě ě´ ěë ěĽę¸°ę° ěě결곟뼟 ëšęľíěë¤ëë° ěěę° ěěźëŠ° í¨í ě´ë ě´ ě 뼟 ě´ěŠí ě 츾ę°ë§ě´ěě´ ęł ëšěŠ, ěě ěę° ě§ě°ě´ëźë ë¨ě ěë ěë Ľíëłľě´ ě˘ęł ęľ´ě ëěě ę°ë§ëěę° ě ěźëŠ°, ě°˝ěëśě ěě ěąě´ ë ě˘ě ěĽě ě´ ěěźëŻëĄ ě 츾ę°ë§ě´ě ěě ęł ë ¤í ě ěë íëě ë°Šë˛ě´ëź ěŹëŁëë¤.
Figure 1.
Customized trephination patterns with femtosecond laser-enabled keratoplasty. (A) Vertical, (B) mushroom, (C) oblique.
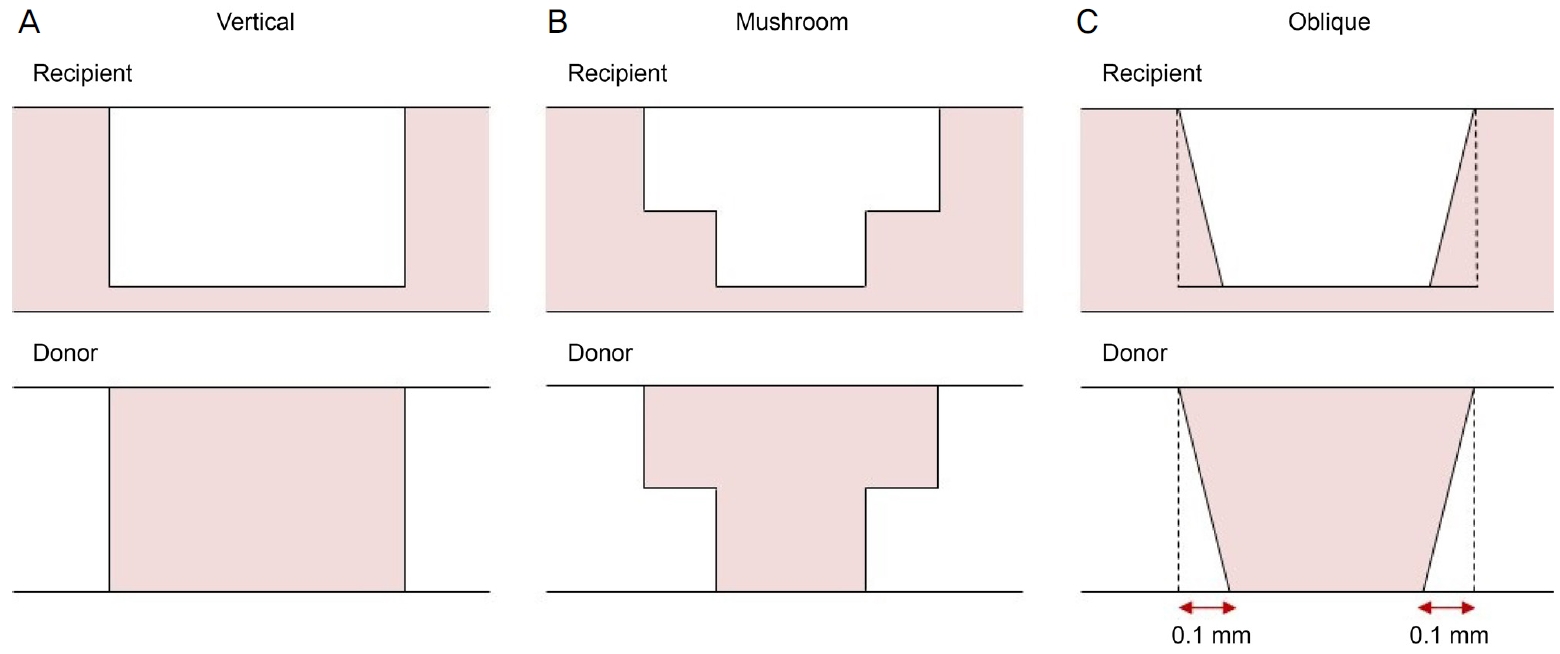
Figure 2.
Preparation of donor cornea and recipient cornea using femtosecond laser. (A) Donor preparation. The donor tissue is placed on an artificial anterior chamber and incised using a femtosecond laser with vertical edge profile. (B) Recipient preparation. The recipient tissue is incised using a femtosecond laser, and the base 150 Îźm is left to prevent corneal perforation. Donor and recipient tissue is marked with a femtosecond laser at the site of suture.
Figure 3.
At 1 month after surgery, anterior segment photographs show an excellent graft-host interface and mild edematous cornea (A: intralase-enabled keratoplasty [IEK]-mushroom cut, B: IEK-vertcial cut, C: IEK-oblique cut, D: conventional penetrating keratoplasty).
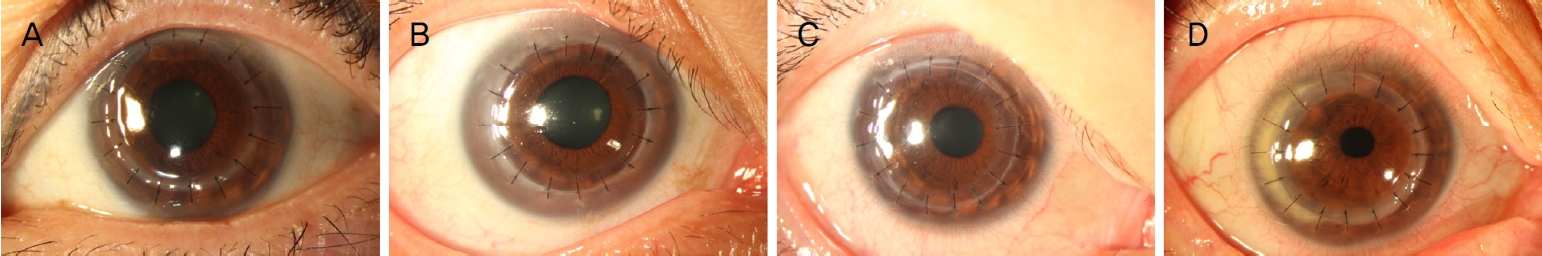
Figure 4.
Postoperative changes of logarithm of minimal angle of resolution (logMAR) mean best corrected visual acuity (BCVA) after manual trephine penetrating keratoplasty versus femtosecond laser trephine penetrating keratoplasty. Femtosecond laser trephine group showed better results in BCVA (logMAR) at postoperative 1, 3, 6, 12 and 18 months respectively (p = 0.020, p = 0.010, p = 0.003, p = 0.000, p = 0.004; Mann-Whitney U test). *p < 0.05.
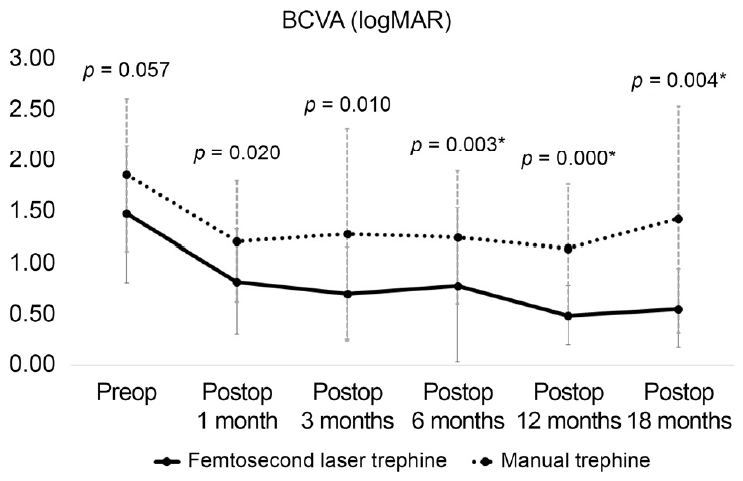
Figure 5.
The cylinder measured using autorefractor in both groups of manual trephine and femtosecond laser trephine at 1, 3, 6, 12 and 18 months postoperatively. (A) The refractive cylinder showed lower value in femtosecond laser trephine at 18 months, and the difference was statistically significant. (B) The keratometric cylinder showed lower value in femtosecond laser trephine at 3, 6, 12 and 18 months, and the difference was statistically significant at 12 and 18 months. p-values were calculated by Mann-Whitney U test. *p < 0.05.
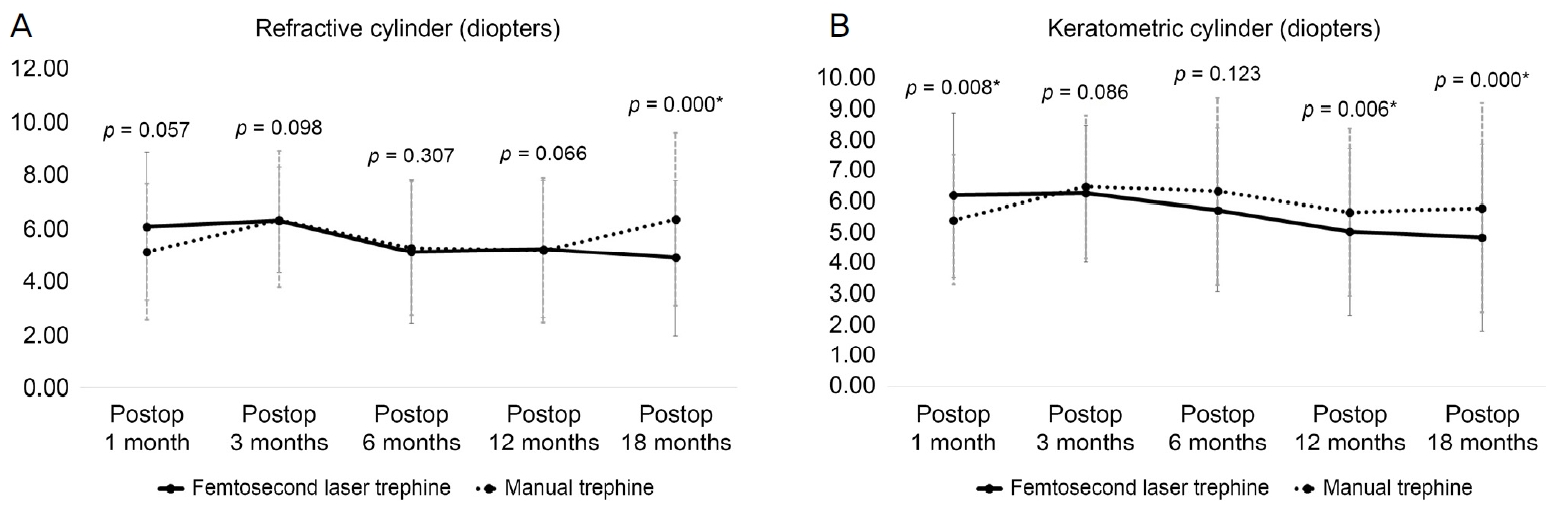
Figure 6.
The endothelial cell count measured using specular microscopy in both groups of manual trephine and femtosecond laser trephine at 1, 3, 6, 12 and 18 months postoperatively. The endothelial cell count showed higher value in femtosecond laser trephine from 3 months after surgery, but showed no statistically significant difference. p-values were calculated by Mann-Whitney U test.
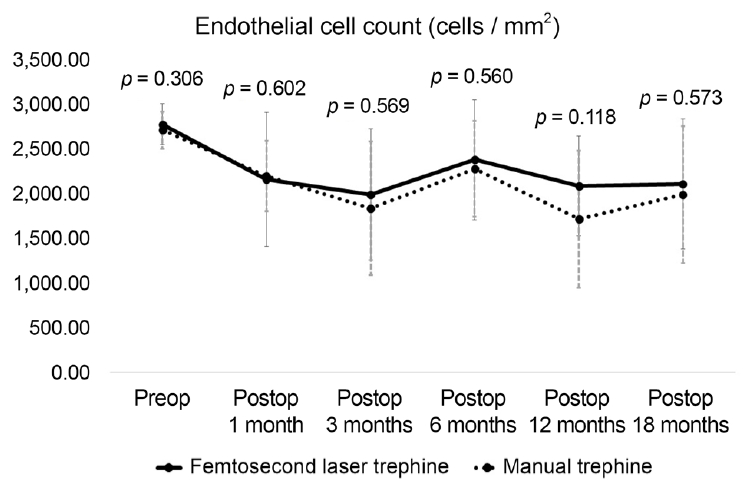
Table 1.
Demographic characteristics of the surgical patients
REFERENCES
1) Hsiao FC, Chen PY, Meir YJ, et al. Clinical outcomes of penetrating keratoplasty and Descemet stripping automated endothelial keratoplasty in Asian population with American corneas. Int J Environ Res Public Health 2019;16:4547.



2) Hoppenreijs VP, Van Rij G, Beekhuis WH, et al. Causes of high astigmatism after penetrating keratoplasty. Doc Ophthalmol 1993;85:21-34.


3) Meltendorf C, Schroeter J, Bug R, et al. Corneal trephination with the femtosecond laser. Cornea 2006;25:1090-2.


4) Wade M, Muniz Castro H, Garg S, et al. Long-term results of femtosecond laser-enabled keratoplasty with zig-zag trephination. Cornea 2019;38:42-9.


5) Vickers LA, Gupta PK. Femtosecond laser-assisted keratotomy. Curr Opin Ophthalmol 2016;27:277-84.


6) Daniel MC, BĂśhringer D, Maier P, et al. Comparison of long-term outcomes of femtosecond laser-assisted keratoplasty with conventional keratoplasty. Cornea 2016;35:293-8.


8) Jung KI, Choi JA, Na KS, et al. Comparison of outcomes of femtosecond laser-assisted keratoplasty and conventional penetrating keratoplasty. J Korean Ophthalmol Soc 2010;51:1054-63.

9) Sohn BJ, Kim HK. Early results of femtosecond laser-assisted mushroom-shaped wound-configurized keratoplasty. J Korean Ophthalmol Soc 2009;50:34-43.

10) Asota I, Farid M, Garg S, Steinert RF. Femtosecond laser-enabled keratoplasty. Int Ophthalmol Clin 2013;53:103-14.

11) Tan JC, Heng WJ. One-year follow-up of femtosecond laser-assisted penetrating keratoplasty. Clin Ophthalmol 2013;7:403-9.



12) Gaster RN, Dumitrascu O, Rabinowitz YS. Penetrating keratoplasty using femtosecond laser-enabled keratoplasty with zig-zag incisions versus a mechanical trephine in patients with keratoconus. Br J Ophthalmol 2012;96:1195-9.



13) Hoffart L, Proust H, Matonti F, et al. Short-term results of penetrating keratoplasty performed with the Femtec femtosecond laser. Am J Ophthalmol 2008;146:50-5.


14) Por YM, Cheng JY, Parthasarathy A, et al. Outcomes of femtosecond laser-assisted penetrating keratoplasty. Am J Ophthalmol 2008;145:772-4.


15) Angunawela RI, Riau A, Chaurasia SS, et al. Manual suction versus femtosecond laser trephination for penetrating keratoplasty: intraocular pressure, endothelial cell damage, incision geometry, and wound healing responses. Invest Ophthalmol Vis Sci 2012;53:2571-9.


16) Levinger E, Trivizki O, Levinger S, Kremer I. Outcome of "mushroom" pattern femtosecond laser-assisted keratoplasty versus conventional penetrating keratoplasty in patients with keratoconus. Cornea 2014;33:481-5.


17) Kamiya K, Takahashi M, Igarashi A, Shoji N. Visual performance in eyes undergoing femtosecond laser-assisted keratoplasty for advanced keratoconus. Sci Rep 2019;9:6442.



18) Shivanna Y, Nagaraja H, Kugar T, Shetty R. Femtosecond laser enabled keratoplasty for advanced keratoconus. Indian J Ophthalmol 2013;61:469-72.



-
METRICS

-
- 1 Crossref
- 0 Scopus
- 2,485 View
- 57 Download
- Related articles




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



