 |
 |
| J Korean Ophthalmol Soc > Volume 62(4); 2021 > Article |
|
국문초록
목적
국내 시신경염(optic neuritis, ON) 환자 중 수초희소돌기아교세포(myelin oligodendrocyte glycoprotein, MOG) 항체 연관 시신경염 환자(MOG-ON)와 시신경척수염(neuromyelitis optica, NMO) 항체 연관 시신경염 환자(NMO-ON)의 임상결과를 비교하고자 한다.
대상과 방법
2018년 1월부터 2020년 6월까지 삼성서울병원에 내원한 시신경염 환자 중 혈청검사상 MOG-면역글로불린(immunoglobulin, Ig) G 양성 또는 NMO-IgG 양성인 환자들의 의무기록을 후향적으로 분석하여 임상양상 및 결과를 비교하였다.
결과
대상 환자는 MOG-IgG 양성 환자 10명, 14안, NMO-IgG 양성 환자 25명, 38안이었다. 최종시력은 MOG-ON군이 NMO-ON군보다 유의하게 좋았으며(p=0.002), 광각무인 환자의 비율이 NMO-ON군에서(11%), MOG-ON군(0%)에 비해 높았다. 시야검사 평균 편차 값은 NMO-ON군에서 평균 -18.98 ± 12.36 dB로 MOG-ON군의 평균 -10.17 ± 10.03 dB보다 유의하게 낮았다(p=0.018). 재발률은 MOG-ON군(79%)이 NMO-ON군(42%)보다 유의하게 높았다(p=0.020).
ABSTRACT
Purpose
To compare clinical outcomes of Korean patients with seropositive myelin oligodendrocyte glycoprotein antibody (MOG-IgG)-related optic neuritis (ON) and those with neuromyelitis optica antibody (NMO-IgG)-related ON.
Methods
Medical records were analyzed retrospectively among patients diagnosed with ON from January 2018 to June 2020, who were positive for MOG-IgG or NMO-IgG on serological tests. Clinical manifestations and outcomes were collected and compared between the two groups.
Results
The study included 14 eyes of 10 MOG-IgG positive patients, and 38 eyes of 25 NMO-IgG positive patients. Final visual acuity differed significantly between the two groups (p = 0.002), and the proportion of patients with no light perception was higher in the NMO-ON group (11%) compared with the MOG-ON group (0%). The mean deviation value on visual field tests also showed a significant difference between NMO-ON and MOG-ON groups (-18.98 ± 12.36 dB versus -10.17 ± 10.03 dB, respectively; p = 0.018). The recurrence rate was 42% in the NMO-ON group and 79% in the MOG-ON group (p = 0.020).
시신경염은 시신경의 염증으로 인해 급성 시력저하, 시야장애, 색각 이상, 안구운동시 통증 등의 증상을 보이는 질환이다. 시신경염은 종종 염증성 탈수초질환과 동반되며, 이 중 다발경화증과의 관련성이 널리 잘 알려져 있다[1-4]. 이와 별개로 비전형적인 염증성 탈수초질환으로서 neuromyelitis optica (NMO)-immunoglobulin (Ig) G와 연관된 시신경척수염범주질환(neuromyelitis optica spectrum disorder; NMOSD) 및 myelin oligodendrocyte glycoprotein (MOG)-IgG 연관 질환 등이 밝혀져 있다[1]. MOG-IgG는 비교적 최근 들어 밝혀진 항체로, 이전에는 다발경화증과 관련된 것으로 분류되다가 최근에 재분류되었으며, NMO-IgG 양성 시신경염과 다발경화증 시신경염과도 다른 특징을 보인다고 알려져 있다[5]. MOG-IgG 양성 시신경염은 현재까지 증례가 많지 않으나 NMO-IgG 양성 시신경염보다 양안 침범이 많고 재발이 많은 것으로 알려져 있고, 시력예후는 더 좋은 것으로 밝혀져 있다[6]. 이 논문에서는 MOG-ON 양성 시신경염 환자들을 NMO-IgG 양성 시신경염 환자들과 비교하여 그 차이를 보고하고자 한다.
2018년 1월부터 2020년 6월까지 삼성서울병원 신경안과에 내원한 시신경염 환자들 중 혈청검사상 NMO-IgG 양성 또는 MOG-IgG 양성인 환자들을 대상으로 후향적으로 연구를 진행하였다. 이 연구는 본원 의학연구윤리심의위원회의 승인 하에 진행되었다(승인 번호: 2020-07-111-001). 시신경염의 진단은 수일에 걸친 점진적인 시력저하, 시야장애, 색각저하, 단안 침범의 경우 상대구심동공운동장애를 토대로 하였으며, 안와자기공명영상검사에서 시신경병증을 유발할 만한 다른 압박성 병변이 보이지 않는 경우에 한정하였다. 안구운동시 통증을 동반하거나 안와자기공명영상 검사에서 시신경의 조영증강을 보이는 소견은 보조적으로 참고하였다. 진단 시 시신경에 영향을 주는 약물 사용력이 있거나, 외상성, 허혈성, 유전성 시신경염이 의심되는 임상 소견을 보이는 경우는 제외하였다. 시력과 시야에 영향을 주는 녹내장, 망막 질환 등 다른 안과적 질환을 동반하는 경우나 다른 전신적, 신경학적 질환으로 인해 시력, 시야에 제한이 생길 수 있는 경우 역시 제외하였다. 모든 시신경염 환자들에게서 혈청검사를 시행하여 NMO-IgG 양성인 경우 NMO-ON으로, MOG-IgG 양성인 경우 MOG-ON으로 분류하였다.
환자의 성별, 시신경염이 발병한 나이를 기록했으며, 임상양상으로 단안성 혹은 양안성인지, 첫 발병부터 마지막 추적 관찰까지 가장 낮았던 시력과 마지막 추적 관찰시의 최종 시력, 시신경부종 유무, 안구운동시 통증 유무를 기록하였다. 시력은 현성굴절검사를 이용한 최대교정시력을 확인하여 Snellen 시력 광각무(no light perception, NLP), 광각유(light perception, LP), 20/200, 20/40, 20/20 기준으로 분류하여 표기하였다. Humphrey Field Analyzer (Carl Zeiss Meditec, Dublin, CA, USA) 30-2 SITA-standard protocol을 이용한 시야검사 평균편차(mean deviation, MD) 및 HRR 색각검사표를 이용한 색각검사 결과를 기록하였다. 치료로 고용량 정맥내 메틸프레드니솔론(intravenous methylprednisolone) 하루 1 g씩 3일간 치료한 것을 1주기로 했을 때, 시행한 총 주기 횟수와 면역억제제 유지 치료를 하는지 여부를 기록하였다. 재발 유무와 재발 횟수를 기재하였다.
통계학적 분석은 chi-square test, Mann-Whitney U test 및 Fisher’s exact test를 사용하였다. 두 군의 성별, 양안성, 재발 여부, 시신경부종 여부, 안구운동시 통증 여부, 면역억제제 유지 여부, 시력 군의 비율 비교에는 chi-square test 혹은 Fisher’s exact test를 사용하였다. 발병 시 나이, 재발 횟수, 고용량 정맥내 메틸프레드니솔론 치료 횟수, 시야검사 평균편차, 색각검사 결과의 통계치를 비교할 때는 Mann-Whitney U test를 사용하였다. 통계적 검정은 SPSS Ver. 25.0 for Window (IBM Corp., Armonk, NY, USA)를 사용하였으며, p<0.05인 경우를 통계적으로 유의하다고 판정하였다.
대상 환자는 NMO-ON 환자가 총 25명 38안, MOG-ON 환자가 총 10명 14안이었다. 혈청검사에서 NMO-IgG와 MOG-IgG가 모두 양성을 보인 경우는 없었다. NMO-ON 환자 중 여자가 22명(88%), 남자가 3명(12%)이었으며, MOG-ON 환자는 여자가 9명(90%), 남자가 1명(10%)이었다. 두 군에서 성비의 유의한 차이는 없었다. 발병 시 나이는 NMO-ON에서 평균 40 ± 16세(범위, 9-75세), MOG-ON에서 평균 50 ± 19세(범위, 9-70세)였으며, 두 군의 유의한 차이는 없었다. 추적 관찰 기간은 NMO-ON이 평균 52 ± 38개월, MOG-ON이 평균 24 ± 45개월이었다(Table 1).
NMO-ON에서 우안 7명(28%), 좌안 5명(20%), 양안 13명(52%)이었으며, MOG-ON에서는 우안 3명(30%), 좌안 3명(30%), 양안 4명(40%)이었다. 두 군에서 양안을 침범한 환자들의 비율의 유의한 차이는 없었다. 시신경부종을 보인 경우는 NMO-ON에서 7안(18.40%), MOG-ON에서 5안(35.70%)으로 빈도에 유의한 차이가 없었으며(p=0.267), 안구운동시 통증이 있는 경우는 NMO-ON에서 통증에 대한 기록이 있는 23안 중 15안(65%), MOG-ON에서 11안 중 9안(82%)으로 유의한 차이가 없었다(p=0.437) (Table 2).
첫 발병시부터 마지막 추적 관찰까지 중 가장 낮았던 시력을 비교했을 때, NMO-ON 환자군과 MOG-ON 환자군에서 유의한 차이가 있었으며(p=0.026), 시력 광각유(LP) 이상 20/200 미만 환자가 NMO-ON에서 20안(53%), MOG-ON에서 2안(14%)으로 유의한 차이가 있었다(p=0.013). 가장 낮았던 시력이 광각무인 환자는 NMO-ON에서 4안(11%), MOG-ON에서 0안(0%)이었다(p=0.564) (Table 3, Fig. 1).
마지막 추적 관찰시의 최종 시력을 비교했을 때, NMO-ON 환자군과 MOG-ON 환자군에서 유의한 시력 차이가 있었다(p=0.002). 최종시력 광각유(LP) 이상 20/200 미만의 환자가 NMO-ON에서 14안(37%), MOG-ON에서 0안(0%)으로 NMO-ON 환자군에서 유의하게 많았으며(p=0.011), 광각무(NLP) 환자수가 NMO-ON에서 2안(5%), MOG-ON에서 0안(0%)이었다(p=1.000) (Table 4, Fig. 2).
시야검사 평균 편차(MD) 값은 NMO-ON에서 평균 -18.98 ± 12.36 dB, MOG-ON에서 평균 -10.17 ± 10.03 dB로 NMO-ON에서 유의하게 낮은 값을 보였다(p=0.018). HRR 최종 색각검사 결과는 NMO-ON에서 평균 1.79 ± 4.44, MOG-ON에서 평균 3.41 ± 3.42였다(p=0.073).
추적 관찰 기간 동안 치료로 고용량 정맥내 메틸프레드니솔론 치료를 시행한 횟수는 NMO-ON에서 평균 3.8 ± 3.89회, MOG-ON에서 평균 2.4 ± 1.43회였다. 유지치료로 경구 면역억제제를 사용하는 경우가 NMO-ON에서 21명으로 84%였으며, MOG-ON에서는 9명으로 90%였다.
재발 여부는 NMO-ON에서 재발한 경우가 평균 53 ± 38개월의 추적 관찰 기간 동안 16안(42%), MOG-ON에서 평균 24 ± 45개월의 추적 관찰 기간 동안 11안(79%)으로, MOG-ON에서 재발 비율이 유의하게 높았다(p=0.020). 재발 횟수는 NMO-ON에서 평균 0.6 ± 1.1회, MOG-ON에서 평균 2.0 ± 1.81회로 유의하게 MOG-ON에서의 재발 횟수가 더 높았으며(p=0.009), 3회 이상 재발한 경우가 NMO-ON에서 2안(5%), MOG-ON에서 4안(29%)으로 전체 중 3회 이상 재발한 비율이 MOG-ON에서 유의하게 높았다(p=0.038) (Table 2).
시신경염은 시신경의 염증성 탈수초 질환으로서, 시신경병증으로만 나타나는 경우도 있으나, 다양한 중추신경계 탈수초 질환과 연관이 있는 경우들도 있다[1,4,7]. 이들 중 다발경화증이 가장 흔하게 동반되는 서양과 달리 동양에서는 예후가 더 불량한 시신경척수염범주질환이 호발하는 편이며, 이와 연관된 항체로 AQP4-IgG 항체에 대한 검사가 임상에서 널리 활용되고 있다. 최근에는 AQP4-IgG 음성 시신경척수염 환자들에서 MOG-IgG 항체가 밝혀진 바 있다[8]. NMO-IgG는 중추신경계에서 흔한 AQP4 단백질에 대한 항체이며, 특히 혈액뇌장벽(blood-brain barrier)의 별아교세포(astrocyte)에 AQP4가 많이 분포한다[3]. MOG-IgG는 신경수초 가장 바깥과 희소돌기아교세포(oligodendrocyte)의 표면에 발현되는 중추신경계 단백질에 대한 항체로[9], 두 항체 모두 발현시 중추신경계에 손상을 일으키게 된다[2]. 이들 항체를 비롯한 다양한 항체 연관 시신경염의 기전과 특성을 규명하여 적합한 치료 방침을 정하려는 노력이 있어왔는데, 비교적 최근 들어 밝혀진 MOG-IgG 연관 시신경염에 대한 연구 역시 활발히 이루어지고 있다[2,8,10-14]. 하지만, NMO-IgG 연관 시신경염과 MOG-IgG 연관 시신경염의 임상양상 및 경과를 직접 비교하여 보고한 논문은 아직까지 드물다[11,15]. Pache et al [16]은 각각 16명의 NMO-ON 환자와 MOG-ON 환자를 대상으로 비교한 연구에서 MOG-ON에서 NMO-ON 보다 재발률이 높지만, 시력예후는 좋다고 보고한 바 있다. Zhao et al [15] 또한 MOG-ON 환자 49명, 64안, NMO-ON 환자 76명, 102안을 대상으로 한 연구에서 MOG-ON에서 NMO-ON과 비슷한 정도로 망막신경섬유층(retinal nerve fiber layer, RNFL)이 얇아지나, 시력예후는 NMO-ON보다 좋으며, 재발 횟수가 유의하게 높다고 보고하였다. 이번 연구에서는 한국인을 대상으로 NMO-IgG 연관 시신경염과 MOG-IgG 연관 시신경염의 임상양상 및 경과를 직접 비교하여 분석하였다.
저자들의 연구에서 양안성의 비율은 MOG-ON에서 40%로 이전 논문에서의 비율과 비슷했다[2,11,15,17]. 시신경부종이 MOG-ON에서 흔하게 보이는 현상이라고 하나, 이번 연구 결과에서는 35.70%로 비율이 높지 않았다. 이전 논문들에서는 43-94% 정도에서 시신경부종이 나타난다고 보고하였다[8,10,11,15,17,18]. MOG-ON에서 안구운동시 통증은 이전 논문들에서 65-100%의 정도로 흔하게 나타난다고 보고되었으며[8,11,12,15], 이번 연구 결과에서도 82%로 비슷한 결과를 보였다.
NMO-ON, MOG-ON에서 모두 여성의 비율이 각각 88%, 90%로 남성의 비율보다 높았으며, 이전 논문들에서는 남성에 대한 여성의 비율이 NMO-ON에서 82-100%, MOG-ON에서 79-94%로[8,15-18] 보고된 바 있다. 저자들의 연구 결과에서는 두 군에서 성비의 유의한 차이는 없었다. 또한 발병 연령이 NMO-ON보다 MOG-ON에서 더 낮은 것으로 알려져 있으나[2,15,17], 이번 연구 결과에서는 MOG-ON의 발병 연령이 평균 49.8세, NMO-ON에서 39.7세로 이전 결과들과 차이를 보였다. 그러나 기존 연구들에서 보고된 MOG-ON의 발병 연령은 평균 20-38.9세, 범위가 2-79세로 다양한 연령 범위를 보인다[2,11,16-18].
NMO-ON은 아프로-캐리비안(Afro-Caribbean), 동아시아인(East Asian)에서 호발한다고 알려져 있다[1,19]. MOG-ON은 Jurynczyk et al [13]의 연구에서는 인종 간의 차이가 없다는 보고가 있으나, 추가적인 다인종의 비교 연구가 필요하다.
Ishikawa et al [20]이 일본에서 531안을 대상으로 분석한 연구에서는 12%가 AQP4-IgG 양성, 10%가 MOG-IgG 양성을 보였으며, 77%가 두 항체 모두 음성이었고, 1안에서 두 항체 모두 양성을 보였다. Höftberger et al [21]이 174명을 대상으로 분석한 연구에서도 두 항체 모두에서 양성을 보인 경우가 2명 있었다. Sato et al [22]이 215명을 대상으로 분석한 연구에서는 두 항체 모두 양성을 보인 경우는 없었다. 저자들의 연구에서도 두 항체 모두 양성을 보인 환자는 없었다.
NMO-ON에서 재발한 경우가 평균 53 ± 38개월의 추적 관찰 기간 동안 16안(42%), MOG-ON에서 평균 24 ± 45개월의 추적 관찰 기간 동안 시신경염 재발 비율은 MOG-ON에서 79% (평균 24개월의 추적 관찰 기간)로, NMO-ON에서의 42% (평균 53개월의 추적 관찰 기간)보다 높았으며, 재발 횟수도 더 높았다. MOG-ON에서의 재발률은 30-89%로 비교적 다양하게 보고되어 있다[6,11,14]. 두 군의 재발 횟수 비교 결과는 이전 Pache et al [16]이 발표한 결과와 유사하다. Pache et al [16]은 평균 시신경염 재발 횟수를 MOG-ON에서 4.5회로, NMO-ON에서의 2회보다 유의하게 높았다고 보고하였다. 또 다른 연구에서 Zhao et al [15]은 평균 재발 횟수가 MOG-ON에서 2.71회로 NMO-ON에서의 1.78회보다 유의하게 높다고 보고하였다. 각 연구 간 평균 재발 횟수의 차이는 연구군의 인종, 나이, 성별, 질병의 중증도 등을 포함한 차이 때문일 것으로 생각된다. 현재까지 국내에서 NMO-ON과 MOG-ON의 환자군의 재발률을 직접 비교한 연구 논문이 발표된 바는 없다.
시력예후 및 시야결손 정도는 MOG-ON에서 NMO-ON군보다 더 좋았다. 최종시력이 광각무(NLP)가 된 환자 비율이 MOG-ON에서 0%, NMO-ON에서 5%로 NMO-ON에서 더 높았다. 이는 이전 논문 결과들과 유사한 결과를 보인다[8,14,15,17]. 또한 최종 시야검사 결과, 평균 편차가 NMO-ON에서 MOG-ON군에 비해 더 낮은 값을 보였다. 이전 연구들에서 NMO-ON은 심각한 RNFL과 신경절세포층(ganglion cell layer)의 손상을 일으켜서 시력저하와 시야장애를 일으키는 것으로 알려져 있다[23,24]. 최근 연구에 따르면 MOG-ON도 비슷한 경로로 시력저하를 유발한다고 밝혀진 바 있다[6,15,25]. Pache et al [16]은 MOG-ON에서는 재발 횟수가 많아 이에 따른 손상이 축적되어 나타나며, 반면 NMO-ON에서는 한 번의 시신경염 발생이 큰 손상을 일으킨다고 하였다. Saadoun et al [26]이 이전에 실험적으로 밝혔던 바에 따르면 MOG-IgG는 신경 수초 변화를 일으키고 신경세포 축삭 단백질이 변화되는 과정에서 염증성 세포 침윤이 관여하지 않고, 보체(complement)가 활성화되지 않으며, 2주 이내 회복하는 반면, NMO-IgG는 유사한 신경 변화에 염증성 세포 침윤과 보체 활성화가 관여하고, 회복이 잘 되지 않는다고 하였다.
NMO-ON의 치료는 급성기에 고용량 정맥내 메틸프레드니솔론을 하루 1 g씩 3-5일간 투여한다. 이에 반응이 없거나 불충분한 경우는 혈장 교환을 시행한다. 이후 장기적으로 유지 치료로 면역억제제를 사용한다[1]. 반면 MOG-ON은 급성기에는 NMO-ON과 마찬가지로 고용량 정맥내 메틸프레드니솔론 치료를 시행하거나 정맥내 면역글로불린요법(intravenous immunoglobulin, IVIg)을 시행하나, 혈장 교환술에 대한 치료 효과는 입증된 바가 없다[14]. MOG-ON에서 장기적인 치료에 대해서는 현재 완전히 정립된 바는 없으나, 재발이 잦거나 장해가 남은 사람들에게서 면역억제제를 사용해볼 수 있다[14]. 따라서 시력저하가 심하고 시야손상이 심한 경우 NMO-ON을 의심하여 초기부터 시력호전 여부에 따라 3-5일간 고용량 정맥내 메틸프레드니솔론 치료나 혈장교환술 등을 고려해볼 수 있으며, 재발이 잦은 시신경염의 경우 MOG-IgG를 적극적으로 검사하여 이에 대한 장기적인 면역억제제 치료를 고려해야 한다.
저자들의 연구의 한계점으로, MOG-ON이 비교적 최근에 진단을 시작한 질환으로 임상경과가 확보된 증례 수가 상대적으로 적은 점을 들 수 있다. 하지만 저자들의 연구는 국내에서 최초로 MOG-ON과 NMO-ON을 비교하여 국내 MOG-ON 환자들과 NMO-ON 환자들 사이에 뚜렷한 임상 경과의 차이가 있음을 입증하였다. MOG-ON은 NMO-ON 보다 높은 재발 경향을 보였고, NMO-ON은 MOG-ON에 비해 더 적은 재발 횟수에도 불구하고 더 불량한 시력예후를 보였다. 저자들의 임상적 차이 결과에 따라 비교적 시력 결과가 양호하면서 시야손상이 적고, 재발을 반복하는 경우 MOG-ON을 더 의심해볼 수 있으나, 이외에는 MOG-ON과 NMO-ON이 임상적으로 큰 차이를 보이지 않았다. 따라서 혈청 항체검사 결과가 나오기 전에는 NMO-ON 혹은 MOG-ON인지 알 수 없으며, 어떤 경우에서도 NMO-ON, MOG-ON 모두를 염두에 두어야 한다. 향후, 보다 더 많은 환자들을 대상으로 NMO-ON을 포함한 다양한 질병과 연관된 시신경염과의 비교를 통해 질환의 임상양상과 경과를 이해하고 치료 방침을 결정하는 데에 이바지할 수 있을 것으로 생각된다.
Figure 1.
The lowest visual acuity from the first onset to the last follow-up, divided into 5 categories. NMO = neuromyelitis optica; MOG = myelin oligodendrocyte glycoprotein; ON = optic neuritis; LP = light perception; NLP = no light perception; BCVA = best-corrected visual acuity. *Fisher’s exact test; †chi-square test.

Figure 2.
Visual acuity at the last follow-up, divided into 5 categories. NMO = neuromyelitis optica; MOG = myelin oligodendrocyte glycoprotein; ON = optic neuritis; LP = light perception; NLP = no light perception; BCVA = best-corrected visual acuity. *Fisher’s exact test.
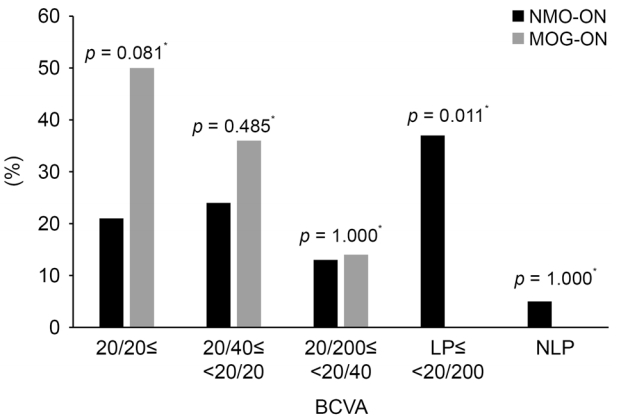
Table 1.
Demographics of patients
| NMO-ON | MOG-ON | p-value | |
|---|---|---|---|
| Number of patients/eyes | 25/38 | 10/14 | - |
| Sex (female) | 22 (88) | 9 (90) | 1.000* |
| Current age (years) | 51 ± 15 | 53 ± 16 | 0.529† |
| Age at onset (years) | 40 ± 16 (9-75) | 50 ± 19 (9-70) | 0.093† |
| Follow-up duration (months) | 52 ± 38 | 24 ± 45 | 0.013† |
Table 2.
Clinical characteristics of patients
| NMO-ON | MOG-ON | p-value | |
|---|---|---|---|
| Bilateral ON (patient) | 13 (52) | 4 (40) | 0.711* |
| Ocular pain (eyes) | 15 (65) | 9 (82) | 0.437* |
| Optic disc swelling (eyes) | 7 (18.40) | 5 (35.70) | 0.267* |
| Relapsing ON (eyes) | 16 (42) | 11 (79) | 0.020† |
| Number of ON episodes | 0.6 ± 1.1 | 2.0 ± 1.81 | 0.009* |
| Mean deviation of visual field test‡ | -18.98 ± 12.356 | -10.17 ± 10.027 | 0.018§ |
| Color vision testΠ | 1.79 ± 4.44 | 3.41 ± 3.42 | 0.073§ |
| Number of steroid pulse therapy | 3.8 ± 3.89 | 2.4 ± 1.43 | 0.706§ |
| Number of patients with immunosuppresant maintenance | 21 (84) | 9 (90) | 1.000* |
Table 3.
The lowest visual acuity from the first onset to the last follow-up
| Visual acuity |
Value |
p-value | |
|---|---|---|---|
| NMO-ON | MOG-ON | ||
| 20/20≤ | 2 (5) | 1 (7) | 1.000* |
| 20/40≤, <20/20 | 8 (21) | 7 (50) | 0.081* |
| 20/200≤, <20/40 | 4 (11) | 3 (21) | 0.370* |
| LP≤, <20/200 | 20 (53) | 2 (14) | 0.013† |
| NLP | 4 (11) | 0 | 0.564* |
Table 4.
Visual acuity at the last follow-up
| Visual acuity |
Value |
p-value* | |
|---|---|---|---|
| NMO-ON | MOG-ON | ||
| 20/20≤ | 8 (21) | 7 (50) | 0.081 |
| 20/40≤, <20/20 | 9 (24) | 5 (36) | 0.485 |
| 20/200≤, <20/40 | 5 (13) | 2 (14) | 1.000 |
| LP≤, <20/200 | 14 (37) | 0 | 0.011 |
| NLP | 2 (5) | 0 | 1.000 |
REFERENCES
2) Lana-Peixoto MA, Talim N. Neuromyelitis optica spectrum disorder and anti-MOG syndromes. Biomedicines 2019;7:42.



3) Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004;364:2106-12.


5) Berger T, Rubner P, Schautzer F, et al. Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. N Engl J Med 2003;349:139-45.


6) Ramanathan S, Reddel SW, Henderson A, et al. Antibodies to myelin oligodendrocyte glycoprotein in bilateral and recurrent optic neuritis. Neurol Neuroimmunol Neuroinflamm 2014;1:e40.



7) Petzold A, Plant GT. Diagnosis and classification of autoimmune optic neuropathy. Autoimmun Rev 2014;13:539-45.


8) Liu H, Zhou H, Wang J, et al. The prevalence and prognostic value of myelin oligodendrocyte glycoprotein antibody in adult optic neuritis. J Neurol Sci 2019;396:225-31.


9) Schluesener HJ, Sobel RA, Linington C, Weiner HL. A monoclonal antibody against a myelin oligodendrocyte glycoprotein induces relapses and demyelination in central nervous system autoimmune disease. J Immunol 1987;139:4016-21.



10) Akaishi T, Sato DK, Nakashima I, et al. MRI and retinal abnormalities in isolated optic neuritis with myelin oligodendrocyte glycoprotein and aquaporin-4 antibodies: a comparative study. J Neurol Neurosurg Psychiatry 2016;87:446-8.


11) Chen JJ, Flanagan EP, Jitprapaikulsan J, et al. Myelin oligodendrocyte glycoprotein antibody-positive optic neuritis: clinical characteristics, radiologic clues, and outcome. Am J Ophthalmol 2018;195:8-15.



12) Ducloyer JB, Caignard A, Aidaoui R, et al. MOG-Ab prevalence in optic neuritis and clinical predictive factors for diagnosis. Br J Ophthalmol 2020;104:842-5.


13) Jurynczyk M, Messina S, Woodhall MR, et al. Clinical presentation and prognosis in MOG-antibody disease: a UK study. Brain 2017;140:3128-38.


14) Tajfirouz DA, Bhatti MT, Chen JJ. Clinical characteristics and treatment of MOG-IgG-associated optic neuritis. Curr Neurol Neurosci Rep 2019;19:100.


15) Zhao G, Chen Q, Huang Y, et al. Clinical characteristics of myelin oligodendrocyte glycoprotein seropositive optic neuritis: a cohort study in Shanghai, China. J Neurol 2018;265:33-40.


16) Pache F, Zimmermann H, Mikolajczak J, et al. MOG-IgG in NMO and related disorders: a multicenter study of 50 patients. Part 4: Afferent visual system damage after optic neuritis in MOG-IgG-seropositive versus AQP4-IgG-seropositive patients. J Neuroinflammation 2016;13:282.



17) Zhao Y, Tan S, Chan TCY, et al. Clinical features of demyelinating optic neuritis with seropositive myelin oligodendrocyte glycoprotein antibody in Chinese patients. Br J Ophthalmol 2018;102:1372-7.


18) Ramanathan S, Prelog K, Barnes EH, et al. Radiological differentiation of optic neuritis with myelin oligodendrocyte glycoprotein antibodies, aquaporin-4 antibodies, and multiple sclerosis. Mult Scler 2016;22:470-82.


19) Pandit L, Asgari N, Apiwattanakul M, et al. Demographic and clinical features of neuromyelitis optica: a review. Mult Scler 2015;21:845-53.



20) Ishikawa H, Kezuka T, Shikishima K, et al. Epidemiologic and clinical characteristics of optic neuritis in Japan. Ophthalmology 2019;126:1385-98.


21) Höftberger R, Sepulveda M, Armangue T, et al. Antibodies to MOG and AQP4 in adults with neuromyelitis optica and suspected limited forms of the disease. Mult Scler 2015;21:866-74.


22) Sato DK, Callegaro D, Lana-Peixoto MA, et al. Distinction between MOG antibody-positive and AQP4 antibody-positive NMO spectrum disorders. Neurology 2014;82:474-81.



23) Jarius S, Wildemann B, Paul F. Neuromyelitis optica: clinical features, immunopathogenesis and treatment. Clin Exp Immunol 2014;176:149-64.



24) Bennett JL, de Seze J, Lana-Peixoto M, et al. Neuromyelitis optica and multiple sclerosis: Seeing differences through optical coherence tomography. Mult Scler 2015;21:678-88.







 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




