 |
 |
| J Korean Ophthalmol Soc > Volume 62(1); 2021 > Article |
|
국문초록
대상과 방법
제브라피쉬를 다양한 농도의 포도씨 유래 폴리페놀로 전처치한 후(각각, 0, 0.1, 1, 10 μg/mL), 청색광에 의한 망막의 산화적 손상 및 변화를 유도하기 위해 청색 발광 다이오드(10,000 Lux, 480 nm)를 4일 동안 처리하였다. 망막 보호 효과를 확인하기 위하여 hematoxylin & eosin 염색으로 광수용체층 및 외핵층의 두께 변화와 외핵층 세포 내 핵 수의 변화를 측정하였다.
ABSTRACT
Purpose
To investigate the oxidative damage and changes of retinas by blue light through zebrafish and to confirm the protective effect of polyphenol on retina cells using grape seed-derived polyphenols.
Methods
To induce oxidative damage and changes of the retina by blue light, blue light LED (10,000 Lux, 480 nm) was added to the zebrafish grown in the dark room after pretreating polyphenols derived from grape seed at various concentrations (0, 0.1, 1, 10 μg/mL, respectively) for 4 days. Changes in retinal thickness and numbers of outer nuclear layer nuclei through hematoxylin & eosin staining were evaluated.
Results
Photoreceptor layer thickness of blue light exposed group was significantly thinner than the group without blue light (108.1 ± 27.7 μm vs 41.1 ± 17.0 μm). As pretreated polyphenol concentration increased, photoreceptor layer thickness was increased (41.1 ± 17.0, 56.3 ± 18.6, 90.7 ± 23.7, 99.1 ± 23.1 μm, p<0.05), and damage to outer nuclear layer nuclei was also decreased.
Conclusions
Exposure to blue light is an important factor for increasing oxidative stress in the retina. Grape seed-derived polyphenols have been shown to protect photoreceptor cells and retinal pigment epithelial cells from oxidative stress. This suggests that the antioxidant effect of polyphenol compounds may help suppress the progression of retinal diseases associated with oxidative stress such as age-related macular degeneration.
인간은 하루 중 다양한 빛에 노출된다. 최근에는 특히 전 연령층에서 스마트폰이나 태블릿 컴퓨터의 사용량이 증가하면서 기기에 의한 청색광(blue light) 노출이 증가하고 있다[1,2]. 나이, 흡연과 더불어 자외선 노출 시간의 증가는 황반변성의 원인으로 알려져 있으며 특히 비교적 짧은 파장(380-530 nm)을 지닌 청색광은 높은 에너지의 가시광선으로 산화스트레스를 발생시켜 나이관련황반변성(age-related macular degeneration)과 망막색소변성증(retinitis pigmentosa)의 발병기전과 연관이 있는 것으로 알려져 있다[3,4]. 나이관련황반변성은 주로 고연령층에서 황반부에 드루젠(drusen)의 침착과 다양한 형태의 변성이 오는 질환으로 후기로 진행될 경우 황반 중심부에 지도형 위축(geographic atrophy)이나 맥락막신생혈관(choroidal neovascularization)이 발생하여 회복 불가능한 중심시력손상을 일으킨다[5,6].
산화스트레스는 나이관련황반변성을 일으키는 병인으로 알려져 있으며 산화스트레스는 주로 망막색소상피(retinal pigment epithelium, RPE)와 맥락막모세혈관(choriocapillary)에 손상을 주어 황반변성을 발생시킨다. 특히 RPE는 망막과 맥락막모세혈관 사이에 단일층을 이루고 있는 세포층으로 생리적으로 광수용체의 영양 공급과 대사물질의 배출 및 탐식(autophagy) 등 시력의 유지에 중요한 역할을 하며 산소소모량이 많아 산화스트레스에 노출되기 쉽다[7,8].
청색광에 의한 산화스트레스는 RPE 세포와 광수용체(photoreceptor) 세포에 손상을 준다. RPE의 손상은 bis-retinoid, N-retinylidene-N-retinylethanolamine (A2E) 등과 같은 지방갈색소(lipofucin)의 침착에 의해 유도되어 반응성 산소종(reactive oxygen species, ROS)의 발생을 일으킨다[9,10]. ROS 는 세포의 미토콘드리아나 리소솜(lysosome)의 손상을 주어[11,12] 대사물질의 배출 및 탐식과 같은 세포 제거 기능의 이상을 초래하고[13] caspase-3의 활성화에 의해 세포자멸사(apoptosis)을 유발하여 망막 조직의 손상을 일으킨다[14]. 광수용체 세포 또한 caspase-3와 로돕신(rhodopsin)에 의해 손상을 받게되어 결국 시력저하를 발생시킨다.
따라서 산화스트레스로부터 보호하는 방법 및 물질에 관한 많은 연구들이 진행 중이며, 꾸준히 섭취할 수 있는 식품에서 유래한 폴리페놀과 같은 화합물에 대한 연구가 활발히 진행되고 있다[15-17]. 폴리페놀은 안토시아닌(anthocyanin)이나 프로안토시아니딘(proanthocyanidin) 등이 풍부하여 항산화 작용을 하며 특히 vitis vinifera의 포도씨에서 유래된 폴리페놀(grape seed-derived polyphenol, GSP)은 프로안토시아니딘이 풍부하게 함유되어 강한 항산화 효과로 산화스트레스 모델에서 치료적 효과를 얻기도 하였다[18].
저자들은 이전 연구에서 GSP 화합물이 산화스트레스가 유도된 in vitro 인간 RPE 세포의 세포 내 ROS의 발생을 감소시키고, 세포를 보호하는 효과가 있음을 발표하였다[19]. 제브라피쉬 망막은 인간의 망막과 같이 원뿔세포가 풍부하고 구조가 비슷하여 나이관련황반변성과 같은 질환을 연구하기에 좋은 모델이다[20-22]. 본 연구에서는 청색광에 의한 제브라피쉬 광수용체층의 구조적 변화와 세포핵 수를 관찰하고 분석하고[23] 청색광의 산화스트레스로부터 GSP 화합물의 망막 보호 효과를 연구하고자 한다.
산란 후 6개월이 지난 성체 제브라피쉬(Danio rerio) 50마리를 5개의 아크릴 수조에 10마리씩 나누었다. Westerfield [24]의 husbandry technique을 사용하여 28.5°C 온도와 200 lux 조명 아래서 14시간 명:10시간 암 주기를 7일간 유지하였고 이후 7일간 암실에서 성장시켰다. 각 수조는 5 L의 동일한 크기로 산소발생기를 설치하고 수중 워머를 이용해 수조 내 온도를 유지하였다. 어분, 새우분, 크릴분, 곡류가 혼합된 상용먹이를 각 수조에 동량으로 하루에 1회 제공하였다. 본 연구는 The Association for Research in Vision and Ophthalmology (ARVO) Statement의 권고사항을 준수하였고 경희대학교 연구윤리심의위원회(Institutional Review Board, IRB)의 승인(승인 번호: KHSASP-20-136)을 받아 진행하였다.
폴리페놀 화합물의 RPE 세포 보호 효과를 확인하기 위해 제브라피쉬에 GSP를 전처리하였다. GSP는 유럽종 포도인 vitis vinifera의 건조된 씨를 분쇄한 다음 에탄올을 이용하여 가온 추출한 후 감압여과 및 농축하여 분말 상태로 얻었다.
GSP의 농도에 따른 망막 조직의 손상 정도를 비교 분석하기 위해 폴리페놀을 처리하지 않은 2개 군과 각각 0.1 ug/mL, 1 ug/mL, 10 ug/mL 농도의 GSP로 처리할 3개 군으로 나누었다. 분말 상태의 GSP 100 mg을 전자저울로 정량하여 100 mL 증류수에 녹여 1,000 ug/mL 농도의 용액을 제조하였고 광원 노출 전, 각 군별로 농도 조건에 맞게 아크릴 수조 물에 첨가하여 희석하였다.
7일간 명/암 주기를 유지한 제브라피쉬를 광원에 노출 전 7일간 암실에서 성장시켰다. 청색 발광 다이오드(blue light LED, 10,000 lux, 480 nm, Samhong LED, Busan, Korea)는 아크릴 수조 위 50 cm 거리에서 조사하였다(Fig. 1). 수조 반대편의 조도(아크릴 1층과 물 통과)는 휴대용 조도계(MT-30, Cosiki)로 측정하였고, 6,000 lux였다. 수조의 가열 여부를 확인하기 위해 1시간마다 수조의 온도를 확인하였다. 폴리페놀을 처리하지 않은 1군은 4일 간 명/암 주기를 유지한 일상 환경에 노출시켰고, 나머지 4군은 명암 주기를 유지하며 각각의 수조에서 광원에 4일간 노출시켜 성장시켰다.
광원 노출 종료 후 제브라피쉬 조직 획득을 위해 마취를 수행하였다. 각 수조의 제브라피쉬는 제브라피쉬 은행 운영지침서에 따라 Tricane (4 mg/mL, Ethyl 3-aminobenzoic methanesulfonate; Sigma-Aldrich, St. Louis, MO, USA)을 이용해 마취를 시행하였고 제브라피쉬의 마취가 완벽히 시행된 후, 안락사를 위해 2-phenoxyethanol (0.4 mg/L)을 투여하였다.
미세핀셋을 이용하여 결막을 잡아당겨 안구를 적출하여 고정액(0.1M phosphate buffer [PB], pH 7.4, 4% paraformaldehyde)에 넣고 실온 상태에서 24시간 이상 보관하였다. 조직검사를 위해 파라핀 블록을 만들고, 7 µm 절편을 만들어 hematoxylin and eosin (H&E) 염색을 시행하였다.
광원 현미경을 통해 H&E 염색이 완료된 망막 조직의 구조 변화를 관찰하였다. 각 군별로 시신경유두(optic disc)를 포함하거나 시신경에 근접한 망막 조직을 선택하였다. 선택한 조직에서 절편을 만들고 5개의 섹션을 랜덤하게 선별하여 망막 형태의 정량 분석을 시도하였다. 각각의 사진에서 광수용체층(photoreceptor layer), 외핵층(outer nuclear layer)의 두께를 측정하고 세포의 개수를 정량적으로 분석하기 위해 외핵층 세포핵(ONL nuclei)의 개수를 측정하였다. 광수용체층의 두께는 바깥경계막(external limiting membrane)부터 광수용체층의 외절(outer segment)의 가장자리까지 측정하였고 동일한 섹션에서 외핵층의 두께를 재고 외핵층의 100 µm 거리 내에 있는 핵의 수를 측정하였다(Fig. 2).
각각의 군별로 10마리 제브라피쉬의 망막 조직에서 분석을 시도하였다. 결과의 일관성을 유지하기 위하여 결과의 측정은 제브라피쉬의 중심 망막 근처로 제한하였다. 대상과 방법에서 서술하였듯이 제브라피쉬 한 마리당 시신경유두가 보이거나 이에 근접한 부위 중 망막 조직이 찢어졌거나, 일부 손실 또는 망막층의 구분이 어려운 경우를 제외였고, 망막박리가 보이지 않는 조직을 이용하여 조직당 5개 섹션에서 두께를 측정하였다(control, n=28; 0 µg/mL, n=20; 0.1 µg/mL, n=14, 1 µg/mL, n=15; 10 µg/mL, n=10) (Fig. 3).
청색광에 의한 손상 정도를 파악하기 위해 청색광에 노출되지 않은 대조군과 4일간 청색광에 노출되고 GSP를 처리하지 않은 제브라피쉬군의 조직 사진을 비교 분석하였다. 대조군에 비하여 청색광에 노출된 군은 광수용체층의 두께가 유의하게 얇아지고(108.1 ± 27.7 μm vs. 41.1 ± 17.0 μm) 층의 불규칙한 변화를 확인할 수 있었으며, 또한 외핵층의 세포핵 수에서 유의미한 감소가 관찰되었다(89.0 ± 25.4 vs. 49.9 ± 15.5) (Table 1, Fig. 4).
GSP의 효과를 평가하기 위해 GSP의 농도를 달리하여(0.1, 1, 10 μg/mL) 전처리한 제브라피쉬에 청색광을 4일간 노출시킨 후 망막 구조의 변화를 확인하였다. GSP를 전처리한 경우, 청색광만 노출되었을 때보다 광수용체층과 외핵층의 두께가 두꺼웠으며, 외핵층 세포핵 수 또한 상대적으로 많았다. GSP의 농도를 높여 전처리를 할수록 미처리군에 비하여 제브라피쉬의 망막두께가 증가하는 양상을 보였으며 세포핵 수 또한 감소량이 적어지는 양상을 보였다(Fig. 4). 청색광에 노출시킨 GSP 미처리군과 비교하여 GSP 0.1 μg/mL 전처리 시 광수용체층 및 외핵층두께, 외핵층 세포핵 개수에서 유의한 차이를 보이지 않았으나 GSP 농도 1.0 μg/mL 이상 전처리(1.0, 10 μg/mL) 시 미처리군에 비해 망막두께 및 세포핵 개수에서 유의한 차이를 보였다(Fig. 5).
본 연구의 목적은 청색광이 제브라피쉬의 망막에 미치는 영향을 평가하고 GSP의 망막 보호 효과 및 농도별 효과의 차이를 분석하고자 함이다. 4일간 청색광에 제브라피쉬를 노출시켰을 때 노출되지 않은 대조군에 비해 망막 광수용체층, 외핵층의 두께, 외핵층 세포핵 수의 유의미한 감소를 보였다. 두께의 감소와 더불어 외핵층 세포핵 수의 감소는 광수용체 세포의 절대적 소실을 보여주며 GSP를 전처리하였을 경우 미처리군 대비 광수용체층, 외핵층의 두께 증가, 외핵층 세포핵 수 감소의 망막 보호 효과를 보였고 이는 일정 수준 GSP 농도(0.1, 1, 10 µg/mL)에 비례하는 양상을 보였다(Fig. 4). 또한 이전 연구에서 24시간 지속적으로 빛을 가하여 제브라피쉬의 망막 손상을 보고한 것과 다르게[25], 본 연구에서는 일상 생활 패턴과 유사한 14시간 광원 노출, 10시간 암실을 유지한 조건에서도 제브라피쉬의 광수용체의 유의한 손상을 관찰할 수 있었으며 0.1 µg/mL의 GSP 농도를 전처리하였을 경우 유의한 보호 효과를 보이지 않았으나 1 µg/mL 이상의 농도에서는 농도에 비례하여 광원에 의한 산화스트레스로부터 망막을 보호하는 효과를 관찰하였다(Fig. 5). 이는 저자들의 이전 연구와 비슷한 결과값을 갖는데 당시 연구 결과에 의하면 배양된 인간 RPE 세포를 과산화수소로 산화스트레스를 유도 시 세포 활성도가 유의하게 감소하였으며 GSP 전처치 시 세포의 생존율이 증가하였고 농도에 비례하여(0.1, 0.5, 1, 5, 10 µg/mL) 세포의 생존율이 유의하게 증가함을 관찰하였다[19].
위 결과는 두 가지 효과로 해석할 수 있다. 먼저, 광수용체에 직접 작용하는 광원에 대한 폴리페놀의 보호 효과이다. 이전 연구에서 광치료에 의한 포유류 광수용체 세포의 세포자멸사[26] 및 소의 광수용체 세포의 세포 사멸을 in vitro [27]에서 확인하였고, Ogawa et al [28]은 in vitro에서 폴리페 놀이 광수용체를 직접적으로 보호함을 발표하였다. 광원은 광수용체 세포에 직접 작용하여 손상을 일으키며 폴리페놀은 이에 대한 보호 효과를 갖고 있음을 의미한다. 두 번째는 광원에 의한 RPE의 손상에 대한 폴리페놀의 보호 효과이다. 저자들은 in vitro에서 광원에 의한 RPE의 손상을 확인하였고, 폴리페놀의 의한 RPE의 보호 효과 또한 확인하였다[19]. 그러나 본 연구에서는 in vivo에서 제브라피쉬 망막의 광원에 대한 RPE의 직접적인 손상을 확인하기 어려웠고, 광수용체층, 외핵층의 두께와 외핵층핵 수로 간접적으로 확인하였다. 위와 같이 생각할 때 결국 청색광은 광수용체와 RPE에서 모두 손상과 사멸화 과정을 일으키며 폴리페놀은 광수용체의 직접 보호와 RPE의 보호로 인한 광수용체 대사 보호 효과를 보여준 것으로 사료된다.
이전 연구들을 보면 과량의 광원 노출은 망막 광수용체와 RPE에 세포자멸사를 유도하며 이는 광수용체 내 간상 세포의 로돕신(rhodopsin)에 의한 청색광 흡수에 의한 것으로 밝혀져 있다[29,30]. 로돕신에 있는 RPE65 단백질은 빛 흡수에 필수적인 물질로 빛에 의한 손상 또한 이 물질에 의해 매개된다[31]. 반복적인 광입자의 흡수는 로돕신의 반복적인 재생성을 일으키고, 이 과정에서 세모 자멸사의 발생할 가능성이 높아진다[32]. 특히 짧은 파장의 청색광과 자외선이 지닌 높은 에너지 광자들은 흡수되어 광수용체와 RPE에 손상을 일으켜 ROS를 생성하며[10,33] 이는 리소솜, 미토콘드리아 DNA의 손상, 혈관내피세포성장인자(vascular endothelial growth factor)의 증가, 염증 반응의 증가와 같은 변화를 일으킨다[14,34]. 결론적으로 본 연구 결과 GSP는 산화스트레스로부터 RPE와 광수용체의 손상을 줄이는 작용이 있었을 것이라 판단된다. 그러나 100 µg/mL 이상의 GSP 처리는 오히려 망막 세포활성도가 감소할 수 있으며[19] 이는 고농도의 식물화합물의 경우 미토콘드리아의 superoxide radical (O2) 생성을 증가시키거나 세포 DNA를 손상 또는 세포 자멸사를 유발할 수 있기 때문이다[35-37].
연령이 증가할수록 ROS에 의한 산화스트레스에 더 취약해진다. 연령에 따라 지방갈색소(lipofucin)가 증가하기 때문이며 나이관련황반변성 환자에서도 이와 유사하게 지방갈색소 생성(lipofuscionogenesis)이 활성화되는 것으로 알려져 있다[38]. 지방갈색소는 RPE에 축적되는 물질로 빛에 의해 산화되어 산소흡수율을 결정하며 파장이 짧을수록 더 많은 양의 산소를 흡수하는 것으로 알려져 있다[39]. RPE에 축적된 지방갈색소는 특히 청색광에 의해 활성화되어 산소 요구량을 높이며 ROS 등의 생성을 높여 RPE 세포의 손상으로 이어진다[40]. 결국 지방갈색소의 활성은 RPE에 산화스트레스를 일으켜 노년층과 황반변성 환자에게서 세포 자멸사를 유도하게 될 가능성을 높인다.
따라서 산화스트레스에 의한 손상을 줄일 수 있는 항산화 작용이 중요하며 Age-Related Eye Disease Study research group (AREDS)의 연구에 따르면 항산화 물질을 규칙적으로 섭취하는 것이 나이관련황반변성의 진행을 억제하는 데 효과가 있음을 확인할 수 있었으며, 비타민 C, 비타민 E, 베타 카로틴(beta carotene), 징크 등 항산화 작용을 하는 보충제나 루테인(lutein), 지아잔틴(zeaxanthin), 오메가3 지방산(omega-3 fatty acids)을 꾸준히 섭취할 경우 그 효과가 있음을 발표하였다[41,42].
본 연구에 사용된 GSP는 유럽종 포도인 vitis vinefera의 포도씨에서 추출하였고, 폴리페놀은 주로 플라보노이드(flavonoid), 에피카테친(epicatechin), 갈로카테친(gallocatechin), 에피카테친 3-0-갈레이트(epicatechin 3-0-gallate), 프로사이아니딘(procyanidin) 등으로 이루어져 있으며 프로안토시아니딘에 의해 강한 항산화 효과를 가지며 비타민 E의 20배, 비타민 C의 50배의 효과를 가진 것으로 알려져 있다[18,43]. 프로안토시아니딘은 자유라디칼(free radical)을 줄이고, 과산화수소와 초과산화물과 같은 ROS들과 반응하거나 세포막의 지질막을 안정화시켜 항산화 효과를 얻으며 베타-아밀로이드(ß-amyloid) 침착에 의한 신경 손상을 억제할 수 있는 것을 보고되었다[44,45].
스마트폰과 태블릿 컴퓨터 등과 같은 전자기기는 인류의 삶을 혁신적으로 바꾸었으며 앞으로 사용량은 꾸준히 증가할 것이다. 전자기기 사용 증가에 따른 청색광의 노출은 망막의 산화스트레스를 야기하는 중요한 요인으로 본 연구는 제브라피쉬를 통해 청색광에 의한 망막의 구조적 손상과 변화를 관찰 및 측정하였고 GSP의 망막 보호 효과를 확인하였다. 다만 제브라피쉬 조직을 얻는 과정에서 찢어지거나 보존이 잘 되지 못하는 경우로 인해 개체수가 부족한 점, 저농도의 GSP에서 보호 효과가 떨어지는 기전에 대하여 설명하기 어려운 점, RPE의 직접적인 손상을 in vivo에서 확인하기 어려웠던 부분은 본 연구의 한계점이다. 앞으로 GSP는 강한 항산화 효과로 나이관련황반변성 진행의 억제에 도움이 될 수 있을 것이라 판단되며 실제 환자에서 결과를 확인하는 대규모의 장기적인 추가 연구가 필요할 것이라 생각된다.
NOTES
Figure 1.
Picture of Zebrafish aquarium. Blue light emission diode (LED) with zebrafishes in the net.

Figure 2.
Cross-sectional hematoxylin and eosin (H&E)-stained histology of zebrafish retina structure (×400). GCL = ganglion cell layer; IPL = inner plexiform layer; INL = inner nuclear layer; OPL = outer plexiform layer; ONL = outer nuclear layer; IS = inner segment; OS = outer segment; PL = photoreceptor layer; RPE = retinal pigmented epithelium.
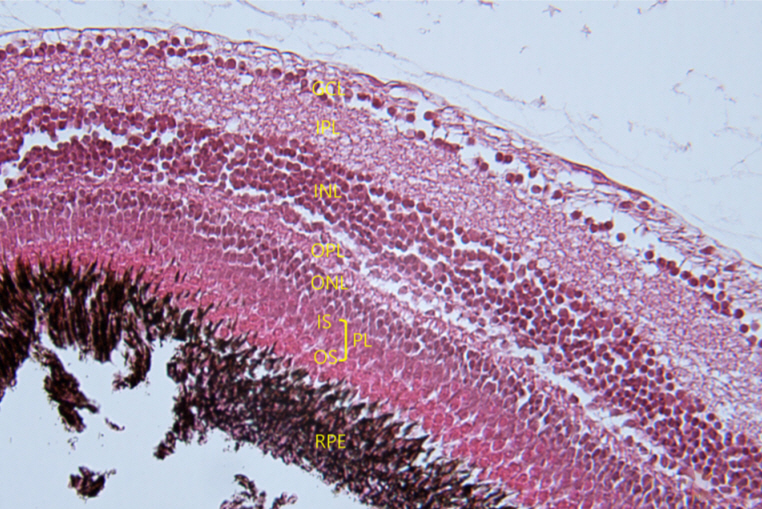
Figure 3.
Hematoxylin and eosin (H&E)-stained (×200), eyes from adult zebrafish were isolated either without blue light treatment or 4 days of blue light exposure. (A) Control group, (B) blue light exposed group without grape seed-derived polyphenols (GSP) treatment. (C-E) Blue light exposed group after GSP treatment ([C] 0.1, [D] 1, [E] 10 μg/mL).
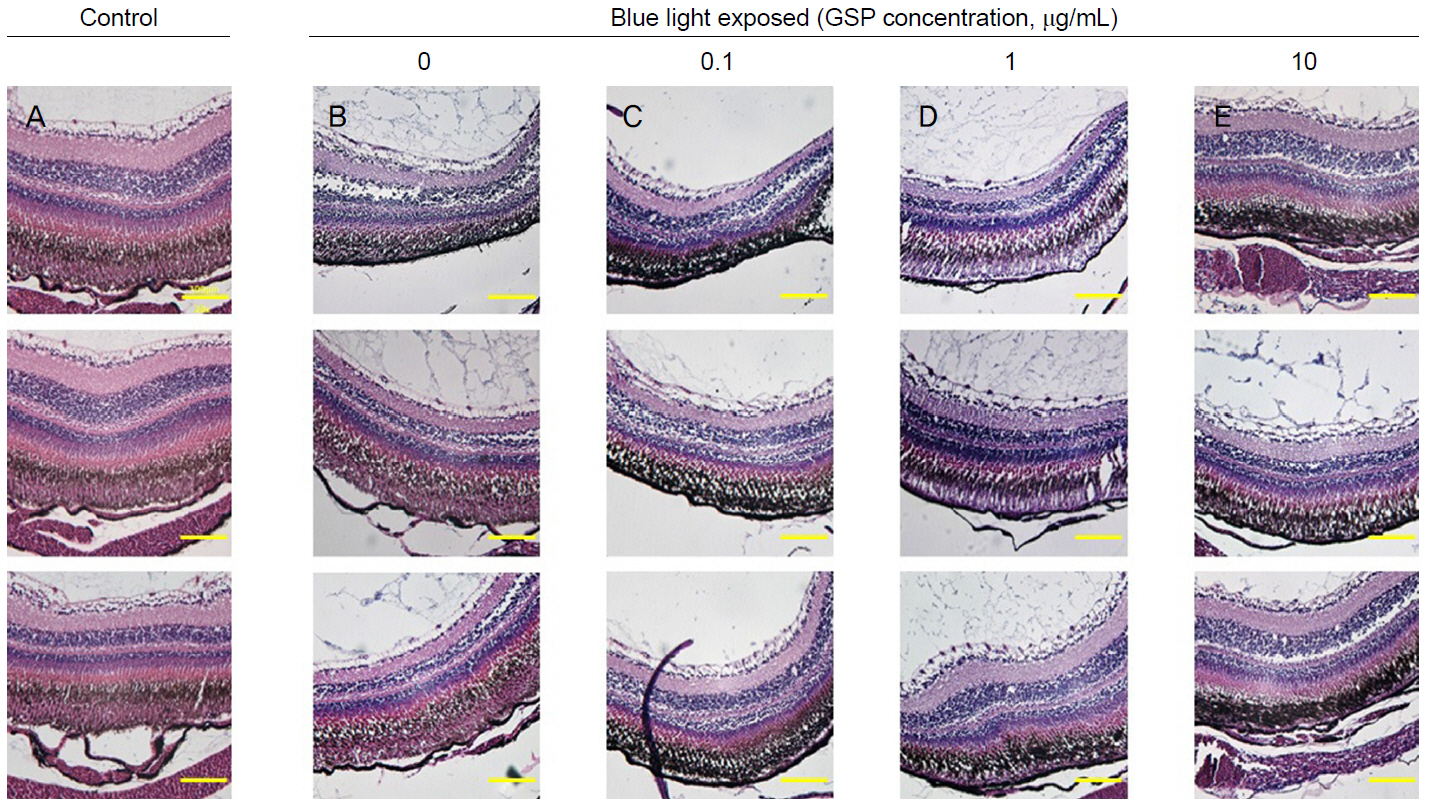
Figure 4.
Effect of blue light and protective role according to grape seed-derived polyphenols (GSP) concentration in morphologic changes of Zebrafish retina. Control as none treated blue light nor GSP. (A) Photoreceptor layer thickness, (B) outer nuclear layer thickness, (C) number of outer nuclear layer nuclei. *Significant differences from control group using analysis of variance.
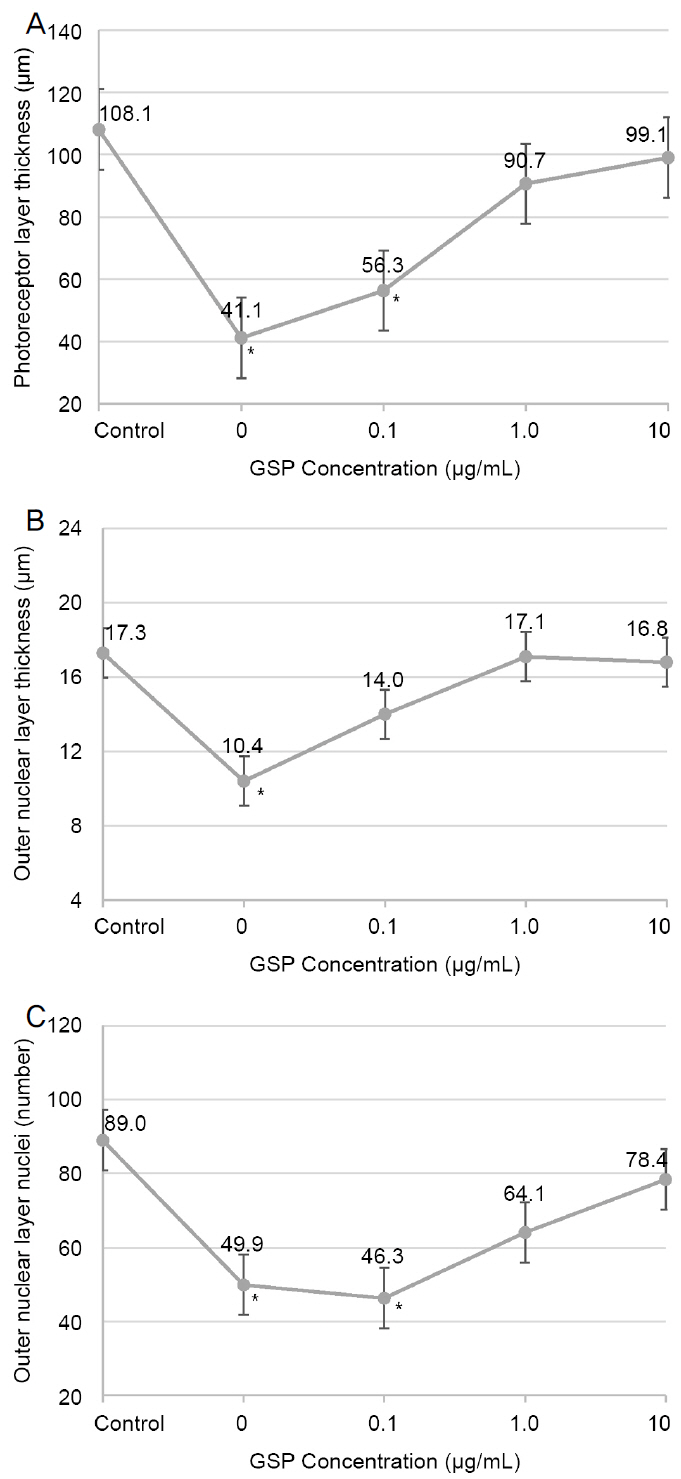
Figure 5.
Morphologic changes of Zebrafish retina due to grape seed-derived polyphenols (GSP) concentration. Photoreceptor layer thickness, Outer nuclear layer (ONL) nuclei number showed significant difference more than 1 ug/mL concentration of GSP. ONL thickness showed significant difference after 0.1 ug/mL concentration of GSP. PL = photoreceptor layer. *Significant differences between groups using analysis of variance.

Table 1.
Zebrafish retinal morphometry
| Number | Blue light treatment (days) | Light/dark time (hours) |
Retinal morphometry mean values |
||||
|---|---|---|---|---|---|---|---|
| PL (μm) | ONL (μm) | ONL nuclei (100 μm) | p-value | ||||
| Control | 28 | 0 | 14/10 | 108.1 ± 27.7 | 17.3 ± 5.5 | 89.0 ± 25.4 | - |
| GSP treatment (μg/mL) | |||||||
| 0* | 20 | 4 | 14/10 | 41.1 ± 17.0 | 10.4 ± 6.3 | 49.9 ± 15.5 | <0.05 |
| 0.1* | 14 | 4 | 14/10 | 56.3 ± 18.6 | 14.0 ± 5.7 | 46.3 ± 19.8 | <0.05 |
| 1 | 15 | 4 | 14/10 | 90.7 ± 23.7 | 17.1 ± 4.1 | 64.1 ± 22.5 | 0.16 |
| 10 | 10 | 4 | 14/10 | 99.1 ± 23.1 | 16.8 ± 6.6 | 78.4 ± 23.7 | 0.23 |
REFERENCES
1) Research on the usage status of smartphone users by gender and age [Internet]. Naju: Korea Internet & Security Agency; 2013. Available from: https://www.kisa.or.kr/uploadfile/201312/201312161356265190.pdf.
2) Mark Mattison-Shupnick. Handling the blues [Internet]. New York (US): Jobson Optical Group; c2014 [cited 2014 Nov 1]. Available from: https://www.2020mag.com/ce/handling-the-blues.
3) Glazer-Hockstein C, Dunaief JL. Could blue light-blocking lenses decrease the risk of age-related macular degeneration? Retina 2006;26:1-4.


4) Margrain TH, Boulton M, Marshall J, Sliney DH. Do blue light filters confer protection against age-related macular degeneration? Prog Retin Eye Res 2004;23:523-31.


5) Nowak JZ. Age-related macular degeneration (AMD): pathogenesis and therapy. Pharmacol Rep 2006;58:353-63.

6) Ambati J, Ambati BK, Yoo SH, et al. Age-related macular degeneration: etiology, pathogenesis, and therapeutic strategies. Surv Ophthalmol 2003;48:257-93.


7) Lu L, Hackett SF, Mincey A, et al. Effects of different types of oxidative stress in RPE cells. J Cell Physiol 2006;206:119-25.


8) Dorey CK, Wu G, Ebenstein D, et al. Cell loss in the aging retina. Relationship to lipofuscin accumulation and macular degeneration. Invest Ophthalmol Vis Sci 1989;30:1691-9.

9) Beatty S, Koh H, Phil M, et al. The role of oxidative stress in the pathogenesis of age-related macular degeneration. Surv Ophthalmol 2000;45:115-34.


10) Justilien V, Pang JJ, Renganathan K, et al. SOD2 knockdown mouse model of early AMD. Invest Ophthalmol Vis Sci 2007;48:4407-20.



11) Chen H, Lukas TJ, Du N, et al. Dysfunction of the retinal pigment epithelium with age: increased iron decreases phagocytosis and lysosomal activity. Invest Ophthalmol Vis Sci 2009;50:1895-902.


12) Blasiak J, Glowacki S, Kauppinen A, Kaarniranta K. Mitochondrial and nuclear DNA damage and repair in age-related macular degeneration. Int J Mol Sci 2013;14:2996-3010.



13) Kaarniranta K, Sinha D, Blasiak J, et al. Autophagy and heterophagy dysregulation leads to retinal pigment epithelium dysfunction and development of age-related macular degeneration. Autophagy 2013;9:973-84.



14) Sparrow JR, Nakanishi K, Parish CA. The lipofuscin fluorophore A2E mediates blue light-induced damage to retinal pigmented epithelial cells. Invest Ophthalmol Vis Sci 2000;41:1981-9.

15) Dong X, Li Z, Wang W, et al. Protective effect of canolol from oxidative stress-induced cell damage in ARPE-19 cells via an ERK mediated antioxidative pathway. Mol Vis 2011;17:2040-8.


16) Li Z, Dong X, Liu H, et al. Astaxanthin protects ARPE-19 cells from oxidative stress via upregulation of Nrf2-regulated phase II enzymes through activation of PI3K/Akt. Mol Vis 2013;19:1656-66.


17) Hanneken A, Lin FF, Johnson J, Maher P. Flavonoids protect human retinal pigment epithelial cells from oxidative-stress-induced death. Invest Ophthalmol Vis Sci 2006;47:3164-77.


18) Moini H, Rimbach G, Packer L. Molecular aspects of procyanidin biological activity: disease preventative and therapeutic potentials. Drug Metabol Drug Interact 2000;17:237-59.


19) Seo KH, Yu SY, Kwak HW. Cytoprotective effect of polyphenolic compounds against oxidative stress in cultured retinal pigment epithelial cells. J Korean Ophthalmological Soc 2016;57:106-12.

20) Branchek T, Bremiller R. The development of photoreceptors in the zebrafish, Brachydanio rerio. I. Structure. J Comp Neurol 1984;224:107-15.


21) Bilotta J, Saszik S, Sutherland SE. Rod contributions to the electroretinogram of the dark-adapted developing zebrafish. Dev Dyn 2001;222:564-70.


22) Doerre G, Malicki J. Genetic analysis of photoreceptor cell development in the zebrafish retina. Mech Dev 2002;110:125-38.


23) Datta S, Cano M, Ebrahimi K, et al. The impact of oxidative stress and inflammation on RPE degeneration in non-neovascular AMD. Prog Retin Eye Res 2017;60:201-18.



24) Westerfield M. The zebrafish book: a guide for the laboratory use of zebrafish, 4th ed. Eugene: University of Oregon Press, 2000;chap. 1-4.
25) Vihtelic TS, Hyde DR. Light-induced rod and cone cell death and regeneration in the adult albino zebrafish (Danio rerio) retina. J Neurobiol 2000;44:289-307.


26) Shahinfar S, Edward D, Tso M. A pathologic study of photoreceptor cell death in retinal photic injury. Curr Eye Res 1991;10:47-59.

27) Laabich A, Vissvesuaran G, Lieu K, et al. Protective effect of crocin against blue light- and white light-mediated photoreceptor cell death in bovine and primate retinal primary cell culture. Invest Ophthalmol Vis Sci 2006;47:3156-63.


28) Ogawa K, Kuse Y, Tsuruma K, et al. Protective effects of bilberry and lingonberry extracts against blue light-emitting diode light-induced retinal photoreceptor cell damage in vitro. BMC Complement Altern Med 2014;14:120.




29) Hafezi F, Marti A, Munz K, Remé CE. Light-induced apoptosis: differential timing in the retina and pigment epithelium. Exp Eye Res 1997;64:963-70.


30) Grimm C, Wenzel A, Williams T, et al. Rhodopsin-mediated blue-light damage to the rat retina: effect of photoreversal of bleaching. Invest Ophthalmol Vis Sci 2001;42:497-505.

31) Iseli HP, Wenzel A, Hafezi F, et al. Light damage susceptibility and RPE65 in rats. Exp Eye Res 2002;75:407-13.


32) Grimm C, Wenzel A, Hafezi F, et al. Protection of Rpe65-deficient mice identifies rhodopsin as a mediator of light-induced retinal degeneration. Nat Genet 2000;25:63-6.


33) Rózanowska M, Wessels J, Boulton M, et al. Blue light-induced singlet oxygen generation by retinal lipofuscin in non-polar media. Free Radic Biol Med 1998;24:1107-12.


34) Demontis GC, Longoni B, Marchiafava PL. Molecular steps involved in light-induced oxidative damage to retinal rods. Invest Ophthalmol Vis Sci 2002;43:2421-7.

35) De Marchi U, Biasutto L, Garbisa S, et al. Quercetin can act either as an inhibitor or an inducer of the mitochondrial permeability transition pore: a demonstration of the ambivalent redox character of polyphenols. Biochim Biophys Acta 2009;1787:1425-32.


36) Wätjen W, Michels G, Steffan B, et al. Low concentrations of flavonoids are protective in rat H4IIE cells whereas high concentrations cause DNA damage and apoptosis. J Nutr 2005;135:525-31.


37) Bouayed J, Bohn T. Exogenous antioxidants--double-edged swords in cellular redox state: health beneficial effects at physiologic doses versus deleterious effects at high doses. Oxid Med Cell Longev 2010;3:228-37.



38) Krohne TU, Stratmann NK, Kopitz J, Holz FG. Effects of lipid peroxidation products on lipofuscinogenesis and autophagy in human retinal pigment epithelial cells. Exp Eye Res 2010;90:465-71.


39) Rózanowska M, Pawlak A, Rózanowski B, et al. Age-related changes in the photoreactivity of retinal lipofuscin granules: role of chloroform-insoluble components. Invest Ophthalmol Vis Sci 2004;45:1052-60.


40) Sparrow JR, Cai B. Blue light-induced apoptosis of A2E-containing RPE: involvement of caspase-3 and protection by Bcl-2. Invest Ophthalmol Vis Sci 2001;42:1356-62.

41) Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001;119:1417-36.



42) Age-Related Eye Disease Study 2 Research Group. Lutein+ zeaxanthin and omega-3 fatty acids for age-related macular degeneration: The Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA 2013;309:2005-15.


43) Shi J, Yu J, Pohorly JE, Kakuda Y. Polyphenolics in grape seeds-biochemistry and functionality. J Med Food 2003;6:291-9.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




