 |
 |
| J Korean Ophthalmol Soc > Volume 61(11); 2020 > Article |
|
국문초록
목적
각막천공 이후 수차례 양막이식술에도 불구하고 각막의 육아종이 반복적으로 발생하는 스티븐스-존슨증후군 환자에서 무세포 보존 각막을 이용한 층판이식술의 효과를 증례 보고하고자 한다.
증례요약
17년 전 스티븐스-존슨증후군이 발병한 46세 남자 환자가 각막천공 후 수차례 양막이식술을 시행 받았음에도 불구하고 각막육아종이 4차례 반복 발생하였다. 2개월 전부터 각막육아종이 또 다시 재발하였고 이후 빠른 속도로 성장하였다. 전신마취하 각막육아종을 제거한 후 4.0 mm 직경의 원형으로 절제한 무세포 보존 사람 각막(Halo; Eversight Inc., Palo Alto, CA, USA)을 육아종 절제부에 층판 이식하였고, 이식 각막 표면에 동일 크기의 양막을 이식하였다. 수술 1달 후 일시적으로 수술 부위 염증 침윤 소견을 보였으나 항생제 치료 후 호전되었으며, 수술 후 8개월간 각막육아종 재발, 수술 부위 융해 및 추가 감염 없이 안정적으로 유지되었다.
ABSTRACT
Purpose
We describe a patient with Stevens-Johnson syndrome who exhibited recurrent anterior corneal granulomas after corneal perforation (despite multiple amniotic membrane [AM] transplantations); the patient was successfully treated by lamellar grafting of an acellular, preserved human cornea.
Case summary
Corneal granulomas developed four times in a 46-year-old man who had been diagnosed with Stevens-Johnson syndrome 17 years priorly and who had undergone multiple AM transplantations after corneal perforation. A corneal granulomatous mass recurred 2 months prior to presentation in our clinic; it rapidly increased in size. With the patient under general anesthesia, the corneal mass was excised and a 4.0-mm-diameter, acellular preserved human cornea (Halo; Eversight Inc., Palo Alto, CA, USA) was grafted. A similarly sized AM was placed over the grafted cornea. Although the engrafted cornea exhibited stromal infiltration 1 month after surgery, the keratitis improved following brief antibiotic treatment. At 8 months postoperatively, the wound was stable; no granuloma recurrence, no graft melting, and no suspected microbial keratitis were observed in the region of the graft.
스티븐스-존슨증후군(Stevens-Johnson syndrome)과 보다 중증의 형태인 독성표피괴사(toxic epidermal necrolysis)는 안구 및 구강 등의 점막과 피부를 침범하는 매우 드물지만 심각한 자가면역성의 수포, 물집성 질환이다[1]. 약 50%에서 급성기 때 안구를 침범하여 가성막결막염 및 외안부 상피결손을 유발하는데, 이때 중증 외안부 합병증(severe ocular complication)을 경험한 환자 중 상당수는 중증 안구건조증, 각막염, 지속 상피결손, 각막궤양, 반흔결막염, 검구유착, 안구 표면 각질화 및 결막낭 단축 등의 만성 합병증과 이로 인한 시력소실을 경험하게 된다[2,3]. 또한 스티븐스-존슨증후군에서 결막 세균총의 변화와 연관되어 감염각막염의 빈도가 증가하는데[4] 이는 결과적으로 각막의 궤양을 거쳐 천공을 초래할 수 있다[5].
스티븐스-존슨증후군에서 각막의 궤양, 융해(melting) 및 천공 발생은 상대적으로 잘 알려졌으나 반복적으로 발생하는 각막육아종에 대해서는 이제까지 보고된 바가 없었다. 나아가 이러한 스티븐스-존슨증후군에서의 재발성 각막육아종 병변에서 무세포 보존 각막을 이용한 수술적 치료 역시 알려진 바 없었다. 본 증례에서는 스티븐스-존슨증후군 환자에서 각막천공 후 수차례 양막이식술에도 불구하고 동일부위에서 재발하는 각막육아종을 무세포 보존 각막을 이용한 층판이식술을 통해 치료하였기에 이를 보고하고자 한다.
46세 남자 환자가 과거력상 17년 전 미상의 약물 복용 후 발생한 스티븐스-존슨증후군 발병 직후 5년간 우안의 자가윤부결막이식술, 심부표층각막이식술(deep anterior lamellar keratoplasty), 다층의(multi-layered) 영구양막이식술 및 배양코점막이식술을 시행 받았다.
이후 2차례 각막궤양 천공이 발생하여 매회 수복적 다층영구양막이식술을 시행하였으나 동일 부위에서 각막궤양 및 각막육아종이 4차례 반복 발생하였다. 최초 천공 당시 0.8 mm 직경의 각막궤양천공이 발생하여 즉시 다층 영구양막이식술 및 전방 재건을 시행하였으나 3.5개월 후 양막 융해 및 각막궤양이 발생하였다. 이후 같은 자리에서 육아종이 발생하여 2회 단순 절제술을 시행하였으나 두 번 모두 절제 2-3개월 내 각막육아종이 재발하였으며, 두 번째 재발 후 육아종 절제 및 다층 영구양막이식술을 시행하였으나 1-2주 뒤부터 각막의 상피결손이 재발하고 양막의 융해 소견을 보였다. 이후 보존적 치료 중 각막궤양천공이 재발하여 다층 영구양막이식술을 재시행하였으며, 수술 3개월 후 이식 표면의 심한 상피결손이 관찰되었다.
이후 15개월 만에 재방문한 외래에서 우안 각막 표면에 궤양성 병변이 관찰되어(Fig. 1A) 점안 항생제 투여 및 보존적 치료 후 호전되었으나, 3개월 이후 방문 시 흡사 각막실질 속에서부터 돌출되면서 빠져나오는 형상의 각막육아종성 종괴가 관찰되었고(Fig. 1B) 눈 깜빡임 시 이물감을 호소하였다. 점안 항생제, 점안 스테로이드, 점안 0.1% 사이클로스포린 투약에도 빠른 속도로 성장하여(Fig. 1C) 수술 직전에는 장경 4 mm, 단경 3 mm 크기로 비대해졌다(Fig. 1D). 각막융해 또는 감염성 궤양으로 인한 심한 염증, 혹시 모를 종괴 후부의 미세 천공으로 인한 이차적인 염증으로 인한 화농성 육아종 발생, 이전 육아종성 종괴의 불충분한 제거에 의한 재발 등의 다양한 가능성을 염두에 두고 병소 및 주변부 조직을 충분히 제거한 후 양막보다 훨씬 두꺼운 무세포 보존 사람 각막(sterile full-sized and split thickness cornea, Halo; Eversight Inc., Palo Alto, CA, USA)을 이용한 층판이식술을 계획하였다.
수술은 전신마취하에 시행하였다. 우안 유경성 종괴(Fig. 2A, B)를 절제하고 기저의 영양 혈관들을 전기 소작한 후(Fig. 2C), 종괴의 목(stalk)을 중심에 두고 4.0 mm 직경의 원형 피부 생검 펀치(Stiefel Laboratories, Research Triangle Park, Durham, NC, USA)를 이용하여 기저 각막기질을 층판 절제하였다(Fig. 2D, E). 이후 무세포 사람 보존각막(sterile full-sized and split thickness cornea, Halo, Eversight, Ann Arbor, MI, USA)을 4.0 mm 직경의 원형으로 절제하여 10-0 나일론 봉합사로 고정 봉합하였다(Fig. 2F, G). 이식 각막편 위로 상피화를 도모하기 위해 동결 양막(MS-Amnion; MSBIO, Seongnam, Korea)을 이식각막편과 동일 크기인 4.0 mm 원형으로 절제한 후 기저막이 위로 오게 하여 영구 양막이식술을 시행하였고(Fig. 2H), 각막이 다 덮이도록 기저막이 아래로 오도록 하여 임시 양막덧댐술을 시행한 후 수술을 종료하였다(Fig. 2I). 절제 종괴의 병리조직검사상 육아종을 동반한 만성기 활동 염증소견이 관찰되었다(Fig. 3).
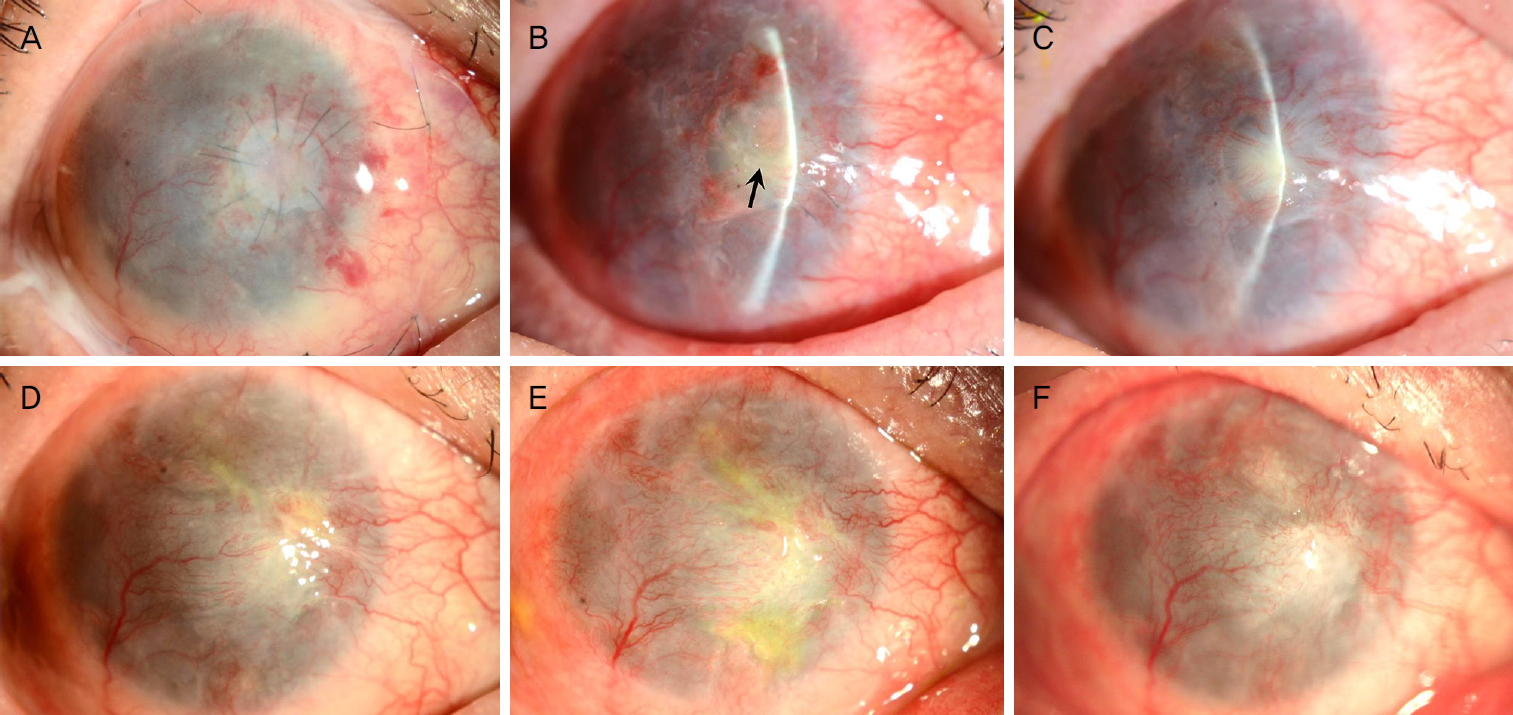
수술 1개월 후 수술 부위에서 염증 침윤을 동반한 감염성 각막염 추정 소견이 발생하였으나 찰과 배양검사상 음성이었고 경험적 점안 항균제 및 항진균제로서 2.5% vancomycin, 5% ceftazidime, 1% voriconazole 투약 후 호전되었다. 이후 점안 항생제와 점안 0.1% 사이클로스포린 투약하면서 경과 관찰하였으며 수술 8개월 후 각막의 육아종 재발, 수술 부위 융해 및 추가 감염 없이 안정적으로 유지되었다(Fig. 4).
결막 육아종은 눈꺼풀성형술, 익상편절제술, 콩다래끼 절개, 안와 내 hydroxyapatite 임플란트 삽입술, 사시수술 등의 다양한 수술 이후에 종종 발생한다[6-8]. 이에 반해 각막에서 발생한 육아종은 결막에 비해 그 보고가 현저히 드물다[9-11]. 그중 Ferry [6]은 1989년 100례의 각막육아종을 포함한 가장 많은 수의 증례를 보고하였으나 상당수는 다래끼 혹은 안구 및 안구 부속기 수술 이후에 발생하였고, Cameron and Mahmood [11]이 보고한 14명의 증례들은 안구건조증, 속눈썹눈찌름증, 알칼리 화학 화상, 안반흔유사천포창(ocular cicatricial pemphigoid), 녹내장 안약 점안, 안와 방사선 치료, 외안부 감염성 궤양 환자들로서, 스티븐스-존슨증후군 환자에서 발생한 각막육아종은 이제껏 국내외에서 보고된 바 없었다.
스티븐스-존슨증후군 환자에서 만성기에서는 안구 표면 안정화를 목적으로 눈물점폐쇄, 점막이식(mucous membrane graft), 양막이식, 구강점막이식 등이 시도되는데[3,12], 이는 눈꺼풀 안쪽면의 각질화된 표면에서 기인하는 반복적인 마찰 자극이 각막의 염증, 신생혈관 형성, 반흔화 및 윤부 줄기세포 결핍을 초래하기 때문이다[13]. 각막의 육아종은 결막육아종과 마찬가지로 다수의 혈관으로 구성되어 있으면서 주로 림프구와 형질 세포(plasma cell)로 구성된 염증세포의 침윤이 특징적이며[11], 본 스티븐스-존슨증후군 환자에서 역시 지속적인 만성기 염증이 반복적인 육아종의 발생에 일조했다고 추정된다.
스티븐스-존슨증후군 및 독성표피괴사 환자들에서 각막궤양, 융해, 천공 등이 발생하였을 때 당장 안구 보전(salvaging) 목적으로 과거 조직 접합제 사용, Gunderson 결막피판술, 치료적 전층 각막이식술, 동종 각막윤부이식술 등이 시도되었다[3]. 본 증례에서 과거 수차례 양막이식술을 했음에도 불구하고 매번 동일한 과거 수술 부위에서 각막육아종이 재발하였는데, 이는 스티븐스-존슨증후군의 질병특성상 심한 염증이 오랜 기간 지속 및 수시 악화되는 상황에서, 이식 양막 표면으로 상피화가 이루어지고 양막이 충분히 기질화되기 전에 빠르게 융해되었기 때문일 것이라고 생각된다. 이는 본 증례에서 무세포 보존 각막이식과 동반이식한 양막이 이식한 보존 각막과는 달리 쉽게 생착하지 못하고 초기에 일부 융해되었던 점과도 상통한다. 다양한 원인에 의해 발생한 각막 30-90% 깊이의 각막궤양에서 영구적 다층양막이식을 시행한 이전 연구에서, 11안 중 7안에서 12개월 후에도 양막이 부분적으로 남아있었고, 9안에서는 12개월까지 각막궤양의 재발 없이 유지된 바 있다[14]. 하지만 본 증례의 경우 다층양막이식 후 1-2주만에도 양막이 융해되기 시작했는데, 스티븐스-존슨증후군 환자에 이식한 양막 위로 상피가 충분히 재생되기에 앞서 안구 표면의 과도한 면역 염증, 마찰 및 미상의 감염 등에 의해 빠르게 융해된 후 회복되지 못한 것으로 생각된다.
스티븐스-존슨증후군 환자는 결막의 세균총이 변화되고 다양한 병적 세균의 번식이 쉬운 것으로 알려져 있다[4]. 본 환자의 경우 비록 육아종의 재발 전 통상적으로 시행한 결막 구석 세균배양에서 세균이 검출되지는 않았으나, 기존 육아종 조직의 불충분한 절제 후 잔여 세균이 지속적으로 증식했을 수 있고 이미 황폐화된 안구 표면에서의 만성 염증이 더해져 화농성 육아종의 재발로 이어졌을 가능성이 있다. 이에 본 증례에서는 육아종의 목(stalk)을 포함하여 주변부 각막을 충분히 절제하였으며, 그 후 다층양막보다는 이식 후 안정성이 보다 높을 무세포 각막을 이식한 것이 각막육아종의 재발 방지에 유효하게 작용한 것으로 보인다.
본 증례에서 적용한 보존 각막은 전자선 조사(electron beam irradiation, 15-21 KGy) 후 무세포화 시켰기 때문에 이론적으로 거부 반응의 위험을 줄일 수 있고, 콜라겐 섬유의 배열이 규칙적인 각막 고유의 특성상 봉합 후 조직의 늘어짐 및 융해에 강하며, 쌀 유래 재조합 사람 혈청 알부민(rice derived recombinant human serum albumin) 용액 속에서 상온 보관되기 때문에 사용이 편리하다는 장점이 있다. 관련 연구로서 스티븐스-존슨증후군 환자에서 전층각막이식 수혜자 대기 중 교량 요법(bridging therapy)으로서 무세포 보존 각막을 사용하여 심부표층각막이식술을 시행한 1건의 연구가 과거 보고된 바 있으나[15], 양막이식술에도 재발하는 각막육아종에서 육아종의 재발 방지를 목적으로 무세포 보존 각막을 적용한 것은 본 증례 보고가 최초이다.
물론 본 단일 증례를 통해서 각막육아종 등 염증성 병변을 동반한 스티븐스-존슨증후군 환자에서 무세포 보존 각막을 이용한 층판이식술의 장기적 치료 효과를 확립할 수 없고 또한 스티븐스-존슨증후군 질병 특성상 동반 감염 위험을 항상 염두에 두어야 한다. 하지만, 봉합이 용이하고 융해에 강한 각막 조직의 특성상 각막육아종을 동반하는 등의 만성기 스티븐스-존슨증후군 환자에서 안구 표면의 안정화 목적으로 적용 시 또 하나의 치료적 대안이 될 수 있겠다.
Figure 1.
Slit-lamp photographs of the corneal granulomatous mass before surgery in 46-year-old man who was previously diagnosed with Stevens-Johnson syndrome with severe ocular complications. (A) There was seen a corneal ulcer (inside the white dotted oval) at previously perforated and amniotic membrane-transplanted area without mass-like lesion no mass-like at 5 months before surgery. (B-D) Afterwards, the corneal granulomatous mass appeared at 3’o clock corneal mid-periphery. At 2 months before surgery, the reddish round mass appeared emanating from the corneal stroma (B). The mass enlarged gradually and rapidly at 1 month before surgery (C) and just before the surgery (D).
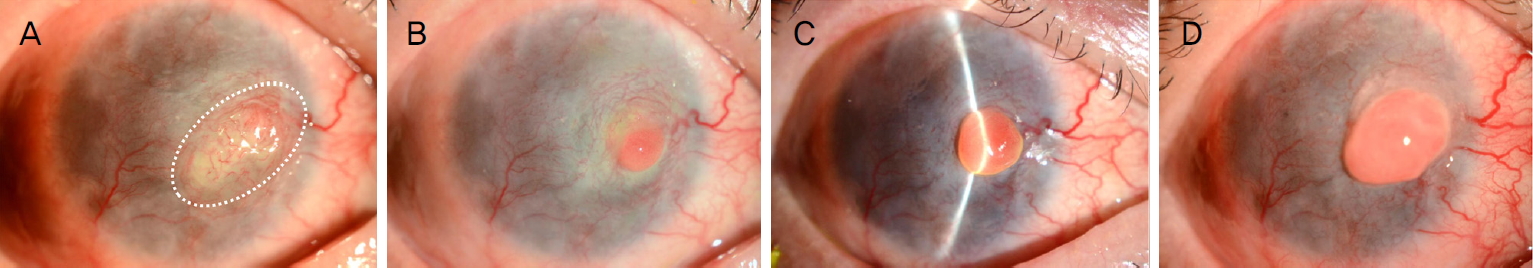
Figure 2.
Intraoperative photos (A, B). The pedunculated oval mass and its stalk (arrow, B) is noted before the excision (C-I). After the excision of the mass, the feeder vessels were electrocauterized (C). The mass-excised area was partially cut using 4.0 mm skin biopsy punch (D), then lamellar dissection of the underlying corneal tissue was done (E). The acellular preserved human cornea (F, G) and the cryopreserved human amniotic membrane (AM) (H) were cut into 4.0 mm circle and transplanted at the mass-excised area using 10-0 nylon sutures. Finally, temporary AM patch was performed (I).

Figure 3.
The histologic appearance of corneal granuloma in this case. There is capillary proliferation in a lobular pattern, with chronic and active inflammatory cells (hematoxylin-eosin stain; original magnification, ×100).
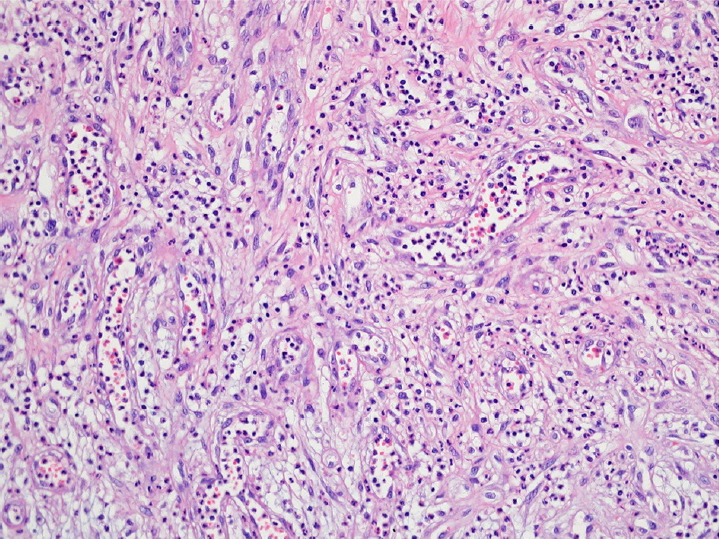
Figure 4.
The time-serial slit-lamp photographs over 8 months after surgery. (A) The engrafted preserved cornea and amniotic membrane is observed at 1 day after surgery. (B) At 1 month after surgery, the keratitis with corneal stromal infiltration is noted (arrow). (C) After the experimental topical antibiotics and antifungal combination therapy, the corneal infiltrative lesion improved at 2 months after surgery. (D-F) At 4 months (D), 6 months (E), and 8 months (F) after surgery, there was no recurrence of corneal granuloma, graft melting and the additional suspicious microbial keratitis at the graft area.
REFERENCES
1) Frey N, Jossi J, Bodmer M, et al. The Epidemiology of Stevens-Johnson syndrome and toxic epidermal necrolysis in the UK. J Invest Dermatol 2017;137:1240-7.


2) Sotozono C, Ang LP, Koizumi N, et al. New grading system for the evaluation of chronic ocular manifestations in patients with Stevens-Johnson syndrome. Ophthalmology 2007;114:1294-302.


3) Kohanim S, Palioura S, Saeed HN, et al. Acute and chronic ophthalmic involvement in Stevens-Johnson syndrome/toxic epidermal necrolysis - a comprehensive review and guide to therapy. II. Ophthalmic disease. Ocul Surf 2016;14:168-88.


4) Frizon L, Araújo MC, Andrade L, et al. Evaluation of conjunctival bacterial flora in patients with Stevens-Johnson Syndrome. Clinics (Sao Paulo) 2014;69:168-72.



5) Sachdev R, Bansal S, Sinha R, et al. Bilateral microbial keratitis in highly active antiretroviral therapy-induced Stevens-Johnson syndrome and toxic epidermal necrolysis: a case series. Ocul Immunol Inflamm 2011;19:343-5.


6) Ferry AP. Pyogenic granulomas of the eye and ocular adnexa: a study of 100 cases. Trans Am Ophthalmol Soc 1989;87:327-47.


7) Lin CJ, Liao SL, Jou JR, et al. Complications of motility peg placement for porous hydroxyapatite orbital implants. Br J Ophthalmol 2002;86:394-6.



8) Espinoza GM, Lueder GT. Conjunctival pyogenic granulomas after strabismus surgery. Ophthalmology 2005;112:1283-6.


9) Googe JM, Mackman G, Peterson MR, et al. Pyogenic granulomas of the cornea. Surv Ophthalmol 1984;29:188-92.


10) Mietz H, Arnold G, Kirchhof B, Krieglstein GK. Pyogenic granuloma of the cornea: report of a case and review of the literature. Graefes Arch Clin Exp Ophthalmol 1996;234:131-6.


12) Iyer G, Pillai VS, Srinivasan B, et al. Mucous membrane grafting for lid margin keratinization in Stevens-Johnson syndrome: results. Cornea 2010;29:146-51.


13) Di Pascuale MA, Espana EM, Liu DT, et al. Correlation of corneal complications with eyelid cicatricial pathologies in patients with Stevens-Johnson syndrome and toxic epidermal necrolysis syndrome. Ophthalmology 2005;112:904-12.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




